卡维地洛对瘦素诱导的人肝星状细胞活化增殖的影响及机制研究Δ
2017-08-11梁传栋河北省人民医院门诊办公室石家庄050051河北省人民医院代谢病重点实验点石家庄050051河北省人民医院神经外二科石家庄050051河北省人民医院消化内二科石家庄050051
穆 华,张 哲,梁传栋,刘 娜(1.河北省人民医院门诊办公室,石家庄 050051;.河北省人民医院代谢病重点实验点,石家庄 050051;.河北省人民医院神经外二科,石家庄 050051;4.河北省人民医院消化内二科,石家庄050051)
卡维地洛对瘦素诱导的人肝星状细胞活化增殖的影响及机制研究Δ
穆 华1*,张 哲2,梁传栋3,刘 娜4#(1.河北省人民医院门诊办公室,石家庄 050051;2.河北省人民医院代谢病重点实验点,石家庄 050051;3.河北省人民医院神经外二科,石家庄 050051;4.河北省人民医院消化内二科,石家庄050051)
目的:研究卡维地洛对瘦素诱导的LX2人肝星状细胞(HSC-LX2)活化增殖的影响及机制。方法:取对数生长期的HSC-LX2细胞分为空白对照组、瘦素刺激组和卡维地洛低、中、高浓度组(5、10、20μmol/L),除空白对照组外,其余各组均加入0.1 g/L的瘦素及相应浓度的卡维地洛作用24 h。采用MTT法检测细胞的光密度(OD)值,计算细胞增殖抑制率;流式细胞术检测细胞周期和凋亡情况;实时荧光定量聚合酶链式反应法检测细胞中α-平滑肌肌动蛋白(α-SMA)、基质金属蛋白酶抑制因子1(TIMP-1)、瘦素及瘦素受体mRNA表达;Western blot法检测磷酸化Janus激酶2(p-JAK2)、磷酸化信号转导和转录激活因子3(p-STAT3)蛋白表达。结果:与空白对照组比较,瘦素刺激组细胞的OD值增加、凋亡率降低、G0/G1期细胞减少(P<0.05);α-SMA、TIMP-1、瘦素、瘦素受体mRNA表达和p-JAK2、p-STAT3蛋白表达均增强(P<0.05)。与瘦素刺激组比较,卡维地洛各浓度组细胞的OD值减小、凋亡率升高、细胞主要阻滞在G0/G1期(P<0.05);α-SMA、TIMP-1、瘦素、瘦素受体mRNA表达和p-JAK2、p-STAT3蛋白表达均减弱(P<0.05),且呈浓度依赖性(P<0.05)。结论:卡维地洛能够抑制瘦素诱导的HSC-LX2细胞的活化增殖,促进HSC-LX2细胞凋亡;其机制可能与下调瘦素、瘦素受体基因表达并阻断瘦素诱导的细胞内JAK 2/STAT3信号通路激活有关。
卡维地洛;人肝星状细胞;增殖;凋亡;瘦素;Janus激酶2;信号转导和转录激活因子3
肝纤维化是各种原因引起的慢性肝病形成及发展的中间阶段,其发病机制尚未完全阐明。目前认为,肝星状细胞(Hepatic stellate cells,HSC)活化增殖在肝纤维化发病中起关键作用。而瘦素是导致肝纤维化的始动因子之一,其通过与HSC的瘦素受体结合能够激活Janus激酶2/信号转导和转录激活因子3(JAK2/STAT3)信号通路,致使HSC活化增殖并抑制HSC凋亡[1-2]。HSC活化的主要标志物包括α-平滑肌肌动蛋白(α-SMA)和基质金属蛋白酶抑制因子1(TIMP-1)。因此,抑制HSC活化增殖、诱导HSC凋亡可能是治疗肝纤维化的重要措施。卡维地洛是第3代β受体阻滞药,具有良好的抗肾小球纤维化作用。本文通过研究卡维地洛对LX2人肝星状细胞(HSC-LX2)活化增殖及瘦素诱导的JAK2/STAT3信号通路的影响,初步探讨卡维地洛对肝纤维化的影响及作用机制。
1 材料
1.1 仪器
960酶标仪(美国Sigma公司);Chem iDocTMXRS+化学发光凝胶成像系统(美国Bio-Rad公司);7300实时荧光定量聚合酶链式反应(RT-PCR)仪(美国ABI公司);EPICSXL流式细胞仪(美国贝克曼库尔特有限公司)。
1.2 药品与试剂
重组瘦素(美国Protech公司,批号:8110060R,纯度:≥98%);卡维地洛注射用粉末(齐鲁制药有限公司,批号:H20020547,规格:100mg/瓶);MTT试剂盒(南京建成生物工程研究所,批号:C6628);膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)凋亡试剂盒(美国BD公司);碘化丙啶(PI)染液(广州浩玛生物科技有限公司);鼠源磷酸化JAK2(p-JAK2)、磷酸化STAT3 (p-STAT3)、β-肌动蛋白(β-actin)多克隆抗体(美国Santa Cruz公司);辣根过氧化物酶(HRP)标记的羊抗鼠免疫球蛋白G(IgG)二抗(北京康为世纪生物科技有限公司);反转录反应体系、SYBR Green RT-PCR试剂盒、Trizol总RNA提取试剂盒(美国Promega公司)。
1.3 细胞
HSC-LX2细胞购自博慧斯生物医药科技有限公司,在37℃、5%CO2及饱和湿度条件下,用含10%胎牛血清、100 u/m L青霉素、100μg/m L链霉素、4mmol/m L谷氨酰胺的RPM I1640培养液常规培养。
2 方法
2.1 分组与给药
将HSC-LX2细胞培养至70%融合时,加入0.25%胰酶消化,以1∶3比例传代。将处于对数生长期的HSC-LX2细胞以5×105m L-1密度接种于6孔板中。细胞分5组:空白对照组(加含10%胎牛血清的RPM I1640培养液)、瘦素刺激组[加含10%胎牛血清和瘦素(0.1 g/L)的RPM I1640培养液]和卡维地洛低、中、高浓度组[加含10%胎牛血清、瘦素(0.1 g/L)和相应浓度卡维地洛(5、10、20μmol/L)的RPM I1640培养液],共培养24 h。
2.2 MTT法检测细胞增殖抑制率
取对数生长期的HSC-LX2细胞,消化、离心,以5× 105m L-1接种于96孔板中,每孔100μL。待细胞贴壁后弃培养液,按“2.1”项下方法分组、给药,继续培养24 h,每孔加入MTT 20μL,培养4 h后在酶标仪490 nm波长处测定各孔光密度(OD)值,重复3次,取均值,计算细胞增殖抑制率:细胞增殖抑制率(%)=(瘦素刺激孔平均OD值-给药孔平均OD值)/瘦素刺激孔平均OD值× 100%。试验重复8次。
2.3 流式细胞术检测细胞周期分布和凋亡情况
取对数生长期的HSC-LX2细胞,消化、离心,以1× 105个/孔接种于24孔板中,按“2.1”项下方法分组、给药,给药后培养24 h,0.25%胰酶消化细胞,磷酸盐缓冲液(PBS)清洗,70%乙醇重悬细胞,4℃固定24 h。测定前30m in加入PI溶液,振荡混匀,避光,流式细胞仪检测细胞周期。测定前1 h加入标记荧光素FITC的Annexin V和PI染液,流式细胞仪检测细胞凋亡率。试验重复8次。
2.4 RT-PCR法检测细胞中a-SMA、TIMP-1、瘦素、瘦素受体mRNA表达
采用Trizol试剂提取细胞总RNA,按照试剂盒说明书加样进行反转录合成DNA,RT-PCR仪扩增,引物序列由上海生工生物工程技术服务有限公司合成。反应体系:25μL;反应条件:93℃预变性5m in;93℃变性45 s,55℃退火1m in,72℃延伸45 s,40个循环。用仪器自带的分析软件得到各样本、各基因扩增的ct值,其中ct值是PCR产物的荧光达到检测阈值时的扩增循环数。以β-actin为内参,按2-ΔΔct法计算目标基因的相对表达量。试验重复8次。RT-PCR引物序列及产物长度见表1。

表1 RT-PCR引物序列及产物长度Tab 1 RT-PCR prim er sequencesand product length
2.5 Western blot法检测细胞中p-JAK 2、p-STAT3蛋白表达
提取细胞总蛋白,半干法电泳转移至聚偏二氯乙烯(PVDF)膜,10%脱脂奶粉封闭2 h,依次加入特异性p-JAK2、p-STAT3多克隆抗体,4℃孵育过夜。洗膜后加入HRP标记的羊抗鼠IgG二抗,室温下孵育2 h,洗膜,化学发光法显色、定影。用UVP 7.0软件扫描测定蛋白条带积分光密度(IOD)值。以β-actin为内参,以目的蛋白与内参IOD值的比值表示目的蛋白的相对表达量。试验重复8次。
2.6 统计学方法
3 结果
3.1 细胞增殖情况
与空白对照组比较,瘦素刺激组细胞的OD值明显增加(P<0.05),卡维地洛各浓度组细胞的OD值明显减小(P<0.05)。与瘦素刺激组比较,卡维地洛各浓度组细胞的OD值明显减小(P<0.05),且呈浓度依赖性(P<0.05)。各组细胞增殖抑制率的测定结果见表2。

表2 各组细胞增殖抑制率的测定结果(n=8)Tab 2 Determ ination results of cell inhibition rate in each group(n=8)
3.2 细胞周期分布和凋亡情况
与空白对照组比较,瘦素刺激组活细胞数及S期细胞比例明显增加、凋亡率及G0/G1期细胞比例明显降低(P<0.05);卡维地洛各浓度组活细胞数及S期细胞比例明显降低、凋亡率及G0/G1期细胞比例明显增加(P<0.05)。与瘦素刺激组比较,卡维地洛各浓度组活细胞数及S期细胞比例明显降低、凋亡率及G0/G1期细胞比例明显增加(P<0.05),且呈浓度依赖性(P<0.05)。各组细胞凋亡的流式图见图1,细胞周期分布和凋亡率测定结果见表3。
3.3 细胞中活化标志物a-SMA、TIMP-1m RNA表达情况
与空白对照组比较,瘦素刺激组细胞中α-SMA、TIMP-1mRNA表达明显增强(P<0.05);卡维地洛各浓度组细胞中α-SMA、TIMP-1mRNA表达明显减弱(P<0.05)。与瘦素刺激组比较,卡维地洛各浓度组细胞中α-SMA、TIMP-1mRNA表达明显减弱(P<0.05),且呈浓度依赖性(P<0.05)。各组细胞中α-SMA、TIMP-1 mRNA表达的测定结果见表4。
3.4 细胞中瘦素、瘦素受体m RNA表达情况
与空白对照组比较,瘦素刺激组细胞中瘦素、瘦素受体mRNA表达明显增强(P<0.05);卡维地洛各浓度组细胞中瘦素、瘦素受体mRNA表达明显减弱(P<0.05)。与瘦素刺激组比较,卡维地洛各浓度组细胞中瘦素、瘦素受体mRNA表达明显减弱(P<0.05),且呈浓度依赖性(P<0.05)。各组细胞中瘦素、瘦素受体mRNA表达的测定结果见表4。
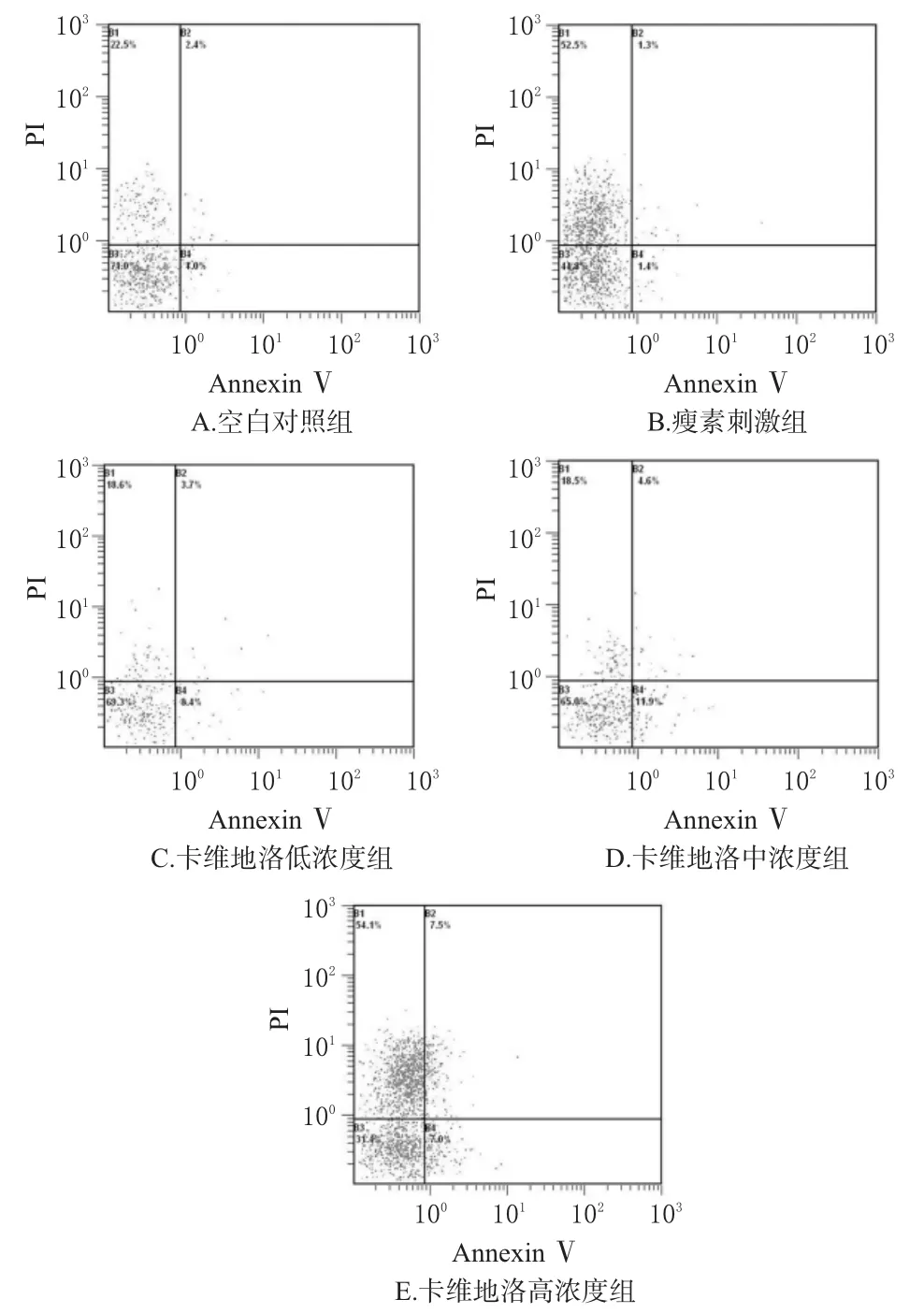
图1 各组细胞凋亡的流式图Fig 1 Flow graph of cellapoptosis in each group
表3 各组细胞细胞周期分布和凋亡率的测定结果(x± s,n=8)Tab 3 Determ ination results of cell cycle distribution and apoptosis rate in each grou(p±s,n=8)
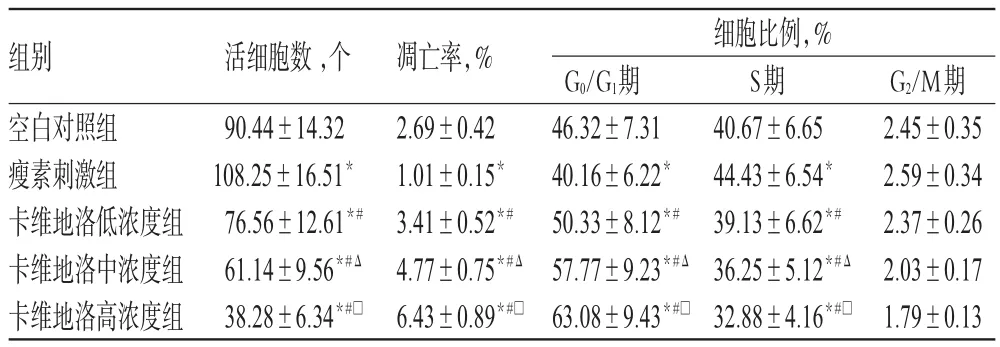
表3 各组细胞细胞周期分布和凋亡率的测定结果(x± s,n=8)Tab 3 Determ ination results of cell cycle distribution and apoptosis rate in each grou(p±s,n=8)
注:与空白对照组比较,*P<0.05;与瘦素刺激组比较,#P<0.05;与卡维地洛低浓度组比较,ΔP<0.05;与卡维地洛中浓度组比较,□P<0.05Note:vs.blank control group,*P<0.05;vs.leptin-stimulated group,#P<0.05;vs.carvedilol low-concentration group,ΔP<0.05;vs. carvedilolmedium-concentration group,□P<0.05
组别空白对照组瘦素刺激组卡维地洛低浓度组卡维地洛中浓度组卡维地洛高浓度组G2/M期2.45±0.35 2.59±0.34 2.37±0.26 2.03±0.17 1.79±0.13活细胞数,个90.44±14.32 108.25±16.51*76.56±12.61*#61.14±9.56*#△38.28±6.34*#□凋亡率,% 2.69±0.42 1.01±0.15*3.41±0.52*#4.77±0.75*#△6.43±0.89*#□细胞比例,% G0/G1期46.32±7.31 40.16±6.22*50.33±8.12*#57.77±9.23*#△63.08±9.43*#□S期40.67±6.65 44.43±6.54*39.13±6.62*#36.25±5.12*#△32.88±4.16*#□
3.5 细胞中p-JAK 2、p-STAT3蛋白表达情况
与空白对照组比较,瘦素刺激组细胞中p-JAK2、p-STAT3蛋白表达明显增强(P<0.05);卡维地洛各浓度组细胞中p-JAK2、p-STAT3蛋白表达明显减弱(P<0.05)。与瘦素刺激组比较,卡维地洛各浓度组细胞中p-JAK2、p-STAT3蛋白表达明显减弱(P<0.05),且呈浓度依赖性(P<0.05)。各组细胞中p-JAK2、p-STAT3蛋白表达的电泳图见图2,测定结果见表5。
表4 各组细胞中a-SMA、TIMP-1、瘦素和瘦素受体m RNA表达的测定结果(±s,n=8)Tab 4 Determ ination results of a-SMA,TIMP-1,leptin,leptin receptor m RNA expressions in cells in each grou(p±s,n=8)

表4 各组细胞中a-SMA、TIMP-1、瘦素和瘦素受体m RNA表达的测定结果(±s,n=8)Tab 4 Determ ination results of a-SMA,TIMP-1,leptin,leptin receptor m RNA expressions in cells in each grou(p±s,n=8)
注:与空白对照组比较,*P<0.05;与瘦素刺激组比较,#P<0.05;与卡维地洛低浓度组比较,ΔP<0.05;与卡维地洛中浓度组比较,□P<0.05Note:vs.blank control group,*P<0.05;vs.leptin-stimulated group,#P<0.05;vs.carvedilol low-concentration group,ΔP<0.05;vs. carvedilolmedium-concentration group,□P<0.05
组别空白对照组瘦素刺激组卡维地洛低浓度组卡维地洛中浓度组卡维地洛高浓度组瘦素受体0.98±0.15 1.07±0.16*0.80±0.14*#0.69±0.11*#△0.52±0.08*#□α-SMA 0.88±0.14 0.97±0.16*0.73±0.12*#0.65±0.10*#△0.47±0.07*#□TIMP-1 0.79±0.13 0.90±0.15*0.67±0.11*#0.54±0.09*#△0.41±0.06*#□瘦素1.13±0.16 1.23±0.18*0.99±0.12*#0.81±0.13*#△0.65±0.09*#□
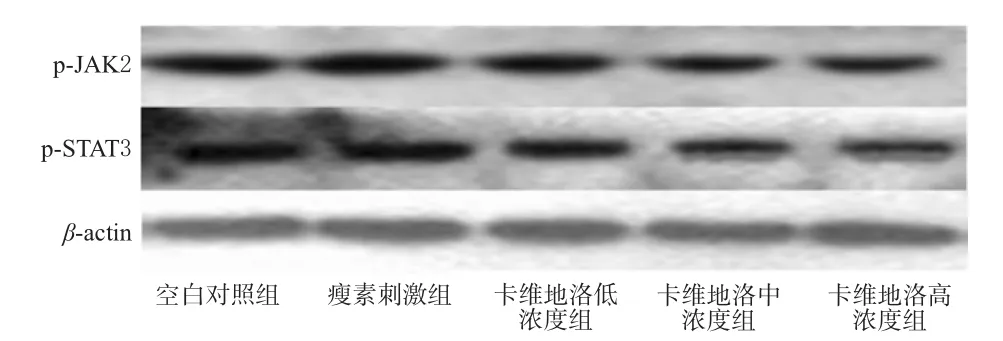
图2 各组细胞中p-JAK 2、p-STAT3蛋白表达的电泳图Fig 2 Electrophoresis chart of p-JAK 2,p-STAT3 protein expressions in cells in each group
表5 各组细胞中p-JAK 2、p-STAT3蛋白表达的测定结果(±s,n=8)Tab 5 Determ ination results of p-JAK 2,p-STAT3 protein expressions in cells in each group(x± s,n=8)

表5 各组细胞中p-JAK 2、p-STAT3蛋白表达的测定结果(±s,n=8)Tab 5 Determ ination results of p-JAK 2,p-STAT3 protein expressions in cells in each group(x± s,n=8)
注:与空白对照组比较,*P<0.05;与瘦素刺激组比较,#P<0.05;与卡维地洛低浓度组比较,ΔP<0.05;与卡维地洛中浓度组比较,□P<0.05Note:vs.blank control group,*P<0.05;vs.leptin-stimulated group,#P<0.05;vs.carvedilol low-concentration group,ΔP<0.05;vs. carvedilolmedium-concentration group,□P<0.05
组别空白对照组瘦素刺激组卡维地洛低浓度组卡维地洛中浓度组卡维地洛高浓度组p-STAT3蛋白0.84±0.14 0.98±0.16*0.72±0.12*#0.60±0.09*#△0.45±0.07*#□p-JAK2蛋白0.93±0.15 1.14±0.18*0.81±0.14*#0.69±0.11*#△0.51±0.08*#□
4 讨论
在HSC转化为肌成纤维细胞过程中,HSC活化增殖是肝纤维化的中心环节,活化的HSC大量表达α-SMA、TIMP-1及各种细胞外基质成分,最终导致肝纤维化、肝硬化甚至肝衰竭[3]。研究显示,肥胖基因编码产物瘦素通过促进HSC活化增殖参与肝脏纤维化的形成及发展。正常情况下,肝细胞不表达瘦素,但表达其受体;而在肝纤维化发生后,瘦素及瘦素受体表达随着肝纤维化的严重程度增加而增强[4]。瘦素与瘦素受体结合后通过激活JAK2/STAT3信号通路而发挥其生物学功能[5]。因此,下调瘦素及瘦素受体表达或阻断JAK2/STAT3信号通路对于延缓或逆转肝纤维化具有重要意义。近年来,多项研究表明,交感神经系统过度激活与肝损伤后的修复和纤维化进程密切相关,而交感神经系统阻滞剂能够明显抑制肝纤维化进程[6]。笔者前期研究发现,HSC能够合成和释放去甲肾上腺素,并表达α1、β1、β2等亚型肾上腺素受体,且其表达水平随着肝纤维化进展而增强[7]。此外,笔者进一步发现去甲肾上腺素能够上调体外活化的大鼠HSC瘦素及瘦素受体表达,并通过肾上腺素α、β2受体对HSC发挥促增殖和抑凋亡作用,这可能是交感神经系统促进肝纤维化进程的机制之一[8]。
卡维地洛是新一代β受体阻滞药,具有阻滞肾上腺素α1、β1、β2受体,抗炎,抗氧化,抑制平滑肌细胞增殖的作用[9]。临床研究表明,卡维地洛能够明显降低门脉压力,可作为预防肝硬化门脉高压消化道出血的首选药物[10]。另外,Ding Q等[11]研究表明,卡维地洛能够抑制血管生成,从而抑制肝纤维化进程。然而,卡维地洛的抗肝纤维化作用是否涉及瘦素机制目前尚未见报道。为此,笔者选择HSC-LX2细胞为研究对象,旨在观察卡维地洛对HSC-LX2细胞活化增殖、凋亡及瘦素诱导JAK2/ STAT3信号通路激活的影响。本研究结果表明,卡维地洛通过阻断瘦素诱导的JAK2/STAT3信号通路的激活,可抑制HSC-LX2细胞活化增殖、促进其凋亡。
[1]Hellerbrand C.Hepatic stellate cells:the pericytes in the liver[J].Pflugers Arch,2013,465(6):775-778.
[2]Nepal S,Park PH.Modulation of cell death and survival by adipokines in the liver[J].Biol Pharm Bull,2015,38 (7):961-965.
[3]Schuppan D,Kim YO.Evolving therapies for liver fibrosis [J].JClin Invest,2013,123(5):1887-1901.
[4]朱净,潘亮,许晶,等.瘦素及Ⅰ和Ⅲ型胶原蛋白在肝纤维化大鼠肝组织中的变化[J].基础医学与临床,2012,32 (10):1224-1225.
[5]BertolaniC,Marra F.Role of adipocytokines in hepatic fibrosis[J].Curr Pharm Des,2010,16(17):1929-1940.
[6]Bruinstroop E,Fliers E,Kalsbeek A.Hypothalam ic controlof hepatic lipidmetabolism via the autonom ic nervous system[J].Best Pract Res Clin Endocrinol Metab,2014,28(5):673-684.
[7]刘娜,张晓岚,梁传栋,等.肝纤维化过程中去甲肾上腺素各受体亚型表达的动态变化[J].中华肝脏病杂志,2009,17(9):653-656.
[8]刘娜,穆华,梁传栋,等.去甲肾上腺素对肝星状细胞表达瘦素以及瘦素受体的影响[J].世界华人消化杂志,2015,23(7):1052-1058.
[9]Araújo Júnior RF,Garcia VB,Leitão RF,etal.Carvedilol improves inflammatory response,oxidative stress and fibrosis in thealcohol-induced liver injury in ratsby regulating kuppfer cells and hepatic stellate cells[J].PLoSOne,2016,11(2):e0148868.
[10]Li T,KeW,Sun P,et al.Carvedilol for portal hypertension in cirrhosis:systematic review w ithmeta analysis[J]. BMJOpen,2016,6(5):e010902.
[11]Ding Q,Tian XG,LiY,etal.Carvedilolmay attenuate liver cirrhosis by inhibiting angiogenesis through the VEGFSrc-ERK signaling pathway[J].World J Gastroenterol,2015,21(32):9566-9576.
Study on the Effect and Its M echanism of Carvedilol on Leptin-induced Activation and Proliferation of Human Hepatic Stellate Cells
MU Hua1,ZHANG Zhe2,LIANG Chuandong3,LIU Na4(1.Outpatient Office,Hebei People’s Hospital,Shijiazhuang 050051,China;2.Key Laboratory of Metabolites,Hebei People’s Hospital,Shijiazhuang 050051,China;3.SurgicalWard 2,Dept.of Neurosurgery,Hebei People’s Hospital,Shijiazhuang 050051,China;4.Medical Ward 2,Dept.of Gastroenterology,Hebei People’s Hospital,Shijiazhuang 050051,China)
OBJECTIVE:To study the effect and itsmechanism of carvedilol on leptin-induced activation and proliferation of LX2 human hepatic stellate cells(HSC-LX2).METHODS:HSC-LX2 w ith logarithmic grow th periodswere divided into blank control group,leptin-stimulated group and carvedilol low-concentration,medium-concentration,high-concentration groups(5,10,20 μmol/L).Except for the blank control group,other groups were added 0.1 g/L leptin and corresponding concentration of carvedilol. A fter 24 h,MTTmethod was used to detect the optical density(OD)value of cells and calculate the proliferation rate.Flow cytometry was used to detect the cell cycle and apoptosis.Real-time fluorescence quantitative polymerase chain reactionmethod was used to detect theα-smooth muscle actin(α-SMA),matrix metalloproteinase inhibition factor 1(TIMP-1),leptin,leptin receptor mRNA expressions.Western blotmethod was used to detect phosphorylated Janus kinase 2(p-JAK2),phosphorylated signal transduction and transcriptional activator 3(p-STAT3)protein expressions.RESULTS:Compared w ith blank control group,OD value of cell was increased in leptin-stimulated group;apoptotic rate was decreased;cells of G0/G1were decreased;α-SMA,TIMP-1,leptin,leptin receptor mRNA expressions and p-JAK2,p-STAT3 protein expressions were increased(P<0.05).Compared w ith leptin-stimulated group,OD values of cells were decreased in carvedilol concentration groups;apoptotic rate was increased,and the cells were mainly blocked in G0/G1phase;α-SMA,TIMP-1,leptin,leptin receptormRNA expressions and p-JAK2,p-STAT3 protein expressions were decreased(P<0.05)and was concentration-depended(P<0.05).CONCLUSIONS:Carvedilol can inhibit the activation and proliferation of leptin-induced HSC-LX2,promote its apoptosis.Themechanism may associate w ith down-regulating leptin,leptin receptor gene expression and blocking JAK2/STAT3 signal pathway activation by leptin in cells.
Carvedilol;Human hepatic stellate cells;Proliferation;Apoptosis;Leptin;Janus kinase 2;Signal transduction and transcriptional activator 3
R361+.3
A
1001-0408(2017)19-2620-05
2016-10-13
2016-11-29)
(编辑:邹丽娟)
河北省医学科学研究重点课题计划项目(No. ZL20140250)
*主治医师,硕士。研究方向:慢性肝病。电话:0311-85988343。E-mail:mh8375@126.com
#通信作者:主治医师,博士。研究方向:慢性肝病。电话:0311-85988543。E-mail:1093961170@qq.com
DOI 10.6039/j.issn.1001-0408.2017.19.08
