扶正解毒祛瘀方联合奥沙利铂对人结肠癌HT-29细胞增殖与凋亡的影响及机制研究Δ
2017-08-11赵秀梅张桂贤柴仲秋刘晓芸刘洪斌天津市医药科学研究所天津30000天津市滨海新区中医医院肛肠科天津30045
赵秀梅,周 冰,张桂贤,柴仲秋,刘晓芸,刘洪斌#(.天津市医药科学研究所,天津 30000;.天津市滨海新区中医医院肛肠科,天津 30045)
扶正解毒祛瘀方联合奥沙利铂对人结肠癌HT-29细胞增殖与凋亡的影响及机制研究Δ
赵秀梅1*,周 冰2,张桂贤1,柴仲秋2,刘晓芸2,刘洪斌1#(1.天津市医药科学研究所,天津 300020;2.天津市滨海新区中医医院肛肠科,天津 300451)
目的:研究扶正解毒祛瘀方(简称“扶正方”)联合奥沙利铂(L-OHP)对人结肠癌HT-29细胞增殖与凋亡的影响及机制。方法:将HT-29细胞分为空白对照组(不加药物)、扶正方组(1 000mg/L)、L-OHP组(31.25mg/L)和联合用药组(1 000mg/L扶正方+31.25mg/L L-OHP)。加入相应药物作用48 h后,采用MTT法检测细胞增殖情况,倒置显微镜下观察细胞形态的改变,流式细胞术检测细胞周期和凋亡率,实时荧光定量聚合酶链式反应(qRT-PCR)法检测细胞中促凋亡基因Bax、抑凋亡基因Bcl-2mRNA的表达,Western blot法检测细胞中Bax、Bcl-2蛋白的表达。结果:与空白对照组比较,L-OHP组和联合用药组细胞增殖均受到抑制、S期和G2/M期细胞比例升高、G0/G1期细胞比例降低(P<0.05),L-OHP组、扶正方组和联合用药组细胞凋亡率升高、细胞中BaxmRNA及蛋白的表达上调、细胞中Bcl-2mRNA的表达下调(P<0.05),且联合用组变化较两药单用组更明显(P<0.05)。结论:扶正方与L-OHP联合应用可抑制HT-29细胞的增殖、促进细胞凋亡,且作用优于两药单用;其机制可能与上调细胞中Bax基因与蛋白表达、下调细胞中Bcl-2基因表达有关。
扶正解毒祛瘀方;奥沙利铂;人结肠癌HT-29细胞;增殖;凋亡;体外
奥沙利铂(Oxaliplatin,L-OHP)是继顺铂、卡铂后的第三代铂类抗癌药物,其通过产生烷化结合物作用于DNA,形成链内和链间交联,从而抑制DNA的合成及复制。近年,含L-OHP在内的FOLFOX4方案被推荐为Ⅱ、Ⅲ期大肠癌患者的一线治疗方案[1-2]。但是在使用L-OHP的过程中仍出现了化疗药物所共有的问题,如毒副作用大、患者耐受性差等。近年来,中医药治疗已成为大肠癌综合治疗中重要的组成部分,尤其在增强大肠癌术后化疗的抗肿瘤作用、减轻化疗所致的毒副作用、辅助患者平稳度过化疗阶段、降低术后复发和转移率、延长生存期等方面凸显了其优势[3-5]。本课题组成员在长期的临床实践中,以参苓白术散、桃红四物汤和小承气汤为基础,以扶正解毒祛瘀为立法依据,组方后得到扶正解毒祛瘀方(简称“扶正方”),针对大肠癌术后常见的气虚毒瘀证型进行治疗,结果发现扶正方在扶助体内正气及增强化疗药物抗癌效果作用的同时,还有通腑泻浊、减轻化疗毒副作用的功效,前期的研究也证实了扶正方有协同增加L-OHP抗肿瘤的作用[6],但其作用机制尚不明确。为此,本研究分别通过MTT法、流式细胞术、实时荧光定量聚合酶链式反应(qRT-PCR)、Western blot等方法检测扶正方联合L-OHP对人结肠癌HT-29细胞的增殖、凋亡的影响及可能的相关机制,希望为大肠癌的中西医结合综合治疗提供试验依据。
1 材料
1.1 仪器
FACSCantoⅡ型流式细胞仪(美国BD公司);Light-Cycler 480Ⅱ型qRT-PCR仪(瑞士Roche公司);Infinite M 200型酶联免疫检测仪(瑞士Tecan公司);IM型倒置显微镜(日本Olympus公司)。
1.2 药品与试剂
扶正方由太子参、慧苡仁、生槐花、知母、当归、黄柏、桃仁、红花等中药按照一定比例组成,由天津市滨海新区中医医院提供,按照临床用药煎煮方法浓缩成每1 g含2.015 g生药的浸膏,装于密闭玻璃瓶中,4℃保存,批号为20150909,临用时用含10%小牛血清的RPM I1640培养液制备成相应浓度的药液。
注射用L-OHP(南京制药厂有限公司,批号: 201411132,规格:50mg/瓶);MTT(美国Sigma公司);细胞周期、荧光素FITC标记的膜联蛋白V(Annexin-V FITC)凋亡检测试剂盒(天津三箭生物技术有限公司,批号:CY2001-O、AO2001-02P-G);兔源Bax、Bcl-2抗体(美国Santa Cruz公司);荧光定量试剂盒SYBR Green M ix(美国Roche公司);兔源β-肌动蛋白(β-actin)单克隆抗体(美国CST公司);辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(IgG)二抗(北京中杉金桥生物技术有限公司);引物由北京Invitrogen生物技术公司合成。
1.3 细胞株
人结肠癌HT-29细胞购自中国科学院典型培养物保藏委员会细胞库。
2 方法
2.1 细胞增殖抑制率测定
取对数生长期HT-29细胞,经0.25%胰酶消化后,吹打成单细胞悬液,用含10%小牛血清的RPM I1640培养液调整细胞密度为1×105m L-1,接种于96孔板上,每孔100μL,置于37℃、5%CO2培养箱中孵育24 h。然后将细胞随机分为扶正方组(1 000mg/L)、L-OHP组(31.25 mg/L)和联合用药组(1 000 mg/L扶正方+31.25 mg/L L-OHP),并另设不加药物的空白对照组,每组设4个复孔。培养48 h后,小心弃去上清,每孔加入MTT溶液(0.5 g/L)100μL,继续培养4 h后弃去上清,每孔再加入二甲基亚砜(DMSO)溶液150μL,用微量振荡器振荡10 m in使结晶物充分溶解。以酶标仪于570 nm波长下检测每孔的光密度(OD)值,按下式计算细胞增殖抑制率:增殖抑制率(IR,%)=(1-给药组OD值/空白对照组OD值)×100%。
2.2 细胞形态观察
取对数生长期的HT-29细胞,调整成密度为1×105m L-1的细胞悬液,接种于25 cm2的培养瓶中,贴壁24 h后,按“2.1”项下分组、给药。然后将细胞置于37℃、5% CO2饱和温度培养箱中培养48 h后,在倒置显微镜下观察各组细胞的形态学变化。
2.3 细胞周期测定
收集“2.2”项下作用48 h的HT-29细胞,用冷磷酸盐缓冲液(PBS)洗涤2次,离心,收集细胞沉淀,然后用70%冰乙醇溶液,在4℃下固定细胞24 h,再用PBS洗涤2次后将细胞重悬于PBS中。加核糖核酸酶A(终质量浓度为50μg/m L),于37℃水浴30m in,加入碘化丙啶(PI,终质量浓度为20μg/m L),避光,室温孵育15m in,流式细胞仪测定细胞周期情况。试验重复3次。
2.4 细胞凋亡测定
收集“2.2”项下作用48 h的HT-29细胞,PBS洗2遍,将细胞重悬于试剂盒配套的1×结合缓冲液(Binding buffer)中,用Annexin V与PI染料避光孵育15m in,流式细胞仪测定细胞凋亡情况。试验重复3次。
2.5 细胞中Bax、Bcl-2mRNA表达检测
收集“2.2”项下作用48 h的HT-29细胞,根据RNA提取试剂盒提取总RNA,逆转录成cDNA,qRT-PCR扩增以检测各组细胞中相关基因表达量。引物序列:β-actin,上游引物序列为5′-ATCAGCAAGCAGGAGTATG-3′,下游为5′-AATAAAGCCATGCCAATC-3′,扩增片段长度为105 bp;Bax,上游引物序列为5′-TCTGACGGCAACTTCAACTG-3′,下游为5′-AACCACCCTGGTCTTGGAT-3′,扩增片段长度为90 bp;Bcl-2,上游引物序列为5′-TGTTGTTCAAACGGGATTCA-3′,下游为5′-GAGCCAAGTGCAGCCACAATA-3′,扩增片段长度为120 bp。PCR反应步骤:95℃、5 m in;95℃、20 s,60℃、20 s,72℃、20 s,50个循环;72℃、5m in。总反应体系为25μL。采用公式2-ΔΔct计算各基因表达的相对表达水平,其中Δct为目的基因ct值-内参基因ct值。试验重复3次。
2.6 细胞中Bax、Bcl-2蛋白表达检测
收集“2.2”项下作用48 h的HT-29细胞,按总蛋白提取试剂盒说明书提取总蛋白,二喹啉甲酸(BCA)法检测蛋白浓度,每孔蛋白上样20μg,进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,湿法转至聚偏二氟乙烯(PVDF)膜上,5%脱脂牛奶封闭1 h,TBST缓冲液洗膜,加入一抗4℃孵育过夜,次日取出,置于洗膜容器中,TBST缓冲液洗膜3次,加入二抗,于室温下水平摇床上孵育1 h。避光条件下滴加发光液,反应1m in。将PVDF膜置于凝胶成像仪中,根据条带的亮度设置适当的曝光时间进行曝光,保存图片。将采集到的图片用凝胶图像处理系统分析条带的灰度值,以目的蛋白与内参(β-actin)条带灰度值的比值表示目的蛋白的相对表达水平。试验重复3次。
2.7 统计学方法
3 结果
3.1 细胞增殖抑制率测定结果
经扶正方、L-OHP或二者联合作用48 h后,HT-29细胞的增殖均受到不同程度的抑制。与空白对照组比较,L-OHP组及联合给药组细胞OD值显著降低(P<0.05),且联合用药组细胞OD值显著低于扶正方组和L-OHP组(P<0.05),结果详见表1。
表1 各组细胞IR测定结果(±s,n=4)Tab 1 Determ ination results of cell IR in each group (±s,n=4)

表1 各组细胞IR测定结果(±s,n=4)Tab 1 Determ ination results of cell IR in each group (±s,n=4)
注:与空白对照组比较,*P<0.05;与联合用药组比较,#P<0.05Note:vs.blank control group,*P<0.05;vs.combination group,#P<0.05
IR,%组别空白对照组扶正方组L-OHP组联合用药组12.57±8.83 48.99±1.65 54.86±2.46 OD值0.736 7±0.040 1 0.644 1±0.053 1#0.3758±0.012 2*#0.332 6±0.018 1*
3.2 细胞形态观察结果
空白对照组细胞状态良好,胞质饱满,相邻细胞生长融合成片;扶正方组细胞生长形态较空白对照组无明显变化;而L-OHP组和联合用药组细胞逐渐向圆形转变,体积缩小,伪足回缩,细胞间隙增大、折光性变差,几无片状细胞生长区,细胞生长抑制明显,尤以联合用药组细胞形态变化更为显著,结果详见图1。

图1 细胞形态观察结果(×100)Fig 1 Observation results of m orphlolgic changes(× 100)
3.3 细胞周期分布检测结果
与空白对照组比较,扶正方组G0/G1、S、G2/M期细胞比例无明显变化(P>0.05);而L-OHP组及联合用药组S、G2/M期细胞比例显著升高(P<0.05),G0/G1期细胞比例显著降低(P<0.05),细胞被阻滞在S期和G2/M期,结果详见图2、表2。
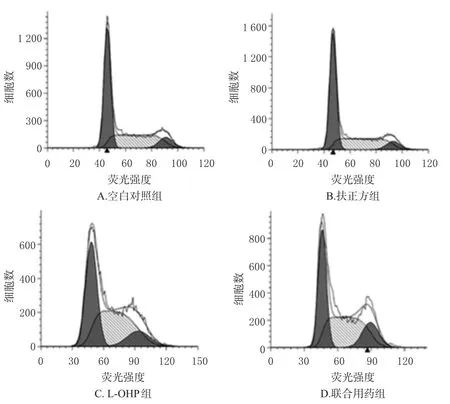
图2 细胞周期分布图Fig 2 Distribution chartof the cell cycle
表2 各组细胞周期与细胞凋亡率测定结果(±s,n= 3,%)Tab 2 Determ ination results of the cell cycle and apoptosis rate in each grou(p±s,n=3,%?)

表2 各组细胞周期与细胞凋亡率测定结果(±s,n= 3,%)Tab 2 Determ ination results of the cell cycle and apoptosis rate in each grou(p±s,n=3,%?)
注:与空白对照组比较,*P<0.05;与联合用药组比较,#P<0.05Note:vs.blank controlgroup,*P<0.05;vs.combination group,#P<0.05
细胞周期分布比例 细胞凋亡率2.7±0.1 11.5±1.8*#19.2±1.8*#28.0±1.2*S组别空白对照组扶正方组L-OHP组联合用药组G0/G154.12±2.16 56.24±0.97#42.29±1.34*40.06±2.65*37.57±0.92 34.81±2.69#45.14±1.98*44.57±1.48*G2/M 8.32±1.24 8.96±1.72#12.58±0.64*15.37±1.16*
3.4 细胞凋亡测定结果
与空白对照组比较,扶正方组、L-OHP组及联合用药组细胞凋亡率均显著升高(P<0.05),且联合用药组细胞凋亡率显著高于扶正方组和L-OHP组(P<0.05),结果详见表2。
3.5 细胞中Bax、Bcl-2m RNA及蛋白表达测定结果
与空白对照组比较,扶正方组、L-OHP组及联合用药组细胞中Bax mRNA及蛋白表达增强(P<0.05),Bcl-2mRNA的表达减弱(P<0.05),且联合用药组变化程度较扶正方组和L-OHP组更明显(P<0.05);各给药组细胞中Bcl-2蛋白表达均有所减弱,但差异无统计学意义(P>0.05),结果详见图3、表3。
4 讨论
在前期体外试验中笔者曾发现,将浓缩后的中药复方加入到培养体系中,采用MTT法测定细胞增殖时,镜下观察到高浓度样品孔生成的甲臜颗粒明显少于低浓度孔,但其测定出的OD值常常与低浓度样品孔的OD值相当,甚至超过低浓度孔,这说明浓度较高时,中药本身的颜色会对试验结果产生干扰。为此,笔者在本研究中将配制后的扶正方药液经过0.22μm无菌滤膜过滤,在除菌的同时还去除了药液中不溶性颗粒,从而改善了药液的澄清度。此外,加入MTT试剂前,先将细胞上清弃去,再加入由PBS缓冲液配制的低浓度MTT(0.5 g/L)溶液100μL,又进一步减低了药液本身对测定的影响,保证了试验结果的可信度。

图3 各组细胞中Bax、Bcl-2蛋白表达的电泳图Fig 3 Electrophoresis chart of Bax,Bcl-2 protein expressionsof cells in each group
表3 各组细胞中Bax、Bcl-2m RNA及蛋白表达测定结果(±s,n=3)Tab 3 Determ ination results of the Bax,Bcl-2m RNA and protein expressions of cells in each group (±s,n=3)
表3 各组细胞中Bax、Bcl-2m RNA及蛋白表达测定结果(±s,n=3)Tab 3 Determ ination results of the Bax,Bcl-2m RNA and protein expressions of cells in each group (±s,n=3)
注:与空白对照组比较,*P<0.05;与联合用药组比较,#P<0.05Note:vs.blank control group,*P<0.05;vs.combination group,#P<0.05
组别空白对照组扶正方组L-OHP组联合用药组Bax蛋白表达0.68±0.03 0.64±0.04 0.57±0.09 0.56±0.08 mRNA表达1.00±0.05 1.34±0.27*#1.88±0.34*#2.35±0.38*蛋白表达0.91±0.02 1.04±0.03*#1.34±0.04*#1.69±0.11*Bcl-2 mRNA表达1.00±0.06 0.70±0.16*#0.48±0.05*#0.35±0.10*
前期实验中,笔者测定了不同质量浓度的扶正方(390.63、781.25、1 562.5、3 125、6 250 mg/L)和L-OHP (3.91、7.81、15.63、31.25、62.5、125mg/L)作用48 h后对HT-29细胞增殖的影响,结果二者均呈浓度依赖性地抑制细胞生长。中西医结合抗肿瘤治疗是今后的发展方向之一,在术后辅助化疗中显示了“增效减毒”的优势[7-8]。课题组成员在临床实践中明确发现,大肠癌患者术后化疗期间以扶正方为辅助用药,其化疗副反应少,且身体状况平稳,显示了良好的效果。为此,在观察扶正方与L-OHP合用后对HT-29细胞增殖的影响时,笔者选择了对细胞增殖抑制率在30%以下的1 000、2 000mg/L两个质量浓度进行考察,结果低、高质量浓度的扶正方与L-OHP合用均具有协同增效作用[6]。考虑到中药本身对测定结果的干扰,故在本次试验中选择1 000mg/L的作用浓度。L-OHP剂量选择的是其半数抑制浓度(IC50)附近的浓度(31.25mg/L),因为当剂量过大时,与扶正方合用后,L-OHP本身的抑制率与合用的抑制率差别往往不会太大,不利于评价合用后的效果。
肿瘤的发生与多种癌基因的激活和抑癌基因的失活有关。Bcl-2家族是最重要的凋亡调控基因,包括促凋亡蛋白和抗凋亡蛋白,前者包括Bax、Bak、Bad等,后者有Bcl-2、Bcl-xl和M cl-1等,两者的比例决定了细胞的命运。当接受到上游信号后,促凋亡蛋白(如Bax)表达发生改变,从胞质转移到线粒体膜上与Bcl-2或Bcl-xl形成二聚体,改变线粒体膜的通透性,从而引起细胞色素C的释放。细胞色素C再与凋亡蛋白酶活化因子1结合,激活半胱氨酸蛋白酶9(Caspase-9),进而通过级联反应激活下游的Caspase-3,最终导致细胞凋亡[9-10]。本研究表明,L-OHP单用及与扶正方联合作用于HT-29细胞后,均可明显抑制细胞增殖,促进细胞凋亡,上调细胞中BaxmRNA和蛋白表达,下调细胞中Bcl-2mRNA的表达,使细胞被阻滞在S和G2/M期,且两药联合后作用更显著。以上结果说明,扶正方和L-OHP联合应用具有协同作用,这可能是通过抑制Bcl-2mRNA转录、促进Bax mRNA转录,进而抑制Bcl-2蛋白表达、促进Bax蛋白表达,最终抑制HT-29细胞增殖并诱导其凋亡。本研究结果显示,扶正方和L-OHP联合用药具有合理性,为进一步完善大肠癌的联合用药方案提供了试验依据。
[1]Lonardi S,Sobrero A,RosatiG,etal.PhaseⅢtrial comparing 3-6 months of adjuvant FOLFOX4/XELOX in stageⅡ-Ⅲcolon cancer:safety and compliance in the TOSCA trial[J].Ann Oncol,2016,27(11):2074-2081.
[2]Suenaga M,Fujimoto Y,Matsusaka S,etal.Perioperative FOLFOX4 plus bevacizumab for initially unresectable advanced colorectal cancer(NAVIGATE-CRC-01)[J].Onco Targets Ther,2015,doi:10.2147/OTT.S83952.
[3]李悠然,谷云飞,陈邑岐,等.四君子汤加减联合化疗对结直肠癌患者的Meta分析[J].中国实验方剂学杂志,2016,22(6):204-209.
[4]王容容,王其美,蒋益兰,等.健脾消癌方联合化疗治疗晚期转移性结直肠癌的临床研究[J].中华中医药杂志,2016,31(5):1732-1736.
[5]郑兴斌.人参多糖注射液在直肠癌患者化疗中的作用研究[J].中国药房,2009,20(18):1425-1427.
[6]刘晓芸,赵秀梅,张桂贤,等.扶正解毒祛瘀方对大肠癌术后化疗增效减毒的作用[J].中国中西医结合外科杂志,2016,22(2):150-156.
[7]朱方勇,王斌,艾岩,等.健脾益气解毒方联合化疗治疗晚期大肠癌临床研究[J].现代中西医结合杂志,2016,25 (3):261-263.
[8]崔佑刚,孔祥余,林峰,等.槐耳颗粒联合XELOX方案治疗Ⅳ期大肠癌的疗效研究[J].中国现代药物应用,2016,10(20):11-13.
[9]Thornberry NA,Lazebnik Y.Caspases:enemiesw ithin[J]. Science,1998,281(5381):1312-1316.
[10]Leibow itz B,Yu J.M itochondrial signaling in cell death via the Bcl-2 fam ily[J].Cancer Biol Ther,2010,9(6): 417-422.
Study on the Effect and Its M echanism of Fuzheng Jiedu Quyu Formula Combined w ith Oxaliplatin on Proliferation and Apoptosis of Human Colon Cancer HT-29 Cell
ZHAO Xiumei1,ZHOU Bing2,ZHANG Guixian1,CHAIZhongqiu2,LIU Xiaoyun2,LIU Hongbin1(1.Tianjin Institute of Medical and Pharmaceutical Sciences,Tianjin 300020,China;2.Dept.of Anorectal,TCM Hospital of Tianjin Binhai New Area,Tianjin 300451,China)
OBJECTIVE:To study the effect and itsmechanism of Fuzheng Jiedu Quyu formula(short for“Fuzheng formula”) combined w ith oxaliplatin(L-OHP)on human colon cancer HT-29 cell proliferation and apoptosis.METHODS:HT-29 cells were divided into blank control group(w ithout drugs),Fuzheng formula group(1 000 mg/L),L-OHP group(31.25 mg/L)and combination group(1 000 mg/L Fuzheng formula+31.25 mg/L L-OHP).A fter cultured w ith corresponding drug for 48 h,MTT method was used to detect the cell proliferation;the changes of cellularmorphology were observed by invertmicroscope;flow cytometry was used to detect the cell cycle and apoptosis rate.Proapoptotic gene Bax,apoptotic gene Bcl-2 mRNA expressions were determined by real-time fluorescence quantitative polymerase chain reaction method;Bax,Bcl-2 protein expressions were assayed by Western blot.RESULTS:Compared w ith blank control group,cell proliferation was inhibited in L-OHP group and combination group;cell proportion was increased in S stage,G2/M stage and decreased in G0/G1stage(P<0.05).Cell apoptosis rate in L-OHP group,Fuzheng formula group and combination group was increased;Bax mRNA and protein expression were up-regulated,Bcl-2 mRNA expression was downregulated(P<0.05);and combination group changed more obviously than the single drug groups(P<0.05).CONCLUSIONS:Fuzheng formula combined w ith L-OHP can inhibit HT-29 cell proliferation and promote its apoptosis,show ing better effects than either of the two drugs alone.Themechanism may be associated w ith up-regulation of Bax gene and protein expressions and down-regulation of Bcl-2 gene expressions in cells.
Fuzheng Jiedu Quyu formula;Oxaliplatin;Human colon cancer HT-29 cell;Proliferation;Apoptosis;in vitro
R735;R979
A
1001-0408(2017)19-2613-04
2016-11-11
2017-02-24)
(编辑:林 静)
天津市中医药管理局中医中西医结合科研课题(No. 13164);天津市滨海新区塘沽科技发展专项资金项目(No.2013MS05-03);天津市滨海新区卫生局一般扶持项目(No.2014BWKY014)
*副研究员,硕士。研究方向:中药药理、肿瘤药理。电话:022-27236112。E-mail:zxmm lg@eyou.com
#通信作者:研究员,硕士生导师,博士。研究方向:肝胆胰疾病。电话:022-27313851。E-mail:jtss@sina.com
DOI 10.6039/j.issn.1001-0408.2017.19.06
