不同Ti4+含量掺杂Li[Li0.2Mn0.54Ni0.13Co0.13]O2的制备和电化学性能
2017-08-10范宏
范宏
(承德护理职业学院药学检验系生化化学教研室,河北承德067000)
电池材料
不同Ti4+含量掺杂Li[Li0.2Mn0.54Ni0.13Co0.13]O2的制备和电化学性能
范宏
(承德护理职业学院药学检验系生化化学教研室,河北承德067000)
采用钛酸四丁酯[Ti(OC4H9)4]水解和 900℃高温烧结工艺制得不同 Ti4+含量掺杂下的Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2正极材料。采用XRD、SEM等表征方法对Ti4+掺杂前后的Li[Li0.2Mn0.54Ni0.13Co0.13]O2颗粒的微观结构、表面形貌进行分析研究,发现掺杂前后材料的结构并未明显变化。电化学测试结果表明,虽然Ti4+表现为非电化学活性,使得掺杂有Ti4+的正极材料其首次充放电比容量有所降低,但是在高倍率性能及循环性能测试中,Ti4+掺杂改性效果表现明显。其中当Ti4+掺杂量为x=0.02时,其倍率性能及循环性能最佳。在5C高倍率下放电,Li[Li0.2Mn0.54Ni0.13Co0.13]0.98Ti0.02O2样品的放电比容量要比未掺杂样品高出约 20mA·h/g。而且经过 100次循环后,Li[Li0.2Mn0.54Ni0.13Co0.13]0.98Ti0.02O2样品的放电比容量仍有187.9mA·h/g,容量保持率高达96.8%。而未掺杂样品的100次循环后容量保持率仅有91.2%。
x Li2MnO3·(1-x)LiMO2;Ti;掺杂改性;电化学性能
随着锂离子电池在日常生活中的大量广泛应用,人们对其能量密度的需求日益增加[1]。而传统的锂离子电池正极材料,像层状LiCoO2[2],橄榄石状的LiFePO4[3]和尖晶石状的LiMn2O4[4],由于其放电比容量低,无法满足电子设备及仪器的大功率需求。最新研究合成的富锂锰基正极材料x Li2MnO3·(1-x)LiMO2(M=Mn,Ni,Co),以其成本低廉,实际可利用比容量超过250mA·h/g,成为发展能量密度大于300W·h/kg锂离子电池正极材料的重要候选材料[5],从而受到广大科研人员的深入研究调查。尽管富锂锰基正极材料具有较高的充放电比容量,然而,由于其自身组分、结构和较高的充电电压等因素,使得该高容量层状富锂正极材料存在较大的首次不可逆容量损失(50~100mA·h/g),循环稳定性和高倍率性能也不理想,从而限制了在电子产品、新能源汽车上的应用[6]。
为了使得该种材料能迅速应用在实际生活中,科研人员尝试多种方法来解决上述存在的问题,其中离子掺杂、表面包覆、混合处理等方法得到证实,能够切实对该富锂锰基正极材料在放电过程中存在的问题进行改善。其中,离子掺杂改性以其方法简单易操作、合成效果明显,得到科研工作者和产业化需求的大量研究。
但是离子掺杂改性要求掺杂离子与正极材料中的Mn4+(0.053 nm)、Ni2+(0.069 nm)、Co3+(0.068 5 nm)和Li+(0.076 nm)半径相近,以便离子之间能够易于替换[7]。Ti4+(0.061nm)与上述阳离子半径相似,易达到替换效果。另外,J.A.Saint等[8]研究表明,Ti能稳定正极材料的晶体结构,抑制正极材料与电解液接触副反应的发生。因而在本文中,以Ti4+作为掺杂改性离子,研究了不同Ti4+掺杂量对Li[Li0.2Mn0.54Ni0.13Co0.13]O2的形貌、微观结构及电化学性能的影响。
1 实验
1.1 Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)样品的制备
将 MnSO4·H2O、NiSO4·7H2O、CoSO4·6H2O按一定的化学计量比溶解在水溶液中,以氨水为络合剂,NaOH为沉淀剂,采用共沉淀法合成[Mn0.54Ni0.13Co0.13](OH)1.6前驱体。
将钛酸四丁酯[Ti(OC4H9)4]溶于乙醇后得到悬浮液,并不停搅拌。随后向悬浮液中加入设定配比量的[Mn0.54Ni0.13Co0.13](OH)1.6前驱体粉末。在水蒸气的作用下,Ti(OC4H9)4会水解为TiO2,沉积在前驱体颗粒表面。将上述混合液放入水浴锅中持续搅拌并加热,直至乙醇挥发蒸干。将所得混合物与锂盐在900℃高温下混合煅烧,其中Li+、Ti4+在烧结过程中会向[Mn0.54Ni0.13Co0.13](OH)1.6颗粒内扩散,最终制得不同 Ti4+含量掺杂的 Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)试样。
1.2 Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)样品的表征
采用D/max-2500型 X 射线衍射仪对Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)试样进行XRD分析,使用Cu靶Kα射线,管压为40 kV,电流为40mA,扫描速度为2(°)/min,步长为0.02°,扫描范围(2θ)为10~80°。采用JSM-5600LV型扫描电镜对合成样品的表面形貌、颗粒大小进行观察。通过Optima5300DV型电感耦合等离子体发射光谱仪(ICP-OES)对 Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)4个样品进行元素成分比例分析。
1.3 Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)样品的电化学性能测试
以N-甲基吡咯烷酮(NMP)为溶剂,将正极活性材料、乙炔黑、聚偏二氟乙烯(PVDF)按质量比8∶1∶1配制混合浆料,均匀涂在20μm厚的铝箔上。将Al箔在100℃、-0.1MPa干燥箱中放置12 h后,用压片机冲成直径12mm的圆片。然后在充满氩气的手套箱中组装CR2032型扣式电池:以得到的圆片作为正极,金属锂片作为负极,Celgard2300聚丙烯多孔膜作为隔膜,滴入1mol/L的LiPF6/EC-EMC(体积比1∶1)的复合电解液。采用LANDCT2001A电池测试系统对组装的电池进行电化学性能测试,控制温度为25℃恒温,电压测试区间为2.0~4.8 V,电流密度为1C=250mA/g。
2 结果与讨论
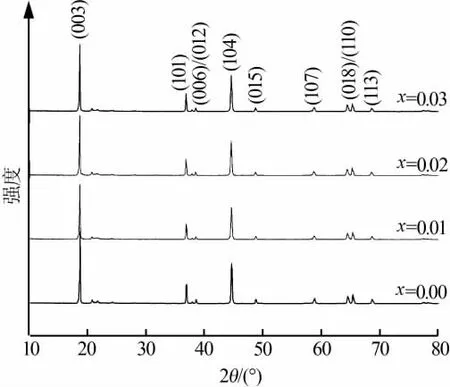
图1 Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)正极材料的XRD谱图
图1为Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)的XRD谱图。掺杂前后均表现出具有x Li2MnO3·(1-x)LiMO2正极材料的典型结构特征,其衍射峰为α-NaFeO2层状结构特征峰,归属于六方晶系、R-3m空间群。在20~25°的比较弱的衍射峰对应着过渡金属层中LiMn6排列分布,即Li+与Mn2+之间形成的超晶格有序结构[9]。同时,图1中(006)/(012)和(018)/(110)两对衍射峰分裂明显,说明所制备的样品层状结构完整,晶型良好[10]。另外掺杂前后材料衍射峰无显著变化,且无杂质峰存在,说明Ti4+已掺杂进入正极晶体内部结构中。
表1为Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)正极材料的晶格参数及(003)/(104)峰强比值。其中,c/a值代表着材料试样的层状结构稳定性,(003)与(104)的衍射峰强度比I(003)/I(104)表征着由于Li+和Ni2+相似的离子半径所造成的材料阳离子混排[11]。特别是当样品的晶胞参数 c/a值大于4.899时,说明合成的正极材料的层状结构稳定[12]。当I(003)/I(104)值超过1.2时,说明其材料中的阳离子混排度低[13]。而表1中c/a值及I(003)/I(104)值均较高,说明 Li[Li0.2Mn0.54Ni0.13Co0.13]O2在经过不同含量 Ti4+掺杂后,其材料的层状结构都比较稳定,阳离子混排度较低。
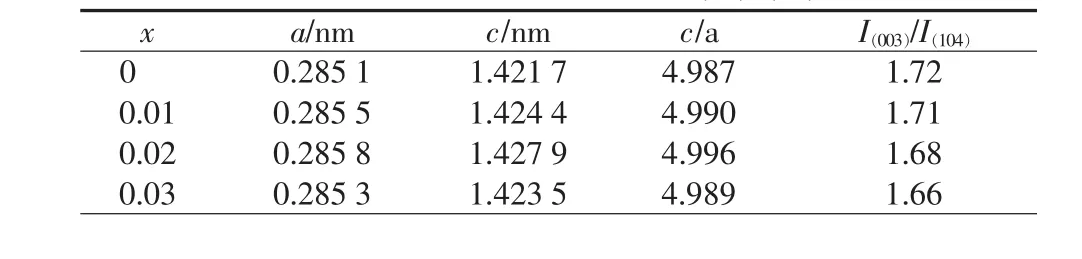
表1 Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)正极材料的晶格参数及I(003)/I(104)

图2 Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)正极材料的SEM图
图 2为Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)正极材料的SEM图。从图2可以看到,所有样品颗粒形貌都比较相似,由直径为200~600 nm的块状颗粒组成,并且无明显团聚现象,说明结晶性能良好。Ti4+掺杂到Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极后,并未明显改变材料的形貌,说明Ti4+已成功掺杂到Li[Li0.2Mn0.54Ni0.13Co0.13]O2晶胞颗粒中。 表 2为Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)正极材料的元素含量分析检测结果。根据表2的数据,可以看到经过实验合成的不同Ti4+掺杂量的Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料,其Mn,Ni,Co和Ti元素的含量与试验设计值相近,说明合成试样的元素含量比达到实验的预期要求。
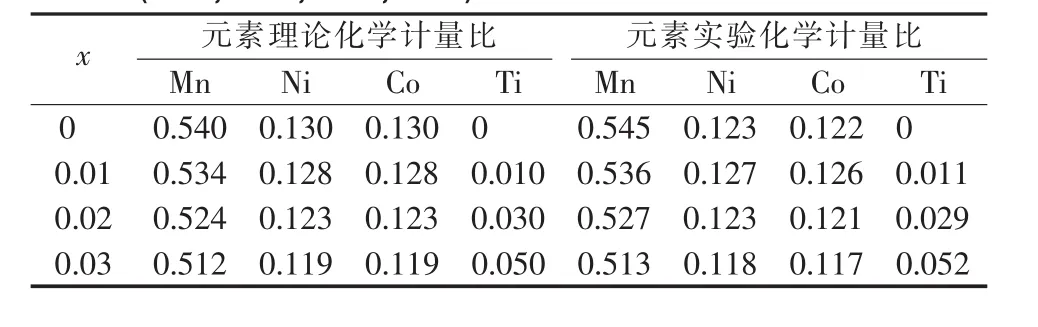
表2 Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)正极材料的ICP检测结果
图 3为 Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)正极材料在2.0~4.8 V电压区间,0.1C倍率下的首次充放电曲线。4个样品的首次充电曲线表现出相同的特征,均为4.5 V以下电压逐渐上升区域和4.5 V充电平台区域。当电压低于4.5 V时,对应着Ni、Co元素的氧化反应,即Ni2+氧化到Ni4+、Co3+氧化到Co4+。当充电电压达到4.5 V平台时,Li+从Li2MnO3组分中脱出,与O2-结合最终以Li2O的形式不可逆地脱出,造成首次放电过程中不可逆容量损失[14]。随着Ti4+掺杂量的增多,4种正极材料样品的首次充放电比容量分别为 380.1/244.3、374.4/235.6、373.2/228.4、367.5/218.2mA·h/g。Ti4+呈电化学惰性,无法参加电化学反应,因而会降低Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料中有效活性物质,最终使得掺杂有Ti4+的Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)正极材料的首次充放电比容量出现不同程度的减少。
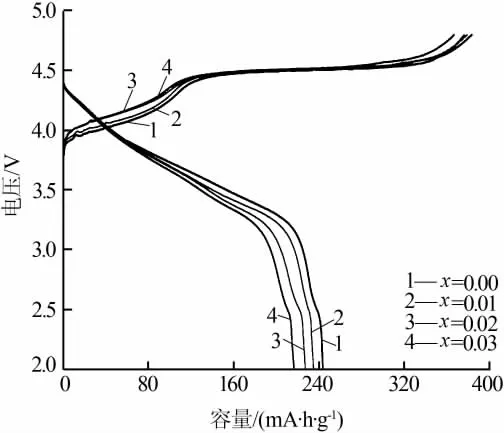
图3 Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)正极材料的首次充放电曲线
图4为Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)正极材料的倍率循环图。从图4看出,随着 Ti4+掺杂量的逐渐增加,Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料的倍率性能先上升再下降。其中当Ti4+掺杂量为x=0.02时,其倍率性能最佳,在0.1C、0.2C、0.5C、1C、2C、5C倍率下放电比容量分别为245.1、233.2、196.7、174.5、157.4、134.4 mA·h/g。而未掺杂Ti4+的正极材料,其在不同倍率下的放电比容量分别是 238.7、222.3、184.8、164.4、145.4、115.3 mA·h/g。随着放电倍率逐渐升高,Ti4+的掺杂改性对Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料的电化学性能提升的效果更加明显。这主要是因为掺杂离子Ti4+半径较Co3+和Mn4+大,掺杂有Ti4+的正极材料的晶胞常数及体积变大,扩展了Li+在充放电过程中嵌入脱出的扩散通道,降低了Li+的扩散阻力,因而提高了其倍率性能[15]。但是当Ti4+掺杂量达到x=0.03时,其倍率性能反而下降,这是因为过多的电化学惰性Ti4+掺杂,使得正极材料中参与电化学反应的有效活性物质减少所致。
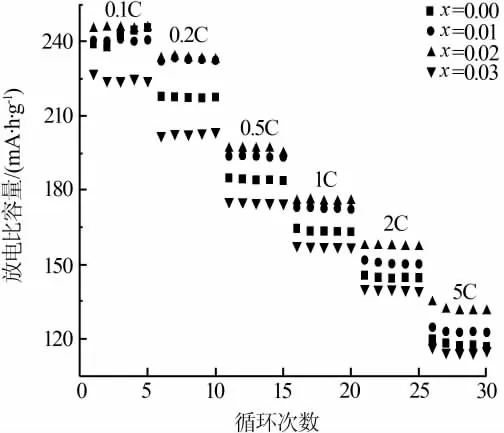
图4 Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)正极材料的倍率循环图
图5为Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)正极材料在0.5C,2.0~4.8 V间的循环性能。从图5可以看到,随着循环次数的增加,所有样品的放电比容量都出现不同程度的下降。这是因为在电池充放电过程中,电解液不断侵蚀正极材料,并与其发生副反应,产生的副产物会粘附在正极材料表面,增加SEI膜界面阻抗,影响Li+的嵌入脱出速率,使得放电性能下降。图中掺杂有Ti4+的正极材料,其放电比容量随充放电反应进行,明显比未掺杂正极要衰减缓慢。其中Ti4+掺杂量为x=0.02的样品,其放电比容量不仅最高,循环性能也是最佳。经过100次循环后,其放电比容量仍有187.9mA·h/g,容量保持率高达96.8%。而未掺杂的样品100次循环后容量保持率仅有91.2%。这说明掺杂有Ti4+的正极材料,在充放电过程中,电解液与正极颗粒表面的副反应受到抑制,Li[Li0.2Mn0.54Ni0.13Co0.13]O2的晶体结构在电解液的侵蚀下比较稳定,从而缓解了电池的循环放电容量衰减。而当Ti4+的掺杂量过高时,循环性能反而下降,主要还是非电化学活性的Ti4+所引起的。
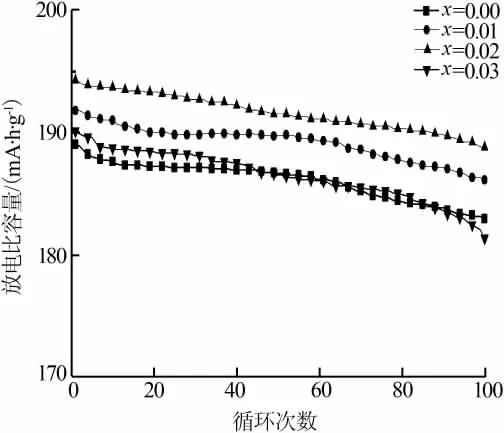
图5 Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)正极材料的循环性能
通过倍率性能和循环性能测试发现,掺杂有Ti4+的正极材料样品,其电化学综合性能明显优于未掺杂样品。但是当Ti4+掺杂量过高,其倍率性能和循环性能由于正极材料中有效活性物质含量减少,反而有所下降,说明离子掺杂改性中掺杂量对改性效果也十分重要。
3 结论
以NaOH为沉淀剂,氨水为络合剂,采用共沉淀方法合成[Mn0.54Ni0.13Co0.13](OH)1.6前驱体,并通过溶液水解与高温烧结工艺相结合制得Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2(x=0,0.01,0.02,0.03)正极材料。XRD与SEM结果显示,Ti4+的掺杂改性并没有改变Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料的晶体结构及颗粒形貌特征。同时电化学测试结果表明,虽然Ti4+表现为非电化学活性,使得掺杂有Ti4+的正极材料,其首次充放电比容量有所降低。但是在高倍率性能及循环性能测试中,Ti4+掺杂改性效果表现明显。其中当Ti4+掺杂量为x=0.02时,其倍率性能及循环性能最佳。在5C高倍率下放电,Li[Li0.2Mn0.54Ni0.13Co0.13]0.98Ti0.02O2样品的放电比容量要比未掺杂样品高出约20mA·h/g。而且经过100次循环后,Li[Li0.2Mn0.54Ni0.13Co0.13]0.98Ti0.02O2样品的放电比容量仍有187.9mA·h/g,容量保持率高达96.8%。而未掺杂的样品100次循环后容量保持率仅有91.2%。Ti4+掺杂改性样品的优异电化学性能,主要归因于Ti4+的掺杂不仅扩展了Li+在充放电过程中嵌入脱出的扩散通道,降低了Li+的扩散阻力,而且抑制了电解液与正极颗粒表面的副反应发生,维持正极材料表面的晶体结构。说明Ti4+掺杂Li[Li0.2Mn0.54Ni0.13Co0.13]O2正极材料,是一条切实有效的改性方法。
[1] EtacheriV,Marom R,ElazariR,etal.Challenges in thedevelopment ofadvanced Li-ion batteries:a review[J].Energy&Environmental Science,2011,4:3243-3262.
[2] TangW,Liu L L,Tian S,etal.Nano-LiCoO2as cathodematerialof large capacity and high rate capability for aqueous rechargeable lithium batteries[J].ElectrochemistryCommunications,2010,12(11):1524-1526.
[3] 许涛,宫璐,曹利娜,等.磷酸铁锂电池铁溶解对电池性能的影响[J].无机盐工业,2016,48(4):76-78.
[4] ZhaoS,BaiY,ChangQJ,etal.SurfacemodificationofspinelLiMn2O4with FeF3for lithium ion batteries[J].Electrochimica Acta,2013,108:727-735.
[5] Wu Q H,Qu B,Tang J,et al.An alumina-coated Fe3O4-reduced graphene oxide composite electrode as a stable anode for lithiumion battery[J].Electrochimica Acta,2015,156:147-153.
[6] Yuan W,Zhang H Z,Liu Q,et al.Surface modification of Li(Li0.17Ni0.2Co0.05Mn0.58)O2with CeO2as cathode material for Li-ion batteries[J].Electrochimica Acta,2014,135:199-207.
[7] Deng ZQ,Manthiram A.Influence of cationic substitutions on the oxygen loss and reversible capacity of lithium-rich layered oxide cathodes[J].Journal of Physical Chemistry C,2011,115:7097-7103.
[8] Saint J A,Best A S,Hollenkamp A F,et al.Compatibility of LixTiyMn1-yO2(y=0,0.11)electrode materials with pyrrolidiniumbased ionic liquid electrolyte systems[J].Journalof the ElectrochemicalSociety,2008,155(2):A172-A180.
[9] Ju JH,Cho SW,Hwang SG,etal.Electrochemical performance of Li[Co0.1Ni0.15Li0.2Mn0.55]O2modified by carbons as cathode materials[J].Electrochimica Acta,2011,56:8791-8796.
[10] Zheng JM,Wu XB,YangY.Improved electrochemicalperformance of Li[Li0.2Mn0.54Ni0.13Co0.13]O2cathodematerial by fluorine incorporation[J].Electrochimica Acta,2013,105:200-208.
[11] Jin X,Xu Q J,Liu HM,etal.Excellent rate capability ofMg doped Li[Li0.2Ni0.13Co0.13Mn0.54]O2cathodematerial for lithium-ion battery[J].Electrochimica Acta,2014,136:19-26.
[12] Yabuuchi N,Ohzuku T.Novel lithium insertion material of LiCo1/3Ni1/3Mn1/3O2foradvanced lithium-ion batteries[J].Journalof Power Sources,2003,119/120/121:171-174.
[13] Wang Z Y,Liu E Z,He C N,et al.Effect of amorphous FePO4coating on structure and electrochemical performance of Li1.2Ni0.13Co0.13Mn0.54O2as cathodematerial for Li-ion batteries[J]. JournalofPower Sources,2013,236:25-32.
[14] Song BH,LaiM O,Lu L.Influence of Ru substitution on Li-rich 0.55Li2MnO3·0.45LiNi1/3Co1/3Mn1/3O2cathode for Li-ion batteries[J].Electrochimica Acta,2012,80(1):187-195.
[15] Kang SF,Qin H F,Fang Y,etal.Preparation and electrochemical performance of yttrium-doped Li[Li0.20Mn0.534Ni0.133Co0.133]O2as cathodematerial for lithium-ion batteries[J].Electrochimica Acta,2014,144:22-30.
联系方式:xauatme@foxmail.com
Preparation and electrochem icalpropertiesof Li[Li0.2M n0.54Ni0.13Co0.13]O2doped w ith different contentsof Ti4+
Fan Hong
(BiologicalChemistry Lab,Departmentof Pharmaceutical Inspection,Chengde Nursing VocationalCollege,Chengde 067000,China
The Li[Li0.2Mn0.54Ni0.13Co0.13]1-xTixO2cathodematerials doped with different contents of Ti4+were synthesized via Ti(OC4H9)4hydrolysis and 900℃ high temperature sintering process.The microstructure and surface morphology of Li[Li0.2Mn0.54Ni0.13Co0.13]O2before and after Ti4+dopingwere characterized by XRD and SEM.Results revealed that themicrostructure and surfacemorphology did not change distinctly before and after Ti4+doping.The electrochemical testing results demonstrated that the initial charge and discharge capacities of the Ti4+doping cathodes declined owing to the electro chemical inactive of Ti4+.However the Ti4+dopingmodification could efficiently improve the high rate capacity and cycle performance.When x=0.02,the sample showed the optimal rate capacity and cycle performance.The discharge capacity of Li[Li0.2Mn0.54Ni0.13Co0.13]0.98Ti0.02O2wasabout20mA·h/g larger than thatofundoped one at5C rate.Besidesa high capacity retention of96.8%(187.9mA·h/g)after100 cyclesat0.5C ratewasobtained for the Li[Li0.2Mn0.54Ni0.13Co0.13]0.98Ti0.02O2sample,while the undoped sample only delivered the capacity retention of91.2%.
x Li2MnO3·(1-x)LiMO2;Ti;dopingmodification;electrochemicalproperty
TQ131.11
A
1006-4990(2017)07-0069-05
2017-01-19
范宏(1968— ),女,硕士,副教授,主要从事材料化学研究,近5年发表论文11篇。
