胃肠胰神经内分泌肿瘤的临床病理特点(附104例分析)
2017-08-09吴霜肖秀丽叶入裴黄廷玉刘怡君龙汉安
吴霜,肖秀丽,叶入裴,黄廷玉,刘怡君,龙汉安
(西南医科大学附属医院,四川泸州646000)
胃肠胰神经内分泌肿瘤的临床病理特点(附104例分析)
吴霜,肖秀丽,叶入裴,黄廷玉,刘怡君,龙汉安
(西南医科大学附属医院,四川泸州646000)
目的 探讨总结胃肠胰神经内分泌肿瘤(GEP-NEN)的临床病理特点。方法 收集104例GEP-NEN患者的性别、年龄、肿瘤部位、病理检查结果、瘤体最大径、WHO分级、淋巴结及远处转移情况、免疫组化结果[细胞增殖指数(Ki-67)、嗜铬粒素A(CgA)、突触素(SYN)]等资料并探讨GEP-NEN的临床病理特点。结果 本组GEP-NEN的发病部位为结直肠(37.50%)、胃(26.92%)、食管(25.96%),胰腺仅占9.62%。104例患者中男女比例为1.67:1,胰腺的神经内分泌肿瘤(NEN)中女性居多(P<0.05)。患者年龄20~86岁,其中胰腺NEN患者发病平均年龄较其他消化道NEN患者小。WHO分级为神经内分泌瘤(NET)G128例(26.92%)、NET G214例(13.46%)、神经内分泌癌(NEC)62例(59.62%),胰腺NEN中NEC所占比例低于其他消化道NEN(P<0.05)。本组有淋巴结转移49例,有远处转移19例,胰腺NEN患者淋巴结转移率相对最低。病理检查显示,GEP-NEN中NET、NEC各有较为典型的组织病理学形态。免疫组化染色CgA阳性68例(65.38%),SYN阳性88例(84.62%)。不同部位肿瘤组织中SYN表达率差异也有统计学意义。结论 GEP-NEN最常见发病部位为结直肠和胃,男性多于女性;与其他消化道NEN相比,胰腺NEN相对少见,女性患者居多,发病年龄小,恶性程度低;大多数GEP-NEN具有较典型的组织病理学形态,肿瘤组织多表达CgA、SYN。
神经内分泌肿瘤;胃肠胰神经内分泌肿瘤;嗜铬粒素A;突触素;细胞增殖指数
神经内分泌肿瘤(NEN)是起源于肽能神经元和神经内分泌细胞的一组异质性肿瘤,可发生于全身各个器官和组织,如食管、胃肠、胰腺、肺及支气管等,其中以消化系统最为常见。根据肿瘤的形态学、增殖活性及分化程度,可分为神经内分泌瘤(NET)和神经内分泌癌(NEC)[1]。2010年WHO分类中认为NEN至少为潜在恶性[2]。NEN的特点是能够分泌与储存不同的肽类和神经胺[3]。过去认为胃肠胰神经内分泌肿瘤(GEP-NEN)能够生产肽类活性物质,可引起特异性的激素综合症[4]。目前学者们逐渐认识到GEP-NEN绝大部分为无功能性肿瘤[5]。由于GEP-NEN较少见,缺乏特异性症状,诊断比较困难,且国内相关研究较少,故本研究收集了2010年9月~2016年8月西南医科大学附属医院确诊的104例GEP-NEN患者的病例资料,探讨GEP-NEN的临床病理特点,现报告如下。
1 资料与方法
1.1 研究对象 西南医科大学附属医院经病理确诊的GEP-NEN患者104例,诊断标准参考中国胃肠胰NEN病理学诊断共识意见、美国国立癌症网络指南、欧洲NEN协会共识[6,7]。
1.2 资料收集方法 收集患者的性别、年龄、肿瘤部位、病理检查结果、瘤体最大径、WHO分级[8]、淋巴结及远处转移情况、免疫组化结果[细胞增殖指数(Ki-67)、嗜铬粒素A(CgA)、突触素(SYN)]等资料。
1.3 统计学方法 采用SPSS17.0统计软件包进行分析。多样本间率的比较采用 检验和Fisher确切概率法,各组间WHO分级比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
104例患者中,肿瘤部位为结直肠39例(37.50%)、胃28例(26.92%)、食管27例(25.96%)、胰腺10例(9.62%)。患者性别男65例、女39例,男女比例为1.67∶1,胰腺NEN以女性居多(P均<0.05)。患者年龄20~86岁,其中肿瘤位于食管、胃、结直肠、胰腺者平均年龄分别为62.6、54.6、58.9、43.6岁,胰腺NEN患者发病平均年龄较其他发病部位者小。肿瘤最大径≤2 cm 60例、>2 cm 44例。WHO分级为NET G128例(26.92%)、NET G214例(13.46%)、NEC 62例(59.62%),胰腺NEN恶性程度高的NEC所占比例低于其他消化道NEN(P均<0.05)。有淋巴结转移49例,有远处转移19例,胰腺NEN患者淋巴结转移率相对最低。不同发病部位的GEP-NEN患者临床病理参数见表1。

表1 不同发病部位的GEP-NEN患者临床病理参数(例)
NET光镜下瘤细胞可排列成实性巢状、小梁状、缎带状或者腺管样;肿瘤细胞均匀一致,呈多边形,胞质中等或丰富,嗜伊红染色,部分呈现细颗粒状;细胞呈圆形或卵圆形,形态规则,核仁一般不明显(图1A);肿瘤细胞外周被纤维间质和丰富的小血管围绕(图1B)。NET Ki-67指数≤20%(图1C)。NEC包括小细胞癌和大细胞神经内分泌癌。小细胞癌的瘤细胞小(体积一般小于3个淋巴细胞),似淋巴细胞,胞质稀少,核深染,核仁不明显,核分裂象易见,呈巢团状排列或弥漫分布,常伴坏死(图2A、B);大细胞神经内分泌癌的瘤细胞体积常大于3个淋巴细胞,胞质丰富,核仁明显,核分裂象易见,呈菊形团状排列或弥漫分布,常伴坏死。NEC Ki-67指数>20%(图2C)。68例患者CgA呈阳性,阳性率为65.38%;88例患者SYN呈阳性,阳性率为84.62%。不同部位GEP-NEN患者免疫组化染色CgA、SYN阳性结果见表2。不同部位肿瘤组织中SYN阳性表达率差异有统计学意义。
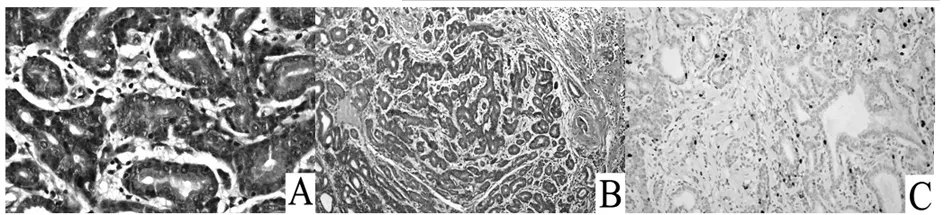
注:A示肿瘤细胞大小比较一致,形态规则,核较小,核分裂不易见;B示肿瘤细胞呈腺管状分布,肿瘤细胞外周被纤维间质围绕;C示Ki-67指数≤20%。
图1 胃NET G1组织病理切片镜下观察结果
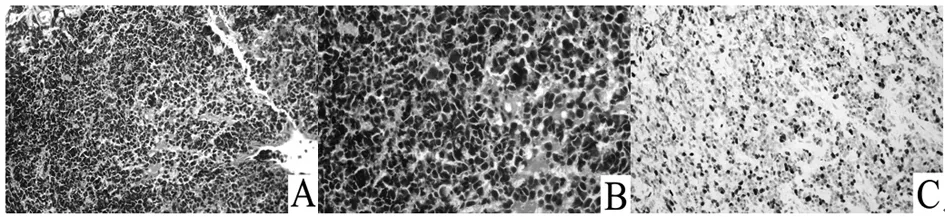
注:A示肿瘤细胞呈弥漫分布,瘤细胞小,细胞呈多边形;B示肿瘤细胞胞质稀少,核深染,伴有坏死;C示Ki-67指数>20%。
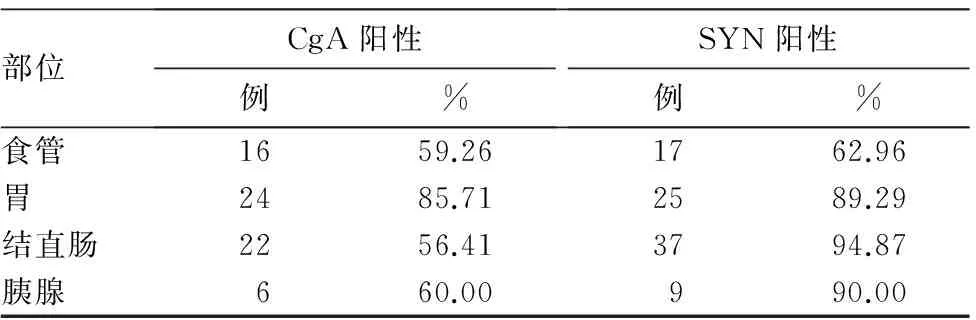
图2 食管小细胞型NEC组织病理切片镜下观察结果
3 讨论
NEN是一类较少见的肿瘤,约占消化道恶性肿瘤的2%。Yao等[9]研究显示美国NEN的发病率在30年内(1973~2004年)增长了3.8倍,其他国家及国内各地区NEN检出率也呈上升趋势[10~12]。NEN的检出率提高可能也与影像学、免疫组化等诊断技术的改进和消化道内镜的普及有关。NEN可发生于全身许多器官组织,由于消化道分布多种神经内分泌细胞,因而消化道的神经内分泌肿瘤最常见。由于GEP-NEN临床症状缺乏特异性,国内相关研究较少,且内陆地区对于GEP-NEN的认识和文献发表情况不及沿海地区,缺乏大样本报道。因此,我们收集了我院消化系统NEN患者的病例资料,分析其临床特点,为临床工作提供参考。
本研究104例GEP-NEN患者中,男性患者数量较女性患者多,男女比例为1.67∶1,与国内相关研究结果基本一致[13~15]。有学者[14]提出不同部位在性别分布上的比较差异具有统计学意义,与本研究结果相符。在我国,胃肠道与胰腺是NEN最常发生的部位,占NEN总数的55%~70%。在发达国家,GEP-NEN多发部位依次是直肠、空肠、胰腺和胃[9]。有学者[16]统计分析了11 427例NEN患者的资料,发现小肠NEN最多,占44.7%,其次依次是直肠(19.6%)、阑尾(16.7%)、结肠(10.6%)和胃(7.2%)。本研究中37.50%(39/104)的肿瘤发生在结直肠,其次分别为胃(26.92%)、食管(25.96%)、胰腺(9.62%),结直肠和胃是GEP-NEN最常见的部位,该结果与国内研究较为一致[14,15]。我们分析国内和国外患者GEP-NEN好发部位的差异可能与环境、遗传、人种差异等有关。有学者[9]还发现在不同数据库之间GEP-NEN发病部位的差异与性别、种族因素均有关系。欧美地区以空回肠、直肠和肺多发,亚太地区以直肠、胃及胰腺多发。
本研究发现,胰腺NEN患者发病年龄较其他消化道NEN小,且胰腺NEN患者淋巴结转移率相对最低,这与国内相关研究较一致[17]。有学者[18]提出食管NEN早期可合并远处转移,进展迅速。并且胃NEN与胃腺癌相比,更易出现淋巴结转移、肝转移和瘤栓。本研究中食管、胃、结直肠NEN的淋巴结转移率分别为62.96%、50.00%、38.46%。关于肿瘤直径与肿瘤转移之间的关系,研究者[19]提出直径≤2 cm的NET转移率是14.2%,直径>2 cm的NET为38.4%。孟曼等[20]将直肠NEN按照不同病理分级分组,发现G1、G2、G3级病例中肿瘤直径>2 cm者所占比例分别为0、23.81%、50%,认为所以将肿瘤直径2 cm作为转移判断指标,具有很好的特异度和敏感度。关于GEP-NEN远处转移率,本研究与国内报道不尽相同,可能与样本量较少、病例资料不齐全等有关。我们还发现,胰腺NEN多数为恶性程度低的NET,且恶性程度高的NEC所占比例低于其他消化道NEN患者,提示肿瘤原发部位不同,恶性程度可能存在一定差异。
虽然GEP-NEN具有典型的组织病理学形态,但与一般腺癌难以区分,临床中常诊断为腺癌伴神经内分泌分化等。为了避免临床医师对治疗方面的疑惑和对概念的混淆,临床诊断中不推荐使用“腺癌伴神经内分泌分化”的诊断名称[1,7,21],建议在进行诊断时,采用免疫组化染色等方法以提高诊断准确性。根据国外相关诊疗指南和国内共识,GEP-NEN的必检项目包括神经内分泌标志物(SYN、CgA)和增殖指数(Ki-67/MIB1)[22,23]。Ki-67可反映肿瘤细胞的增殖活性,若其高表达则提示细胞增殖活跃。有学者报道Ki-67指数是GEP-NEN的独立预后指标[24]。该指标也是GEP-NEN的分级标准之一。CgA为嗜铬颗粒,存在于神经内分泌细胞和神经元的分泌囊泡内,但此类囊泡并不是所有的神经内分泌细胞均含有。CgA是目前公认的极具价值的GEP-NEN肿瘤标志物。SYN是一种位于突触前囊泡内的糖蛋白,绝大多数的NEN细胞可弥漫表达SYN。本研究中GEP-NEN总体CgA阳性率为65.38%、SYN阳性率为84.62%,SYN阳性率较CgA阳性率更高,与相关学者得出的结果相符[15,25],并且本研究发现不同部位肿瘤组织中SYN表达率差异也有统计学意义。本研究中结直肠SYN的阳性率为94.87%,而CgA的阳性率仅为56.41%,主要是因为在乙状结肠和直肠肿瘤多表达CgB,而一般抗体只是抗CgA或CgA与CgB的混合,因而阳性率较低。SYN可以作为肠道NEN的首选检测标志物,其在肠道的表达较为稳定。
综上所述,GEP-NEN相对男性好发,胰腺NEN与其他消化道NEN相比恶性程度较低;虽然大多数GEP-NEN具有比较典型的组织病理学形态,但诊断还需要参考免疫组化染色结果,CgA、SYN阳性对诊断GEP-NEN有较高的敏感度。
[1] 李增山.胃肠胰神经内分泌肿瘤分类及病理学进展[J].浙江大学学报(医学版),2016,45(1):10-23.
[2] Strosberg J, Nasir A, Coppola D, et al. Correlation between grade and prognosis in metastatic gastroenteropancreatic neuroendocrine tumors[J]. Hum Pathol, 2009,40(9):1262-1268.
[3] Massironi S, Sciola V, Peracchi M, et al. Neuroendocrine tumors of the gastro-entero-pancreatic system[J]. World J Gastroenterol, 2008,14(35):5377-5384.
[4] Garcia-Carbonero R, Capdevila J, Crespo-Herrero G, et al. Incidence, patterns of care and prognostic factors for outcome of gastroenteropancreatic neuroendocrine tumors (GEP-NETs): results from the National Cancer Registry of Spain (RGETNE)[J]. Ann Oncol, 2010,21(9):1794-1803.
[5] Rindi G, Bordi C, La RS, et al. Gastroenteropancreatic (neuro)endocrine neoplasms: the histology report[J]. Dig Liver Dis, 2011,43(3):S356-S360.
[6] 2013年中国胃肠胰神经内分泌肿瘤病理诊断共识专家组.中国胃肠胰神经内分泌肿瘤病理诊断共识(2013版)[J].中华病理学杂志,2013,42(10):691-694.
[7] Vinik AI, Woltering EA, Warner RR, et al. NANETS consensus guidelines for the diagnosis of neuroendocrine tumor[J]. Pancreas, 2010,39(6):713-734.
[8] Fred T,Elaine S,Sunil R ,et al.The WHO classification of tumors of the digetive system[M]. Lyon: IARC Press, 2010:13.
[9] Yao JC, Hassan M, Phan A, et al. One hundred years after "carcinoid":epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States[J]. J Clin Oncol, 2008,26(18):3063-3072.
[10] Scherubl H, Streller B, Stabenow R, et al. Clinically detected gastroenteropancreatic neuroendocrine tumors are on the rise: Epidemiological changes in Germany[J]. World J Gastroenterol, 2013,19(47):9012-9019.
[11] Starzynska T, Deptala A, Krolicki L, et al. Colorectal neuroendocrine neoplasms - management guidelines (recommended by the Polish Network of Neuroendocrine Tumours)[J]. Endokrynol Pol, 2013,64(6):494-504.
[12] Fraenkel M, Kim M, Faggiano A, et al. Incidence of gastroenteropancreatic neuroendocrine tumours: a systematic review of the literature[J]. Endocr Relat Cancer, 2014,21(3):R153.
[13] 郭林杰,唐承薇.中国胃肠胰神经内分泌肿瘤临床研究现状分析[J].胃肠病学,2012,17(5):276-278.
[14] 高尤亮,王晨,曾德华,等.消化系统神经内分泌肿瘤389例临床病理分析[J].吉林医学,2014,35(7):1392-1393.
[15] 高欣,许春舫,郭凌川,等.苏州地区146例消化系统神经内分泌肿瘤流行病学和临床病理特征分析[J].山东医药,2015,55(44):45-47.
[16] Maggard MA, O'Connell JB, Ko CY. Updated Population-Based Review of Carcinoid Tumors[J]. Ann Surg, 2004,240(1):117-122.
[17] 叶必星,林琳.胃肠胰腺神经内分泌肿瘤的临床病理特征分析[J].中华消化杂志,2010,30(5):301-304.
[18] Vos B, Rozema T, Miller RC, et al. Small cell carcinoma of the esophagus: a multicentre Rare Cancer Network study[J]. Dis Esophagus, 2011,24(4):258-264.
[19] Soga J. Early-stage carcinoids of the gastrointestinal tract: an analysis of 1914 reported cases[J]. Cancer, 2005,103(8):1587-1595.
[20] 孟曼,令狐恩强,赵坡,等.不同病理分级的直肠神经内分泌肿瘤的临床特征与预后分析[J].中华消化外科杂志,2014,13(10):789-792.
[21] Scardoni M, Vittoria E, Volante M, et al. Mixed Adenoneuroendocrine Carcinomas (MANECs) of the Gastrointestinal Tract: Targeted Next Generation Sequencing Suggests a Monoclonal Origin of the Two Components[J]. Neuroendocrinology, 2014,100(4):310-316.
[22] Kulke MH, Anthony LB, Bushnell DL, et al. NANETS treatment guidelines: well-differentiated neuroendocrine tumors of the stomach and pancreas[J]. Pancreas, 2010,39(6):735-752.
[23] Ramage JK. Guidelines for the management of gastroenteropancreatic neuroendocrine (including carcinoid) tumours[J]. Gut, 2012,61(1):6-32.
[24] Foltyn W, Zajcki W, Marek B, et al. The value of the Ki-67 proliferation marker as a prognostic factor in gastroenteropancreatic neuroendocrine tumours[J]. Endokrynol Pol, 2012,63(5):362-366.
[25] 钱小星,杨仁保,周杭城.嗜铬素A、突触素联合神经内分泌激素检测对胃肠胰神经内分泌肿瘤诊断及预后临床价值[J].肝胆外科杂志,2015,23(2):148-151.
四川省科学技术专项资金计划项目(LY-55);泸州市政府-泸州医学院联合专项(2013LZLY-J28)。
龙汉安(E-mail:461158628@qq.com)
10.3969/j.issn.1002-266X.2017.27.023
R735.2
B
1002-266X(2017)27-0076-04
2017-03-08)
