外源茉莉酸甲酯对灵芝多糖及灵芝酸含量的影响
2017-08-09辛燕花张铁丹杨龙龙徐澜梁彬孟悦
辛燕花,张铁丹,杨龙龙,徐澜,梁彬,孟悦
(1.忻州师范学院,山西 忻州 034000; 2.广州万物生健康产业有限公司,广东 广州 510642)
外源茉莉酸甲酯对灵芝多糖及灵芝酸含量的影响
辛燕花1,2,张铁丹2,杨龙龙1,徐澜1,梁彬1,孟悦1
(1.忻州师范学院,山西 忻州 034000; 2.广州万物生健康产业有限公司,广东 广州 510642)
[目的]探寻外源茉莉酸甲酯对灵芝多糖及灵芝酸含量的影响。[方法]用含有不同浓度的茉莉酸甲酯在不同的发酵时间对液体培养基中的灵芝进行诱导培养。[结果]在发酵培养的第4天,添加外源茉莉酸甲酯浓度为50 μmol·L-1时,灵芝菌丝体和菌液中灵芝多糖含量最高,菌丝体中灵芝多糖含量为398.98 mg·g-1,是对照的1.83倍;菌液中的灵芝多糖含量为4.20 g·L-1,是对照的1.56倍。添加外源茉莉酸甲酯浓度为100μmol·L-1时,灵芝菌丝体及菌液中灵芝酸含量最多,灵芝菌丝体中灵芝酸为50.02 mg·g-1,是对照的1.93倍;菌液中灵芝酸含量为7.10 mg·L-1,是对照的2.21倍。[结论]说明外源茉莉酸甲酯能够有效的促进灵芝多糖和灵芝酸的合成。
灵芝; 茉莉酸甲酯; 多糖; 灵芝酸
灵芝(Ganodermalucidum)又称灵芝草、神芝、芝草、仙草、瑞草[1],在分类系统上是隶属于真菌门(Eumycota),担子菌亚门(Basidiomycotina)、层担子菌纲(Hymenomycetes),无隔担子菌亚纲(Holobasidiomycetidae),非褶菌目(Aphyllophorales),灵芝菌科(Ganodermataceae),灵芝属(Ganoderma)[2]。灵芝在我国已有久远的药用历史,始载于《神农本草经》,医书上一直将其列为上品,称其含有补中益气、滋阴强壮、扶正固本、延年益寿等功效。灵芝是《中国药典》收录的一种中药材,是食药同源的一种真菌,灵芝中的多糖、三萜、核苷、生物碱、氨基酸多肽、微量元素等活性物质和营养成分是其药效物质基础,其中三萜化合物和多糖是灵芝最主要的两大活性成分。灵芝酸是一种三萜类物质,目前分离得到100种左右,现代药理研究发现灵芝酸有保肝、抗肿瘤、抗 HIV-1及HIV-1蛋白酶活性、抗组织胺释放、抑制血管紧张素、抗氧化等作用[3~6]。灵芝多糖具有较强的免疫调节、抗氧化、抗肿瘤、抗衰老以及调节血糖等生理功能[7~10]。
研究表明,茉莉酸甲酯(methyljasmonate,MeJA)作为一种信号分子,可以诱导许多植物的生理反应[11,12],在植物中,茉莉酸甲酯可以诱导单萜类生物碱和类异戊二烯的生物合成,通过激活活性氧或者依赖于钙离子的蛋白激酶等手段进行防御反应等[13~16],在真菌中,茉莉酸甲酯参与调节隐球菌和青霉菌的生长[16],并且有研究者发现茉莉酸甲酯可以调控大型真菌灵芝中的三萜类合成代谢途径[17]。本试验在不同的发酵时间对灵芝液体培养基中添加不同浓度的茉莉酸甲酯进行诱导培养,探讨外源茉莉酸甲酯对灵芝多糖及灵芝酸含量的影响,为灵芝多糖和灵芝酸的提取提供新的理论基础。
1 材料与方法
1.1 材料
1.1.1 菌种
灵芝购于福建省农科院研究所。
1.1.2 培养基和菌株生长条件
PDA液体培养基:马铃薯(去皮)200 g,磷酸氢二钾3 g,硫酸镁2.0 g,葡萄糖20 g,25 ℃,180 r·min-1培养7 d。
1.1.3 主要试剂和仪器
茉莉酸甲酯购于Sigma公司;熊果酸标准品购于成都植标化纯生物技术有限公司;其他试剂均为分析纯。所用仪器:TYAIB 0.24/10高压蒸汽灭菌锅:宁波久兴医疗器械有限公司;SW-CJ-2F 净化工作台:上海博迅实业有限公司医疗设备厂;752 N紫外可见光光度计:上海仪电分析仪器有限公司。
1.2 试验方法
1.2.1 样品处理
以乙醇为助剂(2 mL·L-1),在不同发酵时间(3,4,5,6 d)的培养基中分别加入茉莉酸甲酯,使茉莉酸甲酯的终浓度分别为0、20、50、100、150、200 μmol·L-1,在25 ℃恒温室内的摇床上以180 r·min-1转速进行振荡发酵培养7 d,4 000 r·min-1离心10 min,收集菌液和菌丝体,菌丝体放入电热鼓风干燥箱40 ℃烘干,研成粉末后,待测。
对灵芝菌丝体及发酵液中灵芝多糖和灵芝酸进行检测。
1.2.2 灵芝多糖的测定
以葡萄糖为标准品,采用苯酚-硫酸法测定灵芝多糖含量,参照文献[18]进行。
1.2.2.1 标准曲线制作
以0.1 g·L-1的葡萄糖标准液绘制标准曲线。参照文献[18]进行。用紫外分光光度计在489 nm处,测吸光度。得标准曲线回归方程为A=6.121 4C+0.007 7,R2=0.999 4。
1.2.2.2 灵芝多糖提取
灵芝多糖提取参照文献进行[18],稍作改动:菌液中多糖的测定:取5.00 mL 菌液,加 15 mL 无水乙醇,混匀,静置12 h 后4 000 r·min-1离心10 min,弃上清,在室温下晾干沉淀,获得胞外粗多糖;然后加20.00 mL 双蒸水进行溶解后,对溶液进行脱色和脱蛋白处理后,测量吸光度,计算含量。 菌丝体中多糖的测定:精确称量烘干后的菌丝体0.100 0 g于50 mL离心管中,加入10.00 mL双蒸水,在微波炉中用中火(P50,1.3 kw)微波3 min后, 4 000 r·min-1离心10 min,取上清液5.00 mL于试管中,加15 mL 无水乙醇,静置12 h沉淀多糖,离心,弃上清,在室温下晾干沉淀,得到胞内粗多糖;在沉淀中加 10.00 mL 双蒸水进行溶解后,对溶液进行脱色和脱蛋白处理,测量吸光度,计算含量。
1.2.3 灵芝酸测定
以熊果酸为标准品,采用香草醛-冰醋酸和高氯酸法测定灵芝总三萜含量[18]。
1.2.3.1 标准曲线的制作
制作熊果酸标准曲线[18],在 548 nm 波长下测定吸光度,得标准曲线回归方程为A=3.446 4C+0.003,R2=0.999 4。
1.2.3.2 灵芝酸测定
灵芝酸测定参照文献进行[18],稍作改动。菌液中灵芝酸的测定:吸取培养液2.00 mL,60 ℃水浴15 min 后,在冰水浴中加入5.00 mL冰醋酸立即摇匀,室温静置 15 min,测定吸光度,计算含量。菌丝体中灵芝酸的测定:精密称取烘干后的菌丝体0.1 000 g于50 mL离心管,加入10.00 mL 95%乙醇,放入微波炉用中低火(P30)微波1.5 min,离心 (4 000 r·min-1,10 min),取上清液,向沉淀中加入 10.00 mL 95%乙醇,同上处理后,合并2 次提取液,取1 mL 提取液,步骤同上,测定吸光度,计算含量。
1.2.4 统计学分析
采用SPSS11.5软件对数据进行处理和统计分析。
2 结果与分析
2.1 灵芝多糖含量的分析
2.1.1 灵芝菌丝体中多糖含量分析
从图1中可以看出,灵芝菌丝体中多糖的含量与发酵时间和茉莉酸甲酯的浓度有关。在一定的发酵时间添加不同浓度的茉莉酸甲酯进行诱导培养后,菌丝体中多糖的含量基本上呈现出先升高后下降的趋势,茉莉酸甲酯的浓度为20、50、100 μmol·L-1时可以促进菌丝体中多糖含量的积累,而添加高浓度的茉莉酸甲酯浓度150、200 μmol·L-1时,菌丝体中多糖的含量有所的降低。值得注意的是,在不同的发酵时间,茉莉酸甲酯的浓度为50 μmol·L-1时,多糖的积累都达到最大值。
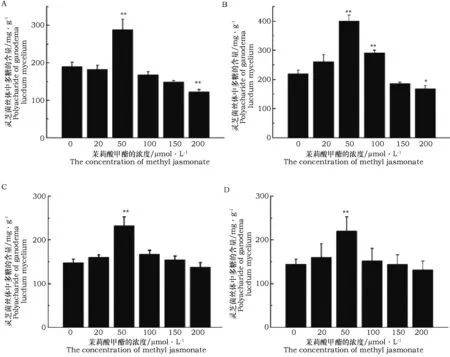
图1 不同发酵时间添加不同浓度茉莉酸甲酯对灵芝菌丝体中多糖含量的影响Fig.1 Effects of fermentation time and concentration of methyl jasmonate on Ganoderma lucidum mycelia polysaccharide 注:a: 发酵第3天;b:发酵第4天;c:发酵第5天;d:发酵第6天。图2~图4同Note: a: Fermentation on the third day; b: Fermentation on the fourth day; c: Fermentation on the fifth day; d: Fermentation on the sixth day. The same as in Fig.2~Fig.4

图2 不同发酵时间添加不同浓度茉莉酸甲酯对灵芝发酵液中多糖含量的影响Fig.2 Effects of fermentation time and concentration of methyl jasmonate on Ganoderma lucidum broth polysaccharide
在发酵第3天、第4天、第5天、第6天添加茉莉酸甲酯浓度为50 μmol·L-1时,菌丝体中多糖含量分别是空白组含量的1.98、2.75、1.60、1.5倍。在酵液培养的第4天,添加外源莉酸甲酯的浓度为50 μmol·L-1时,灵芝菌丝体中多糖含量达到最大值,为398.98 mg·g-1。
2.1.2 发酵液中灵芝多糖含量分析
从图2中可以看出,灵芝发酵液中多糖的含量受到发酵时间和茉莉酸甲酯的浓度影响。在一定的发酵时间添加浓度不同的茉莉酸甲酯进行诱导培养后,发酵液中多糖的含量基本上呈现出先升高后下降的趋势。在不同的发酵时间,茉莉酸甲酯的浓度为50 μmol·L-1时,多糖的积累都达到最大值。
在发酵第3天、第4天、第5天、第6天添加茉莉酸甲酯浓度为50 μmol·L-1时,发酵液中多糖含量分别是空白组含量的1.42、2.00、1.62、1.48倍。发在酵液培养的第4天,添加外源莉酸甲酯的浓度为50 μmol·L-1时,灵芝发酵液中多糖含量达到最大值,为4.25 g·L-1。
2.2 灵芝酸含量的分析
2.2.1 灵芝菌丝体中灵芝酸的含量分析
从图3中可以看出,灵芝菌丝体中灵芝酸的含量随着不同的发酵时间和添加外源茉莉酸甲酯浓度的不同而变化。在一定的发酵时间添加不同浓度的茉莉酸甲酯进行诱导培养后,菌丝体中灵芝酸的含量基本上呈现出先升高后下降的趋势。与对照相比,在不同的发酵时间培养的灵芝,低浓度的茉莉酸甲酯对灵芝酸的积累有促进的作用,高浓度的茉莉酸甲酯则有抑制的作用。当添加外源茉莉酸甲酯的浓度为100 μmol·L-1时,对灵芝菌丝体中灵芝酸的含量影响最显著。在发酵第3天、第4天、第5天、第6天添加茉莉酸甲酯浓度为100 μmol·L-1时,灵芝酸的含量分别是空白组含量的1.79、4.00、1.89、1.65倍。发在酵液培养的第4天,添加外源莉酸甲酯的浓
度为100 μmol·L-1时,灵芝菌丝体中灵芝酸含量积累到最大值为50.02 mg·g-1。
2.2.2 灵芝发酵液中灵芝酸的含量分析
由图4可以看出,灵芝发酵液中灵芝酸的含量随着不同的发酵时间和添加不同浓度的外源茉莉酸甲酯而变化。在相同的发酵时间添加浓度不同的茉莉酸甲酯进行诱导培养后,发酵液中灵芝酸的含量基本上呈现出先升高后下降的趋势。与对照相比,添加不同浓度的外源茉莉酸甲酯都能促进灵芝发酵液中灵芝酸的积累。在不同的发酵时间,添加外源茉莉酸甲酯的浓度为100 μmol·L-1时,对灵芝发酵液中灵芝酸的含量影响最显著,添加外源茉莉酸甲酯浓度为100 μmol·L-1时,在发酵第3天、第4天、第5天、第6天发酵液中多糖含量分别是空白组含量的2.13、2.22、2.03、2.05倍。发在酵液培养的第4天,添加外源莉酸甲酯的浓度为100 μmol·L-1时,灵芝发酵液中灵芝酸含量积累到最大值,为7.10 mg·L-1。
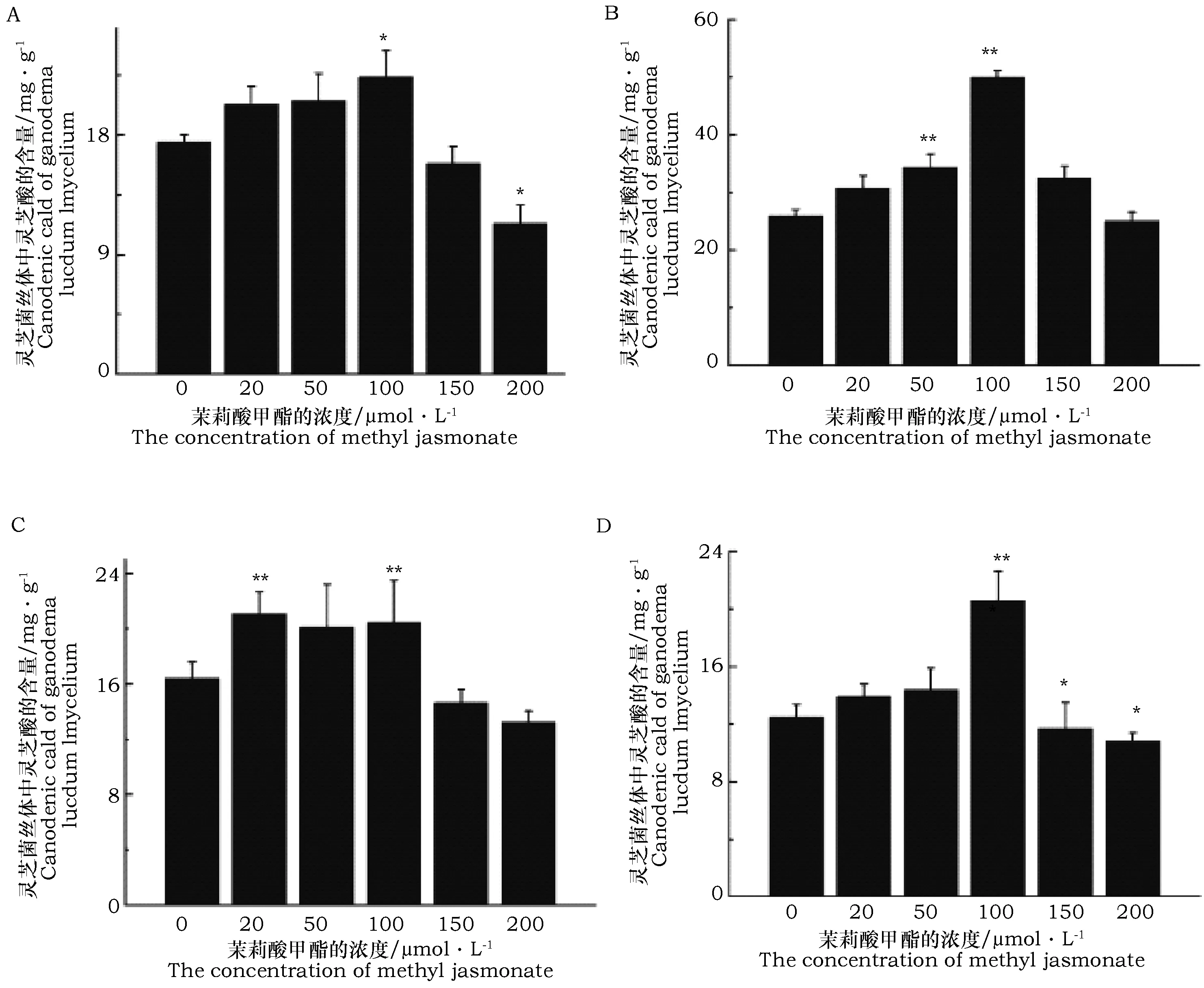
图3 不同发酵时间添加不同浓度茉莉酸甲酯对灵芝菌丝体中灵芝酸含量的影响Fig.3 Effects of fermentation time and concentration of methyl jasmonate on Ganoderma lucidum mycelia ganoderic acid
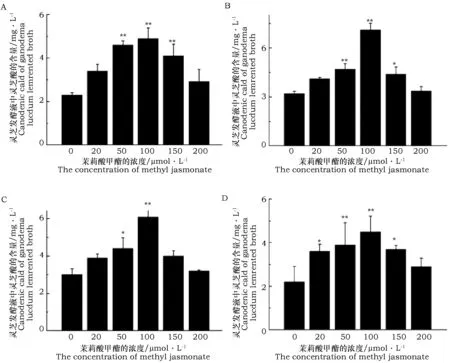
图4 不同发酵时间添加不同浓度茉莉酸甲酯对灵芝发酵液中灵芝酸含量的影响Fig.4 Effects of fermentation time and concentration of methyl jasmonate on Ganoderma lucidum broth ganoderic acid
3 讨论与结论
灵芝多糖和灵芝酸由于突出的药用价值引发人们的极大关注。灵芝多糖和灵芝酸都是灵芝在生长发育过程中的次生代谢产物,次生代谢产物积累是一个重要的感应应急过程,取决于茉莉酸甲酯对多个基因的调节反应[19]。大量研究表明,不同时期的细胞对诱导子的反应灵敏度不同,当细胞达到一定生长周期才可以有效的接受诱导信号,此时,诱导子表现出最强的诱导活性。李阳等研究发现,在高山红景天愈伤组织培养20天后加入一定浓度的茉莉酸甲酯后,高山红景天中的多糖积累达到最大[20]。在本研究中,添加茉莉酸后灵芝多糖和灵芝酸的积累都是在灵芝发酵培养的第4天积累达到最大值,对其生长曲线的观察,发现在发酵的第4天,灵芝菌株正处于稳定期,当细胞处于稳定期的时候,初级代谢基本完成,开始生产有用的次级代谢产物[21]。因此,在发酵培养的第4天添加适当浓度的茉莉酸甲酯,灵芝多糖和灵芝酸的含量都达到了最大值。这个结果与之前的文献报道类似,当细胞处于稳定期的时候,茉莉酸甲酯诱导的次生代谢物的积累达到最大值[22~24]。
外源茉莉酸甲酯的诱导效应除了与细胞的生长周期有关外,还与茉莉酸甲酯的浓度有一定的关系。有研究者发现低浓度的茉莉酸甲酯能够促进葡萄悬浮细胞中酚性成分含量的增加[25],促进红豆杉悬浮细胞中紫杉醇的积累[26],使长春花悬浮培养不定根中吲哚生物碱的含量增加[27],促进三七组苗中总皂苷的含量[28]。在本研究中也发现低浓度的茉莉酸甲酯可以有效促进灵芝中多糖和灵芝酸的积累,高浓度的茉莉酸甲酯有抑制的作用。外源茉莉酸的诱导促进灵芝次生代谢物质的产生和积累的机制,因次生代谢物类型的不同而不同,在本研究中,多糖的积累达到最大值时所需茉莉酸甲酯的浓度要低于灵芝酸所需要的浓度。高浓度的茉莉酸甲酯对灵芝中多糖和灵芝酸积累起到抑制的原因是否是因为高浓度的茉莉酸甲酯对灵芝产生了较强的氧化损伤,还是抑制了这些次级代谢物的关键酶的表达,还需要进一步的探究。
[1]赵岩,张莹,初乐,等.灵芝多糖的研究进展[J].中国果菜,2014, 34(2):27-30.
[2]邵力平,沈瑞祥,张素轩,等.真菌分类学[M].北京:中国林业出版社,1983:1714-1749.
[3]Smina TP,Mathew J,Janardhanan KK,et al. Antioxidant activity and toxicity profile of total triterpenes isolated from Ganoderma lucidum (Fr.) P.Karst occurring in South India[J]. Environmental Toxicology and Pharmacology, 2011, 32(3):438-446.
[4]Ko HH, Hung CF,Wang JP,et al. Antiinflammatory triterpe-noids and steroids from Ganoderma lucidum and G.tsugae[J]. Phytochemistry, 2008, 69(1): 234-239.
[5]徐雪峰, 李桂娟, 闫浩,等. 赤灵芝多糖分离纯化及体外抗氧化性研究[J]. 食品与机械, 2017,33(1):144-148.
[6]Xu JW,Zhao W,Zhong JJ. Biotechnological production and application of ganoderic acids[J]. Applied Microbiology and Biotechnology, 2010, 87(2):457-466.
[7]Chan WK, Cheung CCH, Law HKW, et al.Ganodermalucidumpolysaccharides can induce human monocytic leukemia cells into dendritic cells with immuno-stimulatory function[J]. Journal of Hematology & Oncology, 2008, 1(1):4503-4508.
[8]时冉冉, 陈娇, 宗自卫. 灵芝多糖抗肿瘤作用的免疫分子机制研究[J]. 生物技术世界, 2016(2):317.
[9]Meng J, Hu X, Shan F, et al. Analysis of maturation of murine dendritic cells (DCs) induced by purified Ganoderma lucidum polysaccharides (GLPs)[J]. International Journal of Biological Macromolecules, 2011, 49(4):693-699.
[10]Zhang M, Su L, Xiao Z, et al. Methyl jasmonate induces apoptosis and pro-apoptotic autophagy via the ROS pathway in human non-small cell lung cancer[J]. American Journal of Cancer Research, 2016, 6(2):187.
[11]Fedderwitz F, Nordlander G, Ninkovic V, et al. Effects of jasmonate-induced resistance in conifer plants on the feeding behaviour of a bark-chewing insect, Hylobius abietis[J]. Journal of Pest Science, 2016, 89(1):97-105.
[12]Creelman RA, Tierney ML, Mullet JE. Jasmonic acid/methyl jasmonate accumulate in wounded soybean hypocotyls and modulate wound gene expression[J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(11):4938-4941.
[13]Munemasa S, Murata Y, Hossain MA,et al. TheArabidopsiscalcium-dependent protein kinase, CPK6, functions as a positive regulator of methyl jasmonate signaling in guard cells[J]. Plant Physiology, 2011, 155(1): 553-561.
[14]Oh SY, Kim JH, Park MJ, et al. Induction of heat shock protein 72 in C6 glioma cells by methyl jasmonate through ROS-dependent heat shock factor 1 activation[J]. International Journal of Molecular Medicine, 2005, 16(5):833-839.
[15]Raina SK, Wankhede DP, Jaggi M, et al. CrMPK3, a mitogen activated protein kinase fromCatharanthusroseusand its possible role in stress induced biosynthesis of monoterpenoid indole alkaloids[J]. BMC Plant Biology, 2012, 12(1):134.
[16]Yao HJ, Tian SP. Effects of a biocontrol agent and methyl jasmonate on postharvest diseases of peach fruit and the possible mechanisms involved[J]. Journal of Applied Microbiology, 2005, 98(4): 941-950.
[17]Ren A, Qin L, Shi L, et al. Methyl jasmonate induces ganoderic acid biosynthesis in the basidiomycetous fungusGanodermalucidum[J]. Bioresource Technology, 2010, 101(17):6785-6790.
[18]陈志玲,温鲁,贾智慧.几种微量元素和维生素对灵芝多糖及灵芝酸含量的影响[J].安徽农业科学, 2009, 37(5): 2041-2043.
[19]Pauwels L, Inzé D, Goossens A. Jasmonate-inducible gene: what does it mean? [J]. Trends in Plant Science, 2009, 14(2):87-91.
[20]李阳, 廉美兰, 邵春绘,等. 茉莉酸甲酯对高山红景天愈伤组织中红景天苷和多糖积累的影响[J]. 中国中药杂志, 2014, 39(21):4252-4257.
[21]Hall RD, Holden MA, Yeoman MM. Immobilization of Higher Plant Cells [M]∥Y.P.S.Bajaj,MedicinalandAromaticPlantsI, Berlin Heidelberg, Springer 1988:136-156.
[22]Cusidó RM, Palazón J, Bonfill M, et al. Improved paclitaxel and baccatin III production in suspension cultures ofTaxusmedia[J]. Biotechnology Progress, 2002, 18(3):418-423.
[23]Expósito O,Bonfill M,Onrubia M,et al. Effect of taxol feeding on taxol and related taxane production inTaxusbaccatasuspension cultures[J]. New Biotechnology, 2009, 25(4):252-259.
[24]Srinivasan V, Ciddi V, Bringi V, et al. Metabolic inhibitors, elicitors, and precursors as tools for probing yield limitation in taxane production byTaxuschinensiscell cultures[J]. Biotechnology Progress, 1996,12(4):457-465.
[25]Claudio DO,Agnieszka C,Christopher D. Induction of secondary metabolism in grape cell cultures by jasmonates[J].Functional Plant Biology,2009,36:323-338.
[26]Qian ZG,Zhao ZJ,Tian WH,et al. Novel syntheticjasmonates as highly efficient elicitors for taxoid production bysuspension cultures ofTaxuschinensis[J]. Biotechnology and bioengineering,2004,86(5):595-599.
[27]uiz-May E,Galaz-Avalos RM,Loyola-Vargas VM.Differential secretion and accumulation of terpene indole alkaloids in hairy roots of Catharanthus roseus treated with methyljasmonate[J].Molecular Biotechnology,2009,41(3):278-285.
[28]朱宏涛, 李江, 李元,等. 茉莉酸甲酯对三七组培苗中总皂苷含量的影响[J]. 西部林业科学, 2014(2):72-78.
(编辑:马荣博)
Effect of exogenous methyl jasmonate on contents of polysaccharide and acid ofganodermalucidum
Xin Yanhua1,2, Zhang Tiedan2, Yang Longlong1, Xu Lan1, Liang Bin1, Meng Yue1
(1.XinzhouTeachersUniversity,Xinzhou034000,China; 2.Guangzhoucreationhealthindustrylimitedcompany,Guangzhou510642,China)
[Objective]The study aimed to determine the effect of adding exogenous methyl jasmonate on contents of polysaccharide and acid ofganodermalucidumin liquid culture.[Methods]The contents of polysaccharide and acid ofG.lucidumin culture medium and mycelium were determined by adding different concentrations of exogenous methyl jasmonate on different fermentation days.[Results]TheG.lucidumpolysaccharide contents were the highest in culture solution adding 50 μmol·L-1on the fourth day, with 398.98 mg·g-1in mycelium, and 7.57 g·L-1in its culture medium, which were 2.82 and 6.56 times over that of blank control; TheG.lucidumacid content was the highest in culture solution adding 100 μmol·L-1on the fourth day, with 50.02 mg·g-1in mycelium, and 7.10 mg·L-1in its culture medium, which were 1.93 and 2.21 times over that of blank control.[Conclusion]The contents of polysaccharide and acid ofG.lucidumcould be significantly increased by appropriately adding exogenous methyl jasmonate on the appropriate fermentation day.
Ganodermalucidum, Methyl jasmonate, Polysaccharides, Triterpenoid
2016-11-17
2017-05-26
辛燕花(1986-),女(汉),山西忻州人,讲师,博士研究生,研究方向:天然活性产物研发和分子代谢调控机理
Q93
A
1671-8151(2017)09-0656-07
