HPLC法同时测定大鼠血浆中3种CYP 450探针药物的浓度
2017-08-09李思聪袁定胜杨锐王斌李金良李旭廷
李思聪,袁定胜,杨锐,王斌,李金良,李旭廷*
(1.四川省畜牧科学研究院兽药研究所,成都 610066;2.动物遗传育种四川省重点实验室,成都610066)
HPLC法同时测定大鼠血浆中3种CYP 450探针药物的浓度
李思聪1,2,袁定胜1,2,杨锐1,2,王斌1,2,李金良1,2,李旭廷1,2*
(1.四川省畜牧科学研究院兽药研究所,成都 610066;2.动物遗传育种四川省重点实验室,成都610066)
建立了同时测定大鼠血浆中3种细胞色素P450(CYP450)亚型酶( CYP1A2、CYP2C9、CYP3A4)活性的Cocktail探针药物的高效液相色谱(HPLC)检测方法。分别取非那西丁,咪达唑仑和甲苯磺丁脲三种探针药物,制成混合探针溶液,用一种提取溶剂系统对3种探针药物同时提取,并用高效液相色谱法同时测定3种探针药物的血药浓度,并对其进行专属性、线性范围及检测限、精密度、回收率、稳定性的验证。色谱条件选用Diamonsil C18色谱柱(4.6 mm×250 mm,5 μm);流动相为甲醇-50 mM磷酸盐缓冲对(45∶55,pH 3.2);检测波长230 nm;流速1.0 mL/min;柱温35 ℃。结果表明:非那西丁、咪达唑仑、甲苯磺丁脲的线性范围分别为0.10~10.0 μg/mL(r=0.9993),0.05~5.0 μg/mL(r=0.9999),0.10~50.0 μg/mL(r=0.9991);方法回收率分别为79.28%~87.91%,76.43%~85.36%,82.79%~90.61%。该HPLC检测方法快捷,准确,灵敏度高,可以在同一次试验中,同时测定大鼠血浆中3种CYP450亚酶探针药物(非那西丁,甲苯磺丁脲,咪达唑仑)的浓度,各探针药物的吸收峰分离完全,无干扰,可用于开展某些受试药物对大鼠CYP450的3个主要亚型酶(CYP1A2,CYP2C9,CYP3A4)调控作用的相关研究,从而为相关肝药酶代谢研究提供方法学参考。
细胞色素P450;高效液相色谱法;非那西丁;甲苯磺丁脲;咪达唑仑
细胞色素P450(CYP450)是药物代谢过程中的关键酶,是一个具有大量底物特异性的同工酶大家族,负责生物体内绝大多数外源性化合物的生物转化[1-2],可代谢大约25万种外源性物质[3]。CYP450涉及100余种亚型,其中最主要亚型是CYP3A4(代谢的药物占全部药物的50%),CYP2C9(代谢药物约占10%)和CYP1A2(代谢药物约占4%),是药物代谢和毒理学研究的重要指标[1]。鉴于CYP450在药物代谢过程中的重要性,国内外均把药物对CYP450的影响作为药物联用、食药合用、草药合用的重要依据[4-6]。Cocktail探针药物法是研究药物对CYP450酶活性影响及药物相互作用的主要手段,通过测定特异性探针药物的血药浓度大小间接反映CYP450各亚型的活性情况[7-10]。本研究采用Cocktail探针药物法,HPLC同时测定大鼠血浆中CYP1A2,CYP2C9,CYP3A4的探针药物非那西丁、甲苯磺丁脲和咪达唑仑的浓度,并对该HPLC法进行了方法学研究,以期为开展某些药物对大鼠CYP1A2,CYP2C9和CYP3A4的调控作用和相关药物相互作用研究等提供方法学参考。
1 材 料
1.1 仪器 UltiMate 3000型高效液相色谱仪,美国戴安公司;WH-3微型漩涡混合仪,上海泸西分析仪器厂;Eppendorf MiniSpin plus离心机,德国Eppendorf公司;CQ250超声洗涤器,上海超声仪器厂;MD200-1氮吹仪,杭州奥盛仪器有限公司。
1.2 药物与试剂 非那西丁(批号100095-201205;含量98.0%),甲苯磺丁脲(批号100500-200801;含量98.5%),卡马西平(批号100142-201105;含量99.7%),咪达唑仑对照品(批号171265-201402;含量99.8%),以上对照品均购自中国食品药品检定研究院;甲醇为色谱纯,其他试剂均为分析纯,水为纯化水。
1.3 实验动物 健康清洁级SD雄性大鼠,体重200±20 g,由成都达硕实验动物有限公司提供,合格证号:SCXK(川)2013-24。整个试验期间,于室温20~24 ℃下饲养,每天采食供给饲料及纯化水,采血前12 h限饲。
2 方 法
2.1 色谱条件 色谱柱:Diamonsil C18(4.6 mm×250 mm,5 μm);流动相为甲醇-50 mM磷酸盐缓冲对(45∶55,pH 3.2);紫外检测波长230 nm;流速1.0 mL /min;柱温35 ℃。
2.2 溶液配制
2.2.1 对照品储备液的制备 分别取干燥至恒重的非那西丁,咪达唑仑,甲苯磺丁脲和卡马西平(内标)对照品适量,精密称定,加甲醇分别制成每1 mL含4 μg的储备液,4 ℃避光冷藏备用。
2.2.2 Cocktail混合探针液的制备 精密称取非那西丁40 mg,甲苯磺丁脲20 mg,咪达唑仑10 mg至同一EP管中,加入0.2% CMC-Na水溶液10 mL,涡旋混匀,超声10 min, 即配制成Cocktail混合探针液。该混合探针液于大鼠给药前新鲜配制,配好后立即使用。
2.3 大鼠血浆样品处理 取大鼠血浆100 μL,加入含内标卡马西平的甲醇溶液(4 μg/mL)100 μL,涡旋30 s,超声10 min后,13000 r/min离心5 min,弃沉淀,取上清液,0.45 μm滤膜过滤,取20 μL进样测定。
2.4 方法学验证
2.4.1 专属性试验 分别取大鼠空白血浆;含有卡马西平,非那西丁,咪达唑仑及甲苯磺丁脲对照品的大鼠空白血浆样品;大鼠灌胃Cocktail混合探针液后0.5 h尾静脉采集的血浆样品,按照2.3项进行血浆样品处理;另外取卡马西平,非那西丁,咪达唑仑及甲苯磺丁脲混合对照品。上述4个待测样品,参照2.1项色谱条件,分别取20 μL进样,记录色谱图。
2.4.2 线性范围和检测限 取6只试管并分别精确加入一定量的非那西丁,甲苯磺丁脲,咪达唑仑对照品储备液,40 ℃氮气流下挥干甲醇溶液,残留物中再分别精密加入含内标卡马西平的甲醇储备液(4 μg/mL)100 μL和大鼠空白血浆100 μL,使各组分中药物浓度分别为非那西丁0.10,0.50,1.00,2.00,5.00,10.0 μg/mL;甲苯磺丁脲0.10,1.00,2.00,5.00, 25.0,50.0 μg/mL;咪达唑仑0.05,0.10,0.50,1.00,2.50,5.00 μg/mL,涡旋30 s,超声10 min后,13000 r/min离心5 min,弃沉淀,取上清液,0.45 μm滤膜过滤,按2.1项下条件进样20 μL,测定分析,以各组分探针药物的浓度为横坐标,探针药物和内标的峰面积比为纵坐标进行线性回归,得非那西丁、甲苯磺丁脲、咪达唑仑的回归方程。
2.4.3 精密度试验 分别取非那西丁0.50,5.00,10.0 μg/mL,咪达唑仑0.10,0.50,1.00 μg/mL,甲苯磺丁脲5.0,25.0,50.0 μg/mL 3个浓度的标准血浆样品,各取5份,按2.3项下方法进行血浆样品处理,按2.1项下条件测定,于同1 d内进样5次测定,求得日内RSD;连续测定5 d,求得日间RSD。
2.4.4 回收率试验 分别取非那西丁0.50,5.00,10.0 μg/mL,甲苯磺丁脲5.0,25.0,50.0 μg/mL,咪达唑仑0.10,0.50,1.00 μg/mL 3个浓度的标准血浆样品,各5份,按2.3项下方法进行血浆样品处理,按2.1项下条件测定,用已求得的标准曲线回归方程计算浓度,并以测定值的平均值与配制的理论浓度比较,计算相对回收率。
2.4.5 稳定性试验 分别配制含3个探针药物的低、中、高浓度的标准血浆样品,于室温放置24 h,-20 ℃冻存30 d,反复冻融3次。按2.3项下方法处理,按2.1项下条件测定,记录探针药峰面积和内标峰面积,计算样品浓度及RSD。
2.5 应用 选取SD雄性大鼠8只(体重200±20 g),按照10 mL/kg B.W.灌胃给药Cocktail混合探针液,灌胃后0.083,0.25,0.50,0.75,1,2,4,24 h尾静脉取血,每次取血量0.2 mL。血样采集后置于肝素抗凝的试管中,4000 r/min离心5 min分离得到血浆,按照2.3项下方法进行血浆处理,按2.1项色谱条件,各取20 μL进样,记录色谱图和峰面积。
3 结果与分析
3.1 专属性试验 在上述色谱条件下测得色谱图如图1所示,分别为空白血浆(图1-A),卡马西平、非那西丁、咪达唑仑及甲苯磺丁脲混合对照品(图1-B),含卡马西平、非那西丁、咪达唑仑及甲苯磺丁脲对照品的大鼠空白血浆(图1-C),大鼠灌胃Cocktail混合探针液后0.5 h血浆样品(图1-D)。从图1可见,非那西丁,咪达唑仑及甲苯磺丁脲与内标卡马西平,空白血浆中的内源性物质分离良好。
3.2 线性范围和检测限 探针药物中,非那西丁的回归方程为:Y=0.7878X-0.0306,r=0.9993;甲苯磺丁脲的线性方程为:Y=0.6372X+0.0751,r=0.9991;咪达唑仑的线性方程为:Y=0.975X-0.0087,r=0.9999。线性范围分别为:非那西丁0.10~10.0 μg/mL;甲苯磺丁脲0.10~50.0 μg/mL;咪达唑仑0.05~5.0 μg/mL,最低定量限(S/N=10)非那西丁、甲苯磺丁脲均为0.10 μg/mL,咪达唑仑为0.05 μg/mL。

1-A:空白血浆(blank plasma);1-B:探针药物+卡马西平(probe drugs+carbamazepine);1-C:空白血浆+探针药物+卡马西平(blank plasma +probe drugs+carbamazepine);1-D:大鼠给予探针药物后0.5 h血浆+卡马西平(plasma after rat administration of probe drugs +carbamazepine)1. 非那西丁(phenacetin);2. 咪达唑仑(midazolam);3. 卡马西平(carbamazepine);4.甲苯磺丁脲(tolbutamide)图1 高效液相色谱图Fig 1 HPLC chromatograms
3.3 精密度试验 表1精密度试验结果表明,不同浓度非那西丁、咪达唑仑、甲苯磺丁脲日内、日间精密度RSD均小于7%,精密度良好。
3.4 回收率试验 表1回收率试验结果表明,不同浓度非那西丁、咪达唑仑、甲苯磺丁脲回收率均值均在75%以上,回收率稳定。
3.5 稳定性试验 表2稳定性试验结果表明,含3种探针药物低、中、高浓度的标准血浆样品经室温存放24 h,-20 ℃冻存30 d,反复冻融3次后,非那西丁、甲苯磺丁脲、咪达唑仑的低、中、高浓度RSD均小于9%,血浆样品稳定性良好。

表1 探针药物的精密度和回收率结果Tab 1 The precisions and recoveries of probes

表2 探针药物的稳定性考察Tab 2 Stabilization determination of probes
3.6 应用 由图2所得均值药-时曲线所示,本测试方法可用于同时测定大鼠体内非那西丁、甲苯磺丁脲、咪达唑仑的血药浓度,可用来评价药物对CYP1A2、CYP2C9、CYP3A4的影响。


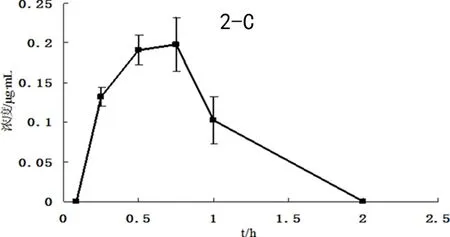
2-A:非那西丁(phenacetin);2-B:甲苯磺丁脲(tolbutamide);2-C:咪达唑仑(midazolam)图2 大鼠灌胃3种探针药物后的血浆浓度均值-时间曲线图Fig 2 Concentration-time curves of the 3 probe drugs in rat plasma after administration
4 讨论与小结
在CYP450探针药物选择中,CYP1A2主要的探针药物有咖啡因[11-12]、茶碱[13]和非那西丁[14-16],本研究CYP1A2探针药物筛选时发现茶碱与血浆内源性物质有干扰,咖啡因属于国家管制类药物,购买不便,故选用非那西丁作为CYP1A2探针底物;CYP2C9探针药物主要有甲苯磺丁脲[14,16]和华法林[17],然而Holbrook AM等[18]报道华法林容易和多种食物及药物相互作用而导致严重不良反应,因此选用甲苯磺丁脲作为CYP2C9探针底物;咪达唑仑是评价CYP3A4代谢活性的常用探针药物,其既可静脉用药,也可口服给药,吸收快速且完全,不良反应轻微,满足安全、快速、特异性强等检测要求,而且与众多的CYP3A4底物有着良好的相关性[19]。综上所述,本实验选择非那西丁、甲苯磺丁脲、咪达唑仑作为大鼠CYP1A2、CYP2C9、CYP3A4的探针药物。
本研究曾对3种探针药物及内标卡马西平进行全波长扫描,各药物在230 nm均有较大紫外吸收;采用甲醇-50 mM磷酸盐缓冲对(65∶35)作为流动相[20],结果咪达唑仑与非那西丁出峰时间重叠,将甲醇浓度逐步降低,咪达唑仑与非那西丁逐渐分离,但甲苯磺丁脲保留时间也随之延后,降至35%时,其保留时间超过60 min,最终确定甲醇浓度在45%时,可有效缩短检测时间;当流动相pH大于3.5时,甲苯磺丁脲具有明显的拖尾现象,pH3.0时,咪达唑仑也出现拖尾,通过优化,流动相pH调为3.2。故最终确定流动相为甲醇-50 mM磷酸盐缓冲对(45∶55;pH3.2),检测波长230 nm,在该条件下3种探针药物及内标分离完全,峰形良好,无杂质峰干扰,血浆内源性物质对3种探针药物及内标的分离测定均无干扰。通过方法学考察表明该HPLC检测方法灵敏度高,专属性好,重现性好,准确性高,稳定可靠,可用于生物样本分析研究。动物实验表明,用该HPLC检测法研究药物在体内代谢具有较好的灵敏度,可以满足动物实验的要求。
本研究建立的方法,可在同一色谱条件下测定3种CYP450亚型酶探针药物的浓度,因而可对各亚型酶的活性进行同时测定,可同时获取经多个代谢途径的信息,且操作简便,快捷,成本较低。为研究药物对CYP450活性的影响,本方法对于评价药物的安全性、预测代谢性药物相互作用以及指导临床合理用药具有积极的意义。
[1] Frye Reginald F. Probing the world of cytochrome P450 enzymes[J]. Molecular interventions, 2004, 4(3): 157-162.
[2] 吴永章, 刘 力, 杨志强, 等. 细胞色素P450与兽药的研发应用[J]. 中国兽药杂志, 2007, 41(1): 46-48.
WU Yong-zhang, LIU Li, YANG Zhi-qiang,etal. Reseach, development and application of cytochrome P450 and veterinary drugs[J]. Chinese Journal of Veterinary Drug, 2007, 41(1): 46-48.
[3] Lewis D F, Watson E, Lake B G. Evolution of the cytochrome P450 superfamily: sequence alignments and pharmacokinetics[J]. Mutation Research/reviews in Mutation Research, 1998. 410(3): 245-270.
[4] 陆兔林, 苏联麟, 季 德, 等. CYP450酶与中药代谢相互作用及酶活性测定的研究进展[J]. 中国中药杂志, 2015, 40(18): 3524-3529.
LU Tu-lin, SU Lian-lin, JI De,etal. Interaction between CYP450 enzymes and metabolism of traditional Chinese medicine as well as enzyme activity assay[J]. China Journal of Chinese Materia Medica, 2015, 40(18): 3524-3529.
[5] 侯 健, 孙 娥, 宋 捷, 等. 肝脏药物代谢酶CYP450与中药肝毒性的关系[J]. 中国中药杂志, 2016, 41(15): 2774-2780.
HOU Jian, SUN E, SONG Jie,etal. Relationship between hepatic drug-metabolizing enzymes CYP450 and traditional Chinese medicine-induced hepatotoxicity[J]. China Journal of Chinese Materia Medica, 2016, 41(15): 2774-2780.
[6] Lin Z, Guo S, Yang C,etal.Invivoeffects of scutellarin on the activities of CYP1A2, CYP2C11, CYP2D1, and CYP3A4/2 by cocktail probe drugs in rats[J]. Pharmazie, 2014, 69(7): 537-541.
[7] D D Breimer, J H Schellens. A 'cocktail' strategy to assessinvivooxidative drug metabolism in humans[J]. Trends in Pharmacological Sciences, 1990, 11(6): 223-225.
[8] 王 亮, 郭 姣, 石忠峰, 等. “Cocktail”探针药物法的研究思路与应用[J]. 辽宁中医药大学学报, 2010, 12(11): 30-34.
WANG Liang, GUO Jiao, SHI Zhong-feng,etal. Research Route and Utilization of Cocktail Probe Drugs[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2010, 12(11): 30-34.
[9] 候丛颂, 杨志宏, 孙晓波. “cocktail”探针药物法及其在研究中药对细胞色素P450影响中的应用进展[J]. 中国药理学与毒理学杂志, 2013, 27(3): 445-450.
HOU Cong-song, YANG Zhi-hong, SUN Xiao-bo. Progress of "cocktail" probe substrates approach and its application in studies of traditional Chinese materiamedica on cytochrome P450 system[J]. Chinese Journal of Pharmacology and Toxicology, 2013, 27(3): 445-450.
[10]阎克里, 赵 丽, 朱秀卿, 等. HPLC法同时测定人血浆中咪达唑仑和阿曲库铵的浓度[J]. 药物分析杂志, 2009, 29(8): 1348-1351.
YAN Ke-li, ZHAO Li, ZHU Xiou-qing,etal. HPLC determination of midazolam and atracurium in human plasma[J]. Chinese Journal of Pharmaceutical Analysis, 2009, 29(8): 1348-1351.
[11]武琴园, 魏玉辉, 张进文, 等. 六味地黄丸对大鼠肝CYP1A2及肠道P-gp活性的影响[J]. 中成药, 2011, 33(1): 37-41.
WU Qin-yuan, WEI Yu-hui, ZHANG Jin-wen,etal. Effect of Liuwei Dihuang Pill on the activity of liver CYP1A2 and P-gp in rat intestines[J]. Chinese Traditional Patent Medicine, 2011, 33(1): 37-41.
[12]Yin S, Cheng Y, Li T,etal. Effects of notoginsenoside R1 on CYP1A2, CYP2C11, CYP2D1, and CYP3A4/2 activities in rats by cocktail probe drugs[J]. Pharmaceutical Biology, 2015, 54(2): 231.
[13]Xia CH, Sun J G, Wang G J,etal. Herb-drug interactions:in vivo and in vitro effect of Shenmai injection, a herbal preparation, on the metabolic activities of hepatic cytochrome P450 3A1/2, 2C6, 1A2, and 2E1 in rats[J]. Planta Med, 2010, 76(3): 245-250.
[14]He X M, Zhou Y, Xu M Z,etal. Effects of long-term smoking on the activity and mRNA expression of CYP isozymes in rats[J]. J Thorac Dis, 2015, 7(10): 1725-1731.
[15]Zhuang Z, Tang M, Zheng Y,etal. Effect of Dimethoate on the Activity of Hepatic CYP450 Based on Pharmacokinetics of Probe Drugs[J]. Pharmacology, 2015, 95(5/6): 243-250.
[16]Wang X S, Hu X C, Chen G L,etal. Effects of vitexin on the pharmacokinetics and mRNA expression of CYP isozymes in rats[J]. Phytother Res, 2015, 29(3): 366-372.
[17]Halladay Jason S, Delarosa Erlie Marie, Tran Daniel,etal. High-throughput, 384-well, LC-MS/MS CYP inhibition assay using automation, cassette-analysis technique, and streamlined data analysis[J]. Drug Metabolism Letters, 2011, 5(3): 220-230.
[18]Holbrook A M, Pereira J A, Lab IR ISR,etal. Systematic Overview of Warfarin and Its Drug and Food Interactions[J]. Arch Intren Med 2005, 165(10): 1095-1106.
[19]Wang B, He F, Lin Y,etal. Effect of recombinant human thylllosin-alphal, an immuno-modulating peptide with 28 amino acids, on the activity of cytochrome P450s[J]. Drug Metab Lett, 2007, 1(3): 199-204.
[20]Liu Y, Jiao J J, Zhang C L. A Simplied Method to Determine Five Cytochrome P450 Probe Drugs by HPLC in a Single Run[J]. Biol. Pharm. Bull, 2009, 32(4): 717-720.
(编辑:侯向辉)
Simultaneous Determination of Three Probe Drugs of CYP450 in Rat Plasma by HPLC
LI Si-cong1,2, YUAN Ding-sheng1,2, YANG Rui1,2, WANG Bin1,2, LI Jin-liang1,2, LI Xu-ting1,2*
(1.InstituteofVeterinaryPhamacology,SichuanAnimalScienceAcademy,Chengdu610066,China; 2.AnimalBreedingandGeneticsKeyLaboratoryofSichuanProvince,Chengdu610066,China)
LIXu-ting,E-mail: 676049640@qq.com
To provide a methodological reference for the study of metabolism of liver enzymes, an HPLC method for simultaneously determining three cytochrome P450(CYP) (CYP1A2, CYP2C9, CYP3A4) probe drugs in rat plasma was established. Cocktail probe solution was prepared by mixing three specific probe drugs of CYP1A2, 2C9 and 3A4(phenacetin, tolbutamide and midazolam, respectively). The three drugs were extracted with one solvent system, determined in rat plasma by HPLC, and verified the specificity, linear range, detection limit, precision, recovery and stability. The isolation was performed on a Diamonsil C18 column (4.6 mm×250 mm, 5 μm) with mobile phase consisting of methanol -50 mM phosphate buffer (45∶55; pH3.2); the detection wavelength was 230 nm; the flow rate was 1.0 mL/min and the column temperature was 35 ℃. Results showed that there were good linearity of phenacetin, midazolam and tolbutamide in the ranges of 0.10~10.0 μg/mL(r=0.9993), 0.05~5.0 μg/mL(r=0.9999), 0.10~50.0 μg/mL(r=0.9991). The recoveries were 79.28%~87.91%, 76.43%~85.36%, 82.79%~90.61%, respectively. The method is rapid, accurate, sensitive and suitable for simultaneously determining the concentrations of three CYP450 probe drugs(phenacetin, tolbutamide and midazolam) in rat plasma, the three drugs and the internal standard(carbamazepine) were separated well under the above HPLC conditions, which could be employed in evaluating the effects of drugs on rat’s CYP450 subtype enzymes(CYP1A2, CYP2C9, CYP3A4) activities and in relatived studies.
CYP450; HPLC; phenacetin; tolbutamide; midazolam
四川省公益性科研院所基本科研业务费项目(SASA2014A13);四川省财政运行专项(SASA2014CZYX010) 作者简介: 李思聪,硕士,从事兽药基础研究与开发工作。
李旭廷。E-mail:676049640@qq.com
10.11751/ISSN.1002-1280.2017.7.05
2017-02-07
A
1002-1280 (2017) 07-0021-07
S859.2
