血管内皮生长因子与胎盘生长因子联合对大鼠急性心肌梗死后血管新生及心功能的影响
2017-08-09张晓婷刘峰王炳银
张晓婷 刘峰 王炳银
·基础研究·
血管内皮生长因子与胎盘生长因子联合对大鼠急性心肌梗死后血管新生及心功能的影响
张晓婷 刘峰 王炳银
目的 观察血管内皮生长因子(VEGF)、胎盘生长因子(PLGF)单独使用和联合使用对急性心肌梗死大鼠心肌梗死缺血边缘区血管新生和心功能的影响。方法 75只雄性SD大鼠随机分为5组:sham 组(假手术组),NS组(250 μl生理盐水),VEGF组(1 μg重组鼠VEGF溶于250 μl生理盐水),PLGF组(1 μg重组鼠PLGF溶于250 μl生理盐水),VEGF+PLGF组(重组鼠VEGF 0.5 μg+重组鼠PLGF 0.5 μg溶于250 μl生理盐水)。sham 组大鼠仅开胸,不结扎左前降支,并且不注射药物,其余所有大鼠均结扎左前降支近端,建立急性心肌梗死模型,并于心肌梗死缺血边缘区注射VEGF和PLGF。术后3周,以超声心动图评估大鼠心脏结构及功能,测定梗死范围,用免疫组织化学方法检测大鼠心肌梗死缺血边缘区Ⅷ因子相关抗原(vWF)染色阳性的内皮细胞评估新生血管数量,α平滑肌肌动蛋白(α-SMA)染色阳性的平滑肌细胞评估新生小动脉数量。结果 冠状动脉结扎3周后,sham组大鼠LVEDD、LVESD、LVEF及LVFS明显优于其余各组,差异均有统计意义(均P<0.01);与NS组、VEGF组及PLGF组比较,VEGF+PLGF组LVEF、LVFS显著增高,而LVEDD及LVESD则显著减少(均P<0.05)。sham组心肌梗死范围显著小于其余四组,差异均有统计意义(均P<0.01);VEGF+PLGF组大鼠梗死范围显著小于NS组[(19.75±3.98)%比(38.70±7.45)%,P<0.01]、VEGF组[(19.75±3.98)%比(32.20±6.00)%,P<0.05]及PLGF组[(19.75±3.98)%比(25.09±5.52)%,P<0.05],差异均有统计学意义。sham组vWF阳性细胞数量和α-SMA阳性细胞数量显著小于其余四组,差异均有统计学意义(均P<0.01);其余四组大鼠vWF阳性细胞数量和α-SMA阳性细胞数量比较,差异均有统计学意义(均P<0.05);而VEGF+PLGF组vWF阳性细胞数量[(64.08±10.89)个/mm2比(55.09±8.20)个/mm2,P<0.05]、α- SMA阳性细胞数量[(11.42±3.15)个/mm2比(9.00±2.19)个/mm2,P<0.05]均高于PLGF组,差异均有统计学意义。结论 将半剂量的VEGF与PLGF联合应用可使心肌梗死缺血边缘区毛细血管和小动脉生成增多,心肌梗死范围减小,并且明显改善心功能。
急性心肌梗死; 血管内皮生长因子; 胎盘生长因子; 血管新生
急性心肌梗死后尽快恢复缺血区域心肌血供,挽救缺血、濒临坏死的心肌细胞,减少心肌梗死面积是改善心肌梗死患者预后的关键。尽管药物治疗、血运重建、再灌注治疗措施和外科手术(冠状动脉旁路移植术)等均取得令人瞩目的进展,提高了患者的生存率和生活质量,然而在我国及时行再灌注治疗的患者不足10%。梗死心肌自身新生血管代偿、缺血预适应的变化过程非常缓慢,且只能部分代偿动脉闭塞引起的心肌缺血[1]。因此,急性心肌梗死后,通过促进缺血部位血管新生、增加侧支循环形成及心肌细胞再生等辅助性治疗从而改善心功能,已成为国内外研究的热点之一[1-2]。
血管内皮生长因子(vascular endothelial growth factor,VEGF) 作为特异的血管内皮细胞促有丝分裂原,能特异性促血管内皮细胞增殖、分裂,促进缺血区域新生血管形成,并启动或强化侧支循环[3]。胎盘生长因子(placental growth factor,PLGF)作为VEGF家族成员,不仅具有更强的促进血管新生作用,且无水肿、纤维素沉着和新生血管瘤等不良反应[4]。有研究显示,VEGF和PLGF可改善心肌梗死后缺血部位血流从而改善心功能[3-4]。本研究采用VEGF和PLGF半剂量联合应用,观察缺血区域新生血管生成及心功能情况,评估与比较不同组心功能、心肌梗死面积及梗死交界区再生血管程度等的差异。
1 材料与方法
1.1 实验动物与分组
SPF级雄性Sprague-Dawley大鼠(SD)75只,年龄为2~3个月,体重250~300 g,由苏州大学动物实验中心提供,在上海交通大学医学院苏州九龙医院动物实验中心饲养。75只SD大鼠随机分为5组,每组15只:sham组(假手术组),NS组(注射生理盐水),VEGF组(注射VEGF),PLGF组(注射PLGF),VEGF+PLGF组(注射VEGF+PLGF)。
1.2 急性心肌梗死模型的建立
急性心肌梗死SD大鼠模型建立参照许官学等[5]的方法。应用3%戊巴比妥溶液(30 mg/kg)腹腔注射麻醉,气管插管后呼吸机辅助呼吸(潮气量3 ml/100 g,呼吸频率100次/min,呼吸比1∶3),在胸骨左缘心脏搏动明显处纵行切开皮肤,经左缘第3~4肋间开胸暴露心脏,于左主干左心耳下方2 mm处进针,肺动脉圆锥旁出针,以5-0丝线结扎左前降支。数分钟后,见左心室前壁心肌变苍白,并伴随局部室壁运动减弱,心电图示胸前导联ST段弓背向上抬高并持续15 min以上为模型制作成功。sham 组大鼠仅开胸在同一解剖位置穿线,不结扎左前降支,并且不注射药物,其余同上述操作步骤,逐层缝合胸壁,待大鼠恢复自主呼吸后,拔出气管插管,喂养观察。确认模型成功后,按照分组立即将250 μl注射液分5点分别注射于梗死交界区,即sham 组及NS组250 μl生理盐水,VEGF组1 μg重组鼠VEGF溶于250 μl生理盐水,PLGF组1 μg重组鼠PLGF溶于250 μl生理盐水,VEGF+PLGF组,重组鼠VEGF 0.5 μg+重组鼠PLGF 0.5 μg溶于250 μl生理盐水。
1.3 超声心动图对心脏结构及功能的评估
冠状动脉结扎术后3周,于腹腔内注射1%戊巴比妥对大鼠进行经胸超声心动图检查(12 MHz探头),用胸骨旁长轴切面,M型超声测量左心室舒张末期内径(left ventricular end diastolic diameter,LVEDD)、左心室收缩末期内径(left ventricular end systolic diameter,LVESD)、左心室缩短分数(left ventricular fractional shortening ,LVFS),以连续测量三个心动周期的平均值作为检测数值。根据Teichholz公式[6]计算左心室射血分数(left ventricular ejection fraction,LVEF)。
1.4 标本采集及处理
完成超声心动图检查后,经股静脉注射10%氯化钾溶液2 ml处死大鼠,迅速开胸,取出心脏,沿冠状动脉沟切除心房和右心室,室间隔保留于左心室,常规石蜡包埋,垂直于室间隔,连续切5 μm厚切片5张,用于常规苏木精-伊红(HE)染色及免疫组化。
1.5 心肌梗死范围测定
各切片经HE染色后,于400倍镜下观察,梗死区细胞纤维排列紊乱,肌层变薄,肌纤维溶解甚至消失,可见纤维组织增生,非梗死区心肌细胞排列整齐,未见断裂、变性坏死,然后以Image Pro Plus 6.0图像分析软件进行定量分析。梗死范围计算:梗死范围(%)=(梗死区心内膜弧长+梗死区心外膜弧长)/(左心室心内膜周长+左心室心外膜周长)×100%。
1.6 梗死交界区新生血管测定
采用免疫组化法检测心肌梗死交界区Ⅷ因子相关抗原(von Willebrand factor,vWF)阳性的内皮细胞数量,评估新生毛细血管情况,检测α平滑肌肌动蛋白(α-SMA)阳性的平滑肌细胞数量,以评估新生小动脉数量。于400倍视野下用病理图像分析软件计数,vWF染色阳性的内皮细胞表示新生血管;于200倍视野下用病理图像分析软件计数,α-SMA染色阳性的平滑肌细胞表示新生小动脉。每张切片计数5个视野。
1.7 统计学分析
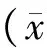
2 结果
2.1 大鼠急性心肌梗死模型
用3%戊巴比妥溶液腹腔麻醉效果好,术中呼吸道分泌物少,无麻醉意外发生。各组存活大鼠数量分别为:sham 组14 只,存活率为 93%;NS组10只,存活率为67%;VEGF组10只,存活率为67%;PLGF组11只,存活率为73%;VEGF+PLGF组12只,存活率为80%。大鼠死亡的主要原因为严重心律失常、肺部损伤和分泌物呼吸道梗塞等。
2.2 超声心动图对大鼠心脏结构及功能的评估情况(表1、图1)
冠状动脉结扎3周后,sham 组大鼠LVEDD、LVESD、LVEF及LVFS明显优于其余各组,差异均有统计意义(均P<0.01);NS组与VEGF组大鼠LVEDD、LVESD、LVEF、LVFS比较,差异均无统计学意义(均P>0.05);与NS组和VEGF组相比,PLGF组及VEGF+PLGF组大鼠LVEF、LVFS显著增高,而LVEDD及LVESD则显著减少(均P<0.01);与PLGF组相比,VEGF+PLGF组大鼠LVEF、LVFS均显著升高(均P<0.05),而LVEDD及LVESD则显著减少(均P<0.05)。
2.3 各组大鼠心肌梗死范围及交界区新生血管情况比较(表2、图2~4)
大鼠心肌HE染色显示,sham组心肌细胞排列整齐,未见断裂、变性坏死;NS组及VEGF组梗死交界区细胞纤维排列紊乱,肌纤维溶解甚至消失,可见纤维组织增生;PLGF组及VEGF+PLGF组梗死交界区存活心肌细胞较NS组及VEGF组较多,且细胞纤维可见成列排列,尤以VEGF+PLGF组明显。大鼠心肌vWF免疫组织化学染色显示,sham组vWF阳性细胞数量最少,VEGF+PLGF组vWF阳性细胞数量显著高于NS组、VEGF组及PLGF组,PLGF组高于VEGF组及NS组,而NS组vWF阳性细胞数量最少;α-SMA免疫组织化学染色显示,sham组α-SMA阳性细胞数量最少,VEGF+PLGF组α-SMA阳性细胞数量高于NS组、VEGF组及PLGF组,PLGF组高于VEGF组及NS组,而NS组与VEGF组α-SMA阳性细胞数量未见明显差异。
冠状动脉结扎后3周, sham组心肌梗死范围显著小于其余四组,差异均有统计意义(均P<0.01);与NS组比较,VEGF组、PLGF组及VEGF+PLGF组大鼠梗死范围显著缩小,差异均有统计学意义(均P<0.05);与VEGF组大鼠相比,PLGF组梗死范围[(25.09±5.52)%比(32.20±6.00)%,P<0.05]、VEGF+PLGF组大鼠梗死范围[(19.75±3.98)%比(32.20±6.00)%,P<0.01]显著缩小,差异均有统计学意义; 与PLGF组大鼠相比,VEGF+PLGF组梗死范围[(19.75±3.98)%比(25.09±5.52)%,P<0.05]亦显著缩小,差异有统计学意义。
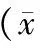
表1 冠状动脉结扎后3周超声心动图测定结果±s)
注:sham组,假手术组;NS组,250 μl生理盐水;VEGF组,1 μg重组鼠VEGF溶于250 μl生理盐水;PLGF组,1 μg重组鼠PLGF溶于250 μl生理盐水;VEGF+PLGF组,重组鼠VEGF 0.5 μg+重组鼠PLGF 0.5 μg溶于250 μl生理盐水;LVEDD,左心室舒张末期内径;LVESD,左心室收缩末期内径;LVEF,左心室射血分数;LVFS,左心室缩短分数; a,与NS组比较,P>0.05;b,与VEGF组比较,P<0.01;c,与NS组和VEGF组比较,P<0.05;d,与PLGF组比较,P<0.05;e,与其余四组比较,P<0.01

图1 大鼠心肌梗死后超声心动图 急性心肌梗死模型建立3周后,sham组大鼠心功能明显优于其余各组,VEGF+PLGF组大鼠心功能较NS组、VEGF组及PLGF组明显改善,而PLGF组大鼠心功能较NS组及VEGF组亦改善
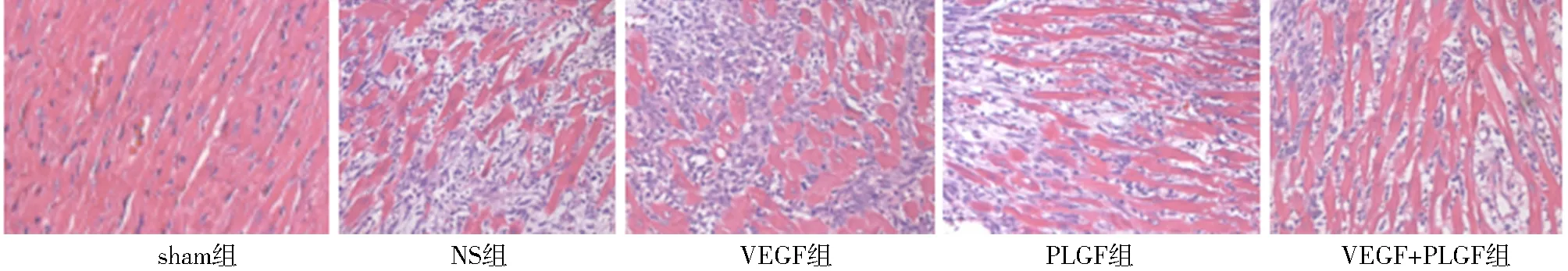
图2 大鼠心肌HE染色(×400) sham组心肌细胞排列整齐,未见断裂、变性坏死;NS组及VEGF组梗死交界区细胞纤维排列紊乱,肌纤维溶解甚至消失,可见纤维组织增生;PLGF组及VEGF+PLGF组梗死交界区存活心肌细胞较NS组及VEGF组较多,且细胞纤维可见成列排列,尤以VEGF+PLGF组明显

图3 大鼠心肌vWF免疫组织化学染色(×400) sham组vWF阳性细胞数量最少,VEGF+PLGF组vWF阳性细胞数量显著高于NS组、VEGF组及PLGF组,PLGF组高于VEGF组及NS组,而NS组vWF阳性细胞数量较sham组多(棕色为阳性细胞)

图4 大鼠心肌α-SMA免疫组织化学染色(×200) sham组阳性细胞数最少,VEGF+PLGF组α-SMA阳性细胞数量高于NS组、VEGF组及PLGF组,PLGF组高于VEGF组及NS组,而NS组与VEGF组α-SMA阳性细胞数量未见明显差异(棕色为阳性细胞)
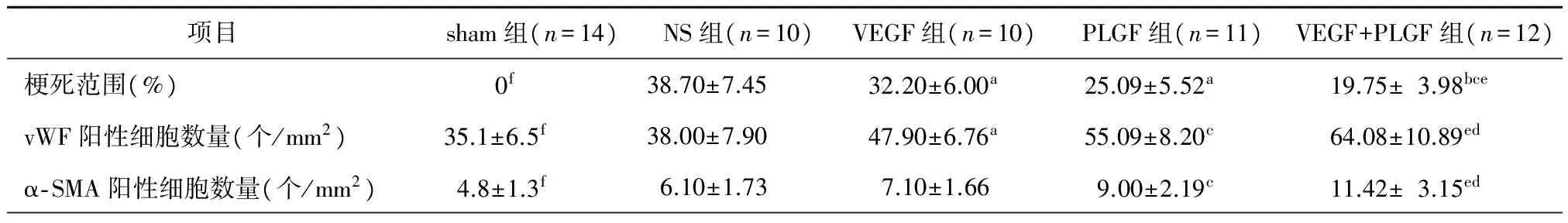
项目sham组(n=14)NS组(n=10)VEGF组(n=10)PLGF组(n=11)VEGF+PLGF组(n=12)梗死范围(%) 0f38.70±7.4532.20±6.00a25.09±5.52a 19.75±3.98bcevWF阳性细胞数量(个/mm2)35.1±6.5f38.00±7.9047.90±6.76a55.09±8.20c 64.08±10.89edα⁃SMA阳性细胞数量(个/mm2)4.8±1.3f6.10±1.73 7.10±1.669.00±2.19c 11.42±3.15ed
注:sham组,假手术组;NS组,250 μl生理盐水;VEGF组,1 μg重组鼠VEGF溶于250 μl生理盐水;PLGF组,1 μg重组鼠PLGF溶于250 μl生理盐水;VEGF+PLGF组,重组鼠VEGF 0.5 μg+重组鼠PLGF 0.5 μg溶于250 μl生理盐水;vWF,Ⅷ因子相关抗原;α- SMA,α平滑肌肌动蛋白; a,与NS组比较,P<0.05;b,与NS组比较,P<0.01;c,与VEGF组比较,P<0.05;d,与VEGF组比较,P<0.01;e,与PLGF组比较,P<0.05;f,与其余四组比较,P<0.01
单因素方差分析发现,sham组vWF阳性细胞数量和α-SMA阳性细胞数量显著小于其余四组,差异均有统计学意义(均P<0.01);其余四组大鼠vWF阳性细胞数量和α-SMA阳性细胞数量比较,差异均有统计学意义(均P<0.05)。VEGF组vWF阳性细胞数量显著高于NS组[(47.90±6.76)个/mm2比(38.00±7.90)个/mm2,P<0.05],但两组间α- SMA阳性细胞数量比较,差异无统计学意义(P>0.05);PLGF组vWF阳性细胞数量[(55.09±8.20)个/mm2比(47.90±6.76)个/mm2,P<0.05]、α- SMA阳性细胞数量[(9.00±2.19)个/mm2比(7.10±1.66)个/mm2,P<0.05]均显著高于VEGF组;而VEGF+PLGF组vWF阳性细胞数量[(64.08±10.89)个/mm2比(55.09±8.20)个/mm2,P<0.05]、α- SMA阳性细胞数量[(11.42±3.15)个/mm2比(9.00±2.19)个/mm2,P<0.05]均高于PLGF组,差异均有统计学意义。
3 讨论
急性心肌梗死是威胁人类生命的严重疾病之一。及时再灌注治疗可以迅速开通梗死相关动脉,挽救濒临坏死的心肌细胞,减少梗死心肌面积。然而,在我国及时行再灌注治疗的患者不足10%。而梗死心肌自身新生血管代偿、缺血预适应的变化过程非常缓慢,且只能部分代偿冠状动脉梗死引起的心肌缺血[7]。未及时行再灌注治疗患者往往发生明显的心室重塑(构),心功能逐渐减退,最终导致心力衰竭。因此,刺激、诱导和促进急性心肌梗死的缺血区域血管新生,促进缺血周边组织侧支循环形成,改善缺血心肌血流供应,已成为急性心肌梗死治疗的研究热点之一[1]。
VEGF为特异的血管内皮细胞促有丝分裂原,在急性心肌梗死后心肌缺血缺氧状态下,细胞外基质中的VEGF与血管内皮细胞膜上的血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR-2)结合后,通过激活Src[8]、Raf-MEK[9],PI3K-Akt[10-12]及DII4-Notch[13]等信号通路,诱导梗死区毛细血管新生,促进缺血周边组织侧支循环建立。然而VEGF主要作用于微血管生成阶段,形成的血管易渗漏、不成熟、不稳定,并且不能促进动脉生成[14-16],因而心功能改善并不明显。也有报道显示,逆转录腺病毒载体导入VEGF后,急性心肌梗死大鼠心功能趋向好转[17]。本研究中,给予外源性VEGF可提高心肌梗死周边区域毛细血管密度,但对梗死区动脉密度及心功能改善无明显作用,这与前述学者研究结果相同[14-16]。
PLGF作为VEGF家族成员同样具有强大的促血管生成作用。在急性心肌梗死后心肌缺血区域与血管内皮生长因子受体1(vascular endothelial growth factor receptor 1,VEGFR-1)结合激活PI-3K/Akt、p38MAPK/ERK和JAK/STAT3等下游信号转导通路[18-19],促进内皮细胞迁移、增殖、聚集,直接刺激血管新生,并可增加小动脉增殖[20],形成的血管更加稳定,可显著改善心功能。在本研究中,PLGF组较VEGF组和NS组毛细血管密度及小动脉密度均增加,心功能明显改善;并且PLGF治疗可增加梗死交界区有效侧支循环、减少梗死范围,减少左心室重构,提高LVEF,改善心功能。
本研究还观察到VEGF+PLGF组较其他三组大鼠心功能改善更明显,新生毛细血管及小动脉数量更多。这可能由于PLGF 特异性的受体为VEGFR-1,而VEGF在缺氧状态下可以与VEGFR-1和VEGFR-2结合,但是VEGFR-2在参与血管生成的内皮细胞中高表达,VEGF的信号主要通过它传导[21]。因此,在病理状态下,PLGF竞争性地与VEGFR-1结合,从而增加VEGF与VEGFR-2的结合,强化VEGF血管生成的功能。并且PLGF 能增加 VEGF 的活性,通过覆盖一层平滑肌细胞来刺激新的动脉形成和血管成形[22]。由此,将VEGF与PLGF联合使用,可能促血管生成作用更强,并且形成更有效的侧支循环,改善心肌缺血区血液供应,对心功能的改善更明显。本研究在该理论基础之上,将VEGF与PLGF剂量减半联合使用,发现较二者单独使用,心肌梗死区毛细血管和小动脉生成更多,心肌梗死范围更小,并且心功能改善更明显。因此,本研究提示,VEGF与PLGF联合使用后促进心肌梗死区毛细血管和小动脉生成及改善心功能效果优于二者单独使用。但本研究样本量较小,并且尚未完全阐明相关生理机制,需要进一步扩大样本量,对生理机制及结果进行深入研究。
[1] Lassaletta AD, Chu LM, Sellke FW. Therapeutic neovascularization for coronary disease: current state and future prospects . Basic Res Cardiol, 2011,106(6):897-909.
[2] Terzic A, Nelson TJ. Regenerative medicine advancing health care 2020. J Am Coll Cardiol, 2010, 55(20):2554-2557.
[3] Gospodarowicz D, Abraham J, Schilling J. Isolation and characterization of a vascular endothelial cell mitogen produced by pituitary-derived folliculo stellate cells. Proc Natl Acad Sci U S A, 1989,86(19):7311-7315.
[4] Binsalamah ZM, Paul A, Khan AA, et al. Intramyocardial sustained delivery of placental growth factor using nanoparticles as a vehicle for delivery in the rat infarct model. Int J Nanomedicine, 2011,6:2667-2678.
[5] 许官学,石蓓,盛瑾,等.改良大鼠急性心肌梗死模型的制备方法.中国老年学杂志,2013,33(14):3367-3370.
[6] Wykrzykowska JJ, Rosinberg A, Lee SU, et al. Autologous cardiomyotisue implantation promotes myocardial regeneration, decreases infarct size, and improves left ventricular function. Circulation, 2011, 123(1):62-69.
[7] Douvaras P, Antonatoa DG, Kekou K, et al. Association of VEGF gene polymorphisms with the development of heart failure in patients after myocardial infarction.Cardiology,2009,114(1):11-18.
[8] Destaing O, Planus E, Bouvard D, et al. β1A integrin is a master regulator of invadosome organization and function. Mol Biol Cell, 2010,21(23):4108-4119.
[9] Takahashi T, Yamaguchi S, Chida K, et al. A single autophosphorylation site on KDR/Flk-1 is essential for VEGF-A-dependent activation of PLC-γ and DNA synthesis in vascular endothelial cells. EMBO J, 2001, 20(11):2768-2778.
[10] Sarbassov DD, Guertin DA, Ali SM, et al. Phosphorylation and regulation of Akt/PKB by the rictor-mTOR complex. Science, 2005, 307(5712): 1098-10101.
[11] Jacinto E, Facchinetti V, Liu D, et al. SIN1/MIP1 maintains rictor-mTOR complex integrity and regulates Akt phosphorylation and substrate specificity. Cell, 2006, 127(1):125-137.
[12] Rotllan N, Wanschel AC, Fernández-Hernando A, et al. Genetic evidence supports a major role for Akt1 in VSMCs during atherogenesis. Circ Res, 2015, 116(11):1744-1752.
[13] Aspalter IM, Gordon E, Dubrac A, et al. Alk1 and Alk5 inhibition by Nrp1 controls vascular sprouting downstream of Notch. Nat Commun, 2015, 6:7264.
[14] Thurston G, Suri C, Smith K,et al.Leakage-resistant blood vessels in mice tansgenically overexpressing angiopoietin-1. Science, 1999,286(5449):2511-2514.
[15] Hershey JC,Baskin EP,Corcoran HA,et al.Vascular endothelial growth factor stimulates angiogenesis without improving collateral blood flow following hindlimb ischemia in rabbits.Heart Vessels, 2003, 18(3):142-149.
[16] 阿迪拉·阿扎提, 马翔, 刘芬,等. 可降解材料纤维蛋白胶介导血管内皮细胞生长因子对心肌梗死组织血管再生的影响.中国组织工程研究,2008,12(27):5253-5256.
[17] Cheng C, Li P, Wang YG, et al. Study on the expression of VEGF and HIF-1α in infarct area of rats with AMI. Eur Rev Med Pharmacol Sci, 2016, 20(1):115-119.
[18] Tchaikovski V, Fellbrich G, Waltenberger J. The molecular basis of VEGFR-1 signal transduction pathways in primary human monocytes. Arterioscler Thromb Vasc Biol, 2008, 28(2):322-328.
[19] Bellik L, Vinic MC, Filippi S, et al. Intracellular pathways triggered by the selective FLT-1-agonist placental growth factor in vascular smooth muscle cells exposed to hypoxia. Br J Pharmacol, 2005, 146(4):568-575.
[20] Roncal C, Buysschaert I, Chorianopoulos E, et al. Beneficial effects of prolonged systemic administration of PLGF on late outcome of post-ischaemic myocardial performance.J Pathol, 2008,216(2):236-244.
[21] Kiselyov A, Balakin KV, Tkachenko SE. VEGF/VEGFR signaling as a target for inhibiting angiogenesis. Expert Opin Investig Drugs, 2007, 16(1):83-107.
[22] Luttun A, Tjwa M, Moons L, et al. Revascularization of ischemic tissues by PLGF treatment, and inhibition of tumor angiogenesis, arthritis and atherosclerosis by anti-Flt1. Nat Med, 2002,8(8):831-840.
Effects of combination of vascular endothelial growth factor and placental growth factor on angiogenesis and cardiac function after acute myocardial infarction in rats
ZHANGXiao-ting,LIUFeng,WANGBing-yin.
XuzhouMedicalUniversity,Xuzhou221004,China
Correspondingauthor:LIUFeng,Email:fliu@medmail.com.cn
Objective To evaluate the combined effects of vascular endothelial growth factor (VEGF) and placental growth factor (PLGF) on angiogenesis and cardiac function and compare with VEGF or PLGF only in acute myocardial infarction rats. Methods Seventy-five males Sprague-Dawley(SD) rats were randomly divided into five groups: sham group, NS group, VEGF group, PLGF group, and VEGF+PLGF group with 15 rats in each group. All the rats underwent LAD ligation and injection of NS, VEGF, PLGF, VEGF+PLGF, in the peri-infarct area, respectively, besides the sham group. Three weeks after coronary artery ligation and different agents injection, cardiac function, myocardial scar area, angiogenesis and arteriogenesis were studied. Cardiac structure and function,and infarct size were assessed by echocardiography. The number of new vessels and the number of new arterioles were evaluated by haematoxylin-eosin staining and immunohistochemistry staining. Results Three weeks after LAD ligation and different agents injection, the LVEDD and LVESD were significantly decreased (P<0.01)in NS group, VEGF group and PLGF group. While the LVEF and LVFS were higher in VEGF+PLGF group than that in other groups. Myocardial infarct size was reduced in VEGF group(P<0.05). Angiogenesis and arteriogenesis were higher in VEGF+PLGF group than that in VEGF group (P<0.01) and PLGF group (P<0.05). Angiogenesis and arteriogenesis were significantly higher in PLGF group than that in VEGF group (P<0.01). The density of microvessels in VEGF group was higher than that in NS group (P<0.05), while arteriogenesis was of no statistical difference. Conclusion The combination of half VEGF and PLGF can increase angiogenesis and arteriogenesis in the ischemic marginal zone of myocardial infarction,decrease myocardial infarction area, and improve cardiac function.
Acute myocardial infarction; Vascular endothelial growth factor; Placental growth factor; Angiogenesis
10.3969/j.issn.1004-8812.2017.06.007
221004 江苏徐州,徐州医科大学研究生学院(张晓婷、刘峰);江苏苏州,上海交通大学附属苏州九龙医院心内科(张晓婷、刘峰、王炳银)
刘峰,Email:fliu@medmail.com.cn
R542.2
2017-02-26)
