金银花等6种植物提取物总黄酮含量与抗氧化性相关性研究
2017-08-08付晶晶肖海芳宋元达
付晶晶 肖海芳 宋元达
(山东理工大学农业工程与食品科学学院,山东 淄博 255000)
金银花等6种植物提取物总黄酮含量与抗氧化性相关性研究
付晶晶 肖海芳 宋元达
(山东理工大学农业工程与食品科学学院,山东 淄博 255000)
以金银花、核桃叶、南非醉茄、何首乌、红景天、石榴皮6种提取物为试验对象,通过硝酸铝—亚硝酸钠比色法测定了总黄酮含量;采用ABTS、DPPH与Fenton法测定了其抗氧化能力并进行比较;采用Pearson法进行相关性分析。结果表明:对DPPH自由基的清除能力顺序为金银花>核桃叶>南非醉茄>红景天>何首乌>石榴皮;对羟基自由基的清除能力顺序为金银花>核桃叶>南非醉茄>何首乌>石榴皮>红景天;对ABTS+自由基清除能力顺序为金银花>核桃叶>红景天>南非醉茄>何首乌>石榴皮。总黄酮含量对DPPH、ABTS+与羟基自由基清除能力的相关系数分别为0.819,0.848,0.791,表明总黄酮含量与清除DPPH、ABTS+自由基能力呈显著相关性,与清除羟基自由基能力相关性不显著。
金银花;何首乌;红景天;石榴皮;南非醉茄;核桃叶;总黄酮;抗氧化活性
由于自由基与人体内多种疾病相关,近年来,自由基与健康的相关性逐渐成为研究热点[1]。自由基又称为“游离基”,是细胞正常的代谢产物[2],它是一种缺乏电子的物质,具有很强的反应性,它可以从其他化合物中获得电子来维持稳定[3]。众多医学研究表明,过量的自由基可以破坏人体内包括DNA[4]、蛋白质[5]、脂质[6]等各种生物大分子的完整性,从而导致各种各样疾病的发生发展。抗氧化剂可以清除自由基从而防止自由基对人体的各种损害[7],BHT、BHA等是人们最常用的合成抗氧化剂,然而,这些抗氧化剂在抗氧化的同时也存在潜在的致癌作用[8]。因此,开发安全、无毒无害、健康的天然抗氧化剂具有重要的应用价值[9]。
黄酮类化合物是植物次生代谢的产物,广泛存在于天然植物中[10-11]。众多研究表明,黄酮类化合物具有抗炎[12]、抗氧化[13]、抗菌[14]、抗肿瘤[15]等生物活性。大多数黄酮类化合物均有较强的抗氧化作用[16],而黄酮类化合物的一些药理活性也往往与其抗氧化作用相关[17]。近年来,因黄酮类其药理作用在食品、医药领域研究较为深入,加快了其化合物的开发利用[18-19]。刘昌平等[20]研究发现,金银花中黄酮类化合物可以阻断亚油酸的自氧化作用;陈红红等[21]研究表明核桃叶中的总黄酮对D-半乳糖导致的衰老小鼠具有延缓衰老的作用;龚晓武等[22]证明了红景天黄酮类提取物对超氧阴离子、DPPH自由基、羟基自由基具有较好的清除作用;王涛等[23]证明何首乌黄酮类提取物对羟基自由基具有较好的清除能力;刘梦星等[24]证明石榴皮总黄酮提取物对羟基自由基具有较好的清除能力;朱海升等[25]研究表明南非醉茄根提取物在抗老年痴呆方面具有重要作用。本研究从植物来源及未来开发利用等多方面考虑,对已经报道的植物进行筛选分析之后,以金银花、何首乌、石榴皮、红景天、南非醉茄、核桃叶6种植物提取物为研究对象,利用硝酸铝—亚硝酸钠比色法[26]测定6种物质提取物总黄酮含量,再采用羟基自由基(·OH)清除率[27]、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)清除率[28]、ABTS+自由基清除率[29]评价6种物质的抗氧化性,以期筛选出抗氧化性最强的植物,并分析其量效关系,旨在为黄酮类功能性食品的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
新鲜核桃叶:采自淄博市博山区;
金银花、何首乌、红景天、石榴皮、南非醉茄提取物:陕西信瑞生物科技有限公司;
芦丁标准品、DPPH、ABTS:纯度≥98%,国药集团化学试剂有限公司;
无水乙醇:分析纯,国药集团化学试剂有限公司;
其他试剂均为分析纯。
1.1.2 主要仪器设备
旋转蒸发器:RE-52AA型,上海亚荣生化仪器厂;
循环水式真空泵:SHZ-D型,巩义市予华仪器有限责任公司;
超声清洗器:KQ-700E型,昆山超声仪器有限公司;
电热鼓风干燥箱:DHG-9140A型,上海一恒科学仪器有限公司;
高速万能粉碎机:FW100型,天津市泰斯特仪器有限公司;
分光光度计:UV-2600 型,日本岛津(中国)有限公司;
电子天平:LE303E/02 型,梅特勒-托利多仪器(上海)有限公司。
1.2 方法
1.2.1 样品液的制备 准确称取0.1 mg金银花、石榴皮、核桃叶、南非醉茄、何首乌、红景天提取物于10 mL容量瓶中用蒸馏水定容至刻度,得到10 mg/mL的样品液。
1.2.2 总黄酮含量的测定
(1) 标准液的配置:准确称取10 mg芦丁标准品,置于100 mL容量瓶中,用60%乙醇定容至刻度,得浓度为0.1 mg/mL的标准液。
(2) 标准曲线的建立:准确吸取芦丁标准液0.00,1.00,2.00,3.00,4.00,5.00 mL置于 10 mL 的试管中,加入30%的乙醇至5 mL,加入5%亚硝酸钠溶液 0.3 mL,混匀;放置 6 min 后加入10%硝酸铝溶液 0.3 mL,摇匀;放置6 min后加入10%氢氧化钠溶液 4 mL,摇匀;最后用60%的乙醇定容至10 mL,摇匀,15 min后于510 nm处测定吸光值,根据所得数据,以芦丁浓度为横坐标,吸光度值为纵坐标绘制标准曲线(见图1),得线性回归方程为:y=11.04x-0.007 6,R2=0.995 2。

图1 芦丁标准曲线
(3) 样品液总黄酮含量的测定:分别准确吸取1 mL各样品液于10 mL容量瓶按1.2.2(2)的方法加入显色剂,加60%的乙醇至刻度,摇匀,10 min后,于510 nm处测吸光度。以未加样品液的为空白,每个样品重复3次。总黄酮含量按式(1)计算:
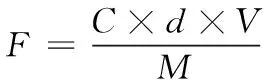
(1)
式中:
F——黄酮类物质含量,mg/g;
C——提取液中总黄酮质量浓度,mg/mL;
d——稀释倍数;
V——提取液定容体积,mL;
M——样品质量,g。
1.2.3 DPPH自由基的清除作用 精密称取7.88 g DPPH,用无水乙醇溶解并定容于100 mL容量瓶中,得到浓度为2×10-4mol/L的DPPH溶液,4 ℃保存,现配现用。避光取2 mL样品液于10 mL容量瓶中,用70%乙醇定容至刻度。取3组标号为1、2、3、4、5的5支5 mL离心管加样,混匀后室温避光静置30 min,在波长为517 nm条件下测定吸光值,按式(2)计算DPPH清除率并计算IC50(当抑制率到达50%时所需抗氧化剂的量)。每个样品做3次平行。

(2)
式中:
D——DPPH自由基清除率,%;
Ai——2 mL样品液与2 mL DPPH混合后的吸光度;
Aj——2 mL样品液与2 mL 70%乙醇混合后的吸光度;
Ac——2 mL DPPH与2 mL 70%乙醇混合后的吸光度。
1.2.4 羟基自由基的清除作用 分别量取0.4,0.8,1.2,1.6,2.0 mL样品液于10 mL容量瓶中,并用70%乙醇定容至刻度。取3组标号为1、2、3、4、5的5支5 mL离心管加样,第一组分别加入1 mL 0.75 mmol/L的邻二氮菲与5种不同浓度梯度的样品1 mL,后加入0.75 mmol/L的硫酸亚铁1 mL,最后加入60 mmol/L H2O21 mL,混匀后水浴60 min,在波长536 nm条件下测定吸光值得As;第二组、第三组分别用蒸馏水替代60 mmol/L H2O2得Ab、用蒸馏水代替样品溶液得Ap,按式(3)计算羟基自由基清除率并计算IC50。每个样品做3次平行。

(3)
式中:
O——羟基自由基清除率,%。
1.2.5 ABTS+自由基的清除作用 分别量取0.4,0.8,1.2,1.6,2.0 mL样品液于10 mL容量瓶中,并用70%的乙醇定容至刻度。取2组标号为1、2、3、4、5的5支5 mL离心管加样,将经暗处理24 h的体积比为1∶1的混合液(7 mmol/L的ABTS和2.5 mmol/L的K2S2O8)稀释40~50倍,使其在734 nm处吸光度为0.7±0.02,制成ABTS+工作液。第一组中分别取0.8 mL ABTS+与0.2 mL无水乙醇混合均匀,测得吸光值为A;第二组中分别取0.8 mL ABTS+与各浓度梯度的提取液0.2 mL混合均匀,测得吸光值为A0。样品混匀后室温避光静置6 min,再在734 nm条件下测定吸光值。按式(4)计算ABTS+自由基清除率并计算IC50。每个样品做3次平行。

(4)
式中:
A——ABTS+自由基清除率,%。
1.2.6 数据分析 采用Spss v19.0软件进行统计分析,Pearson法进行相关性分析,Duncan法进行显著性分析。
2 结果与分析
2.1 6种总黄酮类提取物的含量
由图2可知,6种物质的总黄酮含量顺序为:金银花>核桃叶>南非醉茄>红景天>何首乌>石榴皮。其中,金银花、核桃叶、南非醉茄总黄酮含量分别是石榴皮的4.6,2.5,2.4倍。
2.2 6种提取物的抗氧化活性
2.2.1 DPPH自由基的清除能力 DPPH作为一种稳定的自由基,而被广泛应用于自由基清除试验中。由图3可知,6种不同浓度的黄酮类提取物对DPPH自由基均有清除作用,且随浓度升高清除作用增强,但6种物质清除DPPH自由基的增幅不明显。
研究表明黄酮类物质含量与抗氧化性具有相关性[30],DPPH清除率达到50%时的组分浓度(IC50)与清除能力呈反比,IC50越大,其清除DPPH自由基的能力就越小[31]。图4结果显示6种提取物IC50范围为0.096~0.374 mg/mL,其中金银花提取物的IC50最小为0.096 mg/mL,石榴皮提取物的IC50最大为0.374 mg/mL。6种提取物清除DPPH自由基的顺序为:金银花>核桃叶>南非醉茄>红景天>何首乌>石榴皮。
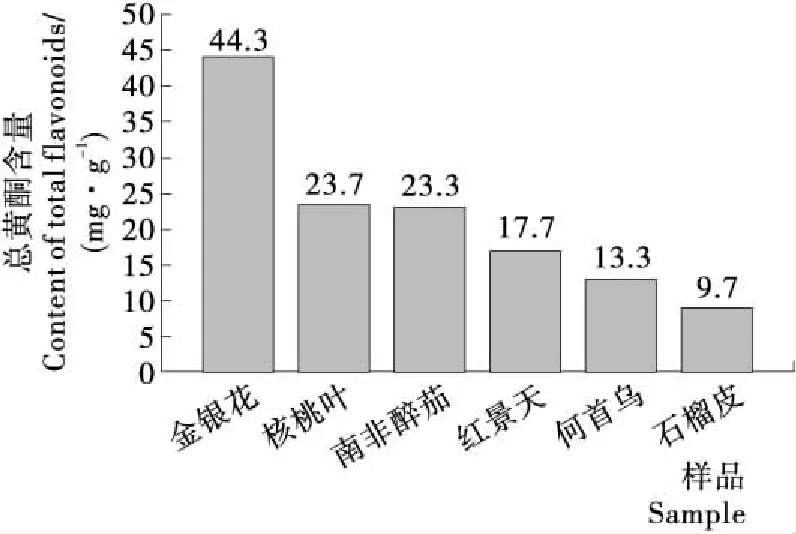
图2 6种提取物的总黄酮含量

图3 6种提取物对DPPH自由基的清除能力

图4 清除DPPH自由基的IC50值
2.2.2 羟基自由基的清除能力 羟基自由基被公认为是最具活性的活性氧,能导致生物体内DNA、蛋白质和脂质氧化损伤。目前关于羟基自由基的产生机理,最被广泛接受的是过渡金属离子催化的Fenton反应[32]。H2O2/Fe2+体系可以通过Fenton反应产生羟基自由基,邻二氮菲-Fe2+水溶液被羟基自由基氧化为邻二氮菲-Fe3+后,其在536 nm处的最大吸收峰消失,A536值降低。当反应体系中加入羟基自由基清除剂时,此过程受到抑制。试验结果表明(见图5)核桃叶、金银花、南非醉茄、红景天、何首乌、石榴皮均对羟基自由基具有清除作用,并且在浓度为0.08~0.16 mg/mL时,清除能力变动幅度较大,0.16 mg/mL后变动幅度趋于平稳。整体看6种提取物对羟基自由基清除能力均随浓度升高而增高,因此6种提取物对羟基自由基清除能力表现出一定的量效关系。
6种植物提取物IC50范围为0.045~0.316 mg/mL(见图6),金银花提取物IC50为0.045 mg/mL,明显低于其它5种物质,红景天提取物IC50最大(为0.316 mg/mL),6种提取物清除羟基自由基的顺序为:金银花>核桃叶>南非醉茄>何首乌>石榴皮>红景天。

图5 6种提取物对羟基自由基的清除作用

图6 清除羟基自由基的IC50值
2.2.3 ABTS+自由基清除能力 ABTS自由基经活性氧氧化产生稳定的蓝绿色自由基ABTS+,在734 nm处有最大吸收峰,在抗氧化物质的作用下反应体系褪色,因而依据吸光值的变化可以衡量待测物对ABTS+自由基清除能力。本试验利用该法测定6种提取液的抗氧化能力,结果表明(见图7),6种提取物对ABTS+自由基均有清除作用。其中金银花提取物在浓度为0.24 mg/mL时增幅较大,其它5种提取物增幅趋于平稳,随提取物黄酮浓度的增加6中提取物对ABTS+自由基清除能力均增加。说明6种提取物对ABTS+自由基的清除能力存在一定的量效关系。
提取物IC50的变动范围为0.067~0.415 mg/mL(见图8),其中金银花提取物IC50最小为0.067 mg/mL,所以其抗氧化性最强,其他5种提取物中石榴皮的IC50最大,其抗氧化性最弱。6种提取物ABTS+自由基清除能力顺序为:金银花>核桃叶>红景天>南非醉茄>何首乌>石榴皮。

图7 6种提取物对ABTS+自由基的清除作用

图8 清除ABTS+自由基的IC50值
2.2.4 6提取物总黄酮含量与抗氧化性相关性分析 对6种总黄酮提取物抗氧化性进行了Pearson法相关性分析(结果见表1),表明总黄酮含量与清除DPPH自由基、ABTS+自由基能力呈显著相关性,与清除羟基自由基能力相关性不显著。由此总黄酮在抗氧化过程中起着较为重要的作用。

表1 6种提取物总黄酮含量与抗氧化性相关性分析†
† *显著相关(P<0.05)。
3 结论
供试的6种植物提取物的总黄酮含量及对自由基清除能力表现出一定的差异性。并且随着总黄酮含量的增加抗氧化能力随之增加。可能是黄酮类物质的多样性及各个样品中具有抗氧化的种类及其中具有抗氧化的有效黄酮种类和含量不同。黄酮类物质种类繁多,但并不是所有的黄酮类化合物都具有相同的抗氧化能力,而是与每种化合物的结构有关。
据以往研究[33]表明黄酮类化合物只是衡量物质抗氧化的一个主要指标,所以不同物质表现出不同的清除能力可能与其主导的抗氧化性物质种类有关。至于能不能将黄酮类物质含量作为唯一衡量抗氧化的指标,值得进一步研究。
[1] GOMBERG M. An instance of trivalent carbon: triphenylmethyl[J]. Journal of the American Chemical Society, 1900, 22(11): 757-771.
[2] SALLA S, SUNKARA R, OGUTU S, et al. Antioxidant activi-ty of papaya seed extracts against H2O2, induced oxidative stress in HepG2 cells[J]. LWT-Food Science and Technology, 2016, 66(1): 293-297.
[3] PHANIENDRA A, JESTADI D B, PERIYASAMY L. Free radicals: properties, sources, targets, and their implication in various diseases[J]. Indian Journal of Clinical Biochemistry, 2015, 30(1): 11-26.
[4] MARNETT L J. Oxyradicals and DNA damage[J]. Carcinogenesis, 2000, 21(3): 361-370.
[5] STADTMAN E R, LEVINE R L. Protein oxidation[J]. Annals of the New York Academy of Sciences, 2000, 899(1): 191-208.
[6] SEPPO Ylä-herttuala. Oxidized LDL and Atherogenesis[J]. Annals of the New York Academy of Sciences, 2006, 874(1): 134-137.
[7] HAKKIM F L, SHANKAR C G, GIRIJA S. Chemical composition and antioxidant property of holy basil (Ocimum sanctum L.) leaves, stems, and inflorescence and their in vitro callus cultures[J]. Journal of Agricultural & Food Chemistry, 2007, 55(22): 9 109-9 117.
[8] 李爱军, 欧仕益, 罗泽榕, 等. 一种天然抗氧化剂复合物抗氧化作用的研究[J]. 食品与机械, 2001, 17(4): 28-30.
[9] POLITEO O, JUKIC M, MILOS M. Chemical composition and antioxidant capacity of free volatile aglycones from basil (Ocimum basilicum L.) compared with its essential oil[J]. Food Chemistry, 2007, 101(1): 379-385.
[10] YANG C, GUNDALA SR, MUKKAVILLI R, et al. Synergisticinteractions among flavonoids and acetogenins in Graviola(Annona muricata) leaves confer protection against prostatecancer[J]. Carcinogenesis, 2015, 36(6): 656-665.
[11] BRICKMAN A M, KHAN U A, PROVENZANO F A, et al. Enhancingdentate gyrus function with dietary flavanols improvescognition in older adults[J]. Nat Neurosci, 2014, 17(12): 1 798-1 803.
[12] GONZALEZ R, BALLESTER I, LOPEZ-POSADAS R, et al. Effects of flavonoids and other polyphenols on inflammation[J]. Critical Reviews in Food Science and Nutrition, 2011, 51(4): 331-62.
[13] PASTORELLO EA, CONTI A, PRACETTONI V, et al. Identification of actinidin as the major allergen of kiwifruit[J]. J Allergy Clin Immu, 1998, 101(4): 531-537.
[14] MOAWAD A, HETTA M, ZJAWIONY J K, et al. Phytochemical investigation of Cycas circinalis and Cycas revoluta leaflets: moderately active antibacterial biflavonoids.[J]. Planta Medica, 2010, 76(8): 796.
[15] DURY L, NASR R, LORENDEAU D, et al. Flavonoid dimers are highly potent killers of multidrug resistant cancer cells overexpressing MRP1[J]. Biochemical Pharmacology, 2017, 124: 10-18.
[16] RICE-EVANS C A, MILLER N J, PAGANGA G. Structure-antioxidant activity relationships of flavonoids and phenolic acids[J]. Free Radic. Biol. Med., 1996, 20(1): 933-956.
[17] 熊皓平, 杨伟丽, 张友胜, 等. 天然植物抗氧化剂的研究进展[J]. 天然产物研究与开发, 2001, 13(5): 75-79.
[18] 王春霞, 蒲彪, 蒋燕, 等. 藤椒冷榨油饼粕中黄酮类物质的提取及体外抗氧化活性研究[J]. 食品与机械, 2017, 33(1): 137-142.
[19] 张赟彬, 李彩侠, 吴亚卿. 黄酮类化合物的研究进展[J]. 食品与机械, 2005, 21(5): 70-73.
[20] 刘昌平. 金银花黄酮的抗氧化活性分析[J]. 安徽农业科学, 2009, 37(20): 9 483-9 484.
[21] 陈红红, 李助乐, 章健, 等. 山核桃叶总黄酮抗衰老作用的研究[J]. 天然产物研究与开发, 2008, 1(5): 892-895.
[22] 龚晓武, 李炳奇, 刘丹丹, 等. 红景天黄酮提取及其抗氧化活性研究[J]. 西北林学院学报, 2011, 26(3): 136-138.
[23] 王涛, 郝云辉, 马晶军. 微波辅助提取何首乌中的总黄酮及其抗氧化性研究[J]. 河北医药, 2014, 36(23): 3 654-3 656.
[24] 刘梦星, 刘祺凤, 田璐阳, 等. 石榴皮中总黄酮超声辅助提取及抗氧化性分析[J]. 湖北农业科学, 2014, 53(4): 894-896.
[25] 朱海升, 刘鄂湖, 鞠娟, 等. 抗老年性痴呆的天然药物研究进展[J]. 中国药房, 2007, 18(3): 223-225.
[26] 郭亚健, 范莉. 关于NaNO2-Al(NO3)3-NaOH比色法测定总黄酮方法的探讨[J]. 药物分析杂志, 2002, 1(2): 97-99.
[27] 洪艳平, 陈木森, 上官新晨, 等. 枸骨叶总黄酮超声辅助提取与测定[J]. 食品与机械, 2009, 25(1): 72-75.
[28] 施英, 徐玉娟, 陈卫东, 等. 桔核中柠檬苦素类物质最佳提取条件的探讨及清除DPPH活性的研究[J]. 食品与机械, 2006, 22(6): 74-76.
[29] 马博, 张婷婷, 黎远成, 等. 麻疯树籽壳总黄酮的提取及其羟基自由基清除作用[J]. 食品与机械, 2014, 30(5): 196-199.
[30] 欧阳凯, 何先元, 陈飞, 等. 四齿四棱草总皂苷提取工艺优化及抗氧化性研究[J]. 食品与机械, 2016, 32(7): 141-145.
[31] 唐福才, 关天旺, 姚敦琛, 等. 微波提取龙眼核中多酚及其抗氧化活性的研究[J]. 广东化工, 2015, 42(5): 176-177.
[32] 贾之慎, 邬建敏, 唐孟成. 比色法测定Fenton反应产生的羟自由基[J]. 生物化学与生物物理进展, 1996, 23(2): 184-186.
[33] 郭小补, 廖森泰, 刘吉平, 等. 不同桑品种的桑叶总黄酮含量与体外抗氧化活性的相关性[J]. 蚕业科学, 2008, 34(3): 381-386.
Acomparative study of contents of total flavonoids and their antioxidant activities in six plants
FU Jing-jing XIAO Hai-fang SONG Yuan-da
(School of Agricultural Engineering and Food Science, Shandong University of Technology, Zibo, Shandong 255000, China)
In the present study, six total flavonoids extracts were prepared from Honey suckle, Walnut leaves,WithaniaSomnifera,Rhodiolarosea, Pomegranate bark, andPolygonummultiflorum. The total flavonoids content of six plant extracts were measured by aluminium nitrate-sodium nitrite colorimetry. The antioxidant activities of six extracts were compared by the detection methods of DPPH, ABTS and Fenton, and then the correlation of total flavonoids content was analyzed by Pearson. The results showed that the DPPH scavenging order was Honey suckle>Walnut leaves>W.Somnifera>R.rosea>P.multiflorum>Pomegranate bark. The hydroxyl radical scavenging order was Honey suckle>Walnut leaves>W.Somnifera>P.multiflorum>Pomegranate bark>Rhodiola rosea. The results showed that the ABTS+scavenging order was Honey suckle>Walnut leaves>R.rosea>W.Somnifera>P.multiflorum>Pomegranate bark. The free radical scavenging ability and flavonoids content of six kinds of extracts showed quantitative relationship. The correlation that the total flavonoid content and DPPH, ABTS+was significantly positive, while with hydroxyl radical was not the same. The correlation coefficients above were 0.819, 0.848 and 0.791, respectively.
Honey suckle; Walnut leaves;WithaniaSomnifera;Rhodiolarosea; Pomegranate bark;Polygonummultiflorum; total flavonoids; antioxidant activity
山东省自然科学基金青年项目(编号:ZR2014CQ002)
付晶晶,女,山东理工大学在读硕士研究生。
肖海芳(1980—),女,山东理工大学讲师,博士。 E-mail:xiaohaifang@sdut.edu.cn
2017—02—25
10.13652/j.issn.1003-5788.2017.06.032
