鄂尔多斯盆地奥陶系烃源岩支链烷烃特征及其地质意义
2017-08-08王成王万春王建丰樊海龙
王成,王万春,王建丰,樊海龙
1.甘肃省油气资源研究重点实验室/中国科学院油气资源研究重点实验室,兰州 730000 2.中国科学院大学,北京 100049
鄂尔多斯盆地奥陶系烃源岩支链烷烃特征及其地质意义
王成1,2,王万春1,王建丰1,2,樊海龙1,2
1.甘肃省油气资源研究重点实验室/中国科学院油气资源研究重点实验室,兰州 730000 2.中国科学院大学,北京 100049
通过对鄂尔多斯盆地奥陶系马家沟组6口井烃源岩岩芯样品饱和烃的GC /MS分析,系统论述了烃源岩中支链烷烃的鉴定方法和依据,检测到碳数分布范围为C15~C21的中等链长的支链烷烃,主要包括2-甲基(异构)、3-甲基(反异构)、高位取代单甲基支链烷烃、双甲基支链烷烃和无环类异戊二烯烷烃;其中异构烷烃和反异构烷烃碳数分布范围较广且短、中、长链都有分布。结合研究区的沉积特征及其他有机地球化学指标,认为鄂尔多斯盆地奥陶系马家沟组中等链长的单甲基支链烷烃来源于一些特殊细菌和藻类,其中蓝细菌为最可能直接输入母质;其次一些异养细菌对原始沉积物的改造也是中等链长支链烷烃富集的重要原因之一;长链的2-甲基异构和3-甲基反异构烷烃可能与热催化重排有很大的关系。
支链烷烃;鄂尔多斯盆地;奥陶系;烃源岩
0 引言
支链烷烃包括单甲基支链烷烃、双甲基支链烷烃、双乙基支链烷烃、多甲基支链烷烃以及无环类异戊二烯烷烃,是生物体、原油和烃源岩中常见的化合物[1-12]。吉利明等[2]在研究鄂尔多斯盆地延长组原油样品时,发现了一系列短—中链的单甲基支链烷烃,其碳数分布在C15~C34,认为可能来源于葡萄藻母质输入;Hanetal.[3]在前寒武纪样品中发现丰富的中链甲基支链烷烃,认为是来源于蓝细菌;Shieaetal.[4]在文献资料中整理蓝细菌席时,发现了大量的中等链长的单甲基支链烷烃;Kenigetal.[5]在Abu Dhabi全新统微生物群可抽提组分中,检测到碳数分布范围C24~C45长链单甲基烷烃,通过同位素示踪认为这些长链单甲基支链烷烃来自以微生物为食的昆虫;Thieletal.[9]在古沉积物和原油中检出碳数分布范围为C14~C24的中等链长的支链羧酸,并认为是中等链长支链烷烃的先驱物;张虎才等[10]在古湖泊沉积中检测出含季碳的长链支链烷烃A~C系列化合物,分别被确定为5,5-二乙基烷烃、6,6-二乙基烷烃、5-丁基,5-乙基烷烃系列,认为该系列支链烷烃化合物来自于某种喜热的菌藻类;Göhringetal.[11]在意大利白垩系海相沥青页岩中发现了一系列的2,6-二甲基支链烷烃,推测该二甲基支链烷烃化合物可能是角鲨烯或胡萝卜素类的衍生物;Chappeetal.[12]在梅赛尔油页岩中检出13,16-二甲基廿八烷,认为可能是一些醚类化合物的衍生物。
综上,支链烷烃在各个年代(前寒武系—现代)各种环境(淡水湖相、海相、热泉极端环境)短、中、长链都有检出。在鄂尔多斯盆地奥陶系马家沟组检测到碳数分布为C15~C21较为丰富的中链支链烷烃及碳数大于C21长链异构烷烃和反异构烷烃,现根据其分布特征并结合其他有机地球化学指标对支链烷烃的鉴定方法及支链烷烃的地质意义进行探讨。
1 研究区地质概况
鄂尔多斯盆地中东部地区马家沟组主要发育马一段—马五段,其中马一段、马三段、马五段主要发育盐岩及碳酸盐岩,马二段、马四段主要发育碳酸盐岩[13]。通过对鄂尔多斯盆地中东部榆9井的单井相分析表明,该区马家沟组分布从马二段到马五段,其中马二段和马四段主要由泥晶白云岩,泥、粉晶灰岩、硬石膏岩及泥岩组成,沉积环境为海侵期沉积;马三段和马五段由大套盐岩夹白云质硬石膏岩、膏质白云岩、泥质白云岩组成,主要以咸化瀉湖沉积为主[14]。鄂尔多斯盆地东部龙探1井勘探表明,井区一带主要发育膏盐岩和盐岩的台地蒸发岩相沉积,主要原因是鄂尔多斯盆地东部在奥陶系马家沟组的马一、三、五段沉积时期,气候干热,海平面下降所致[15]。综上,研究区所在的鄂尔多斯盆地中东部奥陶系以咸化瀉湖或台地蒸发相沉积为主。新富5井位于鄂尔多斯盆地南部的富县地区,该区块属于伊陕斜坡南部,构造较为平缓,主要发育马五段,其沉积环境为云坪、含膏云坪及膏盐湖[16]。
李贤庆等[17-18]认为鄂尔多斯盆地中东部奥陶系马家沟组碳盐岩中有机质以藻质体、藻屑体、和基质腐泥体为主,反应出母质输入以菌藻类的低等生物输入为主。刘德汉等[19]通过激光—荧光显微技术在鄂尔多斯盆地下奥陶统马家沟组碳酸盐岩中发现了含有多种黄色荧光的有机显微组分,包括类似Gloeocapsomorpha prisca的黏球形藻、层状藻、结构藻、藻屑和荧光无定形体。同时,在鄂尔多斯盆地奥陶系马家沟组有机质中藿烷类化合物比较丰富[20-21],烃源岩中的藿烷主要来源于细菌,如蓝细菌、真菌以及厌氧细菌[22],说明包括蓝细菌在内的一些菌藻类在鄂尔多斯盆地奥陶系广泛发育。
2 样品与实验
样品采集自鄂尔多斯盆地中东部奥陶系马家沟组的定北5井、定北8井、大113、大67井以及鄂尔多斯盆地南部新富5井(表1)。将采集的样品除去表面污垢,粉碎至120目,抽提方法采用氯仿索氏抽提,抽提大约72 h,可溶有机质用正己烷沉淀沥青质后,经硅胶—氧化铝(3∶1)进行柱色层分离,用正己烷提取饱和烃、二氯甲烷提取芳香烃、甲醇提取非烃馏分。将分离出的饱和烃馏分进行GC/MS分析,进样品温度:250℃,柱箱温度:80℃(1 min)开始,升温速率4℃/min,至290℃,恒温30 min,色谱柱:KD-5,30 m×0.25 mm×0.25 μm(与HP-5MS柱相同);使用分析仪器为GC7890N/MSMS(7000B)联用仪,采用美国NIST11谱库。
3 结果与讨论
3.1 支链烷烃化合物的确定依据及鉴定方法
支链烷烃化合物的识别主要依据其在TIC上的保留时间、特征离子对比以及质谱特征与文献资料对比,其次将样品质谱图与标准谱库中的质谱图进行对比,判断其碎片的相似程度也是识别未知化合物的重要手段。在EI条件下,由于支链点处分子间能量较低,所以支链烷烃在支链点处会优先断裂,分散成偶质量数的离子碎片和奇质量数离子碎片,其中偶质量数离子来自于氢的位置转移[23-24],所以这一特征被用来确定支链点的位置。在质谱图上,特征离子的质谱峰高明显高于相邻离子的峰高(图1)。在色谱图上,为确定取代基侧链的位置,首先锚定需要鉴定的总离子流峰图,然后调用特征离子进行对比识别,钱宇等[25]总结了单甲基烷烃系列化合物特征离子表(表2),各特征离子质量色谱图对应的化合物为一系列的单甲基烷烃。随着支链烷烃甲基位置靠近碳链中部,质谱图上偶质量数碎片的相对丰度会慢慢增大,所以异构烷烃和反异构烷烃甲基断裂处形成的偶数碎片丰度较低,而高位甲基取代的支链烷烃偶数碎片丰度远高于相应的奇数碎片,在质谱峰图上特征离子异常突出。根据此方法判断鄂尔多斯盆地奥陶系马家沟组烃源岩样品甲基位置从2位到7位。

表1 鄂尔多斯盆地奥陶系样品层位及基本地球化学参数
单甲基支链烷烃包括2-甲基支链烷烃(异构烷烃),3-甲基支链烷烃(反异构烷烃),和高位取代支链烷烃。图1是烃源岩样品XF-5-2中的C18单甲基支链烷烃的质谱图,从图可以看出各单甲基支链烷烃的特征离子高于其相邻的峰高。其色谱图出峰规律是:在总离子流图(TIC)上相同碳数正构烷烃之间,靠近右侧一端,出现一系列有规律的丰度较高的峰(图2),根据其质谱图特征与文献资料对比以及特征离子对比,其出峰顺序一般为6—5—4—2—3(6代表6位甲基),这些峰一般为等间距出现,其单甲基支链烷烃的碳数与其后面对应的正构烷烃保持一致。在这些峰之中,其中有一个峰为烷基环己烷,用m/z=82可识别。2-甲基支链烷烃(异构烷烃)和3-甲基支链烷烃(反异构烷烃)是烃源岩和原油中最常见的一类化合物,其识别和鉴定也较为容易,质谱基峰均为m/z=57,2-甲基支链烷烃具有明显的特征性碎片离子M+-43和M+-15,而反异构烷烃的特征离子为M+-29,异构烷烃和反异构烷烃一般在烃源岩或石油中成对出现,大多数情况下异构烷烃的丰度高于反异构烷烃。所以首先识别异构烷烃和反异构烷烃,然后根据单甲基支链烷烃的等距离出峰原则,去识别其他单甲基侧链位置也是一种常用的鉴定方法。据单甲基取代支链烷烃出峰顺序,高位取代出峰在前,低位取代在后,高位支链烷烃为8-甲基,7-甲基,6-甲基,5-甲基和4-甲基系列。7-甲基以上的烷烃异构体一般为混合物,图3为烃源岩样品XF-5-2中支链烷烃局部放大图,图中T部分为混合物,其峰型与文献[26]中的M峰保持一致,Klomp[27]在对长链支链烷烃的研究中,推测T部分可能存在二甲基取代烷烃和多甲基取代烷烃。对于这类化合物现有的色谱柱条件下很难将其鉴定分离。
无环类异戊二烯烷烃在有机地球化学领域是一种非常常见的的生物标志化合物,其鉴定和识别较为简单,利用特征离子为m/z113和183,结合正构烷烃可以识别出常见的无环类异戊二烯烷烃,如姥鲛烷和植烷。其质谱图其特点是:特征离子m/z183比左右两个相邻的质谱峰都高。

图1 C18单甲基支链烷烃化合物质谱图(n-Me-C18,n表示单甲基取代的位置)Fig.1 Mass spectrum of the monomethyldocosane (n in the expression of n-Me-C18 represents the position of the methyl)

表2 单甲基烷烃系列化合物特征离子表(引自钱宇等[25])
注:2M-12 表示 2-甲基-C12。

图2 鄂尔多斯盆地奥陶系烃源岩(D113-10)支链烷烃局部放大图Fig.2 Distribution of branched alkanes in a Ordovician carbonate sample (D113-10) from the Ordos Basin (partly enlarged)

图3 a.样品XF-5-2 C15~C20支链烷烃的分布图;b. nC17~nC18之间支链烷烃部分放大图(其中2~7数字代表单甲基烷烃位置)Fig.3 a. Distribution of branched alkanes C15~C20 of sample(XF-5-2) ; b. Partly enlarged distrbution of branched alkances between C17~C18(the number from 2 to 7 indicates the position of the methyl in monomwthylalkanes)
3.2 支链烷烃类化合物的分布特征
鄂尔多斯盆地奥陶系马家沟组样品中均检出了较为丰富的支链烷烃,图4为奥陶系马家沟组烃源岩饱和烃总离子流(TIC)及支链烷烃的分布特征图,可以看出碳数分布为C15~C21中等链长的单甲基支链烷烃最为丰富,甲基取代2~7(2代表2位甲基),C21以后长链单甲基支链烷烃只有异构和反异构烷烃有分布(图4);图2为样品(D113-10)中C15~C21中等链长支链烷烃馏分总离子流局部放大图,由图可见,鄂尔多斯盆地奥陶系马家沟组烃源岩中单甲基支链烷烃分布于正构烷烃之间,丰度低于相邻的正构烷烃,甲基取代顺序为6—5—4—2—3。鄂尔多斯盆地奥陶系马家沟组样品中低于C20的无环类异戊二烯烷烃包括:异十六烷(2,6,10-三甲基十三烷)、降姥鲛烷(2,6,10-三甲基十五烷)、姥鲛烷(2,6,10,14-四甲基十五烷)、植烷(2,6,10,14-四甲基十六烷)(图4),丰度较高仅次于正构烷烃。对于碳数大于C21的无环类异戊二烯烷烃,由于其在总离子流图上丰度比较低,常和其他类型化合物共溢出,鉴定较为困难。
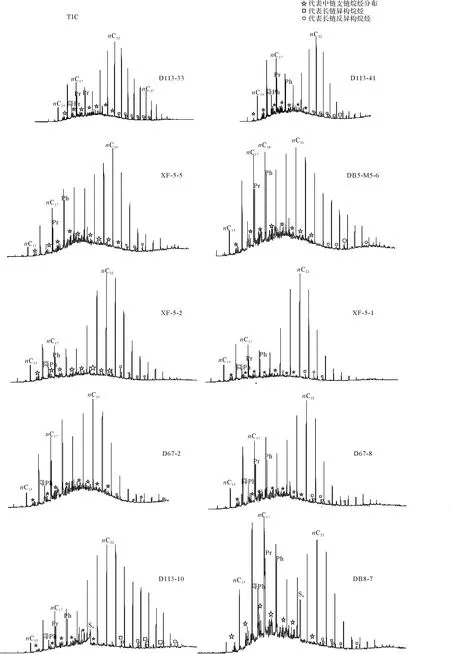
图4 马家沟组烃源岩饱和烃总离子流(TIC)及支链烷烃的分布特征Fig.4 TIC of saturated hydrocarbons in source rocks of the Majiagou Formation and distribution features of branched alkanes
3.3 支链烷烃特征及其地质意义
3.3.1 高位取代支链烷烃系列
一般认为4-甲基取代以上为高位取代支链烷烃。已发现蓝细菌的C16~C21烷烃中4-甲基到8-甲基烷烃的含量相对较高,其中7-甲基和8-甲基异构体占优势[4,28-29]。蓝绿藻可直接产生7-和8-甲基十七烷[30-31]。许多原油和烃源岩,特别是前寒武纪样品含有丰富的中等链长支链烷烃[24,32-33],而在现代沉积物中,特别是在温泉蓝菌席中高位取代的中链支链烷烃含量丰富,而在缺乏蓝细菌的微生物席中没有检出[34]。中等链长支链烷烃在前寒武纪样品中的富集,可能指示烃源岩沉积环境中的蓝细菌发育;中等链长的高位取代的单甲基支链烷烃在南阿曼地区前寒武系和古生界的原油中也有发现[27],其中部分研究认为A种属的葡萄藻最有可能是这部分单甲基烷烃的母质来源[2,35]。鄂尔多斯盆地奥陶系马家沟组的样品中,中等链长支链烷烃系列比较丰富,碳数分布为C15~C21,且研究区以咸化瀉湖或台地蒸发沉积为主,沉积于强还原环境,大部分样品的正构烷烃色谱峰为前峰型为主的双峰型,且主峰碳大多为C17/C22,这类正构烷烃有机质母质输入主要来自细菌、藻类等,其沉积环境一般为水生和远洋[36]。卢鸿等[37]在轮南14井三叠系油砂中,证实了在后峰型正构烷烃之间检测到的单甲基支链烷烃单体碳同位素组成与后峰型正构烷烃的单体碳同位素一致(-30.52‰~-31.64‰),说明二者的母质成因是一致的。所以鄂尔多斯盆地奥陶系马家沟组中等链长支链烷烃成因可能是一些藻类或一些特殊的细菌,结合鄂尔多斯盆地奥陶系以细菌及藻类母质输入特征,认为蓝细菌为支链烷烃最可能的来源。C21之前与之后的单甲基支链烷烃的比值和正构烷烃比值之间有很好的相关性(R2=0.929)(图5)。正构烷烃的∑C22-/∑C23+值可以判断沉积有机质的母质输入类型,正构烷烃nC22之前以低等水生生物或藻类等输入为主,nC23之后主要以高等植物输入为主,所以正构烷烃∑C22-/∑C23+值越大,说明低等水生生物的贡献较大,值越小则表明高等植物的贡献较大[38]。鄂尔多斯盆地奥陶系马家沟组样品该值的平均值为2.25,说明正构烷烃母质以低等水生生物和微生物占优势,而支链烷烃该值与之有很好的相关性,也进一步说明了样品中中链支链烷烃母质可能为一些特殊的菌藻类。Kenigetal.[8]在研究全新统微生物席的开放热解实验残留物时,发现了大量的中等链长的单甲基支链烷烃化合物,其碳数分布为C16~C29,通过对比研究显示,这些支链烷烃与烃源岩和原油样品中检出的单甲基支链烷烃分布相同,同时他们在未经热模拟实验的微生物席中未发现单甲基支链烷烃,所以推测除蓝细菌以外,其他真核生物或者异养细菌也可能合成单甲基支链烷烃。鄂尔多斯盆地奥陶系马家沟组绝大部分样品在nC20和nC21之间有一峰明显高于其他支链烷烃,经质谱对比为硫八元环(S8),单质硫的检出说明存在一些异养细菌,对一些藻类或原始有机质的改造也非常有可能使支链烷烃在沉积有机质中富集,如嗜硫菌等异样细菌。

图5 烃源岩样品中支链烷烃与正构烷烃中的ΣC21-/ΣC22+比值变化的相关性图Fig.5 Branched chain alkane and normal alkanes of the correlation diagram of the Σ C21- / Σ C22+ ratio in source rock
3.3.2 异构烷烃和反异构烷烃系列
鄂尔多斯盆地奥陶系马家沟组的样品中,2-甲基异构烷烃和3-甲基反异构烷烃短链、中链、长链都有检出且丰度较高,异构烷烃的含量一般高于反异构烷烃,这两个系列的碳数分布范围较广,从C15至C29均存在,其奇偶优势不明显。2-甲基异构烷烃和3-甲基反异构烷烃的生源在高等植物和细菌都有报道。ArPino[39]在研究始新世沉积物时,发现其中的异构烷烃分布特征与高等植物中异构烷烃的分布特征极其相似。Chaffee对煤中的2-甲基支链烷烃(异构烷烃)和3-支链烷烃(反异构烷烃)做了大量的研究,发现偶数碳的支链烷烃优势明显,认为其生源可能为高等植物或细菌蜡[40]。同时,Kolattukudyetal.[41]研究指出异构烷烃主要来自前身物2-甲基丙酰辅酶A(C4-COA),加成C2单元侧链后脱羧酸形成,因而具有奇数碳优势,而反异构烷烃的前身物为2-甲基丁酰辅酶A(C5-COA),因而具有偶数碳优势。Mastumotoetal.[42]在南极岩石样品中检测到长链的3-甲基反异构烷烃和反异构酸,推测其生源为岩石内的隐性微生物。以上资料表明异构烷烃和反异构烷烃可能有多种成因。尽管自然界并不缺乏异构和反异构烷烃,但由于它们缺乏生物的专属性并可由同分异构的平衡[27]、热裂解过程中烯烃的酸催化[27,43]等无机成因。所以一般不把他们作为生物标志化合物。样品中Pr/Ph比值≤1(0.7~0.98);Pr/nC17(0.71~0.91)、Ph/nC18比值高(0.88~1.01),正构烷烃的ΣC21-/ΣC22+>1,三环萜烷/藿烷分布范围为0.29~0.50,有机地球化学指标表明鄂尔多斯奥陶系马家沟组的沉积环境为咸水环境,母质类型为细菌和藻类,且鄂尔多斯盆地中东部奥陶系马家沟组沉积特征为咸化瀉湖或台地蒸发,为还原环境,所以排除异构和反异构烷烃来源于高等植物的可能。表3为表征鄂尔多斯盆地奥陶系马家沟组样品成熟度参数的指标:Ts/Tm的分布范围为1.05~1.27,反应高的热演化程度。规则甾烷C29-ααα-20S/20(S+R)比值通常用来衡量有机质成熟度,该值小于0.2,表明有机质未成熟,0.2~0.4,表明有机质处于低熟阶段,值大于0.4则代表了有机质已经达到成熟阶段,20S/(20S+20R)比值的平衡值在0.52~0.55[44]。研究样品氯仿沥青“A”中该值为0.42~0.53,表明沉积有机质达到了成熟阶段,利用C29甾烷20S/(20S+20R)与异构化指数C29甾烷ββ/(ββ+αα)相关性图表征样品成熟度是最常用的(图6),显示样品已达成熟阶段。所以认为鄂尔多斯盆地奥陶系马家沟组样品的异构和反异构烷烃可能与热催化重排有很大的关系。

表3 表征样品成熟度参数的指标
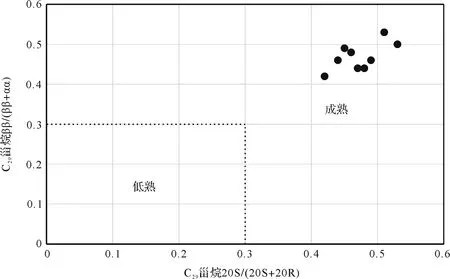
图6 C29甾烷20S/(20S+20R)比值和/(+)比值关系图Fig.6 The diagram of the ratio of C29-ααα-sterane 20S/20(S+R) and C29-/(+)
3.3.3 无环类异物二烯烷烃
无环类异戊二烯烷烃是常见的生物标志化合物,一般认为碳数小于等于C20的规则类异戊二烯烷烃主要来自于植醇。高等植物中的叶绿素,细菌、藻中的菌藻素在微生物作用下都可分解形成植醇。低分子量的类异戊二烯烷烃可能来源于生物分子的主体,如藻类和细菌中的叶绿素、维生素E、古细菌类脂物、蛋白质以及大分子类异戊二烯烷烃的热降解。此外,古细菌是不规则头对头类异戊二烯烷烃的重要来源。角鲨烷,番茄红烷则可能来自于某些高等植物或藻类,丛粒藻烷则主要来自于丛粒藻[45]。总体来说,C20及以下规则的头对尾类异戊二烯烷烃,为广泛分布的生物标志化合物,它是烃源岩及原油抽提物中仅次于正构烷烃而普遍存在的化合物。而对于碳数大于C20的长链无环类异戊二烯烷烃主要是古细菌专属的痕量化合物或原核生物生源的贡献[30]。类异戊二烯烷烃作为重要的支链烷烃其一些参数对沉积环境、有机质降解程度有着重要的地球化学意义。其中(Pr/Ph)可作为沉积环境及介质酸碱度的重要标志,低Pr/Ph值指示有机质形成于还原环境,高Pr/Ph值指示氧化环境[46]。孟仟祥等[47]研究认为,Pr/Ph值>1,指示沉积环境为偏氧化环境;反之,则为还原环境。鄂尔多斯盆地奥陶系马家沟组大多数样品的Pr/Ph<1,指示沉积环境为还原环境。利用Pr/nC17和Ph/nC18能较好地反映有机质的降解程度,由于类异戊二烯烷烃的抗微生物降解能力高于正构烷烃,所以降解较严重的样品的类异戊二烯烷烃的相对丰度会大于其相邻的正构烷烃的丰度,而鄂尔多斯盆地奥陶系马家沟组的Pr/nC17和Ph/nC18的值都比较高,在藿烷系列中,25-降-藿烷在鄂尔多斯奥陶系马家沟组烃源岩普遍检出,通常认为是微生物降解产物,这些都表明鄂尔多斯盆地奥陶系马家沟组烃源岩曾发生微生物降解作用。微生物对原始沉积有机质的改造,是样品中支链烷烃丰富的原因之一。
4 结论
(1) 对烃源岩中支链烷烃的鉴定依据和鉴定方法进行了系统论述,在鄂尔多斯盆地奥陶系马家沟组检测到较为丰富的支链烷烃,包括单甲基支链烷烃,可能存在的双甲基支链烷烃及无环类异戊二烯烷烃。
(2) 鄂尔多斯盆地奥陶系马家沟组支链烷烃的分布特征为:碳数分布范围为C15~C21的中等链长的支链烷烃在所有样品中最为丰富:其中,2-甲基异构烷烃和3-甲基反异构烷烃的中、长链,碳数范围为C15~C29均有分布;低于C20的无环类异物烷烃包括:异十六烷、降姥鲛烷、姥鲛烷、植烷。
(3) 这些丰富中等链长的支链烷烃来自藻类或一些特殊的细菌,其中蓝细菌为最有可能的来源,其次一些异养细菌对原始有机质或藻类的改造,也可能使沉积有机质中中等链长的支链烷烃的富集,如嗜硫菌等一些异样细菌。
(4) 鄂尔多斯盆地奥陶系马家沟组样品中异构烷烃丰度高于反异构烷烃。由于研究区马家沟组热演化程度高,样品成熟度大,认为高丰度的异构烷烃和反异构烷烃可能与热催化重排有很大的关系。
References)
[1] 侯读杰,王铁冠,黄光辉,等. 烃源岩中支链烷烃化合物的检出及意义[J]. 石油勘探与开发,1996,23(4):20-24. [Hou Dujie, Wang Tieguan, Huang Guanghui, et al. Distribution of branched alkanes in the source rocks and its significance[J]. Petroleum Exploration and Development, 1996, 23(4): 20-24.]
[2] 吉利明,李剑峰,宋之光. 鄂尔多斯盆地延长组葡萄藻的石油地质意义[J]. 石油勘探与开发,2009,36(2):156-165. [Ji Liming, Li Jianfeng, Song Zhiguang. Petroleum geological significance of botryococcus in Triassic Yanchang Formation, Ordos Basin[J]. Petroleum Exploration and Development, 2009, 36(2): 156-165.]
[3] Han J, Calvin M. Branched alkanes from blue-green algae[J]. Journal of the Chemical Society D: Chemical Communications, 1970(22): 1490-1491.
[4] Shiea J, Brassell S C, Ward D M. Mid-chain branched mono- and dimethyl alkanes in hot spring cyanobacterial mats: a direct biogenic source for branched alkanes in ancient sediments[J]. Organic Geochemistry, 1990, 15(3): 223-231.
[5] Kenig F, Huc A Y, Purser B H, et al. Sedimentation, distribution and diagenesis of organic matter in a recent carbonate environment, Abu Dhabi, U.A.E.[J]. Organic Geochemistry, 1990, 16(4/5/6): 735-747.
[6] Kenig F, Sinninghe Damsté J S, de Leeuw J W, et al. Molecular palaeontological evidence for food-web relationships[J]. Naturwissenschaften, 1994, 81(3): 128-130.
[7] Kenig F, Sinninghe Damsté J S, Kock-van Dalen A C, et al. Occurrence and origin of mono-, di-, and trimethylalkanes in modern and Holocene cyanobacterial mats from Abu Dhabi, United Arab Emirates[J]. Geochimica et Cosmochimica Acta, 1995, 59(14): 2999-3015.
[8] Kenig F. C16-C29homologous series of monomethylalkanes in the pyrolysis products of a Holocene microbial mat[J]. Organic Geochemistry, 2000, 31(2/3): 237-241.
[9] Thiel V, Jenisch A, Wörheide G, et al. Mid-chain branched alkanoic acids from “living fossil” demosponges: a link to ancient sedimentary lipids[J]. Organic Geochemistry, 1999, 30(1): 1-14.
[10] 张虎才,常凤琴,李斌,等. 柴达木察尔汗湖贝壳堤剖面长链支链烷烃及其古环境意义[J]. 科学通报,2007,52(6):707-714. [Zhang Hucai, Chang Fengqin, Li Bin, et al. Branched aliphatic alkanes of shell bar section in Qarhan Lake, Qaidam Basin and their paleoclimate significance[J]. Chinese Science Bulletin, 2007, 52(6): 707-714.]
[11] Göhring K E H, Schenck P A, Engelhardt E D. A new series of isoprenoid isoalkanes in crude oils and Cretaceous bituminous shales[J]. Nature, 1967, 215(5100): 503-505.
[12] Chappe B, Michaelis W, Albrecht P. Molecular fossils of Archaebacteria as selective degradation products of kerogen[J]. Physics and Chemistry of the Earth, 1980, 12: 265-274.
[13] 杨华,席胜利,魏新善,等. 鄂尔多斯多旋回叠合盆地演化与天然气富集[J]. 中国石油勘探,2006,11(1):17-24. [Yang Hua, Xi Shengli, Wei Xinshan, et al. Evolution and natural gas enrichment of multicycle superimposed basin in Ordos Basin[J]. China Petroleum Exploration, 2006, 11(1): 17-24.]
[14] 周进高,张帆,郭庆新,等. 鄂尔多斯盆地下奥陶统马家沟组障壁潟湖沉积相模式及有利储层分布规律[J]. 沉积学报,2011,29(1):64-71. [Zhou Jingao, Zhang Fan, Guo Qingxin, et al. Barrier-lagoon sedimentary model and reservoir distribution regularity of Lower-Ordovician Majiagou Formation in Ordos Basin[J]. Acta Sedimentologica Sinica, 2011, 29(1): 64-71.]
[15] 史基安,邵毅,张顺存,等. 鄂尔多斯盆地东部地区奥陶系马家沟组沉积环境与岩相古地理研究[J]. 天然气地球科学,2009,20(3):316-324. [Shi Ji’an, Shao Yi, Zhang Shuncun, et al. Lithofacies paleogeography and sedimentary environment in Ordovician Majiagou Formation, eastern Ordos Basin[J]. Natural Gas Geoscience, 2009, 20(3): 316-324.]
[16] 周义军,杨遂正,王欣. 鄂尔多斯盆地奥陶系顶面演化与岩溶储层[J]. 石油物探,2006,45(3):304-310. [Zhou Yijun, Yang Suizheng, Wang Xin. The structural-interface evolution in Ordovician and karst reservoir in Ordos Basin[J]. Geophysical Prospecting for Petroleum, 2006, 45(3): 304-310.]
[17] 李贤庆,侯读杰,张爱云,等. 鄂尔多斯中部奥陶系水溶烃的分子地球化学特征[J]. 沉积学报,2002,20(4):710-715. [Li Xianqing, Hou Dujie, Zhang Aiyun, et al. Characteristics of molecular geochemistry of Ordovician dissolved hydrocarbons in the central part of Ordos Basin[J]. Acta Sedimentologica Sinica, 2002, 20(4): 710-715.]
[18] 李贤庆,侯读杰,胡国艺,等. 鄂尔多斯盆地中部地区下古生界碳酸盐岩生烃潜力探讨[J]. 矿物岩石地球化学通报,2002,21(3):152-157. [Li Xianqing, Hou Dujie, Hu Guoyi, et al. The discussion on hydrocarbon-generated potential of lower Paleozoic carbonates in the central part of Erdos Basin[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2002, 21(3): 152-157.]
[19] 刘德汉,肖贤明,贾蓉芬,等. 碳酸盐岩生烃运移的激光—荧光和有机包裹体研究[J]. 海相油气地质,2000,5(1/2):62-68. [Liu Dehan, Xiao Xianming, Jia Rongfen, et al. Carbonate hydrocarbon migration of laser-the study of fluorescence and organic inclusions[J]. Marine Origin Petroleum Geology, 2000, 5(1/2): 62-68.]
[20] 刘德汉,杨秀珍,孙永革,等. 鄂尔多斯盆地东部下奥陶统碳酸盐—蒸发盐地球化学特征和生气规律[J]. 沉积学报,1995,13(2):93-104. [Liu Dehan, Yang Xiuzhen, Sun Yongge, et al. Geochemical characteristics and gas-producing rules from carbonate-evaporite formation of lower Ordovician series in east Ordos Basin[J]. Acta Sedimentologica Sinica, 1995, 13(2): 93-104.]
[21] 袁东山,郜建军,朱建辉,等. 鄂尔多斯富县地区下古生界烃源岩地球化学特征[J]. 石油天然气学报(江汉石油学院学报),2009,31(4):58-61. [Yuan Dongshan, Gao Jianjun, Zhu Jianhui, et al. Geochemical characteristics of Lower Palaeozoic hydrocarbon source rocks in Fuxian exploration area of Ordos Basin[J]. Journal of Oil and Gas Technology (Journal of Jianghan Petroleum Institute), 2009, 31(4): 58-61.]
[22] Peters K E, Walters C C, Moldowan J M. The Biomarker Guide[M]. 2nd ed. Cambridge: Cambridge University Press, 2005: 1-658.
[23] McCarthy E D, Han J, Calvin M. Hydrogen atom transfer in mass spectrometric fragmentation patterns of saturated aliphatic hydrocarbons[J]. Analytical Chemistry, 1968, 40(10): 1475-1480.
[24] Summons R E. Branched alkanes from ancient and modern sediments: isomer discrimination by GC/MS with multiple reaction monitoring[J]. Organic Geochemistry, 1987, 11(4): 281-289.
[25] 钱宇,王作栋,贾冬,等. 烃源岩中单甲基烷烃化合物分析与鉴定[J]. 沉积学报,2015,33(5):1033-1042. [Qian Yu, Wang Zuodong, Jia Dong, et al. Study on the identification of monomethylalkanes in source rocks[J]. Acta Sedimentologica Sinica, 2015, 33(5): 1033-1042.]
[26] 王春江,夏燕青,张中宁,等. 吐哈盆地侏罗系煤系有机质中支链烷烃的化学结构及地球化学意义[J]. 地球化学,1997,26(1):72-84. [Wang Chunjiang, Xia Yanqing, Zhang Zhongning, et al. Chemical structures of branched alkanes identified in Jurassic coals and coal-related mudstones from the Turpan-Hami Basin and their geochemical significance[J]. Geochemica, 1997, 26(1): 72-84.]
[27] Klomp U C. The chemical structure of a pronounced series of iso-alkanes in South Oman crudes[J]. Organic Geochemistry, 1986, 10(4/5/6): 807-814.
[28] Gelpi E, Schneider H, Mann J, et al. Hydrocarbons of geochemical significance in microscopic algae[J]. Phytochemistry, 1970, 9(3): 603-612.
[29] Han J, McCarthy E D, Calvin M, et al. Hydrocarbon constituents of the blue-green algae Nostoc muscorum, Anacystis nidulans, Phormidium luridium and Chlorogloea fritschii[J]. Journal of the Chemical Society C: Organic, 1968: 2785-2791, doi: 10.1039/J39680002785.
[30] Fehler S W G, Light R J. Biosynthesis of hydrocarbons in Anabaena variabilis. Incorporation of [methyl-14C] and [methyl-2H2] Methionine into 7- and 8-methyl-heptadecanes[J]. Biochemistry, 1970, 9(2): 418-422.
[31] Dowling N J E, Widdel F, White D C. Phospholipid ester-linked fatty acid biomarkers of acetate-oxidizing sulphate-reducers and other sulphide-forming bacteria[J]. Microbiology, 1986, 132(7): 1815-1825.
[32] Bazhenova O K, Arefiev O A. Geochemical peculiarities of Pre-Cambrian source rocks in the East European Platform[J]. Organic Geochemistry, 1996, 25(5/6/7): 341-351.
[33] Jackson M J, Powell T G, Summons R E, et al. Hydrocarbon shows and petroleum source rocks in sediments as old as 1.7×109years[J]. Nature, 1986, 322(6081): 727-729.
[34] Robinson N, Eglinton G. Lipid chemistry of Icelandic hot spring microbial mats[J]. Organic Geochemistry, 1990, 15(3): 291-298.
[35] Audino M, Grice K, Alexander R, et al. Unusual distribution of monomethylalkanes inBotryococcusbraunii-rich samples: origin and significance[J]. Geochimica et Cosmochimica Acta, 2001, 65(12): 1995-2006.
[36] Brassell S C, Eglinton G, Maxwell J R, et al. Natural background of alkanes in the aquatic environment[J]. Aquatic Pollutants, 1978:69-86.
[37] 卢鸿,孙永革,彭平安. 单甲基支链烷烃的单体碳同位素研究[J]. 沉积学报,2003,21(2):360-365. [Lu Hong, Sun Yongge, Peng Ping’an. Molecular stable carbon isotopic compositions of mono-methyl branched alkanes[J]. Acta Sedimentologica Sinica, 2003, 21(2): 360-365.]
[38] 朱扬明,苏爱国,梁狄刚,等. 柴达木盆地咸湖相生油岩正构烷烃分布特征及其成因[J]. 地球化学,2003,32(2):117-123. [Zhu Yangming, Su Aiguo, Liang Digang, et al. Distribution characterization and origin of n-alkanes in saline lacustrine source rocks of Qaidam Basin[J]. Geochimica, 2003, 32(2): 117-123.]
[39] Arpino P. Les Lipides des Sédiments Lacustres Éocènes Thèse[M]. France: Université Louis Pasteur de Strasbourg, 1973.
[40] Johns R B. Biological Markers in the Sedimentary Record[M]. Elsevier, 1986.
[41] Han J, Chan H W S, Calvin M. Biosynthesis of alkanes in Nostoc muscorum[J]. Journal of the American Chemical Society, 1969, 91(18): 5156-5159.
[42] Matsumoto G I, Friedmann E I, Watanuki K, et al. Novel long-chain anteiso-alkanes and anteiso-alkanoic acids in Antarctic rocks colonized by living and fossil cryptoendolithic microorganisms[J]. Journal of Chromatography A, 1992, 598(2): 267-276.
[43] Kissin Y V. Catagenesis and composition of petroleum: origin of n-alkanes and isoalkanes in petroleum crudes[J]. Geochimica et Cosmochimica Acta, 1987, 51(9): 2445-2457.
[44] 范善发,周中毅,潘长春. 应用生物标志物评价塔里木盆地下古生界沉积物的古环境[J]. 沉积学报,1991,9(S):44-51. [Fan Shanfa, Zhou Zhongyi, Pan Changchun. Application of biological markers in the assessment of lower Paleozoic sedimentary palaeoenvironments of the Tarim Basin[J]. Acta Sedimentologica Sinica, 1991, 9(S): 44-51.]
[45] Laughlin A W, Poths J, Healey H A, et al. Dating of Quaternary basalts using the cosmogenic3He and14C methods with implications for excess40Ar[J]. Geology, 1994, 22(2): 135-138.
[46] 妥进才. 塔里木盆地三叠系有利生烃环境[J]. 天然气地球科学,2003,14(2):120-125. [Tuo Jincai. Triassic of Tarim Basin, a favourable environment for hydrocarbon generating[J]. Natural Gas Geoscience, 2003, 14(2): 120-125.]
[47] 孟仟祥,房嬛,徐永昌,等. 柴达木盆地石炭系烃源岩和煤岩生物标志物特征及其地球化学意义[J]. 沉积学报,2004,22(4):729-736. [Meng Qianxiang, Fang Xuan, Xu Yongchnag, et al. Biomarkers and geochemical significance of Carboniferous source rocks and coals from Qaidam Basin[J]. Acta Sedimentologica Sinica, 2004, 22(4): 729-736.]
Characteristics of Branched Alkanes in the Source Rocks of the Ordovian from the Ordos Basin and Their Geological Significance
WANG Cheng1,2, WANG WanChun1, WANG JianFeng1,2, FAN HaiLong1,2
1. Key Laboratory of Petroleum Resources, Gansu Province/ Key Laboratory of Petroleum Resources Research, Institute of Geology and Geophysics, Chinese Academy of Sciences, Lanzhou 730000, China 2. University of Chinese Academy of Sciences, Beijing 100049, China
Taking source rock core samples collected from 6 wells of Majiagou Formation of Ordovician in Ordos Basin as the target, branched alkanes in the saturated hydrocarbons were investigated by GC/MS. The results show that there is relatively high abundance of medium-chain branched alkanes of which carbon number range from 15 to 21, including 2-methyl (iso-alkanes), 3-methyl (anteiso-alkanes), high-methyl branched alkanes, dual-methyl branched alkanes and acyclic isoprenoid alkanes, in which the carbon number of iso-alkanes and anteiso-alkanes has a wide distribution, including short, medium and long-chain. According to sedimentary characteristics and other organic geochemical indexs in the study area, methyl-branched-chain alkanes with medium-chain length of Majiagou Formation of Ordovician in Ordos Basin are considered deriving from some special bacteria and algae, and the cyanobacteria is the most likely direct input parent material. Meanwhile, some heterotrophic bacteria’s transformation to the original sediments is one of the important reasons that the accumulation of medium-chain branched alkanes. The long -chains iso-alkanes and anteiso-alkanes may have much to do with thermal catalytic rearrangement .
branched alkanes; Ordos Basin; Ordovician; source rock
1000-0550(2017)04-0853-10
10.14027/j.cnki.cjxb.2017.04.019
2016-11-21; 收修改稿日期: 2017-02-24
国家重点基础研究发展计划(973计划)项目(2012CB214801);国家科技重大专项项目(2011ZX05005-001);甘肃省重点实验室专项(1309RTSA041)[Foundation: National Key Basic Research Program of China (973 Program),No. 2012CB214801; National Science and Technology Major Project,No. 2011ZX05005-001; Key Laboratory Fund of Gansu Provincial,No.1309RTSA041]
王成,男,1990年出生,硕士研究生,油气地球化学,E-mail: 444707134@qq.com
王万春,女,副研究员,E-mail: lgas@lzb.com
P618.13
A
