巧建思维模型,快解平衡问题
2017-08-08湖南左传鹏杨落星
湖南 左传鹏 杨落星
巧建思维模型,快解平衡问题
湖南 左传鹏 杨落星
化学的核心内容涉及微观世界,建立模型有助于我们认识事物及其变化过程,加深对事物的理解,使复杂的问题简单化。化学平衡和水溶液中的离子平衡是中学化学重要的基本理论知识,该部分内容抽象,且近年来在高考试题中有难度加大趋势。笔者结合高考试题,通过建立思维模型方法,可解决化学平衡中的转化率变化问题和水溶液质子守恒问题,在教学中取得了较好的效果。
一、建立“复制压缩”(或“复制相加”)模型,解转化率问题
化学平衡是化学理论知识中的核心内容,是高考考查的重点和热点,不少学生遇到该类试题心生畏惧,特别是改变投料而产生的转化率、百分含量等物理量的变化问题。针对在恒温恒容或恒温恒压条件下的可逆反应,可以通过建立“复制压缩”或“复制相加”模型虚拟一个中间过程,快速解题。
例1 在一容积不变的密闭容器中充入1mol NO2,建立如下平衡:(g),测得NO2的转化率为a%,在其他条件不变下,再充入1mol NO2,待新平衡建立时,又测得NO2的转化率为b%,则a与b的关系为( )
A.a>b B.a<b
C.a=b D.无法确定
解析:恒容达平衡后充入NO2,平衡右移,NO2转化量增加,但起始投料量也增加,根据转化率的定义难以直接比较a与b的大小。可先“复制”虚拟出一个中间过程Ⅱ,易知Ⅰ与Ⅱ两状态等效,NO2的转化率均为a%,再将容器Ⅱ“压缩”,使容积恢复到原来大小,即得到容器Ⅲ状态,容器Ⅱ与容器Ⅲ中NO2起始投料量相同,又因“压缩”时平衡正移,故达新平衡后NO2的转化率b%必大于a%。应选B项。

不难发现,对于单一反应物可逆反应,达平衡后追加投料,在恒温恒容条件下:
若本题改为在一容积可变的密闭容器中进行,即在恒温恒压条件下进行,又会得出什么结果呢?
再充入1mol NO2前后,压强不变,即反应在恒温恒压条件下进行,同样可通过“复制”虚拟一个中间过程Ⅱ,Ⅰ与Ⅱ两过程等效,NO2的转化率均为a%,此时,只需撤掉容器Ⅱ中间隔离,“相加”即为容器Ⅳ平衡状态。容器Ⅱ与容器Ⅳ中NO2起始投料量相同,故达新平衡后NO2的转化率b%必等于a%。不难发现,在恒温恒压条件下,对于单一反应物可逆反应,平衡后追加反应物投料,无论气体体积如何变化,上述三种情况的转化率均不会改变。

变式 (2014·山东·29节选)研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
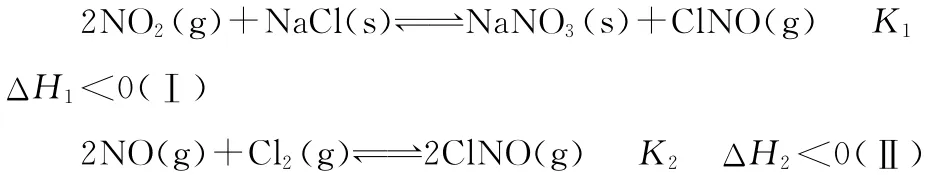
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡。测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2_______________(填“>”“<”或“=”)α1。
解析:平衡时容器中n(ClNO)=7.5×10-3mol·L-1·min-1×10min×2L=0.15mol,则平衡后NO的转化率=0.15mol/0.2mol×100%=75%;建立“复制压缩”模型,将恒容平衡状态压缩即得到恒压平衡状态,平衡正向移动,NO的转化率增大,故α2>α1。

二、建立“组分分离”(或“组分不分离”)模型,列质子守恒式
Brönsted-Lowry酸碱质子理论认为酸碱反应的实质是质子的传递。可逆反应达平衡,酸碱得失质子数相等,即质子守恒。对于含单一溶质的溶液,常规方法是由物料守恒式和电荷守恒式联立得到。但近几年高考试题中出现了不少混合溶质题型,难度明显加大,利用常规方法书写时,因物料守恒式的书写难度较大,且两式联立处理过程烦琐而容易出错。选取起始溶质和溶剂水为基准,笔者建立“组分分离”(或“组分不分离”)模型,可快速列出质子守恒式。
例2 (2014·安徽·11节选)室温下,下列溶液中粒子浓度关系正确的是( )
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O-4)+2c(H2C2O4) (A、C、D选项省略)
解析:选溶质Na2C2O4和溶剂H2O为基准,建立思维模型:
模型中左右微粒浓度之和相等,即为Na2C2O4溶液的质子守恒式:c(OH-)=c(H+)+c(HC2O-4)+2c(H2C2O4)。
变式1 (2012·四川·10节选)常温下,下列溶液中的微粒浓度关系正确的是( )
D.0.2mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合:
2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
(A、B、C选项省略)
解析:0.2mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合后得到浓度比为1∶1的CH3COOH与CH3COONa水溶液。书写质子守恒式时把混合溶液视为两种孤立溶液,建立“组分分离”模型:

则有:c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),故D选项正确。
“组分分离”模型适用于溶质间存在平衡转化关系的混合体系,如变式1中。当CH3COOH与CH3COONa浓度比为m∶n时,对模型中两个孤立体系对应扩大倍数,质子守恒式为mc(CH3COO-)+(m+n)c(OH-)=nc(CH3COOH)+(m+n)c(H+)
当溶质为多种盐且粒子间无平衡转化关系时,只来自于水,质子守恒式与溶质比例无关,选取溶剂水为基准,建立“组分不分离”模型即可快速列出,见变式2。

变式2 (2016·天津·6节选)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
D.当中和百分数达100%时,将三种溶液混合后:
c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)(A、B、C选项省略)
解析:当中和百分数达100%时,NaOH恰好与三种酸完全反应,溶质为NaA、NaB和NaD。
方法一:
电荷守恒:c(A-)+c(B-)+c(D-)+c(OH-)=c(H+)+c(Na+),物料守恒:c(A-)+c(B-)+c(D-)+c(HA)+c(HB)+c(HD)=c(Na+),两式抵消Na+即为质子守恒式。
方法二:
建立“组分不分离”模型如下,模型中左右两边微粒浓度之和相等,快速列质子守恒式:c(OH-)=c(HA)+c(HB)+c(HD)+c(H+),D项正确。

当混合溶液中溶质除了盐还含酸或碱分子,且溶质间无平衡转化关系时,情况较为复杂,高中阶段一般不做要求。
建立思维模型是将化学微观问题宏观化的一种重要手段,也是高中化学核心素养中“宏微结合”与“模型认知”的具体体现。模型教学在传授学生学科知识的同时,培养了学生的观察能力、想象能力、记忆能力和创造性思维能力,既有利于教师的教,也有利于学生的学,是一条提高教师教学效果和学生学习效率的重要途径。
(作者单位:湖南省长沙市长郡中学)
