研读考纲 强化模拟
——高考化学主观题命题方式及解决对策
2017-08-08河北颜建河
河北 颜建河
研读考纲 强化模拟
——高考化学主观题命题方式及解决对策
河北 颜建河
高考如战场。考生经历了一轮、二轮的复习,备考进入冲刺阶段,如何做到提“效”增“益”?这就要求我们的复习,要做到进一步研读“考纲”,强化“热点”,特别是要认真研读近几年的高考“真题”,熟悉这些“热点”所涉及的各种题型的考查方式及切入点,要在强化预测题的“演练”过程中,学会总结,学会反思,努力做到有的放矢。这样,高考的复习收益、效益才能最大化,高考中才能做到战无不胜,取得最好成绩。
命题方式之一:以图表、模型、图形等为核心载体,着力考查基本概念和基本理论知识
《考试大纲》明确指出:化学基本概念和基本理论是高考必考核心内容之一,研读“考纲”,强化“考点”,才是复习之重中之重。为此,对于高考以图表、模型、图形等为核心载体进行命制的“主观”题,必须认真研究,掌握其题型命题方式。同时,要明确这类题型所涉及的“考点”。即命题着力考查盖斯定律与热化方程式、化学反应速率的计算及其影响因素、平衡常数计算及其影响因素、化学平衡移动及其影响因素、电极反应方程式书写,等等。解决好这类题型的对策:(1)泛读。浏览全题,明确已知和待求解的问题;(2)细读。把握关键字、词、数量关系、图表中信息含义等;(3)精读。深入思考,注意挖掘隐含信息。在认真审题后,根据题目中所给出的文字、图象、数据等提炼出重要的信息,联系相关概念、理论和解题技巧等,分析每小题的考查方向,组织答案。同时,书写答案时要“细心、规范、整洁”,避免无谓失分。
例1 (2017·预测)巴黎时间2015年12月12日,气候变化巴黎大会达成包括《巴黎协定》和相关决定的巴黎成果,在气候变化对人类社会和地球构成紧迫的、可能无法逆转的危险面前握手言和,这为绿色低碳循环发展气候经济开启了新的篇章。为了减少碳排放,将碳的氧化物转化为可再生利用的燃料,常采取的措施有:
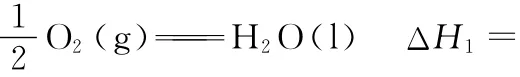
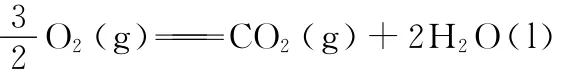
则CO2(g)+3H2(g)CH3OH(g)+H2O(l)的反应热为_________________。
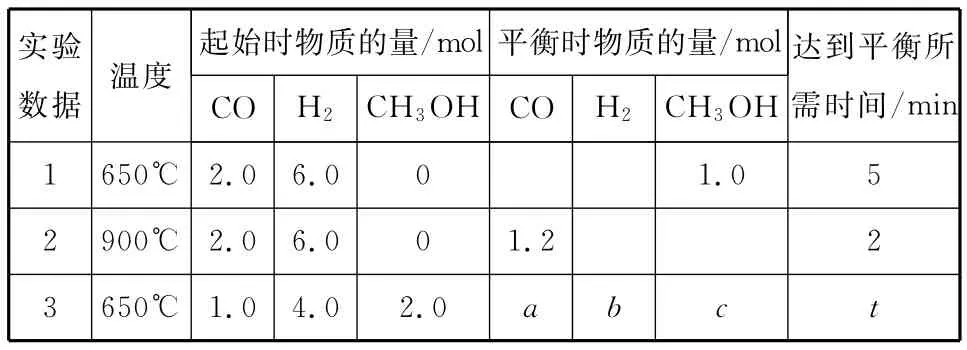
实验数据温度起始时物质的量/mol平衡时物质的量/mol CO H2__CH3OH CO H2__CH3OH达到平衡所需时间/min_1 650℃_2.0 6.0 0 1.0 5_2 900℃_2.0 6.0 0 1.2 2_3 650℃_1.0 4.0 2.0 a b c t____
回答下列问题:
①实验1条件下平衡常数K=________________。
②a、b之间可能的关系为_____________。
(3)密闭容器中充有CO与H2在催化剂作用下发生上述反应,已知CO的转化率(α)与温度、压强的关系如下图所示:

①p1_______________(填“<”“>”或“=”)p2,升高温度能否实现b点到c的转化________(填“能”或“不能”),如果不能说明原因:___________________________________。
②a、c两点的反应速率为va_______________(填“<”“>”或“=”)vc。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是___________________________________(至少写出三条)。
分析与解答 本题是一道以图表、模型、图形等为核心载体进行命题的常考题型,着力考查基本概念和基本理论知识。涉及化学平衡常数,盖斯定律,平衡移动原理等相关知识,试题有一定难度。为此,解决好这类题型的关键就是认真读题,仔细观察试题给予的图表、图形等相关信息,并从中提炼出有用的规律,再结合所学相关知识来寻找解决问题的切入点。
(1)根据盖斯定理,则有ΔH=3×ΔH1-ΔH2=-131.9kJ·mol-1。(2)①K=c(CH3OH)/[c(CO)·c2(H2)],代入数据可得K=0.25;②消耗CO为(1.0-a)mol,则消耗H2为2(1.0-a)mol,则有4mol-2(1.0-a)mol=b mol,b=2a+2。(3)①a点与b点温度相同,b点的转化率小于a点,b点到a点,平衡正向移动,则压强增大,所以p1<p2;b点与c点的转化率是相同的,而升高温度,平衡逆向移动,CO的转化率是降低的,所以不能通过温度的改变实现b点与c点的转化;②c点的温度高,反应速率快;③要提高CO的转化率,采取使平衡正向移动的措施就能达到。
答案:(1)-131.9kJ·mol-1(2)①0.25 ②b=2a+2 (3)①< 不能 b点与c点的转化率是相同的,而升高温度,平衡逆向移动,CO的转化率是降低的 ②<③降温,加压,将甲醇从混合体系中分离出来
命题方式之二:以化学工艺流程(框图信息)为核心载体,着力考查元素化合物相关知识
《考试大纲》明确指出:常见无机物及其运用是高考必考核心内容之一,研读“考纲”,强化“考点”,才是复习之重中之重。为此,对于高考中以化学工艺流程(框图信息)为核心载体进行命制的“主观”题,必须认真研究,掌握其题型命题方式。同时,要明确这类题型所涉及的“考点”。即命题着力考查运用化学反应原理和元素化合物的相关知识来解决工业生产中实际问题的能力。特别是考点中所涉及的离子方程式书写、氧化还原反应和化学平衡移动等相关知识。解决好这类题型的对策:(1)从题干中获取有用信息,了解生产的产品。(2)分析流程中的每一步骤,从几个方面了解流程:①反应物是什么;②发生了什么反应;③该反应造成了什么后果,对制造产品有什么作用。抓住一个关键点:一切反应或操作都是为获得产品而服务。(3)从问题中获取信息,了解流程后着手答题。对反应条件的分析可从以下几个方面着手:①对反应速率有何影响?②对平衡转化率有何影响?③对综合生产效益有何影响?原料成本,原料来源是否广泛、是否可再生,能源成本,对设备的要求,环境保护(从绿色化学)方面作答。
例2 (2017·预测)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域,钒的用途十分广泛,有金属“维生素”之称。接触室中废钒催化剂含V2O5、VOSO4、K2SO4和SiO2等,从废钒催化剂回收得到V2O5的主要流程如下:
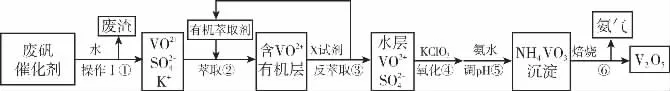
请回答下列问题:
(1)在VOSO4中,Ⅴ元素的化合价为________,①中所得废渣的成分是_____________(写化学式),操作Ⅰ的名称_____________。
(2)步骤②③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层2RAn(有机层)+nH2SO4(水层)
则②中萃取时必须加入适量碱,其原因是___________________________________;③中X试剂为________。
(3)配平④中反应的离子方程式:
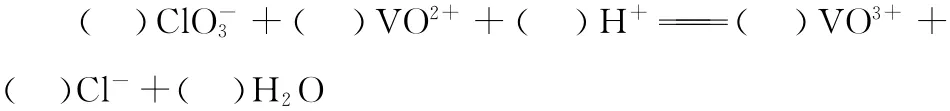
(4)流程中,可以循环利用的物质有_________和________。
(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
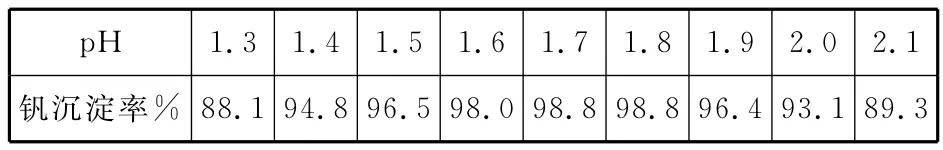
____pH 1.3 1.4 1.5 1.6 1.7 1.8 1.9 2.0 2.1钒沉淀率%88.1 94.8 96.5 98.0 98.8 98.8 96.4 93.1 89.3
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为_________;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_________。(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
分析与解答 本题是一道以化学工艺流程(框图信息)为核心载体进行命题的常考题型,着力考查运用化学反应原理和元素化合物的相关知识来解决工业生产中实际问题的能力。涉及离子方程式的书写、氧化还原反应、化学平衡移动原理等相关知识,试题难度不大。为此,解决好这类题型的关键就是认真读题,仔细观察试题给予的图表和化工工艺流程等相关信息,从中抓住流程所涉及的核心反应及转化关系,并结合试题中的设问来寻找解决问题的切入点。
(1)略。(2)②中萃取时必须加入适量碱,其原因是加入碱中和前边反应产生的硫酸,促使平衡正向移动,提高钒的萃取率;③中反萃取时加入的X试剂是抑制平衡正向进行,可以加入硫酸抑制平衡正向进行。(3)根据电荷守恒及电子守恒,结合质量守恒定律,可配平离子方程式。(4)根据流程示意图分析即可。(5)25℃时,钒沉淀率和溶液pH之间关系从表格数据可知:pH为1.7、1.8时钒沉淀率最高,调节溶液的最佳pH为1.7~1.8,若钒沉淀率为93.1%,则pH=2.0,c(H+)=10-2mol/L,c(OH-)=10-12,此时不产生Fe(OH)3沉淀,根据Ksp[Fe(OH)3]=2.6×10-39,则溶液中c(Fe3+)<Ksp[Fe(OH)3]÷c3(OH-)=2.6×10-39÷(10-12)3=2.6×10-3mol/L。
答案:(1)SiO2过滤 (2)加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率 H2SO4(3)1 6 9 6 1 18 (4)氨气(或氨水) 有机萃取剂 (5)1.7~1.8 2.6×10-3mol/L
命题方式之三:以初步的实践科学探究为核心载体,着力考查化学实验的设计和操作知识
《考试大纲》明确指出:化学实验是高考必考核心内容之一,研读“考纲”,强化“考点”才是复习之重中之重。为此,对于高考中以初步的实践科学探究为核心载体进行命制的“主观”题,必须认真研究,掌握其题型命题方式。同时,要明确这类题型所涉及的“考点”。即命题着力考查综合实验能力,特别是物质制备、物质性质验证或探究型实验以及实验方案的评价和简单实验方案的设计,等等。解决好这类题型的对策:(1)明确实验的目的和原理。实验原理可从题给的化学情境(或题中所给实验目的)并结合元素化合物等有关知识获取;(2)厘清实验操作的先后顺序。根据实验原理所确定的实验方案中的实验过程,确定实验操作的方法步骤,把握各步实验操作的要点,厘清实验操作的先后顺序;(3)分析各项实验装置的作用。在分析解答过程中,要认真细致地分析图中所示的各项装置,并结合实验目的和原理,确定它们在该实验中的作用;(4)得出正确的实验结论。在分析实验现象(数据)的过程中,要善于找出影响实验成败的关键以及产生误差的原因,或从有关数据中归纳出定量公式,绘制变化曲线等。同时,强调实验在化学学科中的重要地位,有条件的话,要让学生重新走进实验室,动手重做典型的实验。
例3 (2017·预测)甲基丙烯酸甲酯是有机玻璃单体,为无色透明溶液。实验室制备甲基丙烯酸甲酯的反应,装置示意图和有关信息如下:
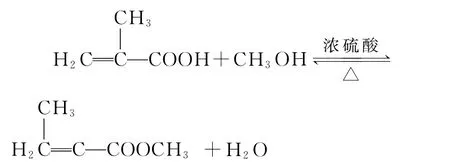
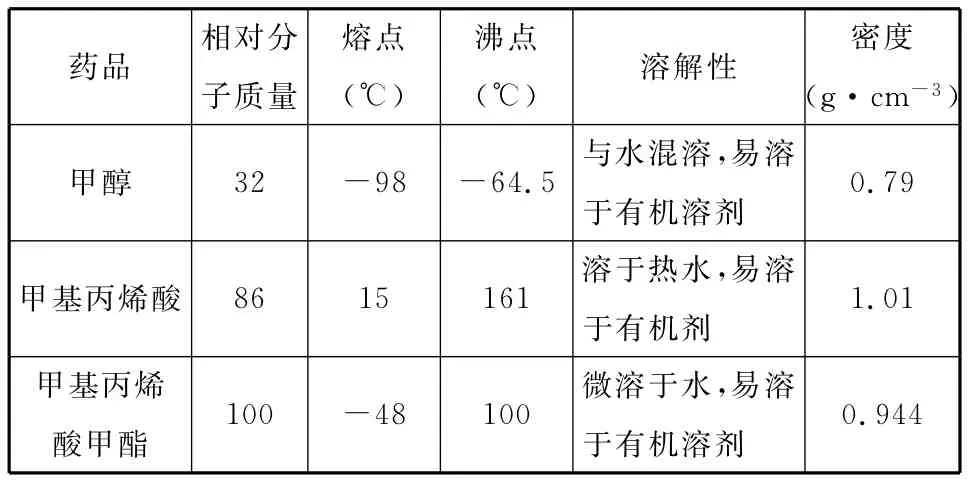
药品相对分____________子质量熔点(℃)___(℃)溶解性密度(g·cm-3沸点甲醇32-98-64.5与水混溶,易溶______________________________________于有机溶剂0.79甲基丙烯酸86 15 161溶于热水,易溶______________________________________于有机剂1.01甲基丙烯__酸甲酯100-48 100微溶于水,易溶于有机溶剂______________0.944
实验步骤如下:
向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;按右图连接装置,加热烧瓶中混合液,通过分水器分离出水,用锥形瓶盛接收集产生的水;当不再有水生成,停止加热;冷却后用试剂X洗涤烧瓶中的混合溶液并分离;取有机层混合液减压蒸馏,得到较纯净的甲基丙烯酸甲酯。请回答下列问题:
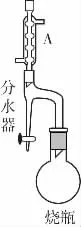
(1)A 装置的名称是________________。
(2)上述实验中浓硫酸有提高甲基丙烯酸甲酯产率的作用,其原理:__________________。但是浓硫酸过多,产率降低,原因是__________________________________________。
(3)上述实验可能生成的副产物结构简式为_________________________(填一种即可)。
(4)试剂X宜选择________(填字母)。
A.饱和食盐水 B.氢氧化钠溶液
C.饱和碳酸钠溶液 D.饱和氯化铵溶液
(5)步骤④中分离有机物操作必需的玻璃仪器主要有______________________________________________________。
(6)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为________(结果保留三位有效数字)。实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是________(填字母)。
A.分水器收集的水里含甲酯
B.实验条件下发生副反应
C.产品精制时收集部分低沸点物质
D.产品在洗涤、蒸发过程中有损失
分析与解答 本题是一道以初步实践科学探究为核心载体进行命题的常考题型,着力考查知识迁移能力、判断分析能力和从相关材料中获取信息的能力。涉及实验仪器的作用、物质的除杂、有机物中常见的分离收集等相关知识,试题难度不大。为此,解决好这类题型的关键就是要抓实验仪器的作用、物质除杂、催化剂等知识,了解减压蒸馏目的,即减压降低物质的熔沸点以及气体的溶解性,从而结合试题中的设问来寻找解决问题的切入点。
答案:(1)球形冷凝管 (2)浓硫酸吸收生成的水,促进酯化可逆反应向正方向移动 浓硫酸量多,浓硫酸具有强氧化性,能氧化有机反应物,若浓硫酸过多则副反应增多,产率降低 (3)CH3OCH3(4)C (5)烧杯、玻璃棒、分液漏斗 (6)85.2% C
命题方式之四:以有机物制备及有机合成路线为核心载体,着力考查有机化学相关知识
《考试大纲》明确指出:常见有机物及运用是高考必考核心内容之一,研读“考纲”,强化“考点”才是复习之重中之重。为此,对于高考中以有机物制备及有机合成路线为核心载体进行命制的“主观”题,必须认真研究,掌握其题型命题方式。同时,要明确这类题型所涉及的“考点”。即命题着力考查以有机物的衍变关系而设计的推断或合成题。这类试题通常以新药、新的染料中间体、新型有机材料的合成作为载体,引入新的信息,组合多个化合物的反应,合成具有指定结构的产物,从中引出相关的各类问题,推断各有机物的结构特点和所含官能团、判断反应类型,考查化学方程式的书写、书写同分异构体、设计产物的合成路线,等等。解决好这类题型的对策:(1)目标有机物的判断:判断目标有机物属于哪类有机物,分析目标有机物中碳原子的个数、碳链组成与原料、中间物质的组成关系;(2)目标有机物的拆分:根据给定原料,利用反应规律把目标有机物分解成若干个片段,找出官能团引入、转换的途径及保护方法;(3)思维能力要求有:思维的深刻性(演绎推理)、思维的灵活性(知识的迁移,触类旁通)和思维的批判性(判断与选择)等。即观察目标分子的结构(目标分子的碳架特征,及官能团的种类和位置)→由目标分子和原料分子综合考虑设计合成路线(由原料分子进行目标分子碳架的构建,以及官能团的引入或转化)→对于不同的合成路线进行优选(以可行性、经济性、绿色合成思想)。同时,要读懂题目,找出有用信息,对于新的有机反应历程,必须弄清来龙去脉,找出解题切入口。
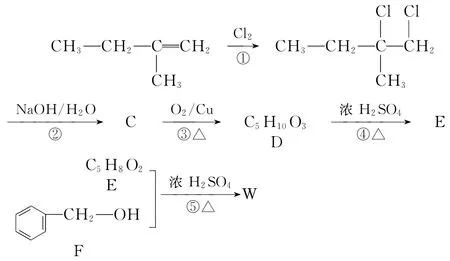
例4 (2017·预测)有机物W可用作调香剂、高分子合成中间体,它的一种合成路线如下所示:
已知:①化合物E核磁共振显示有4个峰,峰面积之比为3∶3∶1∶1;
回答下列问题:
(1)A的系统命名为_________________,D中官能团名称是________。
(2)①②的反应类型分别为________、________。
(3)写出符合下列条件的F的同分异构体________。
Ⅰ.芳香族化合物;Ⅱ.4种不同化学环境的氢原子;Ⅲ.与FeCl3溶液发生显色反应。
(4)反应④的化学方程式是_______________________;反应⑤的化学方程式是_________________。
(5)由苯经如下步骤可合成F:
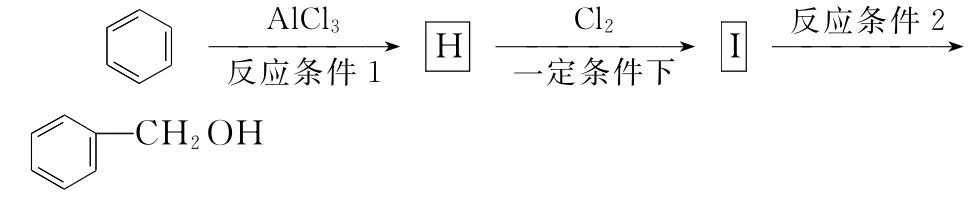
反应条件1所选用的试剂为________,反应条件2所选用的试剂为________;I的结构简式为____________。
分析与解答 本题是一道以有机物的制备合成路线为核心载体进行命题的常考题型,着力考查利用题给信息,对信息进行选择、提炼、加工和运用的能力。涉及有机物结构的书写、反应类型的判断和合成路线的设计,试题有一定难度。为此,解决好这类题型的关键就是认真读题,仔细分析有机物的结构、官能团的转化,从中抓住产物的结构、性质、实验现象、反应类型这条主线,并结合试题中的设问来寻找解决问题的切入点。
根据有机合成路线分析可知,A和氯气发生加成反应生成二氯取代物B;B经反应②卤代烃的取代反应生成C为CH3CH2C(CH3)(OH)CH2(OH);C经反应③醇的氧化反应生成D为CH3CH2C(CH3)(OH)COOH;D经反应④醇的消去反应生成E为CH3—CH C(CH3)—COOH;E和F(C6H5—CH2—OH)经反应⑤酯化反应生成W为CH3—CH C(CH3)—COO—CH2—C6H5。结合题给问题,利用所学相关有机化学基础知识,则试题中的各个问题可迅速给予解答。
答案:(1)2-甲基-1-丁烯 羟基 羧基 (2)加成反应

命题方式之五:以物质的结构、性质为核心载体,着力考查物质结构与性质的相关知识
《考试大纲》明确指出:物质结构与性质是高考必考核心内容之一,研读“考纲”,强化“考点”才是复习之重中之重。为此,对于高考中以物质的结构、性质为核心载体进行命制的“主观”题,必须认真研究,掌握其题型命题方式。同时,要明确这类题型所涉及的“考点”。即命题着力考查在原子结构与物质方面所涉及的核外(价层)电子排布式或轨道表示式(电子排布图),电离能、电负性的大小判断;在分子结构与性质方面有σ键、π键、分子极性、价层电子对数、孤电子对数、分子空间构型和氢键的判断与分析;在晶体结构与性质方面有晶体熔、沸点的比较、晶体类型的判断、晶胞的有关配位数及其微粒计算,等等。为此,解决好这类题型的对策:用好课本,熟悉教材中的如下相关内容:(1)1~36号元素原子或离子的核外电子的排布(尤其是第四周期元素);(2)元素电离能和电负性分别与元素性质的关系;(3)各类化学键(含共价键的“三参数”、配位键等)与物质组成、性质的关系;(4)分子间作用力、氢键与物质性质的关系;(5)四类晶体的构成微粒以及微粒间作用力与晶体性质的关系;(6)键的极性与分子极性的关系;杂化轨道“三类型”与简单分子或者离子的空间结构的关系,等等。认真读题,掌握“物质结构与性质”相关内容,才可迅速找到解决问题的切入点。
例5 (2017·预测)锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:

回答下列问题:
(1)上述方程式中涉及的N、O元素电负性由小到大的顺序是________。
(2)基态S的价电子排布式为_____________;与Cu同周期且最外层电子数相等的元素还有_____________(填元素符号)。
(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol CN-中含有的π键的数目为________。
(5)铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度:________。
(6)下表列出了含氧酸酸性强弱与非羟基氧原子数的关系。
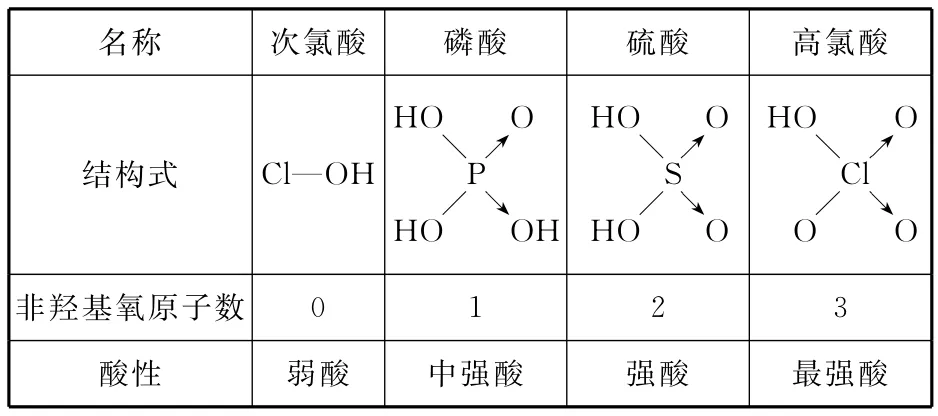
_____名称______次氯酸磷酸硫酸高氯酸HO HO HO结构式Cl—OH P S→→Cl→→OO→OO→HO H HO O OO非羟基氧原子数0 1 2 3_________酸性________弱酸中强酸强酸最强酸
由此可得出的判断含氧酸强弱的一条经验规律是____________。亚磷酸(H3PO3)也是中强酸,它的结构式为_________________,亚磷酸与过量氢氧化钠溶液反应的离子方程式为_________________。
分析与解答 本题是一道以物质的结构、性质为核心载体进行命题的常考题型,着力考查考抽象思维能力、空间想象能力以及知识迁移能力。涉及外电子运动状态、化学键类型、杂化轨道的判断、分子的空间构型及晶体的结构等相关知识,试题难度大。为此,解决好这类题型的关键就是认真读题、读图,利用好物质结构与性质的运用、化学键类型的判断、晶胞的计算,等等,再结合试题中的设问来寻找解决问题的切入点。
(1)略。(2)略。(3)略。(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol CN-中含有的π键的数目为2 NA。(5)铜晶体为面心立方最密堆积,依据密度=质量/体积,则有9.0g·cm-3。(6)略。
答案:(1)N<O (2)3s23p4K、Cr (3)正四面体sp3(4)2 NA(5)9.0g·cm-3(6)含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强 H3PO3+
(作者单位:河北省衡水市故城县教育局)
