铁矾渣热酸分解及硫脲提银
2017-08-08杨建平杨声海陈永明王夏阳
何 静,杨建平,杨声海,陈永明,王夏阳
铁矾渣热酸分解及硫脲提银
何 静,杨建平,杨声海,陈永明,王夏阳
(中南大学冶金与环境学院,长沙 410083)
进行铁矾渣热硫酸分解和分解渣硫脲法提银的试验研究,考察硫酸用量、分解温度、反应时间、液固比对铁矾渣中Fe、Zn、Ag浸出率的影响,以及硫脲法提银的最优条件。结果表明:在硫酸用量为其理论值的1.5倍、分解温度95 ℃、时间2.5 h、液固比2.5:1的最佳条件下,铁矾渣中Fe和Zn浸出率分别为93.85%和92.25%,而Ag的浸出率仅为1.99%。分解液净化后可用中温水热法制备铁红,分解渣中Ag富集到1060 g/t。在液固比10:1、硫脲浓度15 g/L、浸出温度90 ℃、反应时间2.5 h的最优条件下,Ag的平均浸出率在93%以上,同时,渣中Pb的品位由1.7%提高到7.5%。
铁矾渣;湿法炼锌;Ag;硫脲;分解
目前,80%的金属Zn采用“焙烧−浸出−电积”的湿法工艺生产,其中高温高酸浸出铁酸锌时,Fe也同时进入浸出液,为了实现铁锌分离,先后在工业上应用沉铁的方法有黄钾铁矾法、转化法、针铁矿法、赤铁矿法。目前,国内外采用黄钾铁矾法较多,较之于其他方法,该方法渣粒粗、过滤性好,渣含金属较少,但其主要缺点渣量大,需要消耗碱,渣含铁低,且稳定性差[1−3]。铁矾渣一般在冶炼厂附近渣场堆存,这不但占用大量宝贵的土地资源,而且铁矾渣中的重金属,如Zn、Cu、Cd、Pb、As和Sb等,在自然堆存条件下会不断溶出从而污染地下水和土壤[4−6]。目前,铁矾渣的处理包括无害化处理和回收有价金属两个方面。铁矾渣无害化工艺主要有高温烧结法[7−10]、还原焙烧−磁选法[11]、高温水解法[12−14]和溶剂浸出法等,铁矾渣中的铁资源分别以硅酸盐、铁酸盐或Fe2O3等形态在炼铁、微晶玻璃、陶瓷材料、颜料或建材等领域得到增值利用,而重金属元素则得到有效回收或固化处理,由于运营成本高,都未得到推广运用。铁钒渣有价金属的回收,从经济效益上考虑,主要着眼于回收其中的稀散金属Ln、Ag等,韩国瓮山冶炼厂采用两段Ausmelt炉回收铁矾渣中的有价金属工艺已实现工业化,但该工艺固定投资和运行成本都较高,且高温挥发过程中还会造成空气污染[15]。因此,如何经济有效地处理数量庞大的湿法炼锌铁矾渣,仍然是当今有色冶金工业面临的重要环保课题。
国内的研究者针对铁矾渣综合利用也进行了许多研究。赤峰红烨锌冶炼有限责任公司的鞠学珍等[16]和黄善云[17]采用“洗涤−焙烧”工艺对该厂的铁矾渣进行探索试验,即先通过酸洗可使渣中Zn含量由9.20%降低至1.50%;洗渣干燥后加焦粉焙烧,可得含Fe 53%、Zn1.3%的氧化铁渣;但该工艺焙烧的效果差,终渣中的锌含量过高,Fe含量过低,无法达到铁精矿的标准。紫金矿冶设计研究院的蓝碧波等[18]采用“酸浸−焙烧−酸浸”工艺处理铁矾渣,结果表明:渣中的Zn含量可由3.97%降低至约0.085%,酸浸渣铁含量可达到66%;但该工艺流程过长,且酸浸液Zn、Fe含量低,后续回收效率不高。薛佩毅等[15]将黄钾铁矾渣在650 ℃下焙烧1 h,然后在105 ℃、液固比5:1条件下用6 mol/L的NH4C1浸出Zn、Pb和Cd,浸出渣在160 ℃下用23.08%的NaOH溶液浸出1 h,浸出渣中的Fe含量可提高到54%左右;但该工艺浸出温度苛刻,且能耗较大,浸出渣Fe含量偏低,难以达到炼铁原料的要求。
由此,本文作者提出“H2SO4热分解−硫脲提银−尿素中温制备铁红”的含银铁矾渣湿法处理工艺。即首先在H2SO4体系中热分解铁矾渣,产出含Fe、Zn浓度分别为101.3 g/L和13.7 g/L的分解高铁溶液以及将Ag富集到含Ag 1240 g/t的分解渣中,前者经净化后尿素中温可制取铁红,后者采用硫脲浸出提银,研究铁矾渣热硫酸分解,分解渣硫脲法提银过程中硫酸用量、分解温度、反应时间、液固体积质量比对铁矾渣中主要金属浸出率的影响规律及硫脲提银的最优工艺条件。
1 实验
1.1 原料
试验所用铁矾渣取自内蒙古某湿法炼锌厂,其化学成分列于表1,XRD谱分析结果如图1所示。

表1 铁矾渣的化学成分
1) g/t
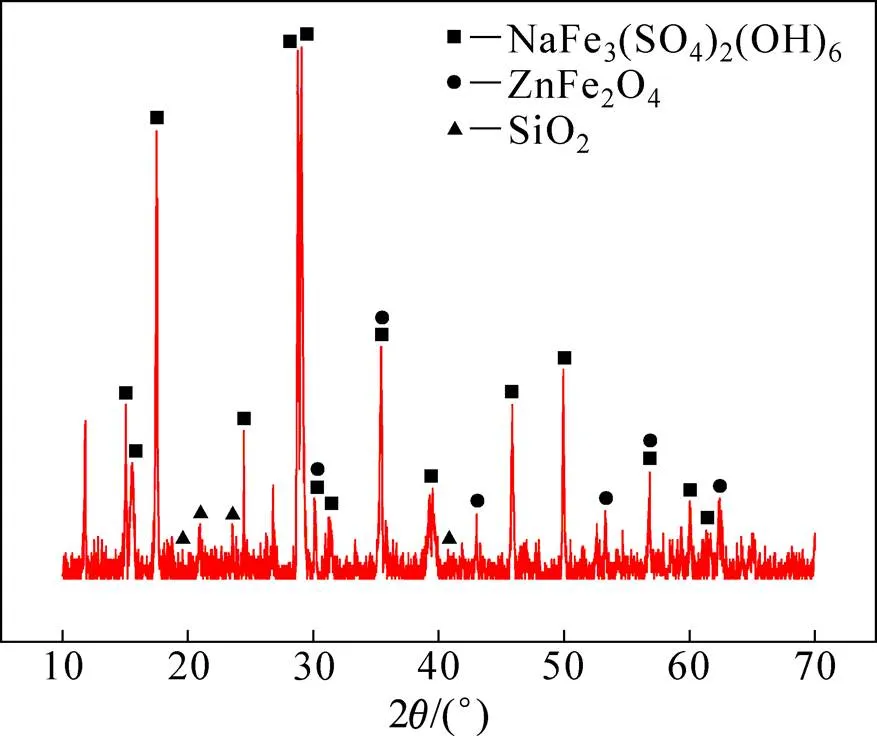
图1 铁矾渣的XRD谱
由表1可知,铁矾渣的主要化学组成为Fe(25.9%)、S(10.1%),其次为Zn(3.6%)、SiO2(2.8%)、Pb(1.7%)。由图1可看出,原料中的Fe主要以钠铁矾NaFe3(SO4)2(OH)6的形式存在;Zn主要以铁酸锌ZnFe2O4的形式存在。而Ag+、Pb2+与Na+、K+、NH4+一样,可能以银铁矾[AgFe3(SO4)2(OH)6]和铅铁矾[Pb0.5Fe3(SO4)2(OH)6]的形式与铁共沉淀进入钒渣,Cu2+、Cd2+及部分Zn2+主要取代铁矾晶格中的Fe3+而进入渣中,而Sb5+、Sn4+、As5+除少部分以SbO43−、SnO32−和AsO43−形态取代铁矾晶格,大部分以独立的FeSbO4、FeSnO3和FeASO4相存在于铁渣中[19−21]。
1.2 试验装置及方法
铁矾渣热酸分解试验装置如图2所示。铁矾渣热酸分解实验在1L密闭的烧杯中进行,温度由恒温水浴锅控制。量取一定量的工业浓硫酸放入烧杯中,按预定液固比加入一定体积的蒸馏水,将其放入恒温水浴锅中,待溶液温度恒定于预定值后,称取40 g铁钒渣缓慢加入烧杯中,磁力搅拌加热,并开始计时。到达预定时间后,停止反应并进行过滤,滤饼用蒸馏水淋洗3次,洗水与滤液合并后量取体积用ICP-AES方法取样分析,滤渣经远红外干燥箱烘干后,称取质量进行取样分析。金属的浸出率用进行表征,计算公式如式(1)所示:

式中:为金属的浸出率,%;为金属的浓度,g/L;为溶液体积,L;为试料质量,g;为金属在试料中所占质量分数,%。
图2 铁矾渣热酸分解试验装置图
Fig. 2 Schematic diagram of experimental set-up for sodium jarosite residue decomposition: 1—Stirring bar; 2—Beaker; 3—Cover; 4—Thermometer; 5—Thermostat with oil bath; 6—Glycerinum; 7—Temperature control button
2 工艺流程及原理
2.1 工艺流程
铁矾渣热酸分解及硫脲提银的原则流程如图3 所示。

图3 铁矾渣热酸分解及硫脲提银的原则流程图
2.2 实验原理
2.2.1 铁钒渣热酸分解原理
如前所述,铁矾渣包含的金属有Fe、Zn、Ag、Cu、Cd、Pb、As、Sb等,主要物相组成为NaFe3(SO4)2(OH)6、ZnO·Fe2O3。因此,铁矾渣热酸分解的主要反应如式(2)和(3)所示。随着黄钾铁矾晶格的破坏,铁矾晶格中的Zn2+、Ag+、Cu2+、Cd2+、Pb2+、As3+、Sb3+等杂质离子均析出。铁矾渣中的砷酸铁在高酸时也会被分解以As5+的形式进入溶液,反应如式(4)所示。
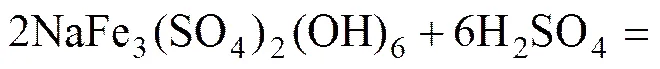
(2)
(3)
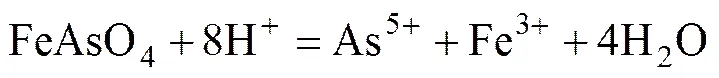
2.2.2 硫脲提银原理
硫脲又称硫代尿素,其分子式为SC(NH2)2,易溶于水,25 ℃下水的溶解度为14%,水溶液显中性。硫脲在酸性介质中具有还原性,如在室温下,硫脲在酸性介质中长时间放置可自行氧化成二硫甲醚(SCN2H3)2。硫脲溶解Ag的原理为在氧化剂存在的条件下,Ag以Ag[(SC(NH2)2)]3+形式溶于硫脲的酸性溶液中,以Fe3+为氧化剂则发生Fe3+到Fe2+还原过程,整个过程发生以下反应:

(5)

(7)
其总反应为

25 ℃下Ag-SC(NH2)2-H2O系电位−pH图见图4。由图4可知,Ag溶解生成Ag[(SC(NH2)2)]3+线在Fe2+氧化成Fe3+线的下面,且Ag溶解线在H2O的热稳定区域,说明在热力学上硫脉提银以Fe3+做氧化剂是可行的;硫脉氧化成二硫甲醚(SCN2H3)2线与银溶解线在相交处对应pH为6.17,说明银溶解所需的pH值需小于6.17,既在酸性介质中,此时析氧线在Fe2+氧化成Fe3+线的上面,说明在酸性溶液里溶解O2不仅自身能够氧化溶解银,还能够氧化Fe2+使Fe3+再生。
图4 Ag-SC(NH)-HO系电位−pH图
Fig. 4 Potential−pH diagram of Ag-SC(NH)-HO system
3 结果与分析
3.1 硫酸用量的影响
在液固体积质量比3:1、浸出时间2.0 h、反应温度为95 ℃的条件下,改变H2SO4的加入量以考察其对铁矾渣分解过程的影响,结果如图5所示。
由图5可知,Fe、Zn、Ag浸出率都随硫酸用量的增加而增加,当硫酸用量为其理论耗量的1.5倍时,三者的浸出率分别达到89.21%、82.01%以及50.1%;此后,继续增加硫酸用量,Fe、Zn、Ag的浸出率基本保持不变。

图5 硫酸用量对Fe、Zn、Ag浸出率的影响
3.2 分解温度的影响
在液固体积质量比3:1、硫酸用量为其理论值的1.5倍、反应时间2.0 h的条件下。改变分解温度以考察其对铁矾渣分解过程的影响,结果如图6所示。
由图6可知,温度对分解过程影响较大,升高温度有利于金属浸出率的增大。尤其是Fe和Zn,当温度由55 ℃提高至95 ℃接近水的沸点时,Fe、Zn浸出率分别由53.53%和43.53%显著增加至89.21%和82.01%。这主要是由于铁矾和铁酸锌常温下难以溶出,常压下只有在较高的温度和高酸的极端条件下,才会分解浸出。另一方面,Ag的浸出率也随着浸出温度的上升而增加,当温度由55 ℃提高至95 ℃时,Ag的浸出率随之由6.9%增加至52.84%。这主要是由于矾渣中的Ag大多以银铁矾形式存在,在浸出过程中,铁矾渣被破坏,被包裹的银裸露出来,Ag与H2SO4反应生成Ag2SO4,低温下Ag2SO4溶解度很小而仍留于浸出渣中,但高温下Ag2SO4溶解度增加明显。
3.3 反应时间的影响
在液固体积质量比3:1、硫酸用量为其理论值的1.5倍、反应温度95 ℃的条件下,改变反应时间以考察其对铁矾渣分解过程的影响,其结果如图7所示。
由图7可知,反应时间延长有利于金属Fe、Zn浸出率的提高。当浸出时间由0.5 h延长至2.5 h时,Fe、Zn的浸出率分别由80.74%和70.92%增加至88.94%和85.43%,Ag的浸出率变化不大;其后继续延长浸出时间,Fe的浸出率变化不大,Zn的浸出率在缓慢增加,Ag的浸出率下降到36.2%,最佳浸出时间为2.5~3 h。
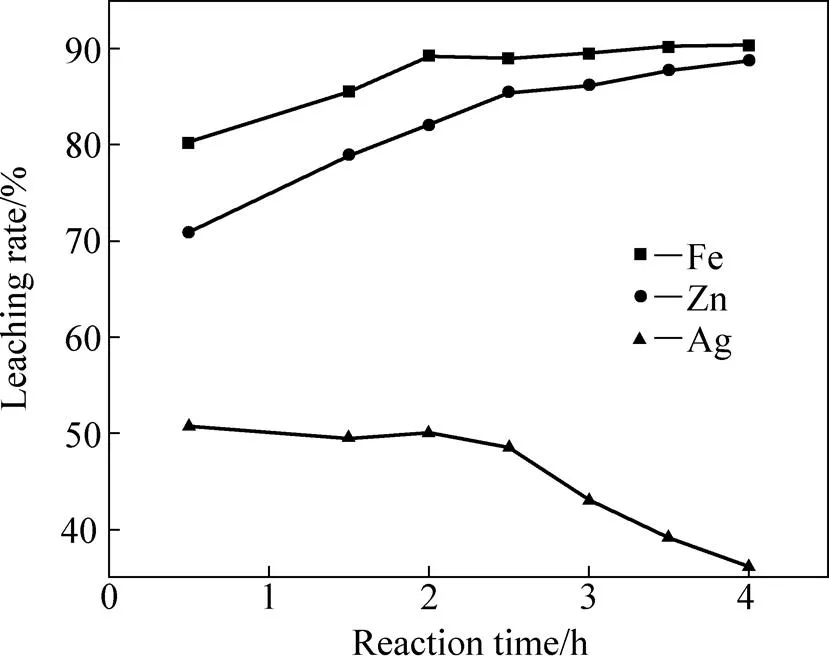
图7 浸出时间对Fe、Zn、Ag浸出率的影响
3.4 液固比的影响
在硫酸用量为其理论值的1.5倍、浸出时间2.0 h、反应温度95 ℃的条件下,改变液固比以考察其对铁矾渣分解过程的影响,结果如图8所示。
由图8可知,随着液固比的增大,Fe、Zn的浸出率都呈减小的趋势,而Ag的浸出率在液固比为3:1时最大,而后随着液固比的增大明显降低,这主要是由于液固比的增加导致硫酸浸出剂浓度大幅降低。液固比过大,浸出液中Fe、Zn、Ag含量随之降低,最终导致生产效率的降低。因此,选择最优的液固体积质量比为2.5:1。
3.5 综合扩大试验
依据单因素条件试验结果,确定热酸分解最优浸出条件为:硫酸用量为其理论值的1.5倍,温度95 ℃,反应时间2.5 h,液固体积质量比2.5:1,同时加入NaCl抑制Ag的浸出。在此条件下进行3次重复试验,每次浸出400 g铁矾渣。得分解渣共计539.37 g,平均渣率为55.05%,其化学组成列于表2。铁矾渣热酸分解过程中,主要金属元素的平衡如表3所示。所得滤液共计2.89 L,合并后其化学组成列于表4。
由表2和3可知,铁矾渣热酸分解后,渣中Fe、Zn分别为9.57%和1.73%,铁矾渣分解过程中Ag、Pb基本留在渣中,Ag的平均含量为1240 g/t,渣计浸出率为8.02%,Ag在浸出过程中可通过增加NaCl的用量来减少其在液中损失;热酸分解渣XRD谱如图9所示,显然,渣中的Fe仍以铁矾的形式存在,Pb、Ca主要以硫酸盐的形式存在,Ag以二价氧化物的形态存在。

图8 液固比对Fe、Zn、Ag浸出率的影响

表2 浸出渣混合后的化学组成/%

表3 铁矾渣热酸分解过程中主要金属元素平衡
如表4所列,分解液中Fe、Zn的平均浓度分别为101.3 g/L和13.7 g/L,液计平均浸出率分别为93.91%、90.31%,Ag的液计平均浸出率为1.99%,杂质金属As的浸出率为86.04%,其在分解液中的浓度高达2.75 g/L,进一步除砷后和深度净化后,该溶液中添加沉铁所需1.5倍尿素后置于高压釜在转速240 r/min、反应温度150~200 ℃、反应时间1 h条件下进行水热法试验,得到的固体XRD谱如图10所示,由图10可知,沉铁产物的为Fe2O3铁红,且无明显杂 质峰。

表4 浸出滤液混合后的化学组成
1) mol/L

图9 热酸分解渣的XRD谱
3.6 分解渣硫脲提银
以张少博等[22]对含银锌酸浸渣硫脲浸银正交试验的研究为参考,进行了硫脲提银主要因素的试验研究,其结果如图11所示。
由图11确定硫脲法提银的最优条件如下:硫脲浓度15 g/L,温度90 ℃,时间2.5 h,液固比10:1。在此条件下,进行3次优化试验,试验规模为200 g热酸浸出渣/次,优化试验结果见表5,硫脲浸出渣见表6。由表5可知,Ag的浸出率最高可达94.8%,平均浸出率为93.5%,溶液中Ag的浓度最高可达107.25 mg/L,平均浓度为103.67 mg/L,浸出液进一步用锌粉置换,可得银粉,置换后液可循环利用提取Ag。浸出渣中Ag的化学成分痕量,渣中Pb的化学成分最高达7.8%,平均为7.4%,平均富集了4.4倍,可送铅回系统。由表6和图9热酸分解渣的XRD谱综合分析可知,硫脲浸出渣主要物相为CaSO4、PbSO4、SiO2等。

图10 沉铁产物的XRD谱

图11 硫脲浓度、温度、时间和液固比对Ag浸出率的影响

表5 优化试验结果

表6 硫脲浸出渣的化学组成
4 结论
1) 硫酸用量、分解温度、反应时间对铁矾渣的分解过程显著。在硫酸用量为其理论值的1.5倍,分解温度95 ℃,反应时间2.5 h,液固体积质量比2.5:1的最佳条件下,铁矾渣中Fe、Zn浸出率分别为93.85%和92.25%,浸出液中Fe、Zn的浓度分别高达101.3 g/L和13.7 g/L,净化除砷后可用水热法制备铁红。
2) 在铁矾渣分解过程中,杂质金属Ag、Pb等基本留在分解渣中,Ag的平均浸出率仅为1.99%,分解渣中Ag富集到1240 g/t。在液固比10:1、硫脲浓度15 g/L、浸出温度90 ℃、反应时间2.5 h的最优条件下,硫脲法提银的浸出率在93%以上,锌粉置换后可得到银粉,置换后液可循环利用提取Ag。铁矾渣中Pb得到富集,品位由1.7%提高到7.5%,可送Pb回收系统。
REFERENCES
[1] 梅光贵. 湿法炼锌学[M]. 长沙: 中南大学出版社, 2001. MEI Guang-gui. Hydrometallurgy of zinc[M]. Changsha: Central South University Press, 2001.
[2] 陈家镛. 湿法冶金中铁的分离与利用[M]. 北京: 冶金工业出版社, 1991. CHEN Jia-yong. Separation and utilization of iron in hydrometallurgy[M]. Beijing: Metallurgical Industry Press, 1991.
[3] 陈永明, 唐谟堂, 杨声海, 何 静, 唐朝波, 杨建广. NaOH分解含铟铁矾渣新工艺[J]. 中国有色金属学报, 2009, 19(7): 1322−1331. CHEN Yong-ming, TANG Mo-tang, YANG Sheng-hai HE jing, TANG chao-bo, YANG jian-guang. Novel technique of decomposition of ammonium jarosite bearing indium in NaOH medium[J]. The Chinese Journal of Nonferrous Metals Society, 2009, 19(7): 1322−1331.
[4] 朱北平, 邓志敢, 张 帆, 魏 昶. 热酸浸出富铟锌浸渣提取锌铟的研究[J]. 矿冶, 2016, 25(3): 45−49.ZHU bei-ping, DENG zhi-gan, ZHANG fan, WEI chang. Study on recovery of indium and zinc from hot-acid leaching residues[J]. Mining and Metallurgical Engineering, 2016, 25(3): 45−49.
[5] 马菲菲, 李志强. 湿法炼锌铁矾渣处理改造实践[J]. 中国有色冶金, 2015, 44(3): 25−28. MA fei-fei, LI zhi-qiang, Processing reform practice on jarosite from zinc hydrometallurgical process[J]. Chinese Nonferrous Metallurgy, 2015, 44(3): 25−28.
[6] 刘 超, 巨少华, 张利波, 彭金辉, 黎氏琼春. 用微波硫酸化焙烧-水浸新工艺从铁矾渣中回收有价金属[J]. 湿法冶金, 2016, 35(1): 36−39. LIU chao, JU shao-hua, ZHANG li-bo, PENG jin-hui, LISHI Qiong-chun. Using new technology of microwave sulphation roasting-water recovery of valuable metals from jarosite[J]. Hydrometallurgy, 2016, 35(1): 36−39.
[7] ASOKAN P, SAXENA M, ASOLEKER S R. Hazardous jarosite use in developing non-hazardous product for engineering application[J]. Journal of Hazardous Materials, 2006, 137(3): 1589−1599.
[8] MOUTANARO L, BIANCHINI N, MA R J, ROMERO M. Sintering behavior of pressed red mud wastes from zinc hydrometallurgy[J]. Ceramics International, 2001, 27(1): 29−37.
[9] SEYER S, CHEN T T, DUTRIZAC J E. Jarofix: Addressing iron disposal in the zinc industry[J]. JOM, 2001, 53(12): 32−35.
[10] ASOKAN P, MOHINI S, SHYAM A. Jarosite characteristics and its utilization potentials[J]. Science of the Total Environment, 2006, 359(2): 232−243.
[11] ZHANG J, SUN Y, LIU X L. Recovery of metals from stainless steel pickling sludge by reduction and magnetic separation[J]. Guocheng Gongcheng Xuebao/the Chinese Journal of Process Engineering, 2014, 14(5): 782−786.
[12] HAGE J L T, SCHUILING R D, VRIEND S P. Production of magnetite from sodiumjarosite under reducing hydrothermal conditions. the reduction of feto fewith cellulose[J]. Canadian Metallurgical Quarterly, 2013, 38(4): 267−276.
[13] SINICA M, SEZEMANAS G, MIKULSKIS D, et al. Investigation of sorption properties in crushed autoclaved aerated concrete waste[J]. Journal of Environmental Engineering & Landscape Management, 2012, 20(1): 67−75.
[14] HU S, FU Y. Resource recovery of copper‐contaminated sludge with jarosite process and selective precipitation[J]. Environmental Progress & Sustainable Energy, 2012, 31(3): 379−385.
[15] 薛佩毅, 巨少华, 张亦飞. 焙烧−浸出黄钾铁矾渣中多种有价金属[J]. 过程工程学报, 2011, 11(1): 56−60. XUE Pei-yi, JU Shao-hua, ZHANG Yi-fei. Recovery of valuable metals by leaching of roasted jarosite residue[J]. The Chinese Journal of Process Engineering, 2011, 11(1): 56−60.
[16] 鞠学珍, 马永涛, 史俊玲, 刘长东. 湿法炼锌黄铵铁矾渣综合利用研究[J]. 有色金属(冶炼部分), 2001(2): 18−20. JU Xue-zhen, MA Yong-tao, SHI Jun-ling, LIU Chang-dong. The comprehensive utilization of ammonium jarosite residue from zinc hydrometallurgical process[J]. Non-ferrous Metallurgy (Metallurgical Part), 2001(2): 18−20.
[17] 黄善云. 降低浸出渣含锌的生产实践[J]. 有色冶炼, 2002(3): 40−42. HUANG Shan-yun. Practice in reducing zinc in leaching residue[J]. Nonferrous Metallurgy, 2002(3): 40−42.
[18] 蓝碧波, 刘晓英, 刘丽华. 铁矾渣综合利用技术研究[J]. 矿产综合利用, 2013, 12(6): 54−58. LAN Bi-bo, LIU Xiao-ying, LIU Li-hua. Research on comprehensive utilization technology of jarosite residue[J]. Multipurpose Utilization of Mineral Resources, 2013, 12(6): 54−58.
[19] LIU H C, XIA J L, NIE Z Y. Relatedness of Cu and Fe speciation to chalcopyrite bioleaching by Acidithiobacillus ferrooxidans[J]. Hydrometallurgy, 2015, 156: 40−46.
[20] DUTRIZAC J E, JAMBOR J L. The behaviour of arsenic during jarosite precipitation: arsenic precipitation at 97℃ from sulphate or chloride media[J]. Canadian Metallurgical Quarterly, 2013, 26(2): 91−101.
[21] DUTRIZAC J E, CHEN T T. Behaviour of the alkaline earth elements (beryllium to radium) during the precipitation of jarosite-type compounds[J]. Canadian Metallurgical Quarterly, 2013, 47(4): 387−401.
[22] 张少博, 陈 雯, 沈强华. 湿法炼锌渣或经浮选所得含铅银精矿浸银试验研究[J]. 矿冶, 2014, 23(2): 70−72. ZHANG Shao-bo, CHEN Wen, SHEN Qiang-hua. A test study on silver-leaching from zinc-hydrometallurgical residue and from flotation concentrate out of the residue[J]. Ming Metallurgy, 2014, 23(2): 70−72.
(编辑 李艳红)
Decomposition of jarosite residue in sulfuric acid medium and recovery of silver with thiourea solution
HE Jing, YANG Jian-ping, YANG Sheng-hai, CHEN Yong-ming, WANG Xia-yang
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
The decomposition of sodium jarosite in H2SO4medium and recovery of silver from silver bearing decomposition residue were studied. The effects of H2SO4additions, decomposition temperature, time and liquid-solid ratio on leaching rate of Fe, Zn and Ag were investigated. The results show that, under the following optimum conditions of H2SO4additions 1.5 times of its experimental value, temperature of 95 ℃, reaction time of 2.5 h and liquid-solid ratio of 2.5׃1, the leaching rates of Fe and Zn can reach 93.85% and 92.25%, the mean leaching rate of Ag is only 1.99%. After being purified, the decomposition solution is used to explore the preparation of iron oxide red by hydrothemal method and silver in decomposition residue can be enriched to 1060 g/t. And then, the optimal conditions of recovery of silver with thiourea solution is determined as follow: thiourea concentration of 15 g/L, liquid-solid ratio of 10:1, temperature of 90 ℃, time of 2.5 h. The results show that the leaching rate of Ag can reach 93%, and then, the lead contents are also improved from 1.7% to 7.5%.
jarosite residue; zinc hydrometallurgy; silver; thiourea; decomposition
Project (51174240) supported by the National Natural Science Foundation of China
2016-05-17; Accepted date: 2016-11-02
HE Jing; Tel: +86-731-88830470; E-mail: he6213@163.com
10.19476/j.ysxb.1004.0609.2017.07.22
1004-0609(2017)-07-1504-09
TF8
A
国家自然科学基金资助项目(51174240)
2016-05-17;
2016-11-02
何 静,教授;电话:0731-88830470;E-mail:he6213@163.com
