血清白细胞介素-10评估不同年龄免疫功能受损并重症肺炎患者病情严重程度及预后的价值
2017-08-08李鋆璐邢丽华李晓燕袁聪聪王石磊赵世龙曹凤安
李鋆璐 邢丽华 李晓燕 袁聪聪 王石磊 赵 松 高 景 赵世龙 曹凤安 曹 杰
(郑州大学第一附属医院呼吸ICU,河南 郑州 450000)
血清白细胞介素-10评估不同年龄免疫功能受损并重症肺炎患者病情严重程度及预后的价值
李鋆璐 邢丽华 李晓燕 袁聪聪 王石磊 赵 松 高 景 赵世龙 曹凤安 曹 杰
(郑州大学第一附属医院呼吸ICU,河南 郑州 450000)
目的 探讨血清白细胞介素(IL)-10评估不同年龄免疫功能受损并重症肺炎患者病情严重程度及预后的价值。方法 180例免疫功能受损并重症肺炎患者,根据年龄分为非老年组(年龄<60岁,112例)、老年组(年龄≥60岁,68例);入院后行APACHEⅡ评分、淋巴细胞亚群及血清IL-10水平检测;比较两组患者病情严重程度及结局差异,血清IL-10表达水平差异及与病情严重程度的关系。结果 相比于非老年组,老年组病情重,APACHEⅡ评分较高〔非老年组(24.22±7.51)分,老年组(36.53±13.52)分〕,死亡率高(非老年组51.79%,老年组73.53%;P<0.05);老年患者血清IL-10水平〔(6.72±1.97)mg/dl〕低于非老年组〔(9.66±2.58)mg/dl,P<0.05〕;相关性分析显示,血清IL-10水平与APACHEⅡ评分呈负相关。结论 检测免疫受损合并重症肺炎患者血清IL-10水平,有助于评估及预测病情严重程度及预后。
白细胞介素-10;免疫功能受损;重症肺炎;严重程度;预后评估
免疫功能受损患者极易合并感染,而肺部感染首当其冲。即使给予强有力抗感染治疗及一系列对症治疗,患者死亡率仍较高〔1~3〕。老年人更是肺部感染的高危人群,由于身体状况、基础疾病等原因,起病隐匿、进展迅速,易发展为脓毒症及多器官功能不全,死亡率高〔4,5〕。新近研究发现重症感染打击机体的作用机制除了微生物的直接毒性作用外,免疫相关的炎症反应也参与其中〔6〕。白细胞介素(IL)-10作为调节性T细胞的主要细胞因子,在维持机体免疫稳态中有着重要作用〔7,8〕。而在重症肺炎中,IL-10可调节促炎反应,减轻组织损伤程度,而随病情加重而出现下调趋势。尤其在老年重症肺炎患者中,IL-10下调水平更加明显〔9,10〕。但在免疫受损合并重症肺炎患者病情进展中,IL-10水平变化尚无研究。本研究探讨IL-10在免疫受损并重症肺炎患者中的变化及与病情严重程度及预后的关系。
1 资料与方法
1.1 一般资料 选择2014年1月至2016年6月入住郑州大学第一附属呼吸ICU且住院时间超过48 h的患者,其中免疫受损患者包括自身免疫性疾病、原发性免疫缺陷综合征(AIDS)、慢性肾功能衰竭、血液透析、终末期肝病、恶性肿瘤、实体器官移植及造血干细胞移植患者〔11〕。重症肺炎参照2007年美国感染病学会和美国胸科学会重症肺炎诊断标准。符合免疫受损入组标准之一及重症肺炎诊断标准,排除急性心脑血管疾病、妊娠妇女患者。入组患者共180例,男105例,女75例,并按年龄分为非老年组(年龄<60岁)及老年组(年龄≥60岁)。非老年组112例,男65例,女47例,年龄18~59〔平均(38.74±11.74)〕岁;其中自身免疫性疾病48例,AIDS 2例,慢性肾衰竭16例,血液透析9例,终末期肝病6例,恶性肿瘤24例,实体器官或造血干细胞移植7例。老年组68例,男40例,女28例,年龄60~85〔平均(72.93±7.98)〕岁;其中自身免疫性疾病30例,AIDS 1例,慢性肾衰竭9例,血液透析4例,终末期肝病4例,恶性肿瘤17例,实体器官或造血干细胞移植3例。两组一般资料无明显差异(P>0.05)。本研究符合伦理学标准,经医院伦理委员会批准,患者或家属均知情同意。
1.2 方法
1.2.1 标本采集 所有患者入院后24 h内行急性生理与慢性健康(APACHE)Ⅱ评分,并于入院第1天抽取外周静脉血3 ml检测外周血淋巴细胞亚群,反映机体免疫功能状态,同时抽取外周血3 ml行血清IL-10水平检测。
1.2.2 实验方法 (1)外周血淋巴细胞比例测定:采用三色流式细胞术,分别用CD3-PE、CD4-FITC、CD8-APC抗体及同行对照抗体标记(购自美国BD公司),并于BD公司的FACScalibur流式细胞仪分析总T细胞(CD3细胞)、CD3+CD4+T细胞、CD3+CD8+T细胞及CD4+/CD8+比值。(2)血清IL-10水平测定:将外周静脉血以3 000 r/min离心20 min取上清,试剂盒置于室温平衡30 min,按试剂盒说明书(购自达科为生物技术有限公司)方法检测,(每个标本设置三个副孔取平均值),最终将酶标板置于酶标仪读取各孔OD值,制作标准曲线后得出稀释浓度并乘以稀释倍数得出外周血中IL-10浓度。
1.3 结局终点评价 根据入组患者入院7 d后的临床症状、影像学表现和死亡率等作为病情结局的判断指标,分为好转(存活)及恶化(死亡)两种结局。
1.4 统计学方法 采用SPSS17.0软件进行t、χ2检验及Spearman秩相关分析。
2 结 果
2.1 两组淋巴细胞亚群检测比较 两组外周血淋巴细胞亚群测定比较无统计学差异(P>0.05)。见表1。
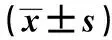
表1 两组淋巴细胞亚群检测
2.2 APACHEⅡ评分、血清IL-10水平 与非老年组比较,老年组患者APACHEⅡ评分较高〔非老年组(24.22±7.51)分,老年组(36.53±13.52)分,P<0.05〕;与非老年组比较,老年组患者血清IL-10水平较低〔非老年组(9.66±2.58)mg/dl,老年组(6.72±1.97)mg/dl,P<0.05〕。通过Spearman秩相关分析发现,APACHEⅡ评分与血清IL-10水平呈负相关(r=-0.62,P<0.05)。
2.3 病情结局 老年组患者死亡率(73.53%)明显高于非老年组(51.79%,P<0.05)。
3 讨 论
IL-10作为Treg细胞主要效应分子,可由巨噬细胞、树突细胞、单核细胞及某些肿瘤细胞等多种细胞分泌,作为免疫调节的细胞因子在抑制自身免疫性疾病、急慢性感染性疾病、某些恶性肿瘤等多种疾病中发挥重要作用。IL-10通过结合其特异性受体IL-10R,抑制抗原呈递细胞功能及促炎因子释放,而发挥免疫抑制作用〔7,12〕。在自身免疫性疾病进展过程中,IL-10表达下调,使免疫调节功能受损而炎症反应多度激活导致病情进展,引起组织器官损伤〔13,14〕。而在某些感染性疾病中,病原体刺激IL-10分泌,使患者血清中IL-10水平升高,促炎因子减少而致病情进展〔15,16〕。因此IL-10在调节炎症反应及抗炎反应的平衡状态中起着重要作用。近期研究发现在重症肺炎病情进展过程中,IL-10表达明显下调,而在IL-10敲除的肺炎小鼠中,虽然病原体清除明显,但是由于过度炎症反应而致小鼠肺部炎性损伤加重。因此可看出重症肺炎病情发展可能与IL-10表达下调而引起的免疫抑制功能受损及炎症反应相对过激相关〔17,18〕。另外研究发现,在重症肺炎小鼠模型中,老年小鼠肺部中性粒细胞浸润明显,炎性损伤更重,机体炎症反应更明显,而小鼠肺泡灌洗液中IL-10表达水平更低,因此老年重症肺炎病情较重可能与免疫抑制功能受损而炎症反应增强有关〔10〕。
本研究发现,免疫功能受损合并重症肺炎患者中,两组患者入院时免疫功能无明显差异,但随着病情进展,两组患者病情严重程度及结局不同,血清IL-10表达水平也有明显差异。这可能与疾病进展过程中由于IL-10表达下调使免疫抑制功能下降,机体不能有效对抗炎症反应有关。因此检测血清IL-10的水平可有助于判断免疫受损并重症肺炎疾病严重程度及预后评估。
1 Letourneau AR,Issa NC,Baden LR.Pneumonia in the immunocompromised host〔J〕.Curr Opin Pulm Med,2014;20(3):272-9.
2 Shorr AF,Susla GM,O'Grady NP.Pulmonary infiltrates in the non-HIV-infected immunocompromised patient:etiologies,diagnostic strategies,and outcomes〔J〕.Chest,2004;125(1):260-71.
3 Linden PK.Approach to the immunocompromised host with infection in the intensive care unit〔J〕.Infect Dis Clin North Am,2009;23(3):535-56.
4 Kaufmann PA,Smolle KH,Krejs GJ.Short-and long-term survival of nonsurgical intensive care patients and its relation to diagnosis,severity of disease,age and comorbidities〔J〕.Curr Aging Sci,2009;2(3):240-8.
5 El-Solh AA,Sikka P,Ramadan F,etal.Etiology of severe pneumonia in the very elderly〔J〕.Am J Respir Crit Care Med,2001;163(3 Pt 1):645-51.
6 王 平,王 玺,张丽涓,等.低分子肝素对老年重症肺炎患者预后的影响〔J〕.中华危重病急救医学,2013;25(12):734-7.
7 Trifunovic J,Miller L,Debeljak Z,etal.Pathologic patterns of interleukin 10 expression-a review〔J〕.Biochem Med(Zagreb),2015;25(1):36-48.
8 Levast B,Li Z,Madrenas J.The role of IL-10 in microbiome-associated immune modulation and disease tolerance〔J〕.Cytokine,2015;75(2):291-301.
9 Aggarwal NR,Tsushima K,Eto Y,etal.Correction:immunological priming requires regulatory T cells and IL-10-producing macrophages to accelerate resolution from severe lung inflammation〔J〕.J Immunol,2016;196(9):3963-5.
10 Williams AE,José RJ,Brown JS,etal.Enhanced inflammation in aged mice following infection with Streptococcus pneumoniae is associated with decreased IL-10 and augmented chemokine production〔J〕.Am J Physiol Lung Cell Mol Physiol,2015;308(6):L539-49.
11 Löbermann M,Borso D,Hilgendorf I,etal.Immunization in the adult immunocompromised host〔J〕.Autoimmun Rev,2012;11(3):212-8.
12 Moore KW,de Waal Malefyt R,Coffman RL,etal.Interleukin-10 and the interleukin-10 receptor〔J〕.Annu Rev Immunol,2001;19:683-765.
13 Peng H,Wang W,Zhou M,etal.Role of interleukin-10 and interleukin-10 receptor in systemic lupus erythematosus〔J〕.Clin Rheumatol,2013;32(9):1255-66.
14 Karam RA,Zidan HE,Khater MH.Polymorphisms in the TNF-α and IL-10 gene promoters and risk of psoriasis and correlation with disease severity〔J〕.Cytokine,2014;66(2):101-5.
15 Barnes PF,Lu S,Abrams JS,etal.Cytokine production at the site of disease in human tuberculosis〔J〕.Infect Immun,1993;61(8):3482-9.
16 Yao Y,Simard AR,Shi FD,etal.IL-10-producing lymphocytes in inflammatory disease〔J〕.Int Rev Immunol,2013;32(3):324-36.
17 Ding S,Wang X,Chen W,etal.Decreased Interleukin-10 Responses in Children with Severe Mycoplasma pneumoniae Pneumonia〔J〕.PLoS One,2016;11(1):E0146397.
18 Penttilä T,Haveri A,Tammiruusu A,etal.Chlamydia pneumoniae infection in IL-10 knock out mice:accelerated clearance but severe pulmonary inflammatory response〔J〕.Microb Pathog,2008;45(1):25-9.
〔2017-01-03修回〕
(编辑 李相军)
河南省科技厅基金资助基金(142300410327);河南省医学科技攻关计划项目(201403060)
邢丽华(1965-),女,博士,主任医师,主要从事呼吸暨重症医学研究。
李鋆璐(1992-),女,硕士,主要从事呼吸暨重症医学研究。
R563.1
A
1005-9202(2017)14-3527-02;
10.3969/j.issn.1005-9202.2017.14.066
