血管性痴呆大鼠肾素-血管紧张素-醛固醇系统的动态变化
2017-08-08李蓓华鲁国洲黄新武
李蓓华 鲁国洲 黄新武
(西南医科大学药学院,四川 泸州 646000)
血管性痴呆大鼠肾素-血管紧张素-醛固醇系统的动态变化
李蓓华 鲁国洲1黄新武
(西南医科大学药学院,四川 泸州 646000)
目的 观察血管性痴呆(VD)大鼠血浆和脑组织肾素-血管紧张素(Ang)-醛固酮(ALD)系统(RAAS)的动态变化。方法 经水迷宫筛选出学习记忆能力正常雄性SD大鼠80只随机分入正常组、模型组(1 d)、模型组(3 d)、模型组(7 d)、模型组(14 d)、模型组(21 d)、模型组(30 d),按照设计时间梯度采用不同时点分别结扎左、右双侧颈总动脉法制备VD模型大鼠。观察正常组和模型组(30 d)的空间学习记忆情况,检测血浆、脑皮质及海马肾素活性、AngⅡ、ALD水平以及脑组织病理学检查。结果 模型组(30 d)和正常组水迷宫数据比较差异显著(P<0.05),说明模型制备成功。血浆、皮质及海马中肾素活性、AngⅡ及ALD的水平模型组随时间增加其水平总体呈现增高趋势,但脑组织与血浆水平变化无线性相关性;脑组织光镜下病理学观察发现,随缺血时间增加脑皮质及海马损伤有加重趋势。结论 RAAS在脑缺血的发生发展中有着重要作用。
肾素-血管紧张素-醛固酮系统;脑缺血;血管性痴呆
高龄人群中血管性痴呆(VD)患者比老年痴呆有更高的死亡率〔1〕。VD发病的确切机制尚不十分清楚。近年研究提示大脑中存在独立于外周的肾素-血管紧张素(Ang)-醛固酮(ALD)系统(RAAS),具有调节大脑生理和病理性作用〔2〕。中枢RAAS中的Ang与学习、记忆密切相关〔3〕。然而在缺血性脑损伤中脑内RAAS的变化及其作用机制至今仍未完全阐明,本文探讨脑缺血所致VD的RAAS动态变化。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠100只,体重(200±10)g,SPF级,由泸州医学院SPF动物医学实验中心提供。
1.2 主要实验试剂及设备 碘【125I】AngⅠ(批号:20140320)、125I AngⅡ(批号:20140320)、125I ALD(批号:20140320),由北京北方生物技术研究所提供,SN-695Bγ放射免疫计数仪(上海核辐日环一厂)、低温离心机(ST16R)〔赛默飞世尔科技(中国)有限公司〕、电子天平(上海精科-上海仪电科学仪器有限公司)、Morris水迷宫(成都泰盟科技有限公司)。
1.3 方法
1.3.1 造模及分组 不同时点永久性结扎左、右颈总动脉造模〔4〕。实行双重结扎(结扎处间隔2 cm左右),保证结扎稳固阻断血流。经过水迷宫筛选出学习记忆能力正常雄性SD大鼠80只,随机分入:正常组、模型组(1 d)、模型组(3 d)、模型组(7 d)、模型组(14 d)、模型组(21 d)、模型组(30 d)。按照造模方法依设计时间梯度进行手术。
1.3.2 水迷宫实验 选取正常组及模型30 d组行定位航行实验:1 w左右,每天将动物从4个入水点面朝池壁轻轻放入水中,记录大鼠从入水至找到平台的游泳轨迹及逃避潜伏期。每次时间为120 s,如果120 s内未找到平台,则将大鼠放在平台上20 s,并记录潜伏期为120 s。
1.3.3 标本采集及处理 实验设计时间截止时,大鼠禁食过夜,各组取5只称重后,1%戊巴比妥钠0.3 ml/100 g 麻醉,腹主动脉取血,加入配置好的抗凝真空采血管内,4℃,3 000 r/min,离心10 min,收集血浆,-20℃保存。取血后,断头取脑,立即分离皮质和海马,称重,匀浆,4℃3 000 r/min,离心10 min,收集上清液,-20℃保存;各组取一部分大鼠称重后,1%戊巴比妥钠0.3 ml/100 g麻醉,进行心脏灌注固定,断头取脑,放入4%多聚甲醛继续固定过夜,包埋切片。
1.3.4 指标检测 血浆及匀浆指标采用放免法进行测定,按照试剂盒说明书步骤进行测定。其中肾素活性的测定实际上是测定血浆中AngⅠ的产生速率,即肾素活性=(测定管AngⅠ浓度37℃-对照管AngⅠ浓度4℃)/样品温育时间。脑病理学检查:各组大鼠包埋脑组织从出现海马时开始连续切片,每个脑组织连续切片10张,间隔选取,HE染色。光镜下观察脑皮质及海马病理学变化。
1.4 统计学方法 采用SPSS17.0软件进行单因素方差分析。
2 结 果
2.1 水迷宫定位航行实验 模型组(30 d)及正常组大鼠逃避潜伏期随实验天数增加均呈现逐步减少的趋势,但模型组(30 d)大鼠减少趋势较弱;与正常组相比较,模型组(30 d)逃避潜伏期有显著差异(P<0.05)。见表1。
2.2 各组大鼠血浆、脑皮质及海马肾素活性水平 血浆:与正常组相比较,模型组(7 d)、模型组(14 d)有显著差异(P<0.05);脑皮质:与正常组相比较,模型组(30 d)有显著差异(P<0.05);脑海马:与正常组相比较,模型组(14 d)、模型组(21 d)、模型组(30 d)有显著差异(P<0.05)。随时间变化,血浆、脑皮质及海马肾素活性水平总体呈增强趋势。各组大鼠肾素活性水平相关性分析,皮质与血浆(r=0.068,P>0.05)、海马与血浆均无相关性(r=0.525,P>0.05),表明皮质和海马与血浆肾素活性水平无线性相关关系。见表2。
2.3 各组大鼠血浆、脑皮质及海马AngⅡ水平 血浆:与正常组相比较,模型组(21 d)、模型组(30 d)有显著差异(P<0.05);脑皮质:与正常组相比较,模型组(1 d)、模型组(3 d)、模型组(7 d)、模型组(14 d)、模型组(21 d)、模型组(30 d)有显著差异(P<0.05);脑海马:与正常组相比较,模型组(14 d)、模型组(21 d)、模型组(30 d)有显著差异(P<0.05)。随时间变化,血浆、脑皮质及海马AngⅡ水平总体均趋向升高。各组大鼠AngⅡ水平相关性分析,皮质与血浆(r=0.081,P>0.05),海马与血浆无相关性(r=0.663,P>0.05),表明皮质和海马与血浆AngⅡ水平无线性相关关系。见表2。
2.4 各组大鼠血浆、脑皮质及海马ALD水平 与正常组相比较,模型组(1 d)、模型组(21 d)有显著差异(P<0.05);脑皮质:与正常组相比较,模型组(1 d)、模型组(3 d)、模型组(7 d)、模型组(30 d)有显著差异(P<0.05);脑海马:与正常组相比较,模型组(14 d)有显著差异(P<0.05)。随时间变化,血浆、脑皮质及海马ALD水平总体处于高水平波动。各组大鼠ALD水平相关性分析,皮质与血浆(r=0.596,P>0.05),海马与血浆无相关性(r=-0.176,P>0.05),表明皮质和海马与血浆ALD水平无线性相关关系。见表2。
2.5 各组大鼠脑皮质HE染色 正常组大鼠皮质细胞数量及分布正常,皮质各层结构正常,蓝染较为均匀,排列较为规律。与正常组比较,各模型组大鼠皮质细胞分布出现异常,主要表现在数量减少;胞核染色加深,胞核固缩;局部可见皮质细胞有核溶解、核碎裂。随脑缺血时间梯度的推进,可见皮质缺血病理变化,皮质细胞数量有一定减少,胞核外形改变、固缩,局部可见核溶解、核碎裂。见图1。
2.6 各组大鼠脑海马HE染色 正常组大鼠海马细胞数量及分布正常,胞核蓝染,着色较为均匀,排列紧密。与正常组比较,各模型组大鼠海马细胞分布出现异常,主要表现在数量减少;胞核染色加深,可见胞核固缩,有核溶解、核碎裂。随脑缺血时间增加,可见海马细胞密度降低,胞核变形、固缩,核溶解、核碎裂。见图2。

表1 各组大鼠定位航行实验逃避潜伏期
与正常组比较:1)P<0.05,下表同
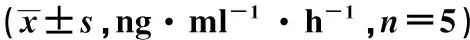
表2 各组大鼠血浆、脑皮质及海马肾素活性、AngⅡ、ALD水平水平

图1 各组大鼠脑皮质HE染色(×400)

图2 各组大鼠脑海马HE染色(×400)
3 讨 论
研究发现,AngⅡ受体拮抗药坎地沙坦与Ca2+通道阻滞剂氨氯地平的比较治疗中,坎地沙坦有着明显的神经保护作用,同时利尿剂同样能够很好地减少血容量,降低血压,消除水肿,但却未发现神经保护功能〔5〕。由此可以推测,RAAS在血管性脑缺血的过程中,有超越血压调控及水盐代谢调节的作用。RAAS在脑缺血后的损伤过程中有着重要作用,其能够进一步加重神经细胞损伤,有实验证明,AngⅡ激活转化生长因子(TGF)-β的释放,促进炎症反应〔6〕。
本研究显示,RAAS在VD大鼠脑皮质和海马中水平升高,HE染色脑皮质及海马缺血损伤加重,表明RAAS成为脑缺血损伤的活跃危险因素。且血浆、脑皮质及海马肾素活性、AngⅡ、ALD水平随缺血时间增加而总体表现增高趋势,但其在脑组织与血浆间无线性关系,光镜下病理学观察皮质及海马细胞随时间延长脑细胞损伤加重,这说明脑缺血后损伤与RAAS活性增加有一定关系,且脑组织RAAS的变化与血浆不一致,具有一定的独立性。这为预防缺血性脑损伤提供了一个较好的方向。
1 Tschanz JT,Corcoran C,Skoog I,etal.Dementia:the leading predictor of death in a defined elderly population:the Cache County Study〔J〕.Neurology,2004;62(7):1156-62.
2 Hajjar I,Hart M,Milberg W,etal.The rationale and design of the antihypertensives and vascular,endothelial and cognitive function(AVEC)trial in elderly hypertensives with early cognitive impairment:role of the renin angiotensin system inhibition〔J〕.BMC Geriatr,2009;9(1):48.
3 Ciobica A,Bild W,Hritcu L,etal.Brain renin-angiotensin system in cognitive function:pre-clinical findings and implications for prevention and treatment of dementia〔J〕.Acta Neurol Belg,2009;109(3):171-80.
4 黄新武,李 华,秦大莲,等.不同时点分别结扎左、右颈总动脉建立大鼠血管性痴呆模型〔J〕.中国老年学杂志,2010;30(14):2006-7.
5 Saavedra JM.Angiotensin Ⅱ AT(1)receptor blockers as treatments for inflammatory brain disorders〔J〕.Clin Sci(Lond),2012;123(10):567-90.
6 Lanz TV,Ding Z,Ho PP,etal.Angiotensin Ⅱ sustains brain inflammation in mice via TGF-beta〔J〕.J Clin Invest,2010;120(8):2782-94.
〔2016-04-27修回〕
(编辑 苑云杰/曹梦园)
黄新武(1972-),男,副教授,硕士,硕士生导师,主要从事脑血管疾病和神经药理相关研究。
李蓓华(1991-),女,在读硕士,主要从事神经药理相关研究。
R96
A
1005-9202(2017)14-3423-03;
10.3969/j.issn.1005-9202.2017.14.018
1 西昌市人民医院
