去除根系和凋落物对滨海沙地3种防护林土壤碳氮库的短期影响
2017-08-07林宝平何宗明郜士垒桑昌鹏温秀萍黄志群林思祖
林宝平, 何宗明,*, 郜士垒, 桑昌鹏, 温秀萍, 林 宇, 黄志群,林思祖
1 福建农林大学林学院,福州 350002 2 国家林业局杉木工程技术研究中心,福州 350002 3 福建师范大学地理科学学院,福州 350007 4 湿润亚热带山地生态国家重点实验室培育基地,福州 350007 5 福建农林大学园艺学院,福州 350002 6 福建省长乐大鹤国有防护林场, 长乐 350212
去除根系和凋落物对滨海沙地3种防护林土壤碳氮库的短期影响
林宝平1,2, 何宗明1,2,*, 郜士垒1,2, 桑昌鹏3,4, 温秀萍5, 林 宇6, 黄志群3,4,林思祖1,2
1 福建农林大学林学院,福州 350002 2 国家林业局杉木工程技术研究中心,福州 350002 3 福建师范大学地理科学学院,福州 350007 4 湿润亚热带山地生态国家重点实验室培育基地,福州 350007 5 福建农林大学园艺学院,福州 350002 6 福建省长乐大鹤国有防护林场, 长乐 350212
以福建长乐滨海沙地上3种人工林(尾巨桉、纹荚相思、木麻黄)土壤为研究对象,设置去除凋落物、去除根系和对照3种处理,观测1年后分析改变地上、地下有机质输入对沙地土壤碳氮储量、可溶性有机碳(DOC)氮(DON)和微生物量碳(MBC)氮(MBN)的影响。结果表明:不同树种人工林间土壤碳氮储量无显著差异;不同树种人工林间土壤活性碳氮组分差异显著,木麻黄土壤DOC含量显著高于纹荚相思,纹荚相思土壤DON显著高于木麻黄和尾巨桉,尾巨桉土壤MBN显著高于木麻黄和纹荚相思。改变地上地下有机质输入对滨海沙地土壤碳氮库有显著影响且这种影响随树种而异。去除凋落物后纹荚相思、木麻黄土壤碳储量分别下降38.0%、25.1%,氮储量分别下降12.9%、12.5%;去除凋落物后尾巨桉、纹荚相思、木麻黄土壤DOC分别下降37.5%、30.6%、52.9%,MBC分别下降31.0%、56.9%、29.7%,MBN分别下降50.7%、34.9%、42.2%;去除根系后尾巨桉、纹荚相思土壤MBC分别下降57.7%、15.4%。回归分析显示,滨海沙地土壤DOC、MBC与土壤碳储量呈显著正相关,土壤DOC和MBC分别能够解释土壤碳储量变化的47.7%和57.7%。研究表明:树种通过调控地上、地下输入影响可溶性有机碳氮和微生物量碳氮,进而影响土壤碳氮库。
土壤碳氮储量; 土壤可溶性有机碳氮;土壤微生物量碳氮;去除根系;去除凋落物;滨海沙地
森林是陆地生态系统最主要的碳库,储存着陆地生态系统碳储量的60%[1- 2],生态系统中碳氮的循环过程相互耦合[3],氮元素的供应量是控制生态系统碳储量的重要因素之一[4]。森林土壤碳储量约占全球土壤碳储量的39%[5],氮储量占森林生态系统氮储量的90%以上[6],其微小变化都可能改变森林生态系统的碳氮平衡。近十几年来,国内外对森林土壤碳氮库及碳氮过程的研究极为关注,在全球范围内开展了大量针对不同区域、不同森林生态系统的土壤碳氮储量、源汇功能、碳氮循环过程的研究,认为土壤亚系统在调节整个森林生态系统碳氮循环中起重要作用[7-8],森林土壤碳氮循环过程的微小变化都会对温室气体、全球气候变化产生重大影响[9]。但由于森林生态系统的复杂性、森林对环境响应的时空动态变化,导致对森林土壤碳氮储量和变率的估算存在很大的不确定性[10],因此迫切需要开展各类森林生态系统碳氮循环机制、土壤碳氮关键过程的深入研究。
滨海沙地人工林生态系统受海、陆、气的相互作用,生态环境脆弱,其碳氮循环特征与内陆森林生态系统存在很大差异,李钦禄等[11]对滨海沙地木麻黄人工林生态系统养分利用特征的研究表明,其土壤碳氮水平仅为同地带正常土壤的10%,林宇等[12]对闽东南沿海沙地厚荚相思和木麻黄人工林的研究表明,滨海沙地土壤碳氮比低于全国平均水平,土壤有机碳和全氮含量与细根生物量密切相关。对于滨海沙地人工林而言,凋落物和植物根系是该生态系统土壤养分输入的最主要来源,凋落物分解和根系周转是影响土壤碳氮循环的重要环节,但目前关于滨海沙地上树种是如何通过凋落物和根系来影响土壤碳氮库的研究还未见报道,因此急需探究凋落物和植物根系在滨海沙地人工林土壤生态系统碳氮循环中所扮演的角色。Smolander等[13]的研究结果表明,植被类型是引起土壤特性差异的关键因子,树种主要通过控制有机物质输入的数量和质量,即地上凋落物、地下根系分泌物和根系周转来影响土壤碳氮循环[14]。通过改变地上、地下有机物质的输入是探究植物和土壤碳氮循环反馈作用的有效方法[15-16]。土壤微生物量碳氮(MBC, MBN)和可溶性有机碳氮(DOC, DON)是土壤碳氮库中易变组分,对土壤的立地管理具有十分敏感的响应[17- 18],可将其作为改变碳输入方式下土壤质量和土壤碳氮储量变化的早期预测指标。为此,选取南方滨海沙地3种典型沿海防护林树种为研究对象,通过设置去除凋落物、去除根系、对照处理来探究滨海沙地不同人工林生态系统土壤碳氮储量、可溶性有机碳氮、微生物量碳氮对凋落物和根系输入的响应,以期为我国滨海沙地人工林生态系统的碳氮循环研究提供科学参考。
1 试验地概况
试验地位于福建省长乐大鹤国有防护林场(119°68′E,25°96′N),东临东海,属南亚热带海洋性季风气候,温和多雨,年平均气温19.2℃,最高气温35℃,最低气温0℃,平均湿度72.3%,年均降水量1200—1800 mm,年日照2000—2300 h。海拔高度为5—13 m,地势平坦,土壤为滨海风积沙土,土壤肥力差,保水能力低。林下天然植被稀少,林下常见零星植物有马缨丹(LantanacamaraLinn.)、白茅(ImperatacylindricalLinn.)、茅莓(RubusparvifoliusL.)、大蓟(CirsiumjaponicumFisch. ex DC.)、硕苞蔷薇(RosabracteataWendl.)等。
2 研究方法
2.1 样品采集
以滨海沙地上尾巨桉(Eucalyptusurophylla×E.grandis,Euc)、纹荚相思(AcaciaaulacocarpaBenth.,Aca)、木麻黄(CasuarinaequisetifoliaJ R Forst & G. Forst.,Cas)人工林为研究对象,各林分基本概况见表1。于2014年7月,在每种人工林内分别设置4个20 m×20 m样地,在每个样地中随机设置3个2 m×2 m小区,小区边缘离树距离0.5 m左右,按照随机区组方法在小区内设计如下3种处理,每种处理重复4次:(1)去除地上凋落物,将小区内凋落物全部去除,并在小区上方1 m处放置孔径为1 mm的尼龙网隔绝凋落物;(2)去除根系,沿小区四周挖1 m深壕沟,并在壕沟内埋入3层孔径为1 mm的尼龙网阻断周围根系向小区内生长;(3)对照,保持自然状态,不作人为干扰。
2015年7月在每个小区内随机选取3个点,采用200 cm3环刀取0—10 cm土层原状土,用于土壤容重的测定;同时,用直径3.8 cm土钻在各小区内沿对角线等距离钻取3个点,采集0—10 cm土层样品,将土样混匀后低温冷藏带回室内。在室内取部分样品用于测定含水率,其余样品过2 mm筛,将过筛的样品分成4份,一部分置于4℃冰箱恒温保存,用于土壤微生物量,一部分样品用于测定土壤pH值,一部分样品在室温下自然风干,用于测定土壤可溶性有机碳、氮含量,另一部分土样自然风干后研磨过0.149 mm筛,用于测定土壤全量碳氮。

表1 3种人工林基本概况(平均值±标准误)
2.2 土壤理化性质的测定
土壤pH值采用pH计测定,土壤全碳、全氮含量采用碳氮元素分析仪(Elemental EL MAX CNS analyzer,德国)测定,土壤碳储量(SCM, Mg/hm2)和氮储量(SNM, Mg/hm2)的计算公式为:
(1)
(2)
式中,n为土壤剖面分割的层数;SCi和SNi分别为第i层土壤全碳含量(%)、全氮含量(%);Bi和Hi分别为第i层土壤容重(g/cm3)和土层厚度(cm)。
土壤可溶性有机碳、氮的测定采用冷水浸提方法[19],用总有机碳分析仪(SHIMADZU TOC-VCPH/CPN Analyzer,日本岛津)测定DOC浓度,用连续流动分析仪(Skala San++,荷兰)测定DON浓度。
2.3 土壤微生物性质的测定
土壤微生物量碳、氮采用氯仿熏蒸法浸提,所得待测液用总有机碳分析仪(SHIMADZU TOC-VCPH/CPN Analyzer,日本岛津)(加入TN单元)测定。土壤微生物量碳计算公式为:
MBC=(CF-CNF) /KEC
(3)
式中,MBC为土壤微生物量碳含量(mg/kg),CF为熏蒸样品的有机碳含量(mg/kg),CNF为未熏蒸样品的有机碳含量(mg/kg);KEC为微生物量碳的浸提系数(0.45)。
土壤微生物量氮计算公式为:
MBN=(NF-NNF) /KEN
(4)
式中,MBN为土壤微生物量氮含量(mg/kg),NF为熏蒸样品的有机氮含量(mg/kg),NNF为未熏蒸样品的有机氮含量(mg/kg);KEN为微生物量氮的浸提系数(0.45)。
2.4 数据处理与分析
采用Excel 2003和SPSS statistics 17.0 对数据进行处理和统计分析,OriginPro 9.0绘图。采用单因素方差分析(One-way ANOVA)比较同一林分、不同处理间土壤各指标之间的差异,均值间的多重比较分析采用最小显著差异法(Least-Significant Difference, LSD)检验,采用Pearson相关系数分析土壤碳氮各指标与理化性质之间的相关性。
3 结果与分析
3.1 各人工林不同处理下土壤碳氮储量
3种人工林土壤碳氮差异不显著,土壤碳储量大小表现为纹荚相思>木麻黄>尾巨桉,氮储量大小表现为木麻黄>纹荚相思>尾巨桉。去除根系和凋落物对不同树种土壤碳氮储量和碳氮比的影响不一致,去除凋落物后纹荚相思、木麻黄的土壤碳储量与对照样地相比分别降低了38.0%、25.1%,土壤氮储量与对照样地相比分别降低了12.9%、12.5%,其中,去除凋落物对纹荚相思土壤碳储量和碳氮比的影响达显著水平(P<0.05)。去除凋落物和去除根系对尾巨桉土壤碳氮储量的影响均不显著。3种人工林土壤碳氮比在7.41—10.63之间变动,去除凋落物降低了3种人工林土壤碳氮比(图1)。
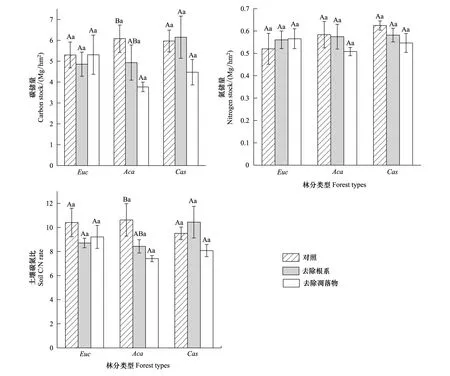
图1 3种人工林不同处理下土壤碳氮储量Fig.1 Soil carbon and nitrogen stocks under different treatments of three plantationsEuc:尾巨桉 Eucalyptus urophylla × E. grandis;Aca:纹荚相思 Acacia aulacocarpa; Cas:木麻黄 Casuarina equisetifolia;未出现相同大写字母表示同一树种不同处理间差异显著(P<0.05),未出现相同小写字母表示相同处理不同树种间差异显著(P<0.05); 横条表示标准误(N=4)
3.2 各人工林不同处理下土壤可溶性有机碳氮的变化
不同人工林土壤DOC含量差异显著(P<0.05),去除根系和凋落物后3种人工林土壤DOC分别减少了3.4%—37.4%、30.6%—52.9%。其中,去除凋落物对3个树种土壤DOC含量的影响均达到显著水平(P<0.05)。不同处理下,纹荚相思人工林土壤DOC含量大小表现为对照>去除凋落物>去根,其余2个树种均表现为对照>去除根系>去除凋落物(图2) 。
3种人工林中,纹荚相思和木麻黄土壤DON含量均显著高于尾巨桉,分别是其4.2倍、2.6倍。去除根系对纹荚相思和木麻黄土壤DON含量的影响大于去除凋落物对其的影响,其中去除根系显著提高了纹荚相思的土壤DON含量(P<0.05),2种处理对尾巨桉土壤可溶性有机氮影响不显著(图2) 。

图2 3种人工林不同处理下土壤可溶性有机碳、氮含量Fig.2 DOC and DON contents in different plantation soilsEuc:尾巨桉 Eucalyptus urophylla × E. grandis;Aca:纹荚相思 Acacia aulacocarpa; Cas:木麻黄 Casuarina equisetifolia;未出现相同大写字母表示同一树种不同处理间差异显著(P<0.05),未出现相同小写字母表示相同处理不同树种间差异显著(P<0.05);横条表示标准误(N=4)
3.3 各人工林不同处理下土壤微生物量碳氮的变化
不同人工林MBC含量差异不显著,去除凋落物和去除根系均降低了土壤MBC含量,其中,去除凋落物显著降低了3个树种土壤MBC含量,去除根系显著降低了尾巨桉和纹荚相思土壤MBC含量(图3)。
尾巨桉土壤MBN含量显著高于纹荚相思和木麻黄(P<0.05),分别是其3.81倍、2.25倍。处理对不同树种的影响不一致,去除根系和凋落物均降低尾巨桉和纹荚相思土壤MBN含量,其中,对尾巨桉的影响达到显著水平(P<0.05)。不同于尾巨桉和纹荚相思, 去除根系后木麻黄土壤MBN含量有所提高,但并不显著,去除凋落物显著降低了木麻黄土壤MBN含量(P<0.05)(图3)。方差分析表明,树种和处理对土壤DOC、DON、MBC、MBN含量均产生极显著影响(P<0.01)。
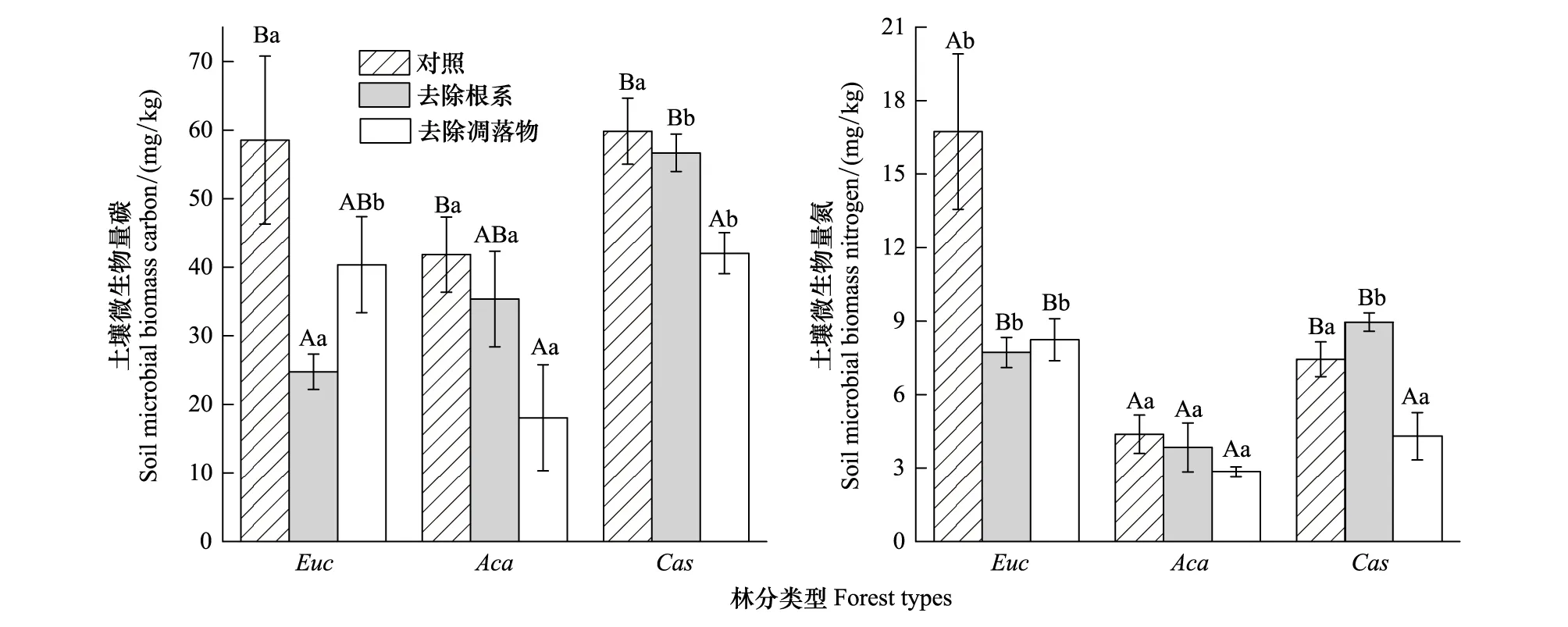
图3 3种人工林不同处理下土壤微生物量碳、氮含量Fig.3 MBC and MBN contents in different plantation soilsEuc:尾巨桉 Eucalyptus urophylla × E. grandis;Aca:纹荚相思 Acacia aulacocarpa; Cas:木麻黄 Casuarina equisetifolia;未出现相同大写字母表示同一树种不同处理间的差异显著(P<0.05),未出现相同小写字母表示同种处理不同树种之间差异显著(P<0.05);横条表示标准误(N=4)
3.4 土壤pH值、土壤碳氮和微生物量碳氮之间的关系
相关分析表明(表2),土壤pH与可溶性有机氮、微生物量氮分别呈极显著负相关(P<0.01)和极显著正相关(P<0.01),土壤DOC和MBC均与土壤碳储量呈显著正相关(P<0.05),但土壤氮储量与其余含氮素成分之间均无显著的相关性。回归分析表明(图4),土壤DOC和MBC分别能够解释土壤碳储量变化的47.7%和57.7%。

表2 土壤pH值、土壤碳氮和微生物量碳氮之间的相关性分析
CS:碳储量 Carbon stock;NS:氮储量 Nitrogen stock;DOC:可溶性有机碳 Dissolved organic carbon;DON:可溶性有机氮 Dissolved organic nitrogen;MBC:微生物量碳Microbial biomass carbon;MBN:微生物量氮 Microbial biomass nitrogen;*在0.05水平(双侧)上显著相关

图4 土壤碳储量与土壤可溶性有机碳和微生物量碳的关系Fig.4 Relationships between soil carbon stock and soil dissolved organic carbon and microbial biomass carbon
4 讨论
4.1 树种和处理对滨海沙地土壤碳氮储量的影响
本研究中,滨海沙地土壤碳氮储量范围分别为5.30—6.08 Mg/hm2和0.52—0.62 Mg/hm2,与荣俊冬等[20]、李钦禄等[11]、莫小香等[21]对我国南部沿海防护林区土壤的研究结果一致,但远低于内陆森林土壤碳氮储量(山地红壤[22-23]、褐土[24]、山地棕壤[25])。这一差异主要由滨海沙地土壤的性质决定,沙地土壤中物理性沙粒占92.1%—93.3%,难以形成团粒结构[26],沙地疏松,渗透性大,保水保肥能力弱,土壤中的养分容易被淋溶而流失,造成有机质含量低。
3种人工林均是在湿地松人工林采伐迹地上营造,土壤的立地条件、种植历史、气候、林龄等因子均一致,不同树种间土壤特性的差异主要由树种引起[13]。树种对土壤的影响主要通过地上凋落物的数量和质量,以及对根呼吸和根分泌物量的控制来实现[27],本研究中,树种间土壤碳氮储量差异不显著,试验地已有研究表明,细根生物量是影响土壤有机碳和全氮的主要因素[12],对试验小区做去根系处理时亦发现3种人工林根系生物量差异不明显,树种间植物根系生物量差异不明显可能是导致土壤碳氮储量差异不显著的原因,但对根系生物量的估计并未基于试验量化的基础上,因此不同树种土壤碳氮储量差异不显著的具体原因还有待进一步探究。国内外关于改变碳输入方式对土壤性质的影响方面的研究有很多,所得出的土壤碳氮对去除凋落物和去除根系的响应结果不一[28-31]。Park和Matzner[28]在德国Bavaria森林研究结果表明,去除凋落物2年后,土壤弱分解有机层基本消失,半分解+高分解有机层土壤碳、氮储量分别降低了8.9%和13.9%;Wang等[30]对中国南方亚热带森林研究发现,去除根系和凋落物1年后,土壤有机碳分别降低了8.5%和0.5%,全氮分别降低9.2%和3.7%;Wan等[31]对亚热带杉木(Cunninghamialanceolata(Lamb.) Hook.)和米老排(MytilarialaosensisLec.)的研究结果表明去除杉木和米老排的凋落物和去除其根系10个月后,土壤全量碳氮均有所上升。可以看出,改变碳输入方式对土壤碳氮储量的影响因不同类型森林生态系统而异,树种、处理的时间、土壤原有状态等都会影响处理后的结果。本研究中,改变碳输入方式1年后3种人工林土壤碳氮储量的变化远高于上述研究成果,表明在滨海沙地人工林生态系统中,凋落物和根系作为土壤有机质的主要来源,影响土壤碳氮的积累或流失,对维持土壤碳氮库具有重要作用。同时,去除根系和凋落物对土壤碳氮储量的影响因树种不同而存在差异,本研究中,土壤原有状态差异不显著,处理时间相同,不同树种养分周转速率的差异可能导致3种人工林土壤碳氮储量对不同碳输入方式响应不一致,供试树种凋落物分解速率表现为纹荚相思>尾巨桉>木麻黄[32-34],凋落物分解速率的差异可能是去除凋落物后纹荚相思土壤碳储量显著降低的原因。
4.2 树种和处理对滨海沙地土壤可溶性有机质的影响
土壤碳库周转相对缓慢,改变碳输入方式对生态系统的影响在短时间内变化不明显,土壤可溶性有机质作为土壤碳氮库中的活性组分,对土壤管理措施的响应较为敏感,可以用来观测不同碳输入方式对土壤碳氮库的影响[18],回归分析也表明土壤可溶性有机碳与碳储量之间具有显著的相关性。3种人工林土壤DOC和DON均存在显著差异,木麻黄DOC含量显著高于尾巨桉和纹荚相思,一般认为,新近凋落物和腐殖质土壤是DOC的主要来源[14],木麻黄人工林年凋落物量是尾巨桉和纹荚相思的1.7倍、2.0倍,因此可认为树种对土壤DOC的影响主要通过对凋落物量的调控来实现。纹荚相思和木麻黄土壤DON含量显著高于尾巨桉,纹荚相思和木麻黄均属于固氮树种,根部大量根瘤菌可以固定空气中游离态氮,增加土壤氮素含量,这可能是其土壤DON含量高于尾巨桉的原因。
去除根系和凋落物显著影响土壤可溶性有机质含量。去除凋落物后尾巨桉、纹荚相思、木麻黄土壤DOC分别下降37.5%、30.6%、52.9%,其降幅远大于其他森林生态系统在相同试验处理下的结果[35-37],说明滨海沙地人工林生态系统土壤易变性有机碳对去除凋落物的响应十分敏感,凋落物对土壤有机碳库的归还是维持滨海沙地人工林生态系统土壤碳氮循环的重要环节。去除根系提高了3种人工林土壤DON含量,其中,对纹荚相思的影响达显著水平,去除凋落物对土壤DON含量影响不显著。这与章宪等[38]、Lajtha等[36]的研究结果相反。原因可能是由于凋落物分解过程中,微生物必须从外界获取氮源以满足自身分解的需要,消耗了土壤中氮素成分[39];去除根系后,土壤中被根系吸收的有效态氮减少可能是造成土壤DON含量上升的原因。同时,Paavolainen等[40]报道了欧洲云杉(Piceaabies(Linn.) Karst.)单萜物质对土壤硝化作用产生了抑制作用,改变了土壤氮循环过程,根系分泌化感物质对土壤氮循环的抑制也可能是导致该现象的原因。图2中明显看出树木根系对土壤DON含量的影响大于凋落物对其的影响,Yano等[41]发现根系所产生的DON是其他枯落物类型的10倍,他认为根系可能是森林DON生产的主要贡献者,本研究结果在一定程度上证明了其观点。
4.3 树种和处理对滨海沙地土壤微生物量碳、氮的影响
土壤微生物是土壤养分转化与循环的动力[42],微生物是土壤稳定态养分转变有效养分的催化剂,微生物量的微小变化都会影响土壤碳氮库的有效性。3种人工林土壤MBN差异显著,尾巨桉和木麻黄MBC含量高于纹荚相思。Garcia-Oliva等[43]研究发现,凋落物淋溶物质及其分解产物中含有的易变性有机碳能够为微生物活动提供大量碳源,从而增加微生物量。此外,林木根系及其分泌物诱导形成的微生物区系不同也可能造成土壤微生物量的差异[44],如Phillips等[45]发现由于植物根系释放分泌物到土壤中,使得根际周围土壤微生物相对活跃;李娇等[46]研究结果表明,根际土壤微生物生物量具有正根际效应,土壤微生物的积累有赖于根系分泌物的释放。本研究发现,纹荚相思和木麻黄土壤微生物量碳氮比值(6.3—11.3)显著高于尾巨桉土壤微生物量碳氮比值(3.3—4.8),有研究表明,土壤微生物量碳氮比值能够反映土壤中微生物的种类和区系,细菌、真菌、放线菌碳氮比分别为5∶1、10∶1、6∶1[47],同时,本研究区域土壤pH值呈酸性,不利于放线菌的活动,而真菌适宜在酸性(pH值:3—6)条件下生活,说明尾巨桉土壤微生物以细菌为主,纹荚相思和木麻黄以真菌为主,放线菌较少。因此,树种通过凋落物分解淋溶的产物和根系分泌物影响土壤的微生物量和微生物种类,从而影响土壤碳氮库的有效性。
去除凋落物和根系对土壤微生物量碳氮的影响因树种而异,两种处理显著降低了土壤MBC、MBN含量,且去除凋落物较去除根系效果更加显著。许多研究表明,切断有机质的输入途径会减少土壤MBC、MBN含量。例如,Li等[48]对热带次生林和加勒比松(PinuscaribaeaMorelet)人工林的研究发现,去除根系7年后,土壤MBC分别降低59%和31%;Sayer等[49]研究发现,去除凋落物使中美洲低地热带森林土壤0—100 cm土层的微生物量碳、氮含量降低。同时,也有研究表明去除根系和凋落物对土壤微生物性质影响并不显著[28,39],万晓华等[50]研究结果表明,去除凋落物、去除凋落物+根系后杉木林土壤MBC、MBN具有明显增加的趋势,可能与减少了杉木针叶分解过程中抑制微生物生长的毒性物质有关。本研究中改变碳输入处理时间仅1a,但土壤MBC、MBN降幅与Li等[48]做相同处理7年后的结果相近,远高于万晓华等[51]对亚热带杉木和米老排人工林去除凋落物和根系后1a的结果,说明滨海沙地人工土壤微生物量对碳输入的响应较内陆森林生态系统更为敏感,营林过程中对凋落物和根系的扰动将会剧烈影响土壤微生物量,同时也反映了滨海沙地人工林生态系统的脆弱性。
此外,控制有机质输入对土壤可溶性有机质和微生物特性的影响因处理时间长短而异[16]。不同森林生态系统中,碳输入方式对土壤碳氮库的影响存在差异,土壤可溶性有机质和微生物量碳氮含量并未在短期内揭示土壤对不同碳输入方式的统一响应,因此有必要进行不同碳源输入对土壤碳氮库和碳氮循环影响的长期研究,这也是森林生态系统碳氮循环研究的薄弱环节[36,52]。
5 结论
(1)不同树种人工林土壤碳氮储量无显著差异,但不同树种人工林土壤活性碳氮组分差异显著。凋落物和根系处理对滨海沙地人工林土壤碳氮库具有显著影响且这种影响随树种而异,去除凋落物显著降低了尾巨桉土壤DOC、MBN,纹荚相思土壤碳储量、DOC、MBC、MBN和木麻黄土壤DOC;去除根系显著降低尾巨桉土壤MBC、MBN,纹荚相思土壤DOC和木麻黄土壤MBN。
(2)滨海沙地人工林土壤碳氮库对碳输入方式的响应十分敏感,凋落物和植物根系是土壤碳氮周转的关键,在沿海防护林经营过程中应加强对凋落物的管理,实现凋落物对土壤养分的自然归还,保持滨海沙地人工林碳氮库的良性循环。
[1] Ceulemans R, Janssens I A, Jach M E. Effects of CO2enrichment on trees and forests: lessons to be learned in view of future ecosystem studies. Annals of Botany, 1999, 84(5): 577- 590.
[2] Reich P B, Hobbie S E, Lee T, Ellsworth D S, West J B, David T, Tilman D, Knops J M H, Naeem S, Trost J. Nitrogen limitation constrains sustainability of ecosystem response to CO2. Nature, 2006, 440(7086): 922- 925.
[3] Schipper L A, Percival H J, Sparling G P. An approach for estimating when soils will reach maximum nitrogen storage. Soil Use and Management, 2004, 20(3): 281- 286.
[4] 王绍强, 于贵瑞. 生态系统碳氮磷元素的生态化学计量学特征. 生态学报, 2008, 28(8): 3937- 3947.
[5] IPCC. Land Use, Land-Use Change and Forest. IPCC Special Report. Cambridge: Cambridge University Press, 2000.
[6] 王敬, 李贤伟, 荣丽, 李德会, 谢娟. 森林土壤氮贮量及氮素输入过程研究进展. 世界林业研究, 2008, 21(1): 14- 19.
[7] 徐小锋, 田汉勤, 万师强. 气候变暖对陆地生态系统碳循环的影响. 植物生态学报, 2007, 31(2): 175- 188.
[8] 方运霆, 莫江明, Gundersen P, 周国逸, 李德军. 森林土壤氮素转换及其对氮沉降的响应. 生态学报, 2004, 24(7): 1523- 1531.
[9] Burton A J, Pregitzer K S. Field measurements of root respiration indicate little to no seasonal temperature acclimation for sugar maple and red pine. Tree Physiology, 2003, 23(4): 273- 280.
[10] 方精云, 王娓. 作为地下过程的土壤呼吸: 我们理解了多少? 植物生态学报, 2007, 31(3): 345- 347.
[11] 李钦禄, 莫其锋, 王法明, 李应文, 徐馨, 邹碧, 李晓波, 陈瑶, 李志安. 华南热带沿海不同林龄木麻黄人工林养分利用特征. 应用与环境生物学报, 2015, 21(1): 139- 146.
[12] 林宇, 何宗明, 丁国昌, 林思祖, 曹光球, 黄秀勇, 张勇. 闽东南沿海2种防护林土壤有机碳和全氮垂直分布. 东北林业大学学报, 2015, 43(9): 67- 71.
[13] Smolander A, Kitunen V. Soil microbial activities and characteristics of dissolved organic C and N in relation to tree species. Soil Biology and Biochemistry, 2002, 34(5): 651- 660.
[14] Kalbitz K, Meyer A, Yang R, Gerstberger P. Response of dissolved organic matter in the forest floor to long-term manipulation of litter and throughfall inputs. Biogeochemistry, 2007, 86(3): 301- 318.
[15] 王清奎. 碳输入方式对森林土壤碳库和碳循环的影响研究进展. 应用生态学报, 2011, 22(4): 1075- 1081.
[16] 陈玉平, 吴佳斌, 张曼, 杨智杰, 陈光水. 枯落物处理对森林土壤碳氮转化过程影响研究综述. 亚热带资源与环境学报, 2012, 7(2): 84- 94.
[17] Burton J, Chen C R, Xu Z H, Ghadiri H. Soil microbial biomass, activity and community composition in adjacent native and plantation forests of subtropical Australia. Journal of Soils and Sediments, 2010, 10(7): 1267- 1277.
[18] Rovira P, Jorba M, Romanyà J. Active and passive organic matter fractions in Mediterranean forest soils. Biology and Fertility of Soils, 2010, 46(4): 355- 369.
[19] Curtin D, Wright C E, Beare M H, McCallum F M. Hot water-extractable nitrogen as an indicator of soil nitrogen availability. Soil Science Society of America Journal, 2006, 70(5): 1512- 1521.
[20] 荣俊冬, 郝瑞, 祝杰伟, 陈羡德, 陈礼光, 吴震, 郑郁善. 沿海沙地竹林细根养分含量及其季节动态. 福建林学院学报, 2007, 27(4): 313- 317.
[21] 莫小香, 叶功富, 游水生, 何玉霜, 危伟, 黄买. 海岸退化沙地不同植被恢复模式的土壤微生物量及其与土壤养分的关系. 福建林学院学报, 2013, 33(2): 146- 150.
[22] 余再鹏, 万晓华, 胡振宏, 王民煌, 刘瑞强, 郑璐嘉, 何宗明, 黄志群. 亚热带杉木和米老排人工林土壤呼吸对凋落物去除和交换的响应. 生态学报, 2014, 34(10): 2529- 2538.
[23] 王卫霞, 史作民, 罗达, 刘世荣, 卢立华, 明安刚, 于浩龙. 我国南亚热带几种人工林生态系统碳氮储量. 生态学报, 2013, 33(3): 925- 933.
[24] 刘冰燕, 陈云明, 曹扬, 吴旭. 秦岭南坡东段油松人工林生态系统碳、氮储量及其分配格局. 应用生态学报, 2015, 26(3): 643- 652.
[25] 赵海燕, 徐福利, 王渭玲, 王伟东, 陈钦程, 赵亚芳, 马亚娟. 秦岭地区华北落叶松人工林地土壤养分和酶活性变化. 生态学报, 2015, 35(4): 1086- 1094.
[26] 黄羌维, 陈由强. 滨海风沙地龙眼园土壤特性的研究. 生态学报, 1994, 14(2): 180- 187.
[27] Huang Z Q, Davis M R, Condron L M, Clinton P W. Soil carbon pools, plant biomarkers and mean carbon residence time after afforestation of grassland with three tree species. Soil Biology and Biochemistry, 2011, 43(6): 1341- 1349.
[28] Park J H, Matzner E. Controls on the release of dissolved organic carbon and nitrogen from a deciduous forest floor investigated by manipulations of aboveground litter inputs and water flux. Biogeochemistry, 2003, 66(3): 265- 286.
[29] 刘星, 王娜, 赵博, 张青, 赵秀海. 改变碳输入对太岳山油松林土壤酶活性的影响. 应用与环境生物学报, 2014, 20(4): 655- 661.
[30] Wang Q K, He T X, Wang S L, Liu L. Carbon input manipulation affects soil respiration and microbial community composition in a subtropical coniferous forest. Agricultural and Forest Meteorology, 2013, 178- 179(17): 152- 160.
[31] Wan X H, Huang Z Q, He Z M, Yu Z P, Wang M H, Davis M R, Yang Y S. Soil C:N ratio is the major determinant of soil microbial community structure in subtropical coniferous and broadleaf forest plantations. Plant and Soil, 2015, 387(1): 103- 116.
[32] 何斌, 秦武明, 余浩光, 刘运华, 覃林, 覃永华. 不同年龄阶段马占相思(Acaciamangium)人工林营养元素的生物循环. 生态学报, 2007, 27(12): 5158- 5167.
[33] 刘文飞, 樊后保, 高春芬, 黄荣珍, 苏兵强. 连续年龄序列桉树人工林凋落物量及养分通量. 生态学杂志, 2009, 28(10): 1928- 1934.
[34] 谭芳林. 木麻黄防护林生态系统凋落物及养分释放研究. 林业科学, 2003, 39(S1): 21- 26.
[35] Kalbitz K, Solinger S, Park J H, Michalzik B, Matzner E. Controls on the dynamics of dissolved organic matter in soils: a review. Soil Science, 2000, 165(4): 277- 304.
[36] Nadelhoffer K J, Boone R D, Bowden R D, Canary J D, Kaye J, Micks P, Ricca A, Aitkenhead J A, Lajtha K, McDowell W H. The DIRT experiment: litter and root influences on forest soil organic matter stocks and function//Foster D, Aber J. Forests in Time: The Environmental Consequences of 1 000 Years of Change in New England. New Haven: Yale University Press, 2004: 300- 315.
[37] Lajtha K, Crow S E, Yano Y, Kaushal S S, Sulzman E, Sollins P, Spears J D H. Detrital controls on soil solution N and dissolved organic matter in soils: a field experiment. Biogeochemistry, 2005, 76(2): 261- 281.
[38] 章宪, 范跃新, 罗茜, 谢锦升, 孙杰. 凋落物和根系处理对杉木人工林土壤氮素的影响. 亚热带资源与环境学报, 2014, 9(2): 39- 44.
[39] Taylor B R, Parsons W F J, Parkinson D. Decomposition ofPopulustremuloidesleaf litter accelerated by addition ofAlnuscrispalitter. Canadian Journal of Forest Research, 1989, 19(5): 674- 679.
[40] Paavolainen L, Kitunen V, Smolander A. Inhibition of nitrification in forest soil by monoterpenes. Plant and Soil, 1998, 205(2): 147- 154.
[41] Yano Y, Lajtha K, Sollins P, Caldwell B A. Chemistry and dynamics of dissolved organic matter in a temperate coniferous forest on Andic soils: effects of litter quality. Ecosystems, 2005, 8(3): 286- 300.
[42] 叶协锋, 张友杰, 鲁喜梅, 魏跃伟, 李琰琰, 刘国顺. 土壤微生物与土壤营养关系研究进展. 土壤通报, 2010, 41(1): 237- 241.
[43] Garcia-Oliva F, Sveshtarova B, Oliva M. Seasonal effects on soil organic carbon dynamics in a tropical deciduous forest ecosystem in western Mexico. Journal of Tropical Ecology, 2003, 19(2): 179- 188.
[44] 曹成有, 陈家模, 卲建飞, 崔振波. 科尔沁沙地四种固沙植物群落土壤微生物生物量及酶活性的季节动态. 生态学杂志, 2011, 30(2): 227- 233.
[45] Phillips R P, Fahey T J. The influence of soil fertility on rhizosphere effects in Northern Hardwood forest soils. Soil Science Society of America Journal, 2008, 72(2): 453- 461.
[46] 李娇, 蒋先敏, 尹华军, 尹春英, 魏宇航, 刘庆. 不同林龄云杉人工林的根系分泌物与土壤微生物. 应用生态学报, 2014, 25(2): 325- 332.
[47] Cleveland C C, Liptzin D. C:N:P stoichiometry in soil: is there a “Redfield ratio” for the microbial biomass? Biogeochemistry, 2007, 85(3): 235- 252.
[48] Li Y Q, Xu M, Sun O J, Cui W C. Effects of root and litter exclusion on soil CO2efflux and microbial biomass in wet tropical forests. Soil Biology and Biochemistry, 2004, 36(12): 2111- 2114.
[49] Sayer E J, Powers J S, Tanner E V J. Increased litterfall in tropical forests boosts the transfer of soil CO2to the atmosphere. PLoS One, 2007, 2(12): e1299.
[50] 万晓华, 黄志群, 何宗明, 胡振宏, 余再鹏, 王民煌, 杨玉盛, 范少辉. 杉木采伐迹地造林树种转变对土壤可溶性有机质的影响. 应用生态学报, 2014, 25(1): 12- 18.
[51] 万晓华, 黄志群, 何宗明, 余再鹏, 王民煌, 刘瑞强, 郑璐嘉. 改变碳输入对亚热带人工林土壤微生物生物量和群落组成的影响. 生态学报, 2016, 36(12): 3582- 3590.
[52] Crow S E, Lajtha K, Filley T R, Swanston C W, Bowden R D, Caldwell B A. Sources of plant-derived carbon and stability of organic matter in soil: implications for global change. Global Change Biology, 2009, 15(8): 2003- 2019.
Short-term effects of root exclusion and litter removal on sandy soil carbon and nitrogen pools in three coastal plantation forests
LIN Baoping1,2, HE Zongming1,2,*, GAO Shilei1,2, SANG Changpeng3,4, WEN Xiuping5, LIN Yu6, HUANG Zhiqun3,4, LIN Sizu1,2
1ForestryCollegeofFujianAgricultureandForestryUniversity,Fuzhou350002,China2ChineseFirEngineeringTechnologyResearchCenter,StateForestryAdministration,Fuzhou350002,China3CollegeofGeographicalScience,FujianNormalUniversity,Fuzhou350007,China4CultivationBaseofStateKeyLaboratoryofHumidSubtropicalMountainEcology,Fuzhou350007,China5CollegeofHorticulture,FujianAgricultureandForestryUniversity,Fuzhou350002,China6ChangleDaheState-OwnedProtectionForestFarmofFujianProvince,Changle350212,China
The aim of this study was to investigate the effects of manipulated organic matter input (root exclusion, litter removal, and control) on the soil carbon (C) and nitrogen (N) pools in three plantation forests growing on the coastal sandy soil in Changle City, Fujian Province, China. Three plantations includedEucalyptusurophylla×E.grandishybrid,Acaciaaulacocarpa, andCasuarinaequisetifolia. The soil C and N stocks, dissolved organic carbon (DOC) and nitrogen (DON) concentrations, and microbial biomass carbon (MBC) and nitrogen (MBN) concentrations were measured after one year of organic matter treatment. The results showed no significant difference in the soil C and N stocks among the three plantations. However, significant difference was observed in the labile carbon and nitrogen components,C.equisetifoliasoil showing significantly higher DOC thanA.aulacocarpasoil,A.aulacocarpasoil showing significantly higher DON thanE.urophylla×E.grandishybrid andC.equisetifoliasoil, andE.urophylla×E.grandishybrid soil showing significantly higher MBN thanA.aulacocarpaandC.equisetifoliasoil. Changes in the above- and below-ground C input significantly affected the soil C and N pools, depending on the tree species. Litter removal decreased soil C stocks ofA.aulacocarpaandC.equisetifoliaby 38.0 and 25.1%, respectively, and the soil N stocks ofA.aulacocarpaandC.equisetifoliaby 12.9 and 12.5%, respectively. Furthermore, litter removal significantly decreased the soil DOC by 37.5, 30.6, and 52.9; MBC by 31.0, 56.9, and 29.7; and MBN by 50.7, 34.9, 42.2 ofE.urophylla×E.grandishybrids,A.aulacocarpa, andC.equisetifolia, respectively. However, the root exclusion decreased only the soil MBC ofE.urophylla×E.grandishybrids andA.aulacocarpaby 57.7 and 15.4%, respectively. Regression analysis indicated that the soil DOC and MBC were positively correlated with the soil C stocks, while accounting for 47.7% and 57.7% of the variations in soil C stocks. In conclusion, our study suggested that the tree species regulate their soil C and N pools through the effects of the above- and below-ground inputs on soil DOC, DON, MBC and MBN.
soil carbon and nitrogen stocks; soil dissolved organic carbon and nitrogen; soil microbial biomass carbon and nitrogen; root exclusion; litter removal; sandy coastal area
国家自然科学基金项目(31570604, 41371269);福建省林业科技项目(闽林科[2012]3号);福建农林大学部级创新平台资助
2016- 03- 13;
2017- 02- 17
10.5846/stxb201603130449
*通讯作者Corresponding author.E-mail: hezm2@126.com
林宝平, 何宗明, 郜士垒, 桑昌鹏, 温秀萍, 林宇, 黄志群,林思祖.去除根系和凋落物对滨海沙地3种防护林土壤碳氮库的短期影响.生态学报,2017,37(12):4061- 4071.
Lin B P, He Z M, Gao S L, Sang C P, Wen X P, Lin Y, Huang Z Q, Lin S Z.Short-term effects of root exclusion and litter removal on sandy soil carbon and nitrogen pools in three coastal plantation forests.Acta Ecologica Sinica,2017,37(12):4061- 4071.
