海带渣添加比例及其酶解产物对凡纳滨对虾生长、消化和非特异性免疫力的影响
2017-08-07彭素晓常志强
彭素晓 常志强 马 骊 李 健*
(1.上海海洋大学水产与生命学院,上海201306;2.农业部海洋渔业资源可持续利用重点开放实验室,中国水产科学研究院黄海水产研究所,青岛266071)
海带渣添加比例及其酶解产物对凡纳滨对虾生长、消化和非特异性免疫力的影响
彭素晓1,2常志强2马 骊1,2李 健2*
(1.上海海洋大学水产与生命学院,上海201306;2.农业部海洋渔业资源可持续利用重点开放实验室,中国水产科学研究院黄海水产研究所,青岛266071)
为探究海带渣添加比例及其酶解产物对凡纳滨对虾生长、消化和非特异性免疫力的影响,本试验进行了如下2个试验:海带渣适宜添加比例试验和海带渣酶解产物应用效果试验。海带渣适宜添加比例试验(试验1):采用单因素试验设计,配制海带渣添加比例分别为0(对照组)、0.5%、1.0%、2.0%、3.0%、5.0%的6种饲料(分别记为D1~D6组),投喂初始体重为(1.00±0.10) g的凡纳滨对虾49 d后,对对虾的生长性能指标以及胃消化酶、血清非特异性免疫酶的活性进行测定。每组3个重复,每个重复35尾对虾。海带渣酶解产物应用效果试验(试验2):在试验1得出海带渣适宜添加比例为3.0%的基础上,以试验1中添加3.0%海带渣饲料作为海带渣对照组(A组),再分别用β-葡聚糖酶酶解海带渣(B组)和蛋白酶酶解海带渣(C组)等量替代A组饲料中的海带渣,投喂初始体重为(1.00±0.1) g的凡纳滨对虾56 d,试验结束后测定对虾的生长性能指标以及胃消化酶、血清非特异性免疫酶的活性。每组3个重复,每个重复35尾对虾。试验1结果显示:D4、D5组对虾的特定生长率、增重率显著高于对照组(P<0.05),D5组对虾的饲料系数显著低于对照组(P<0.05);随着海带渣添加比例的增加,胃中胃蛋白酶及血清中酚氧化酶、超氧化物歧化酶的活性呈现先升高后下降的趋势,上述3种酶的活性均以D5组最高,且D5组血清中酚氧化酶、超氧化物歧化酶的活性显著高于对照组(P<0.05)。试验2结果显示:与未经酶解的海带渣相比,海带渣经β-葡聚糖酶酶解后可显著提高对虾的增重率和特定生长率(P<0.05),并能显著降低饲料系数(P<0.05),海带渣经蛋白酶酶解后可显著提高对虾的成活率(P<0.05);B和C组对虾的胃中纤维素酶活性较A组显著降低(P<0.05);B和C组血清中酸性磷酸酶、酚氧化物酶活性以及C组血清中超氧化物歧化酶活性显著高于A组(P<0.05)。由此得出,凡纳滨对虾饲料中海带渣的适宜添加比例为3.0%。海带渣经β-葡聚糖酶酶解后可促进凡纳滨对虾生长,提高其非特异性免疫力;而海带渣经蛋白酶酶解后可提高凡纳滨的非特异性免疫力,对其生长无促进作用。
海带渣;酶解产物;南美白对虾;生长性能;消化酶;非特异性免疫酶
凡纳滨对虾(Litopenaeusvannamei),又称南美白对虾,具有生长速度快、抗病能力强、抗逆性强等特点,是目前世界上养殖产量最高的三大虾类之一,养殖经济效益显著。在凡纳滨对虾的养殖生产中,营养全面的饲料是对虾健康养殖的基础[1],合适的原料是保障饲料营养全面的关键,但是目前饲料原料的种类和资源有限,所以开发适宜的饲料原料具有重要意义。
海带(LaminariajaponicaAresch)属于大型褐藻类植物,是我国主要海藻养殖品种之一,其生产环境优越,可以富集多种维生素、微量元素及促进生长的活性因子,营养丰富且动物吸收利用率高[2]。目前,我国海带加工已逐步形成了以褐藻胶、甘露醇、碘为主要产品的工业体系,但是海带的工业利用率仅为30%左右,剩余的海带渣仍有大量成分,如蛋白质、纤维素和矿物质等,尚未得到充分开发利用,不但造成大量海带自然生物资源的浪费,而且在生产过程中会有大量富含有机质和营养盐的废渣排放,成为水体富营养化和赤潮诱发的潜在化学因素,给海洋渔业经济和生态带来影响和破坏[3]。近年来有关海藻类产品的应用研究很多,主要集中在家禽[4]、猪[5]、对虾[6]上,研究表明饲料中添加海藻或其提取物对养殖动物有一定的积极作用[7-10]。从20世纪50年代用海带粉作饲料添加剂研究开发至今,其研究和应用一直为人们所看好,目前海带渣在畜禽和水产饲料中直接添加应用的较广泛,但在对虾饲料生产中添加海带渣酶解产物的还很少。因此,本试验通过配制添加不同比例海带渣的饲料,研究对虾饲料中海带渣的试验添加比例,并得出适宜添加比例的基础上对海带渣采用不同酶进行酶解处理,研究海带渣酶解产物的应用效果,以期为海带渣的高值化利用提供参考及理论依据。
1 材料与方法
1.1 试验材料
试验用凡纳滨对虾[体重(1.00±0.10) g]由
潍坊新大地水产养殖有限公司提供;海带渣为商业提胶剩余产品,来自山东明月海藻集团有限公司;饲料原料购自青岛七好饲料有限公司;饲料级β-葡聚糖酶购自和氏璧生物技术有限公司,为粉状制剂,活性为50 000 U/g;饲料级蛋白酶购自和氏璧生物技术有限公司,为粉状制剂,活性为20 000 U/g。
1.2 海带渣酶解方法
针对海带渣中含量较高的蛋白质和纤维素(海带渣的营养水平见表1),选择能对这2种物质作用的2类酶进行初步筛选,分别以酶解液中还原糖和氨基酸浓度作为评价指标,最终选定酶解效果较好的β-葡聚糖酶和蛋白酶对海带渣进行酶解处理,酶解处理方式参考王昌义等[11]的研究方法,具体方法如下:
β-葡聚糖酶酶解海带渣(GT):按海带渣质量的0.1%添加β-葡聚糖酶,固液比为1∶20,充分搅拌后,50 ℃酶解处理24 h,将酶解后固液产物全都作为饲料添加剂;另用3,5-二硝基水杨酸法对酶解液中小分子还原糖的浓度进行测定,测得海带渣经β-葡聚糖酶酶解后生成还原糖的效率为8.98%。β-葡聚糖酶酶解海带渣的营养水平见表1。
蛋白酶酶解海带渣(PT):按海带渣质量的0.2%添加蛋白酶,固液比为1∶20,充分搅拌后,45 ℃酶解处理24 h,将酶解后固液产物全都作为饲料添加剂;另用茚三酮显色法对酶解液中氨基酸的浓度进行测定,测得海带渣经蛋白酶酶解后生成氨基酸的效率为11.3%。蛋白酶酶解海带渣的营养水平见表1。

表1 海带渣及其酶解产物的营养水平(干物质基础)Table 1 Nutrient levels of kelp meal and its enzymatic hydrolysates (DM basis) %
1.3 试验方法
养殖试验在中国水产科学研究院黄海水产研究所水生实验室进行,分为海带渣适宜添加比例试验和海带渣酶解产物应用效果试验2个试验。
1.3.1 试验1:海带渣适宜添加比例试验
以鱼粉、豆粕、高筋粉、虾糠、维生素预混料、矿物质预混料等为原料配制基础饲料(D1组,作为对照组),然后再配制分别以0.5%(D2组)、1.0%(D3组)、2.0%(D4组)、3.0%(D5组)和5.0%(D6组)的海带渣等量替代基础饲料中高筋粉的试验饲料。饲料组成及营养水平见表2。将原料粉碎过80目筛、混合,经绞肉机(恒联TJ12-H)制成直径为2 mm的颗粒饲料,经60 ℃烘干至恒重,-20 ℃保存备用。
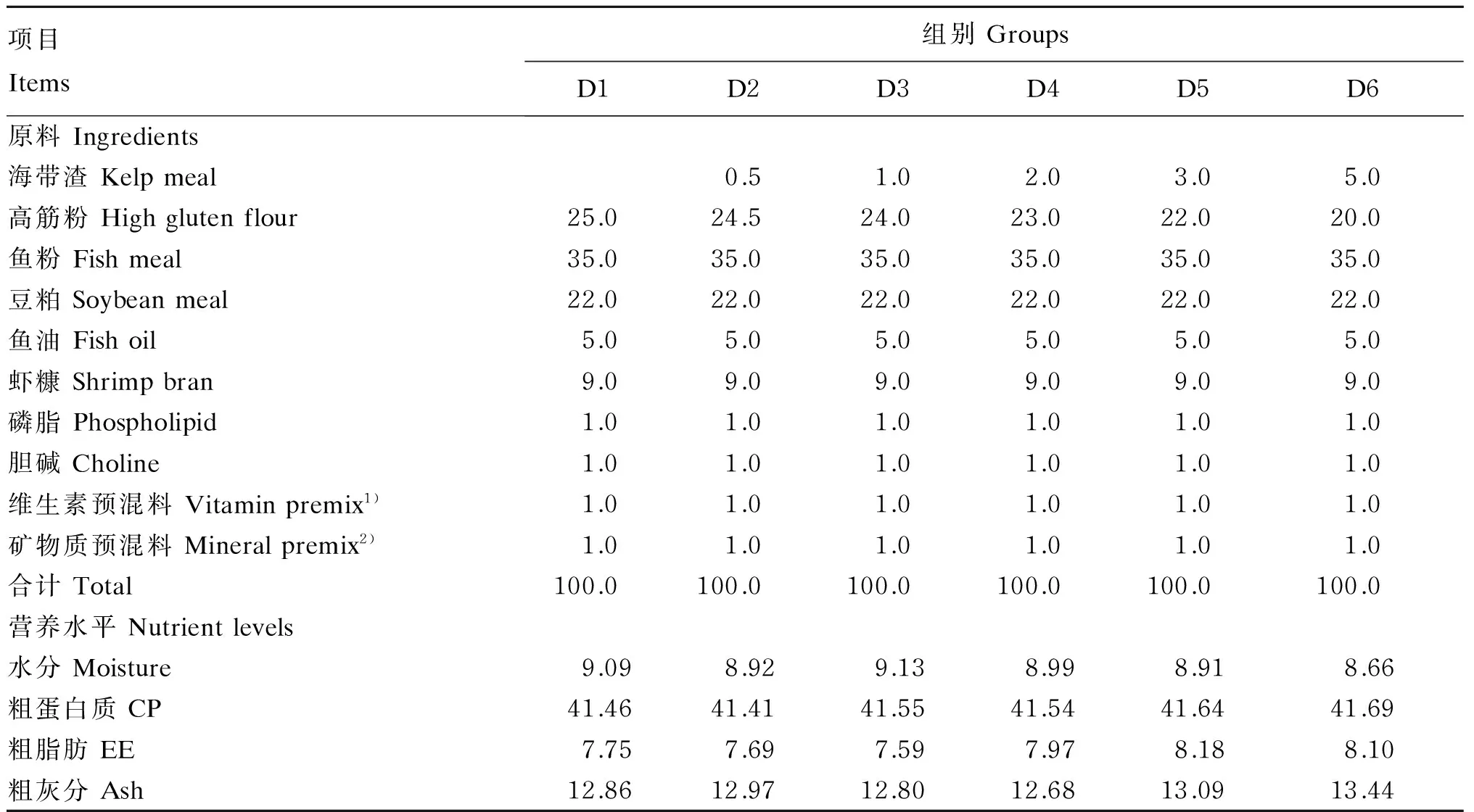
表2 试验1中所用饲料组成及营养水平(干物质基础)Table 2 Composition and nutrient levels of diets used in experiment one (DM basis) %
1)维生素预混料为每千克饲料提供Vitamin premix provided the following per kg of diets:VA 32 mg,VB120.1 mg,VD 5 mg,VE 120 mg,VK 10 mg,硫胺素 thiamine 25 mg,核黄素 riboflavin 45 mg,盐酸吡哆醇 pyridoxine hydrochloride 20 mg,肌醇 inositol 800 mg,泛酸 pantothenic acid 60 mg,烟酸 nicotinic acid 200 mg,叶酸 folic acid 20 mg,生物素 biotin 1.20 mg,次粉wheat middling 18.67 mg。表3同 The same as Table 3。
2)矿物质预混料为每千克饲料提供Mineral premix provided the following per kg of diets:沸石粉 zeolite meal 3 165 mg,MgSO4·H2O 1 500.0 mg,CuSO4·5H2O 10.0 mg,FeSO4·H2O 80.0 mg,ZnSO4·H2O 50.0 mg,KIO380.0 mg,CoCl250.0 mg,Na2SeO320.0 mg,MnSO4·H2O 45.0 mg。表3同 The same as Table 3。
海带渣适宜添加比例试验为期49 d。选取630尾平均初始体重为(1.00±0.10) g的健康凡纳滨幼虾,随机分成6组,每组3个重复,每个重复35尾,以重复为单位养殖在容量为150 L的大白桶中。养殖期间水体温度为21~28 ℃,盐度为30‰~33‰,pH为 7.0~7.6,溶解氧浓度在6.5 mg/L左右。试验虾适应期为1周,1周后按对虾体重的3%~5%投喂相应的配合饲料,每天饱食投喂2次。在投饵前称量饲喂量,投饵后1 h用虹吸法收集残饵,烘干称重,每天记录摄食量。每周换水2次,24 h连续充气,期间发现死虾及时捞出,以免影响水质。
1.3.2 试验2:海带渣酶解产物应用效果试验
根据试验1得出的海带渣添加比例为3.0%时效果最好,选择添加3.0%海带渣的试验饲料作为海带渣对照组(A组),然后再分别用β-葡聚糖酶酶解海带渣(B组)和蛋白酶酶解海带渣(C组)对A组饲料中的海带渣进行等量替代,制作含3.0%海带渣酶解产物的试验饲料。饲料组成及营养水平见表3。
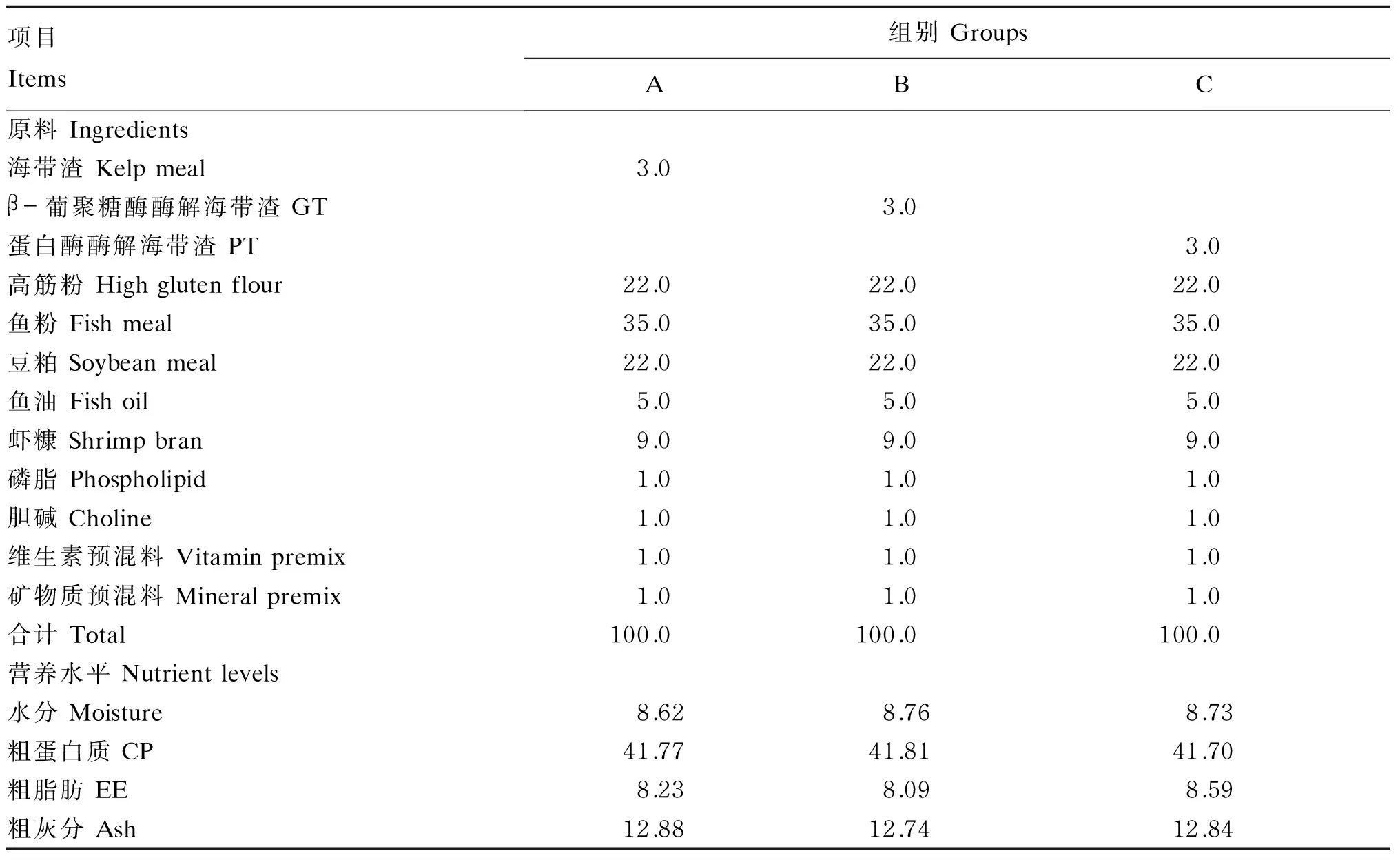
表3 试验2所用饲料组成及营养水平(干物质基础)Table 3 Composition and nutrient levels of diets used in experiment two (DM basis) %
酶解海带渣应用效果试验为期56 d。选取315尾平均初始体重为(1.00±0.10) g的健康幼虾,随机分成3组,每组3个重复,每个重复35尾。其他养殖条件同试验1。
1.4 样品采集与指标测定
1.4.1 样品采集与处理
试验开始和结束时对各组对虾计数和称重。试验结束时,停止投喂24 h,每个重复随机选择5尾(每组共15尾虾),用洁净的干布吸净体表水分,使用吸入抗凝剂的一次性无菌注射器从头胸甲插入心区采集血液。采集好的血液经过4 ℃、5 000 r/min离心15 min后取上清到新的离心管中,于-80 ℃冷藏,用于非特异性免疫酶活性的测定。另在冰盒上解剖取对虾的胃,取样后立即放入离心管中,-80 ℃冷藏,用于消化酶活性的测定。
1.4.2 指标测定及计算公式
饲料中粗蛋白质含量的测定采用凯氏定氮法(VELP,UDK-142 Autom Atic Distillation Unit,意大利);粗脂肪含量的测定采用索氏抽提法(SOXTEC2050 FOSS脂肪测定仪,瑞典);粗灰分含量的测定采用失重法[在微波马弗炉中(550±20) ℃灼烧9 h];水分含量的测定采用直接干燥法[在数显鼓风干燥箱中(105±2) ℃恒温干燥3 h]。
对虾的成活率(survival rate,SR)、增重率(weight gain rate,WGR)、特定生长率(specific growth rate,SGR)、饲料系数(feed conversion ratio,FCR)、日摄食率(daily feeding rate,DFR)的计算公式如下:
成活率(%)=100×终末对虾尾数/
初始对虾尾数;
增重率(%)=100×(终末平均体重-
初始平均体重)/初始平均体重;
特定生长率(%/d)=100×(ln最终体质量-
ln初始体质量)/养殖天数;
饲料系数(%)=100×投喂总量/
(终末总重-初始总重);
日摄食率(%)=100×投喂总量/[养殖天数×
(终末总重+初始总重)/2]。
相关酶活性测定:胃蛋白酶(pepsin,PP)、胃纤维素酶(cellulase,CL)、酸性磷酸酶(acid phosphatase,ACP)、超氧化物歧化酶(superoxide dismutase,SOD)活性及样品蛋白质含量均采用南京建成生物工程研究所的相关试剂盒测定,并以比活力表示;酚氧化酶(polyphenol oxidase,PO)活性采用上海酶联生物科技有限公司的酶联免疫吸附试验(ELISA)试剂盒测定。
1.5 数据统计分析
试验所得数据用Excel 2007整理,以平均值±标准差(mean±SD)表示,采用SPSS 17.0分析软件进行单因素方差分析(one-way ANOVA),并采用Duncan氏法比较组间差异显著性,以P<0.05为差异显著。
2 结 果
2.1 海带渣添加比例及其酶解产物对凡纳滨对虾生长性能的影响
由表4可知,各海带渣添加组对虾的增重率和特定生长率均高于对照组,其中D4、D5组与对照组的差异达显著水平(P<0.05)。饲料系数和日摄食率均以D5组最低,显著低于对照组以及D2、D3组(P<0.05)。

表4 海带渣添加比例对凡纳滨对虾生长性能的影响Table 4 Effects of kelp meal adding proportion on growth performance of Litopenaeus vannamei
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below.
由表5可知,B组对虾的增重率和特定生长率均显著高于A和C组(P<0.05)。B、C组对虾的饲料系数和日摄食率均显著低于A组(P<0.05)。
C组成活率最高,且与A、B组差异显著(P<0.05),A、B组成活率无显著差异(P>0.05)。

表5 海带渣酶解产物对凡纳滨对虾生长性能的影响Table 5 Effects of kelp meal enzymatic hydrolysates on growth performance of Litopenaeus vannamei
2.2 海带渣添加比例及其酶解产物对凡纳滨对虾胃中消化酶活性的影响
由表6可知,凡纳滨对虾的胃中纤维素酶活性随着海带渣添加比例的增加而升高,且D5、D6组的胃中纤维素酶活性显著高于其他各组(P<0.05)。对虾胃中胃蛋白酶活性随着海带渣添加比例的增加呈现先上升后下降的变化,以D5组活性最高,D6组活性最低,且这2组间的差异达到显著水平(P<0.05)。
由表7可知,B和C组对虾的胃中纤维素酶活性较A组显著降低(P<0.05),且B组胃中纤维素酶活性还显著低于C组(P<0.05)。对虾胃中胃蛋白酶活性以B组最低,显著低于A、C组(P<0.05)。
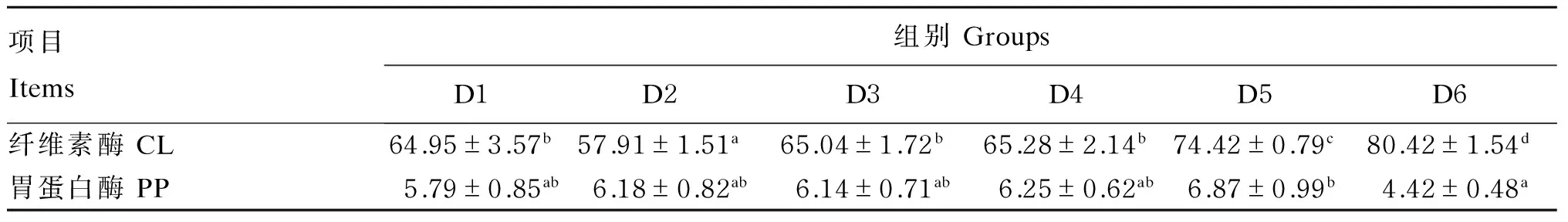
表6 海带渣添加比例对凡纳滨对虾胃中消化酶活性的影响Table 6 Effects of kelp meal adding proportion on digestive enzyme activities in stomach ofLitopenaeus vannamei U/mg prot

表7 海带渣酶解产物对凡纳滨对虾胃中消化酶活性的影响Table 7 Effects of kelp meal enzymatic hydrolysates on digestive enzyme activities in stomach of Litopenaeus vannamei U/mg prot
2.3 海带渣添加比例及其酶解产物对凡纳滨对虾血清中非特异性免疫酶活性的影响
由表8可知,对虾血清中ACP活性各组间差异不显著(P>0.05)。对虾血清中SOD活性随海带渣添加比例的增加呈先上升后下降的趋势,以D5组活性最高,为276.86 U/mL,显著高于其他各组(P<0.05)。对虾血清中PO活性以D5组最高,D6组最低,D3、D4、D5组显著高于其他组(P<0.05),D6组显著低于其他各组(P<0.05)。

表8 海带渣添加比例对凡纳滨对虾血清中非特异性免疫酶活性的影响Table 8 Effects of kelp meal adding proportion on serum non-specific immune enzyme activities of Litopenaeus vannamei
由表9可知,B、C组血清中ACP和PO活性均显著高于A组(P<0.05),且B、C组之间无显著差异(P>0.05);C组血清中SOD活性显著高于A、B组(P<0.05),且A、B组之间无显著差异(P>0.05)。

表9 海带渣酶解产物对凡纳滨对虾血清中非特异性免疫酶活性的影响Table 9 Effects of kelp meal enzymatic hydrolysates on serum non-specific immune enzyme activities of Litopenaeus vannamei
3 讨 论
3.1 海带渣添加比例对凡纳滨对虾生长、消化和非特异性免疫力的影响
本试验结果表明,饲料中添加海带渣能够促进凡纳滨对虾的生长,其中添加2.0%~3.0%的海带渣能够显著促进凡纳滨对虾生长,这与刘立鹤等[12]的研究结果相一致,原因可能是海带渣中含有蛋白质、矿物质以及各种维生素等营养物质,同时含有大量的多糖以及刺激动物生长的活性成分[13]。周歧存等[14]研究同样得出,在凡纳滨对虾饲料中添加3%的海藻粉,对虾增重率和蛋白质效率显著高于对照组,且饲料系数最低。
水产动物消化酶活性可反映其消化能力的强弱。李猛等[15]研究了饲料中添加不同比例的浒苔对刺参纤维素酶活性的影响,结果表明,随着浒苔添加比例的增加,肠道纤维素酶活性呈现先上升后下降的趋势。在本试验中,随着海带渣添加比例的增加,凡纳滨对虾胃中胃蛋白酶活性出现了先上升后下降的趋势而其胃中纤维素酶的活性则持续升高,其原因可能是:随着海带渣添加比例的增加,饲料中纤维素含量也相应的增加,刺激了对虾胃纤维素酶的分泌;纤维素含量高会加快食物在对虾肠道中的排空速度[16],因此当海带渣添加比例过高时,影响了胃蛋白酶的活性。此外,本试验结果还表明,添加2%~5%海带渣组的对虾日摄食率显著低于其他组,可能是因为海带渣添加比例过高影响了饲料的适口性,降低了对虾的摄食量,从而影响了胃蛋白酶的分泌。
研究表明,海藻类产品能够提高日本对虾[17]和刺参[18]血清中的SOD等非特异性免疫酶的活性。SOD是机体清除氧自由基的重要抗氧化关键酶之一[19],Regoli等[20]研究发现生物体对胁迫的适应能力主要取决于其抗氧化能力。PO能启动黑色素的合成,有效抑制病原体胞外蛋白酶和几丁质酶的活性,PO活性的强弱是衡量甲壳动物机体免疫能力强弱的重要参考指标[21]。本试验结果表明,饲料中添加适宜比例的海带渣能够提高凡纳滨对虾血清中SOD、PO的活性,这可能是添加的海带渣经消化释放了岩藻多糖[22],而岩藻多糖具有增强免疫力[23]、提高抗病毒性和抗氧化能力的功能[24-25],而添加5%海带渣组的对虾血清中SOD、PO的活性显著下降,可能是因为随着海带渣添加比例的升高,被消化产生的多糖类浓度升高,而过高浓度的糖类对动物免疫活性有抑制作用[26]。ACP是溶酶体酶的标志酶,在对虾免疫反应中有重要的生物学意义[27-28]。在本试验中,饲料中添加海带渣后对虾血清中ACP活力虽有升高,但效果不显著,可能是海带渣被消化分解产生的物质含量低不能明显改变ACP活性。
3.2 海带渣酶解产物对凡纳滨对虾生长、消化和非特异性免疫力的影响
酶制剂在酶解饲料原料时可以将大分子营养物质转化为分子质量小且更易吸收的营养物质,本试验选用的β-葡聚糖酶是一种纤维素酶,可以将海带渣中的纤维素降解为小分子的糖类。张志勇等[29]研究发现,在凡纳滨对虾饲料中添加海藻β-葡聚糖可显著提高其生长性能,本试验中β-葡聚糖酶酶解海带渣组对虾的增重率、特定生长率显著高于其他2组,且饲料系数最低,这可能是海带渣中的纤维素被酶降解为可消化的糖类并且氧化分解提供能量,并通过减少肠道蠕动减少了能量消耗,从而使更多的营养物质用于生长[30-31]。
本试验中,β-葡聚糖酶酶解海带渣组对虾胃中胃蛋白酶和纤维素酶活性显著低于海带渣对照组和蛋白酶酶解海带渣组,这是因为该组饲料中纤维素含量降低,对纤维素酶的分泌没有促进作用;而蛋白酶酶解海带渣组对虾的胃蛋白酶活性略高于海带渣对照组,可能是因为海带渣被蛋白酶处理后产生了大量氨基酸和小肽等物质,增强了相应底物的浓度,对胃蛋白酶的分泌起到了一定的促进作用[32]。
李桂芹[33]的研究表明海带多糖能提高动物机体的免疫功能。刘晋等[34]研究表明海藻糖类能提高对虾血清中免疫酶的活性。本试验条件下,β-葡聚糖酶酶解海带渣和蛋白酶酶解海带渣组对虾血清中ACP、PO活性及蛋白酶酶解海带渣组对虾血清中SOD活性显著高于海带渣对照组,因此海带渣经β-葡聚糖酶和蛋白酶酶解后可提高对虾血清中非特异性免疫酶的活性。而β-葡聚糖酶酶解海带渣组对虾血清中SOD活性低于其他2组,这可能是因为海带渣经β-葡聚糖酶酶解后释放产生的还原性小分子糖类浓度过高,而高浓度的糖类对动物机体的SOD活性有一定抑制作用[26,35]。在饲料中提供充足的氨基酸是维持动物正常免疫功能和保护宿主抵抗疾病所必需的[36]。大量研究表明,蛋白质是以小肽和氨基酸的形式被动物吸收[37],小肽能增强机体的免疫能力[38]。仇哲等[39]研究表明,海带中氨基酸含量丰富,酶解后氨基酸及必需氨基酸含量上升,在本研究中海带渣经蛋白酶酶解后生成氨基酸的效率为11.3%,提高了饲料中小肽及氨基酸的含量,从而增强了凡纳滨对虾的非特异性免疫力[40]。
4 结 论
① 在本试验条件下,凡纳滨对虾饲料中海带渣的适宜添加比例为3.0%。
② 海带渣经β-葡聚糖酶酶解后可以促进凡纳滨对虾的生长,提高其非特异性免疫力;而海带渣经蛋白酶酶解后可提高凡纳滨对虾的非特异性免疫力,但对其生长无促进作用。
[1] 王彩理,刘丛力,滕瑜.南美白对虾的营养需求及饲料配制[J].天津水产,2008(增刊1):7-12.
[2] 杨小强.新一代活性饲料——大型海藻饲料[J].饲料研究,2000(1):22-25.
[3] 葛蕾蕾.海藻加工废弃物的复合降解及乙醇转化[D].硕士学位论文.青岛:中国海洋大学,2010:10-11.
[4] 孟昭聚.用海带粉作肉鸡饲料添加剂的研究[J].中兽医医药杂志,1996(6):11-12.
[5] 孟昭聚.用海带粉作肉猪饲料添加剂研究[J].当代畜牧,1994(4):10-11.
[6] 周歧存,赵华超.海藻在罗氏沼虾饲料中的应用研究[J].饲料研究,2001(8):5-6.
[7] 甘纯玑,谢苗,钟剑霞,等.褐藻渣的开发利用[J].中国食物与营养,2001(3):18-20.
[8] SMIT A J.Medicinal and pharmaceutical uses of seaweed natural products:a review[J].Journal of Applied Phycology,2004,16(4):245-262.
[9] YILDIRIM Ö,ERGÜN S,YAMAN S,et al.Effects of two seaweeds (UlvalactucaandEnteromorphalinza) as a feed additive in diets on growth performance,feed utilization,and body composition of rainbow trout (Oncorhynchusmykiss)[J].Kafkas Üniversitesi Veteriner Fakültesi Dergisi,2009,15(3):455-460.
[10] 张俊杰,段蕊,许可,等.海带工业中海带渣应用的研究及展望[J].水产科学,2010,29(10):620-623.
[11] 王昌义,单守水,徐世艾.预消化法酶解饲用海藻粉中非淀粉多糖的初步研究[J].饲料工业,2012,33(2):44-48.
[12] 刘立鹤,董爱华,周永奎,等.饲料中不同水平海带粉对凡纳对虾生长及饲料表观消化率的影响[J].广东农业科学,2006(2):72-74.
[13] INDRAYAN A K,SHARMA S,DURGAPAL D,et al.Determination of nutritive value and analysis of mineral elements for some medicinally valued plants from Uttaranchal[J].Current Science,2005,89(7):1252-1255.
[14] 周歧存,肖风波.海藻在南美白对虾饲料中的应用研究[J].海洋科学,2003,27(3):66-69.
[15] 李猛,廖梅杰,王印庚,等.浒苔添加比例与微生物发酵对幼刺参生长、消化和非特异性免疫的影响[J].动物营养学报,2015,27(10):3270-3278.
[16] 胡喜峰,王成章,张春梅,等.不同水平苜蓿草粉对团头鲂生长性能及肉品质的影响[J].西北农林科技大学学报:自然科学版,2005,33(11):49-56.
[17] 李丹彤,张静,陈国栋,等.裙带菜凝集素对日本对虾非特异性免疫因子的影响[J].大连海洋大学学报,2009,24(3):274-278.
[18] 李继业.养殖刺参免疫学特征与病害研究[D].硕士学位论文.青岛:中国海洋大学,2007:10-11.
[19] 张换,曾艳,管于平,等.响应面法优化海带多糖的酶法提取工艺及其抗氧化研究[J].食品科技,2013(5):197-202.
[20] REGOLI F,CERRANO C,CHIERICI E,et al.Seasonal variability of prooxidant pressure and antioxidant adaptation to symbiosis in the Mediterranean demospongePetrosiaficiformis[J].Marine Ecology Progress Series,2004,275:129-137.
[21] JI P F,YAO C L,WANG Z Y.Immune response and gene expression in shrimp (Litopenaeusvannamei) hemocytes and hepatopancreas against some pathogen-associated molecular patterns[J].Fish & Shellfish Immunology,2009,27(4):563-570.
[22] 张哲,张筠.海带中的生理活性多糖[J].食品科技,1999(3):52-53.
[23] MARUYAMA H,TAMAUCHI H,IIZUKA M,et al.The role of NK cells in antitumor activity of dietary fucoidan fromUndariapinnatifidasporophylls(Mekabu)[J].Planta Medica,2006,72(15):1415-1417.
[24] WANG J,ZHANG Q B, ZHANG Z S,et al.Potential antioxidant and anticoagulant capacity of low molecular weight fucoidan fractions extracted fromLaminariajaponica[J].International Journal of Biological Macromolecules,2010,46(1):6-12.
[25] KANG Y M,LEE B J,KIM J I,et al.Antioxidant effects of fermented sea tangle (Laminariajaponica) byLactobacillusbrevisBJ20 in individuals with high level of γ-GT:a randomized,double-blind,and placebo-controlled clinical study[J].Food & Chemical Toxicology,2012,50(3/4):1166-1169.
[26] 原丽.浒苔多糖降血糖作用及其机制的研究[D].硕士学位论文.福州:福建医科大学,2011:32-33.
[27] 张明,王雷,郭振宇,等.脂多糖和弧菌对中国对虾血清磷酸酶、超氧化物歧化酶和血蓝蛋白的影响[J].海洋科学,2004,28(7):22-25.
[28] RAJALAKSHMI S,MOHANDAS A.Copper-induced changes in tissue enzyme activity in a freshwater mussel[J].Ecotoxicology and Environmental Safety,2005,62(1):140-143.
[29] 张志勇,程宗佳,柏世军,等.海藻β-1,3葡聚糖对南美白对虾(Litopenaeusvannamei)生长性能及体成分的影响[J].饲料工业,2014, 35(24):12-15.
[30] 徐彬.刺参幼参预消化配合饲料的研究[D].硕士学位论文.北京:中国农业科学院2009:17-18.
[31] STEINKRAUS K H.Handbook of indigenous fermented foods[M].New York:CRC Press,1983.
[32] 王吉桥,张坤,姜玉声,等.在无藻粉饲料中添加包膜氨基酸对幼刺参生长、消化和免疫指标的影响[J].海洋科学,2010,34(9):36-43.
[33] 李桂芹.海藻糖的生物学功能及其应用[J].安徽农业科学,2007,35(24):7724-7725.
[34] 刘晋,郭长江,刘嘉喜.海藻多糖免疫调节作用的研究进展[J].中国食物与营养,2007(5):49-51.
[35] 秦搏,常青,陈四清,等.饲料中浒苔添加量以及处理方法对幼刺参生长、消化率、消化酶和非特异性免疫酶的影响[J].水产学报,2015,39(4):547-556.
[36] 李秀群.氨基酸对动物营养免疫的影响[J].现代畜牧科技,2015(1):28-29.
[37] 杨凤.动物营养学[M].北京:中国农业出版社,2004:78-80.
[38] 杨义.酶解蛋白对幼建鲤肠道功能和免疫力的影响[D].硕士学位论文.雅安:四川农业大学,2005:48-52.
[39] 仇哲,孙跃春,吴海歌,等.酶解海带产物的营养成分分析[J].黑龙江八一农垦大学学报,2016,28(2):60-63.
[40] 陶冉,位正鹏,崔蓉,等.藻类色素蛋白的资源开发和应用研究[J].食品工业科技,2010,31(4):377-380.
*Corresponding author, professor, E-mail: Lijian@ysfri.ac.cn
(责任编辑 菅景颖)
Effects of Kelp Meal Adding Proportion and Its Enzymatic Hydrolysates on Growth, Digestion and Non-Specific Immunity ofLitopenaeusvannamei
PENG Suxiao1,2CHANG Zhiqiang2MA Li1,2LI Jian2*
(1.CollegeofFishersandLifeSciences,ShanghaiOceanUniversity,Shanghai201306,China; 2.KeyLaboratoryforSustainableUtilizationofMarineFisheriesResource,YellowSeaFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Qingdao266071,China)
This study focused on evaluating the effects of kelp meal adding proportion and enzymatic hydrolysates on growth, digestion and non-specific immunity ofLitopenaeusvannamei. There were two experiments in this study: the optimal adding proportion experiment of kelp meal and the effect experiment of kelp meal enzymatic hydrolysates. The optimal adding proportion experiment of kelp meal (experiment one): according to a single factor experimental design, six diets were formulated to contain 0, 0.5%, 1.0%, 2.0%, 3.0% and 5.0% kelp meal (named as groups D1 to D6, respectively), respectively, fed the shrimps [initial body weight was (1.00±0.10) g] for 49 days, and then the growth performance indices, activities of digestive enzymes in stomach and non-specific immune enzymes in serum ofLitopenaeusvannameiwere measured. There were 3 replicates per group with 35 shrimps per replicate. The effect experiment of kelp meal enzymatic hydrolysates (experiment two): a diet with 3.0% kelp meal was kelp meal control group (group A) that based on the experiment one had the optimal adding proportion, and then 3.0% kelp meal after β-glucanase (group B) and protease treatment (group C) were used to replace an equal amount of kelp meal, respectively. TheLitopenaeusvannameiwith the initial body weight of (1.00±0.10) g were fed those diets for 56-day, the growth performance indices, activities of digestive enzymes in stomach and non-specific immune enzymes in serum ofLitopenaeusvannameiwere measured. There were 3 replicates per group with 35 shrimps per replicate. The results of experiment one showed as follows: the weight gain rate (WGR) and specific growth rate (SGR) in groups D4 and D5 were significantly higher than those in control group (P<0.05). In addition, the feed conversion ratio (FCR) in D5 group was significantly lower than that in control group (P<0.05). With the kelp meal adding proportion increasing, the activities of pepsin (PP) in stomach, and superoxide dismutase (SOD) and phenoloxidase (PO) in serum were firstly increased and then decreased. The activities of those three kinds of enzymes reached the maximum in D5 group, and the activities of serum PO and SOD in D5 group were significantly higher than those in control group (P<0.05). The results of experiment two showed as follows: compared with kelp meal treated without enzyme, kelp meal treated by β-glucanase had significant influence on improving WGR, SGR and reducing FCR (P<0.05), and kelp meal treated by protease can significantly increase survival rate (SR) (P<0.05). The cellulase activity in stomach of groups B and C was significantly decreased compared with group A (P<0.05). The activities of acid phosphatase (ACP) and PO in serum of groups B and C and the serum SOD activity of group C were significantly higher than those of group A (P<0.05). It is suggested that the optimal adding proportion of kelp meal in the diet ofLitopenaeusvannameiis 3.0%. Kelp meal treated by β-glucanase can improve the growth performance and non-specific immunity ofLitopenaeusvannamei, and treated by protease can improve non-specific immunity, but has no enhancement on growth ofLitopenaeusvannamei.[ChineseJournalofAnimalNutrition, 2017, 29(7):2587-2596]
kelp meal; enzymatic hydrolysates;Litopenaeusvannamei; growth performance; digestive enzymes; non-specific immune enzymes
10.3969/j.issn.1006-267x.2017.07.044
2016-12-26
国家虾现代产业技术体系(CARS-47);青岛海洋科学与技术国家实验室鳌山科技创新计划子任务“海水池塘健康养殖技术研发”(2015ASKJ02-03)
彭素晓(1991—),女,山东临沂人,硕士研究生,研究方向为动物营养与微生物发酵。E-mail: 836553017@qq.com
*通信作者:李 健,研究员,博士生导师,E-mail: Lijian@ysfri.ac.cn
S963
A
1006-267X(2017)07-2587-10
