陕西蓝田核桃内生真菌多样性与时空分布1)
2017-08-07刘泽星阿依佳玛丽依玛尔毛光瑞张婷婷翟梅枝
刘泽星 阿依佳玛丽·依玛尔 毛光瑞 张婷婷 翟梅枝
(西北农林科技大学,杨凌,712100)
陕西蓝田核桃内生真菌多样性与时空分布1)
刘泽星 阿依佳玛丽·依玛尔 毛光瑞 张婷婷 翟梅枝
(西北农林科技大学,杨凌,712100)
为了解陕西蓝田核桃(JuglansregiaL.)内生真菌生态多样性与分布特性,采用组织分离法对不同季节的核桃树的不同组织部位进行内生真菌分离,以形态学和分子生物学相结合的方法进行鉴定。共分离获得核桃内生真菌676株,隶属于47个属,其中交链孢霉属(Alternaria)为优势类群,占菌株总数的19.23%;茎叶核菌属(Ectostroma)和葡萄座腔菌属(Botryosphaeria)相对较丰富,分别占菌株总数的8.73%和6.21%。核桃不同部位内生真菌的多样性以茎部最高,1年生茎和2年生茎分别占菌株总数的24.56%和24.41%。不同季节的核桃内生真菌中,秋季(2013年10月)的多样性最高,分布于19个属,占菌株总数的34.91%。不同组织部位的核桃内生真菌多样性因季节变化而异。
核桃;内生真菌;多样性
JuglansregiaL.; Endophytic fungi; Diversity
广义的内生菌的定义是指生活在植物组织内或生活史中的某一段生活在植物组织内,对植物组织没有引起明显病害症状的菌,包括那些生活史中某一阶段营表面生的腐生菌,对宿主暂时没有伤害的潜伏性病原菌和菌根菌[1-3]。目前已研究过的数百种植物中(包括苔藓、蕨类),还未发现没有内生真菌的植物,可以推断内生真菌在植物体内是普遍存在的[3],保守估计每种植物上将会发现6个新的微生物物种,现有植物种类27万种,则内生真菌的数目将会是162万种[4],且不同生境下的同一种植物的内生真菌亦有差异[5],可见内生真菌将是微生物物种的主要角色。按照协同演化的理论,宿主植物与其内生真菌长期共生,相互影响。宿主植物为内生真菌提供能量、矿质元素等,而内生真菌具有固氮、促进植物生长(分泌IAA等植物生长激素物质)、增强植物环境修复能力、抗逆境(干旱等)、抗动物(昆虫、线虫、食草哺乳动物等)摄食、抗病原真菌等作用[6-9]。研究还表明,海南粗榧(Cephalotaxushainanensis)内生真菌A29的次级代谢产物对香蕉枯萎等4种病原菌具有较强抑菌活性[10],柴胡(Bupleurumsp.)内生真菌的次级代谢产物对枯草芽孢杆菌等3种细菌病原菌具有较强抑菌活性[11],核桃内生真菌对棉花立枯病菌等多种病原菌的生长都有抑制作用[12],核桃内生真菌发酵液对苹果轮纹等4种病原菌的抑制率为100%[13]。植物内生真菌的次级代谢产物中存在着天然抑菌活性物质,可为寻找新型抗菌物质提供资源。潜在的植物内生真菌是一个巨大的资源宝库,对研究生物多样性、发现新化合物和开发新药具有重大的意义。本研究以陕西蓝田核桃为研究对象,对其内生真菌的多样性及时空分布的差异性进行研究,为核桃内生真菌资源的开发利用和生态多样性保护提供科学依据。
1 材料与方法
1.1 样本采集
分别于秋季(2013年10月)、冬季(2013年12月)、春季(2014年3月)、夏季(2014年6月)选择陕西省关中地区蓝田县(E109.357481°;N34.197120°;海拔678 m;年降水量720.4 mm)的核桃园采集样品。在每个采样地点,选取固定的生长健壮的核桃树进行采样,采集部位包括根、1年生茎、2年生茎、干茎、叶和果(叶、果只采夏秋两季)。采样方法,用75%的酒精对刀片消毒,分别剪(切)取30~50 cm土层内粗度约1 cm的细根10 cm;1年生幼嫩枝条和2年生枝条各10 cm左右;干茎5 cm×5 cm;健康叶子、果实若干分别装入自封袋,编号,带回实验室后4 ℃保存,12 h内对样品进行处理。
1.2 外植体表面消毒
首先将核桃不同部位各组织用流水冲洗干净,用75%的酒精对刀片消毒,然后将核桃的根、1年生茎、2年生茎分别切成15 mm小段,干茎、叶、果(青皮)切成15 mm×15 mm小块。将以上各组织在无菌条件下进行表面消毒,消毒流程如下:①无菌水冲洗3次→75%酒精消毒3 min→无菌水冲洗3次;②无菌水冲洗3次→3% H2O2消毒3 min→无菌水冲洗3次。
无菌条件下,将处理好的核桃材料在培养基上作组织印迹对照处理,检验消毒效果[12]。
1.3 内生真菌的分离、纯化及保藏
在超净工作台中,用无菌刀片将以上消毒的根、1年生茎、2年生茎分别切成5 mm小段,将干茎、叶、果切成5 mm×5 mm小块,分别接种到马铃薯葡萄糖琼脂(PDA)培养基中,每个培养皿接种3块,每种组织块重复3个培养皿,28 ℃暗培养1~2周,待材料边缘长出菌丝后,采用菌丝末端分离法,将边缘菌丝转接到PDA培养基上进行纯化,多次纯化后得到单一菌落,并转接到试管斜面上置于冰柜中4 ℃保藏[14]。
1.4 菌株的鉴定
菌株的形态学特征鉴定:通过经典方法对分离纯化的菌株进行形态学鉴定,于无菌条件下挑取待鉴定菌株的菌丝,在PDA固体培养基平板中央定植一点,置于28 ℃下培养,观察菌落的颜色、质地、生长速度等特性;在显微镜下观察菌丝体、产孢结构、孢子形态与颜色以及孢子与营养体之间的着生关系等特征[15]。
菌株的分子生物学鉴定:对于形态学鉴定方法难以确定的菌株,在PDA培养基上培养一段时间后,从平板上刮取约0.1 g菌丝体,置于1.5 mL离心管中,用改良的CTAB法提取基因组DNA,并以此为模板,用通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对菌株rDNA-ITS区域进行扩增。PCR反应体系15 μL,PCR mix 7.5 μL,ITS1和ITS4各0.6 μL,模板DNA 0.8 μL,双蒸水补足至15 μL。扩增程序为,94 ℃,4 min;94 ℃,40 s;37 ℃,1 min;72 ℃,1 min,40个循环;72 ℃,10 min。扩增产物用1.2%琼脂糖凝胶(DuRed核酸染料)电泳检测,将符合要求的扩增产物委托上海生工生物技术有限公司进行测序。用Blast程序将测得序列与GeneBank中的序列进行同源性比对,选择同源性99%以上序列作为参考序列,并采用ClustalX 2.0做同源性比较和匹配排序[15-18]。
2 结果与分析
2.1 核桃内生真菌的群落构成及分布
从供试材料的根、茎(1年生茎、2年生茎、干茎)、叶、果4类组织中共分离出676株内生真菌,通过形态学方法结合分子生物学方法(图1)归类为47个属(表1)。
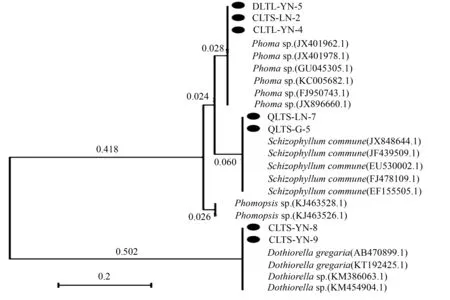
图1 基于ITS序列作系统发育分析的7株内生真菌
交链孢霉属(Alternaria)为优势类群(图2),占菌株总数的19.23%,茎叶核菌属(Ectostroma)和葡萄座腔菌属(Botryosphaeria)相对丰富,分别占菌株总数的8.73%和6.21%。此外,交链孢霉属、茎叶核菌属和黑孢霉属(Nigrospora)广泛分布于4类组织6个部位中,同时交链孢霉属是在属的分类水平上唯一四季生长不衰的菌群。
图2 交链孢霉属内生真菌形态特征
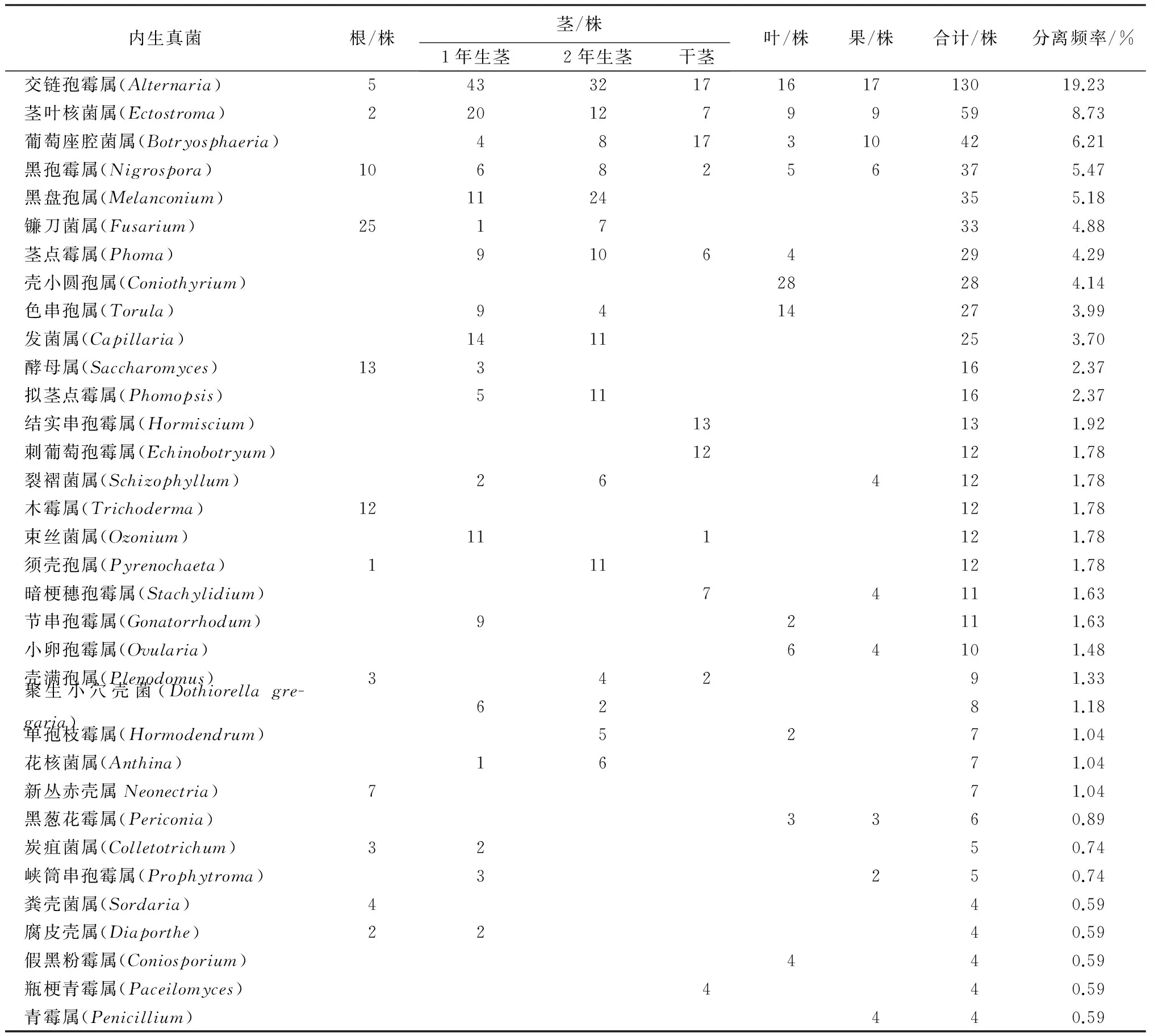
内生真菌根/株茎/株1年生茎2年生茎干茎叶/株果/株合计/株分离频率/%交链孢霉属(Alternaria)5433217161713019.23茎叶核菌属(Ectostroma)22012799598.73葡萄座腔菌属(Botryosphaeria)4817310426.21黑孢霉属(Nigrospora)1068256375.47黑盘孢属(Melanconium)1124355.18镰刀菌属(Fusarium)2517334.88茎点霉属(Phoma)91064294.29壳小圆孢属(Coniothyrium)28284.14色串孢属(Torula)9414273.99发菌属(Capillaria)1411253.70酵母属(Saccharomyces)133162.37拟茎点霉属(Phomopsis)511162.37结实串孢霉属(Hormiscium)13131.92刺葡萄孢霉属(Echinobotryum)12121.78裂褶菌属(Schizophyllum)264121.78木霉属(Trichoderma)12121.78束丝菌属(Ozonium)111121.78须壳孢属(Pyrenochaeta)111121.78暗梗穗孢霉属(Stachylidium)74111.63节串孢霉属(Gonatorrhodum)92111.63小卵孢霉属(Ovularia)64101.48壳满孢属(Plenodomus)34291.33聚生小穴壳菌(Dothiorellagre-garia)6281.18单孢枝霉属(Hormodendrum)5271.04花核菌属(Anthina)1671.04新丛赤壳属Neonectria)771.04黑葱花霉属(Periconia)3360.89炭疽菌属(Colletotrichum)3250.74峡筒串孢霉属(Prophytroma)3250.74粪壳菌属(Sordaria)440.59腐皮壳属(Diaporthe)2240.59假黑粉霉属(Coniosporium)440.59瓶梗青霉属(Paceilomyces)440.59青霉属(Penicillium)440.59
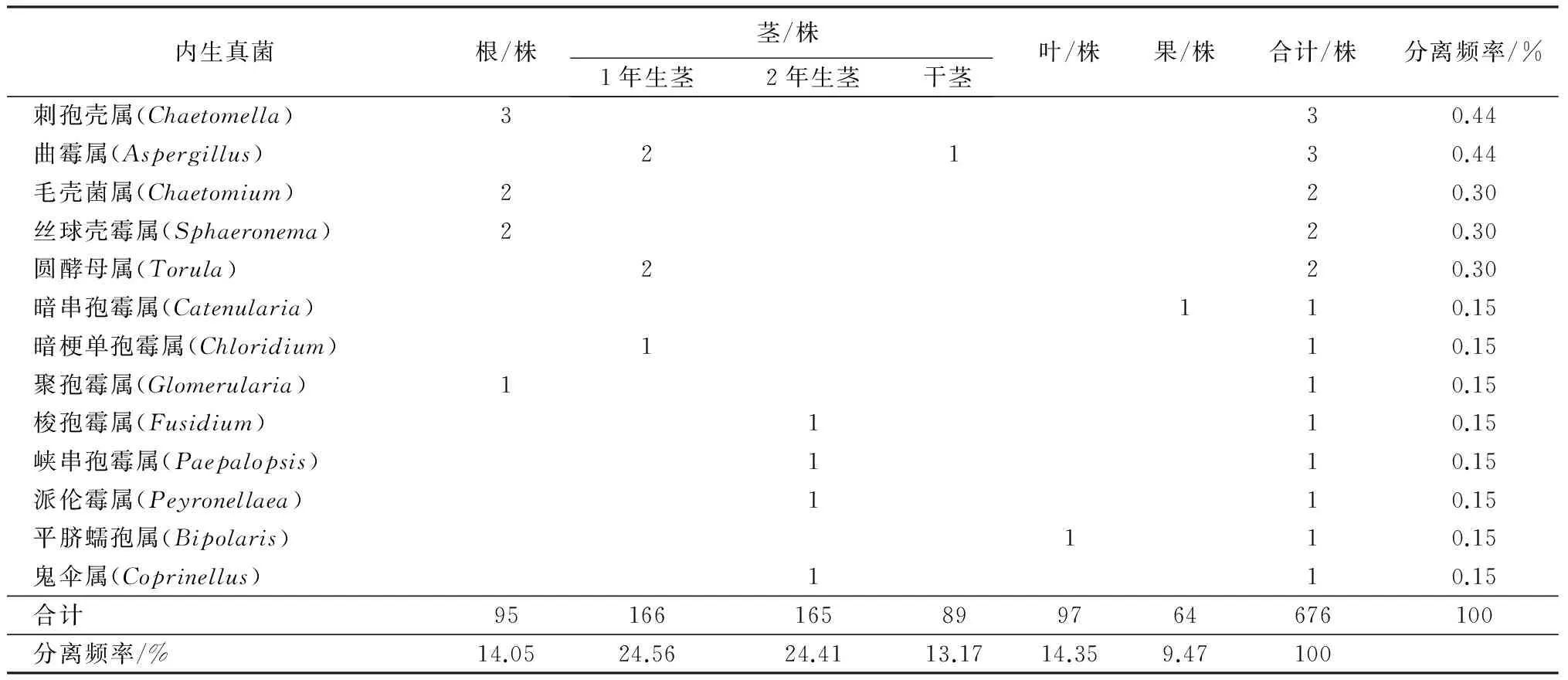
续(表1)
注:表中数字代表相应菌株数量;分离频率=(某属或某部位菌株数/菌株总数)×100%。
2.2 不同部位核桃内生真菌的多样性
由表1可看出,核桃的根、茎、叶、果4大类组织的内生真菌在数量、种群分布以及优势种群等方面都存在较大差异。首先茎部内生真菌的分离频率普遍较高,占到总数的62.14%,由茎分离获得的内生真菌分布于33个属,其中1年生茎和2年生茎分别为24.56%和24.41%;干茎则相对较少,仅13.17%,且低于根部和叶部的分离频率。根、叶、果的内生真菌分离频率分别是14.05%、14.35%和9.47%,各自分布于16、14、12个属中。其次优势种群在各个组织部位的分布存在明显差异。茎中交链孢霉属的种群优势极为明显,占茎部菌株总数的21.90%,相对丰富的茎叶核菌属、黑盘孢属(Melanconium),分别占茎部菌株总数的9.29%和8.33%;根部优势种群主要是镰刀菌属(Fusarium)、酵母属(Saccharomyces)和木霉属(Trichoderma)等;而叶中壳小圆孢属(Coniothyrium)、色串孢属(Torula)以及交链孢霉属是主要的优势种群;果实青皮中内生真菌的种群优势不显著,以交链孢霉属、葡萄座腔菌属、茎叶核菌属居多。此外,不同部位都有各自独有的属,如木霉属(图3)只在根部分离得到,壳小圆孢属仅存在于叶中,说明这些内生真菌对宿主组织有一定的偏好性或专一性[19-21]。此外,47个属的内生真菌中只有3个属的内生真菌在4类组织、6个部位中广泛分布,占比6.4%,它们是交链孢霉属、茎叶核菌属和黑孢霉属,表明这3个属的内生真菌具有较广泛的组织侵染性。
图3 木霉属内生真菌形态特征
2.3 不同季节核桃内生真菌的多样性
由春夏秋冬四季样本分离获得的核桃内生真菌的群落呈现动态变化(表2)。表2显示,四季中以秋季分离获得的内生真菌菌株最多,236株,约为春季分离菌株的3倍。秋季内生真菌分布于19个属,占总菌属比例40.43%,分离频率达到34.91%,这与汪友明等[22]的研究结果一致;相比之下,春季样品中内生真菌相对较少,仅获得85个菌株,分布在13个属,分离频率为12.57%;夏冬两季的内生真菌丰度介于春秋之间,由此可以推测,陕西关中地区核桃内生真菌在一年四季中呈现‘秋盛春衰’的周期性动态变化。在不同季节中,内生真菌的优势种群也有鲜明的区别。在春季,主要寄生在宿主幼枝和树皮的交链孢霉属、束丝菌属(Ozonium)和刺葡萄孢霉属(Echinobotryum)是内生真菌的优势种群;而夏季,在4类组织中都有分布的茎叶核菌属和主要寄生在宿主叶片的壳小圆孢属以及交链孢霉属成为优势种群;秋季的内生真菌优势种群则是黑孢霉属、葡萄座腔菌属和交链孢霉属,黑孢霉属和交链孢霉属的内生真菌广泛分布在宿主的4类组织中,而葡萄座腔菌属仅仅在根部未分离到;冬季核桃树既没有叶子也没有果实,此时的内生真菌优势种群主要分布在茎和根中,它们是交链孢霉属、黑盘孢属和发菌属(Capillaria),其中黑盘孢属和发菌属只分布于宿主的茎中。在47个属的内生真菌中,有33个属仅出现于某一个季节,占总属的70.21%,说明不同季节具有特定的内生真菌种群;但交链孢霉属和镰刀菌属在4个季节的样本中都有分布,交链孢霉属在所有组织中都有分布,镰刀菌属则主要分布在根中。
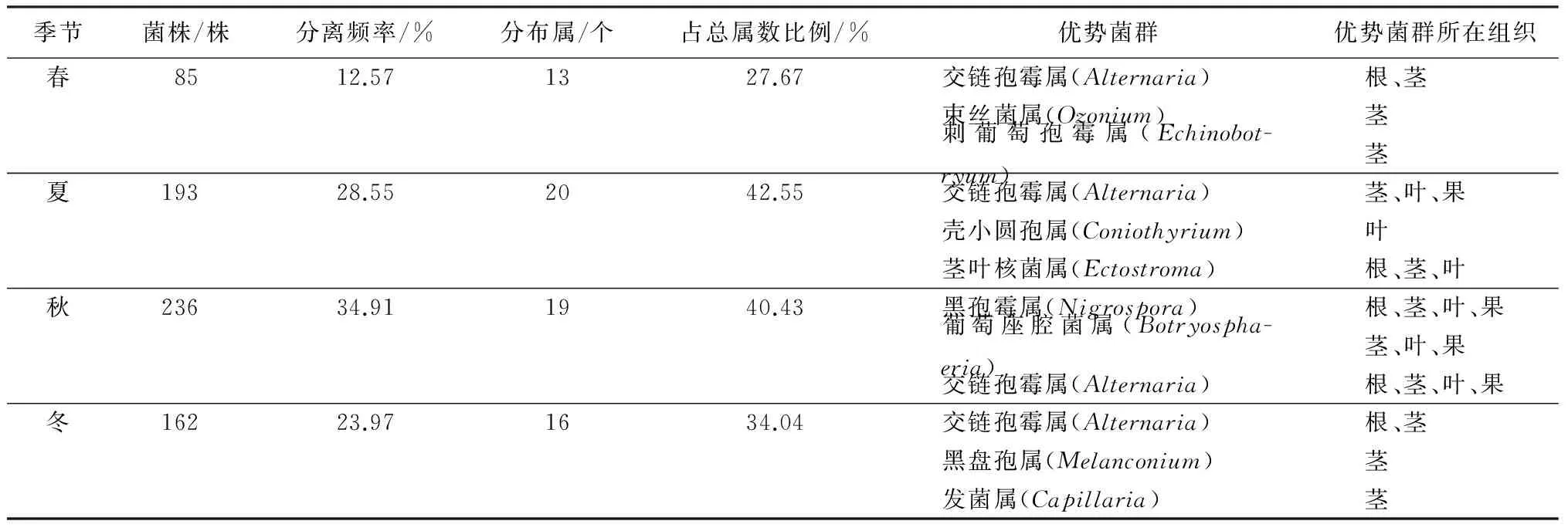
表2 不同季节核桃内生真菌的多样性及优势菌群的分布
3 结论与讨论
本研究从陕西关中地区核桃中分离出隶属于47个属的676株内生真菌,反映了核桃内生真菌的多样性,其中交链孢霉属的种群优势极为明显,这与前人[16,23]的研究结果一致。大量研究表明,交链孢霉属真菌是常见的植物内生真菌[24],它们可以产生与宿主植物相同或相似活性的化合物,如长春花(Catharanthusroseus)中分离到的交链孢霉属真菌能够产生长春新碱[25],喜树(Camptothecaacuminata)中分离到的交链孢霉属真菌能够产抗肿瘤活性物质[26],黄精(Polygonatumsibiricum)中分离的交链孢霉属真菌可产生三萜皂苷[27],这表明交链孢霉属核桃内生真菌具有产生活性物质的可能。
本研究显示,28个属的内生真菌仅分布于单一组织部位中,体现了核桃内生真菌在组织部位上的专一性,表明内生真菌在植物中的分布受组织结构等因素的影响。核桃茎部内生真菌的多样性较高,但干茎中内生真菌多样性相比幼茎较低,这可能与干茎中营养物质减少相关[28]。根和叶部的分离频率相近,但叶只有夏、秋两季的样本。果实青皮中内生真菌多样性较低,这与核桃青皮中富含醌类和黄酮类化合物有密切关系,研究表明胡桃醌具有广泛抑菌作用[29]。
笔者系统地研究了同一树木中内生真菌一年四季的分布。不同季节的核桃内生真菌在一年中呈现‘秋盛春衰’的周期性动态变化。33个属的内生真菌仅出现于某个单一季节,说明核桃内生真菌呈现出显著的季节多样性。推测可能是随着季节的更替,核桃树组织的生长使内生真菌的营养来源发生了变化。优势种群的寄生部位由茎(春天)变为茎和叶(夏天)再到根、茎、叶、果(秋天)最后又回到茎(冬天)。Hoffman et al.[30]研究指出,内生真菌类群会受到环境因子的影响,如采集地的湿度、季节变化、海拔和周围植被类群等,说明绝大多数的内生真菌在分布上都会受到不同外在条件的限制如宿主差异、地域差异、气候差异等,甚至在同一植物的不同组织中内生真菌的群落结构也完全不同。
与同实验室的研究人员毛光瑞[16]和阿依佳玛丽·依玛尔[23]的研究相比,二者的研究侧重于核桃内生真菌在空间上(不同生境)的多样性,本文侧重于研究核桃内生真菌在时间维度(四季)的多样性,首次对同一树木中内生真菌类群的四季变化做了跟踪研究,为全面研究内生菌多样性提供了科学依据。三者主要研究结果具有一致性:第一,核桃内生真菌优势类群为交链孢霉属,其分离频率均是次优势类群2倍以上。第二,核桃不同部位内生真菌以2年生茎的分离频率最高,只是本研究1年生茎分离频率(24.56%)略高于2年生茎(24.41%)。互相之间印证了研究结果的可靠性。
目前,内生真菌多样性的研究往往受到内生真菌分离方法的制约。植物内生真菌的分离多采用组织分离法,即将表面消毒后的植物组织置于培养基上培养,继而分离、纯化内生真菌;进而根据宏、微观形态特征和分子生物学方法鉴定菌种,进行多样性分析。然而任何一种培养基均具有选择性,不能将植物组织中所有内生真菌分离出来,这也是植物内生真菌多样性研究的困境[31]。采用宏基因组测序分析法能更好体现植物组织中内生真菌的种类,但不能将内生真菌分离出来,因此组织分离法尚为当前获得植物内生真菌的主要方法[24,32]。在随后的内生真菌研究中应综合考虑这些因素,以期为高效利用丰富的内生真菌资源奠定基础。
[1] STONE J K, BACON C W, WHITE J F Jr. An overview of endophytic microbes: endophytism defined[M]//BACON C W, WHITE J F Jr. Microbial Endophytes. New York: Marcel Dekker,2000:3-29.
[2] BOTELLA L, DIEZ J J. Phylogenic diversity of fungal endophytes in Spanish stands ofPinushalepensis[J]. Fungal Diversity,2010,47(1):9-18.
[3] 刘蕴哲,何劲,张杰,等.植物内生真菌及其活性代谢产物研究进展[J].菌物研究,2005,3(4):30-36.
[4] STROBEL G A. Endophytes as sources of bioactive products[J]. Microbes Infect,2003,5(6):535-544.
[5] FISHER P J, PETRINI O, PETRINI L E, et al. Fungal endophytes from the leaves and twigs ofQuercusilexL. from England, Majorca and Switzerland[J]. New Phytologist,1994,127(1):133-137.
[6] CAO R, LIU X, GAO K, et al. Mycoparasitism of endophytic fungi isolated from reed on soilborne phytopathogenic fungi and production of cell wall-degrading enzymes in vitro[J]. Curr Microbiol,2009,59(6):584-592.
[7] 何美仙.植物内生真菌作为生防因子的研究进展[J].植物保护,2005,31(1):10-14.
[8] 杨润亚,冯培勇,李清.植物内生真菌农药活性的研究进展[J].农药,2006,45(7):440-444.
[9] 李方圆,张超兰,黄河,等.反枝苋内生菌筛选及其铬富集效果研究[J].西南农业学报,2016,29(7):1694-1700.
[10] 刘翊昊,刘四新,胡晓苹,等.海南粗榧内生真菌A29代谢产物抑菌活性的研究[J].武汉理工大学学报,2015,37(11):37-42.
[11] 李玲玲,罗合春,张先淑.柴胡内生真菌鉴定与抑菌活性筛选[J].生物技术通报,2015(10):165-170.
[12] 王伟,翟梅枝,徐文涛,等.核桃内生菌研究Ⅰ:核桃内生菌的分离及代谢产物活性研究[J].西北农业学报,2008,17(1):77-81.
[13] 翟梅枝,高智辉,徐文涛,等.核桃内生真菌G8菌株的分离鉴定及抑菌活性[J].中南林业科技大学学报,2008,28(4):92-97.
[14] 方中达.植病研究方法[M].北京:中国农业出版社,1998:138-140.
[15] 周启武,赵宝玉,路浩,等.苦马豆内生真菌分离鉴定与多样性分析[J].畜牧兽医学报,2013,44(3):465-474.
[16] 毛光瑞,翟梅枝,史冠昭,等.陕西不同生境核桃内生真菌多样性[J].微生物学通报,2016,43(6):1262-1273.
[17] 吴发红,黄东益,黄小龙,等.几种真菌DNA提取方法的比较[J].中国农学通报,2009,25(8):62-64.
[18] 白周艳,王晓炜,马荣,等.新疆杏树(ArmeniacaMill.)内生真菌多样性分析[J].新疆农业大学学报,2011,34(4):321-327.
[19] BOYLE C, GÖTZ M, DAMMANN-TUGEND U, et al. Endophyte-host interactions III. Local vs. systemic colonization[J]. Symbiosis,2001,31(4):259-281.
[20] SUN J, GUO L, ZANG W, et al. Diversity and ecological distribution of endophytic fungi associated with medicinal plants[J]. Sci China, C, Life Sci,2008,51(8):751-759.
[21] ALY A H, DEBBAB A, PROKSCH P. Fungal endophytes: unique plant inhabitants with great promises[J]. Appl Microbiol Biotechnol,2011,90(6):1829-1845.
[22] 汪友明,樊美珍,李增智.安徽黄山红豆杉内生真菌多样性与生态分布[J].菌物学报,2015,34(5):1-4.
[22] 汪友明,樊美珍,李增智.安徽黄山红豆杉内生真菌多样性与生态分布[J].菌物学报,2016,35(3):360-363.
[23] 阿依佳玛丽·依玛尔,刘泽星,毛光瑞,等.不同生境春季核桃内生真菌分离及其多样性[J].西北林学院学报,2016,31(6):184-189.
[24] 侯晓强,任秀艳,付亚娟,等.北沙参内生真菌多样性研究[J].广东农业科学,2015,42(18):20-24.
[25] 张玲琪,郭波,李海燕,等.长春花内生真菌的分离及其发酵产生药用成分的初步研究[J].中草药,2000,31(11):805-807.
[26] 郑丹,刘吉华,张剑,等.4株产抗肿瘤活性物质喜树内生真菌的鉴定及其主要代谢产物HPLC初步比较[J].药物生物技术,2007,14(3):190-195.
[27] 李艳玲,王德才,史仁玖,等.泰山黄精内生真菌的分离鉴定及抑菌活性研究[J].中草药,2013,44(11):1490-1494.
[28] KUMAR D S S, HYDE K D. Biodiversity and tissue-recurrence of endophytic fungi inTripterygiumwilfordii[J]. Fungal Diversity,2004,17(1):69-90.
[29] 仲军梅,刘玉梅.核桃青皮的开发利用研究进展[J].食品工业科技,2014,35(19):396-400.
[30] HOFFMAN M T, ARNOLD A E. Geographic locality and host identity shape fungal endophyte communities in cupressaceous trees[J]. Mycol Res,2008,112(Pt3):331-344.
[31] HYDE K D, SOYTONG K, Hyde K D. The fungal endophyte dilemma[J]. Fungal Diversity,2008,33:163-173.
[32] CHEN Z B, XIA T Y, WANG D K, et al. Diversity analysis of endophytic fungi inMenthausing illumina MiSeq high-throughput sequencing technology[J]. Medicinal Plant,2016,7(1/2):46-50.
1)国家自然科学基金项目(31370552)。
刘泽星,男,1991年6月生,西北农林科技大学林学院,硕士研究生。E-mail:360473788@qq.com。
翟梅枝,西北农林科技大学林学院,教授。E-mail:plum-zhai@163.com。
2016年9月7日。
S718.81; S664.1
责任编辑:程 红。
Diversity and Temporal-spatial Distribution of Endophytic Fungi fromJuglansregiaL. in Lantian, Shaanxi//Liu Zexing, Yimaer·Ayijiamali, Mao Guangrui, Zhang Tingting, Zhai Meizhi(Northwest A & F University, Yangling 712100, P. R. China)//Journal of Northeast Forestry University,2017,45(3):90-95.
The experiment was conducted to study the endophytic fungal ecology diversity and distribution characteristics of theJuglansregiawoody tree in Lantian of Shaanxi Province. The fungal endophytes from different tissues of walnut tree in the four seasons were isolated, which were classified by morphology and similarity of internal transcribed spacer (ITS) sequence. A total of 676 endophytic fungal strains in 47 genera were isolated, in whichAlternariawere the dominant genera accounting for 19.23% of the total strains. The proportion ofEctostromaandBotryosphaeriawere second abundant stains, accounting for 8.73% and 6.21%, respectively. In different tissues of walnut, endophytic fungal from stem showed the highest diversity. The strains isolated from the annual and biennial stem were accounted for 24.56% and 24.41% of the total strains, respectively. Among different seasons, endophytic fungi obtained from autumn (October 2013) samples displayed the highest diversity and was distributed in 19 genera, accounting for 34.91% of the total strains. Therefore, the diversity of the endophytic fungi from different tissues of walnut was varied with the four seasons.
