温度对凤丹种子萌发和上胚轴生长抑制的影响
2017-08-07梅玉芹刘政安宋松泉
梅玉芹刘政安宋松泉
(1云南省临沧市种子管理站,临沧677000;2中国科学院植物研究所,北京 100093)
温度对凤丹种子萌发和上胚轴生长抑制的影响
梅玉芹1刘政安2宋松泉2
(1云南省临沧市种子管理站,临沧677000;2中国科学院植物研究所,北京 100093)
以成熟的凤丹种子为材料,研究了种子对水分的吸收、温度对种子萌发的影响以及低温处理对解除萌发种子上胚轴生长抑制的作用。结果表明:凤丹种子不存在休眠特性;种子萌发具有热抑制现象,萌发后的种子(幼苗)具有上胚轴生长抑制;适宜温度能使萌发热抑制的种子恢复萌发,低温处理能有效地解除萌发种子的上胚轴生长抑制。
凤丹;种子;萌发热抑制;上胚轴生长抑制;低温
凤丹(Paeonia ostii)为芍药科(Paeoniaceae)芍药属(Paeonia)牡丹组(Sect. Moutan)的多年生落叶小灌木,是目前油用牡丹栽培的主要品种[1]。凤丹种子具有上胚轴休眠特性,在适宜温度下胚根发育成根,而上胚轴不伸长,处于休眠状态,必须经过一段时间的低温后上胚轴才能伸长[2]。郑光华[3]报道牡丹种子萌发后根长在4cm时添加赤霉素可促进上胚轴伸长。张霁等[4]认为低温处理的适宜根长为2~3cm。张玉刚等[5]认为,牡丹种子上胚轴休眠只有在胚根长达3cm时5℃低温处理1~2周才能打破休眠,否则没有效果。林松明等[6]在解除凤丹上胚轴休眠研究中发现,当根长大于4cm时,用4℃低温处理20~25d可以解除凤丹上胚轴休眠。但是,关于低温处理解除凤丹种子上胚轴休眠所需的生长状态还不清楚。本文以成熟的凤丹种子为材料,在上述工作的基础上,研究了种子对水分的吸收、温度对种子萌发的影响以及低温解除萌发种子上胚轴生长抑制的作用,以期找到低温解除凤丹种子上胚轴生长抑制的适宜生长状态,为油用牡丹育苗提供技术参数。
1 材料与方法
1.1 材料 凤丹种子于2016年8月初采自河南洛阳牡丹种植基地。种子采集后放在25℃、75%相对湿度中晾干。种子千粒重为364g,含水量为8.4%(鲜重为基础)。
1.2 种子对水分的吸收 将种子置于垫有2层滤纸的培养皿中,每个培养皿中加入10mL蒸馏水,于20℃下吸胀。3个重复,每个重复25粒种子。第1天每2h测定一次种子的重量,第2~4天每12h测定一次,第5天后每24h测定一次;同时观察种子的萌发状态。
1.3 温度对种子萌发的影响 种子经选择后,用自来水在室温下浸泡48h,期间换几次水;然后将种子置于直径为150mm、装有湿润珍珠岩的培养皿中,分别在15℃、20℃、25℃和30℃下进行萌发。每个温度3个重复,每个重复50粒种子。珍珠岩含水量为60%~70%,种子与珍珠岩的比例为1∶4。每2d观察一次,以胚根突破种皮2mm作为种子萌发的标准,记录萌发种子数和补充消耗的水分。当种子萌发37d时测量萌发种子的根长,萌发52d时计算最终萌发率。
1.4 低温处理对解除萌发种子上胚轴生长抑制的影响 将在20℃下种子萌发37d后根长为0cm、0.2cm和3.0~6.0cm的种子/幼苗进行2种处理。(1)分别在4℃中层积0d、10d、20d、30d和40d,方法是将种子/幼苗埋在含水量为60%~70%的珍珠岩中,种子与珍珠岩的体积比例为1∶4;然后置于20℃下生长,观察低温处理对上胚轴生长抑制的影响。(2)直接在4℃下层积生长136d,观察对上胚轴生长抑制的作用;所产生的幼苗于恒温光照培养室中培养,观察其生长状态。每个重复30粒种子/幼苗,3次重复。
2 结果与分析
2.1 种子对水分的吸收 凤丹种子种皮较厚,坚硬革质。在吸胀初期,种子的吸水速率逐渐增加,到吸胀18h时,吸水速率达到最大,为2.63mg/seed·h,随后种子的吸水速度减慢。与此同时,种子含水量随着吸水时间的延长而逐渐增加,吸水至298h,种子的含水量为77.94%,此时种子开始萌发(表1)。
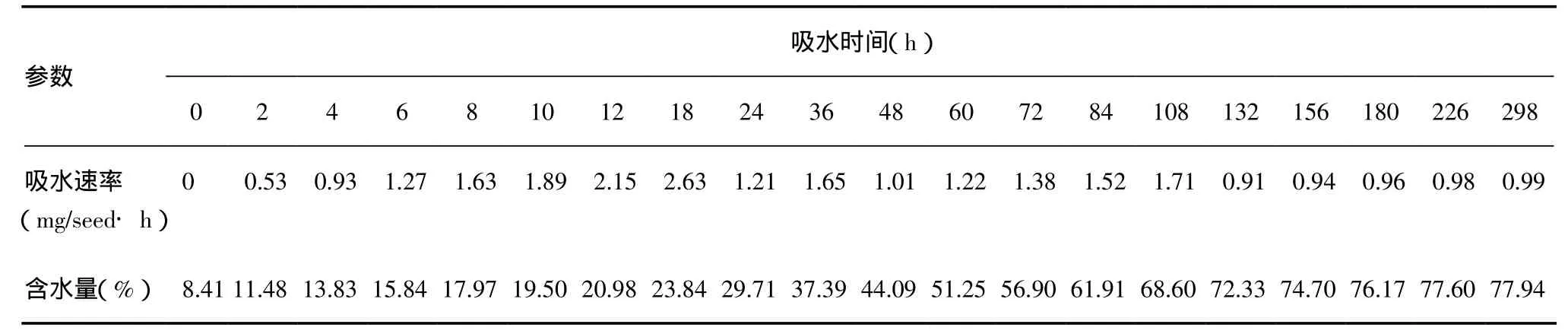
表1 凤丹种子的水分吸收进程
2.2 温度对种子萌发的影响 从表2可知,在15℃下,凤丹种子的初萌期为13d,13~23d种子萌发较快,23~31d种子萌发减慢,第31天萌发结束,最终萌发率为58.0%。在20℃下,初萌期为11d,11~15d种子萌发慢,15~37d种子萌发较快,37d时萌发率为92.7%,52d萌发结束,萌发率为94.7%(表2)。在25℃下,初萌期为25d,种子萌发较慢,37d萌发结束,萌发率仅有10.7%。在30℃下,种子不萌发,部分种子腐烂。表明20℃为凤丹种子萌发的适宜温度。
将在15℃、20℃、25℃和30℃下萌发52d未萌发的种子转移至20℃下继续萌发,观察对逆境温度的修复。结果发现:经15℃萌发52d的未萌发种子转移至20℃下继续萌发30d,种子萌发率不变;25℃和30℃下未萌发的种子转移至20℃下,其萌发率分别由10.7%提高到58.0%,由0提高到56.0%(表2)。
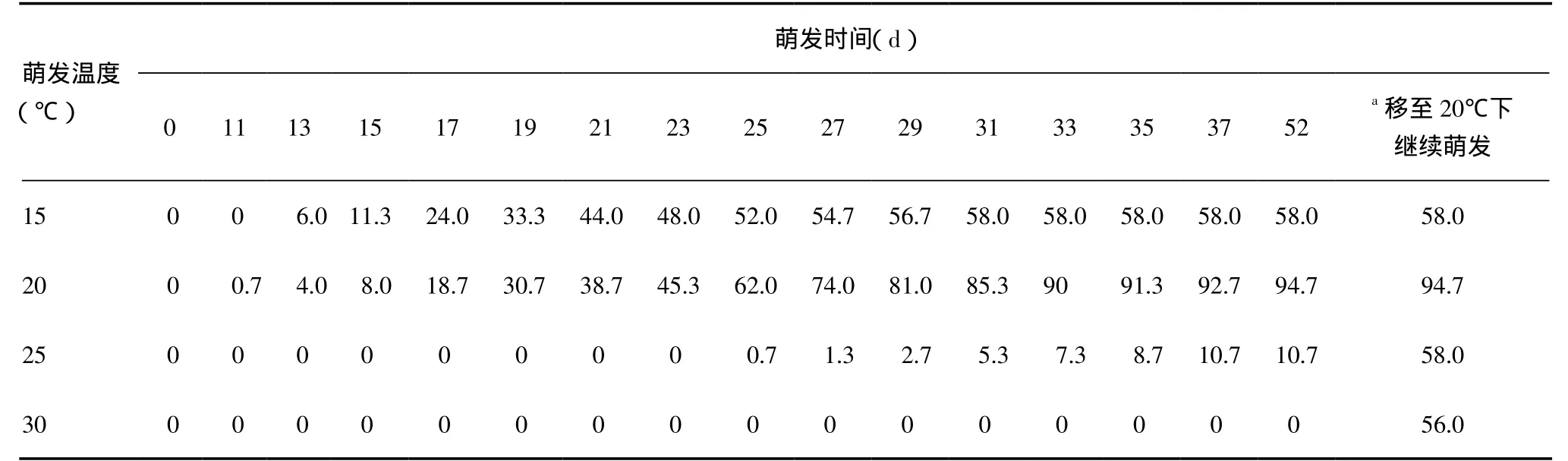
表2 不同温度下凤丹种子的萌发进程 (%)
不同温度下不同萌发时间凤丹种子胚根的长度及其百分率观察表明:15℃和20℃下有利于根的生长,25℃下根的生长受到抑制;20℃比15℃较为有利,例如在20℃下根长大于5cm的比例为13.7%,高于15℃下的1.2%(表3、表4)。观察试验表明,在20℃下部分根已经长出多条侧根。可见,20℃为凤丹种子萌发的适宜温度。

表3 不同温度下不同萌发时间凤丹种子胚根的长度 (cm)

表4 萌发37d时凤丹种子根长的范围及其百分率 (%)
2.3 低温处理对解除种子上胚轴生长抑制的影响将不同根长的种子/幼苗于4℃下层积不同时间后,再置于20℃下生长。根长为0cm的种子对4℃处理不起反应;根长为0.2cm和3.0~6.0cm的种子经过4℃处理后,上胚轴生长率随着处理时间的延长而增加(表5)。不同根长的种子一直在20℃下只长根,上胚轴生长受到抑制不生长,且种子均出现不同程度的腐烂。
将不同根长的种子/幼苗置于4℃下生长136d后,根长为0cm、0.2cm和3.0~6.0cm的种子的上胚轴生长率分别为90.7%、98.6%和96.8%(表5),且无种子腐烂;将这些幼苗进行移栽,在恒温光照培养室中培养,均能成活成苗。
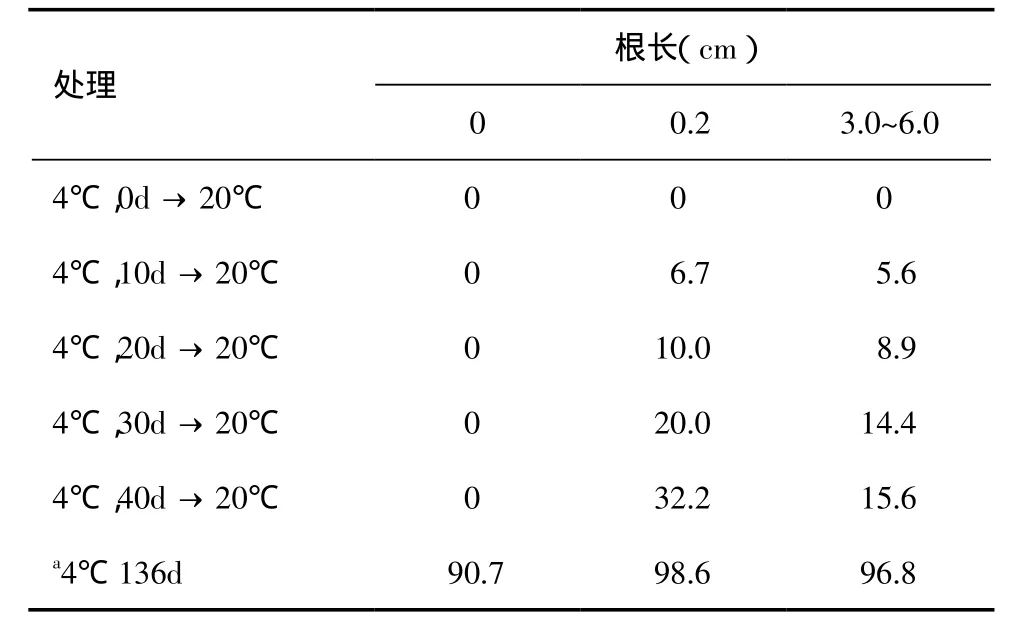
表5 低温处理下不同根长种子上胚轴的生长率 (%)
3 讨论
种子休眠是指具有活力的种子在适宜的萌发条件下暂时不能完成萌发的特性[7]。凤丹种子的含水量随着吸水时间的延长而逐渐增加,表明凤丹种子的种皮是透水的,不存在物理休眠。
本研究表明,在15℃和20℃下,凤丹种子的初萌期分别为13d和15d,萌发至37d时,种子的萌发率分别为58%和92.7%,胚根长分别为3.54cm和3.76cm;表明凤丹种子不存在休眠特性,在适宜的条件下能够正常萌发。这些结果与杨期和等[8]的报道不同,他们认为牡丹种子具有休眠特性,包括胚轴(下胚轴)和胚芽(上胚轴)。在25℃和30℃下未萌发的种子转移至20℃下能使种子恢复萌发,表明凤丹种子具有萌发热抑制现象;结果类似于莴苣种子的萌发热抑制[9]。本研究认为用“上胚轴生长抑制(growth inhibition of epicotyls)”比用“上胚轴休眠(epicotyl dormancy)”更能准确地描述牡丹种子的幼苗生长状态。此外,凤丹种子千粒重为364g,为大粒种子,发芽床不宜为滤纸,而应采用沙床或以珍珠岩、蛭石为基质。
尽管在15℃和20℃下,尤其是在20℃下凤丹种子能够萌发,但上胚轴生长受到抑制;这些结果与郑光华[3]的报道一致。根长为0.2cm和3.0~6.0cm的种子经过4℃处理后上胚轴生长率随着处理时间的延长而增加,根长为0.2cm的种子高于根长为3.0~6.0cm的种子,表明低温处理能有效地解除凤丹幼苗的上胚轴生长抑制。不同根长的种子置于4℃下136d后,种子上胚轴的生长率大于90%,且无种子腐烂,与郑光华[3]、张霁等[4]和林松明等[6]的报道有差异,即凤丹种子萌发到一定阶段后就能感受低温,从而解除上胚轴生长抑制,但其机理有待进一步研究。
[1] 崔亮虎,黄弄璋,刘欣,等.不同贮藏条件对油用牡丹种子出油率的影响[J].中国种业,2016(10):28-30
[2] 刘淑敏,王莲英,吴涤新,等.牡丹[M].北京:中国建筑工业出版社,1987:67-68
[3] 郑光华.几种园林植物种子休眠与发芽生理的研究[J].园艺学报,1963,2(3):312-313
[4] 张霁,刘心民.低温解除牡丹种子上胚轴休眠的试验[J].浙江农业科学,2008(3):295-296
[5] 张玉刚,郭绍霞,王莲英.牡丹容器育苗的初步研究[J].中国农学通报,2004,20(1):182-184
[6] 林松明,徐迎春,蔡仁志,等.打破凤丹种子上胚轴休眠的研究[J].江苏农业科学,2006(1):84-86
[7] Bewley J D,Bradford K J,Hilhorst H W M,et al.Seeds,physiology of development,germination and dormancy[M].3rd edition.New York:Springer,2013
[8] 杨期和,叶万辉,宋松泉,等.植物种子休眠的原因及休眠的多形性[J].西北植物学报,2003,23(5):837-843
[9] Wang W Q,Song B Y,Deng Z J,et al.Proteomic analysis of Lactuca sativa seed germination anad thermoinhibition by sampling of individual seeds at germination and removal of storage proteins by PEG fractionation[J].Plant Physiol,2015,167:1332-1350
2017-03-31)
