不同组织来源间充质干细胞体外成骨分化能力的比较研究
2017-08-07赵刚刘微微高伟玮马洁
赵刚 刘微微 高伟玮 马洁
天津市康婷生物工程有限公司,天津 300385
骨组织缺损是一种因外伤、肿瘤切除、感染等因素引起的骨质流失从而形成的较大间隙,这一问题在临床较为常见并且较难处理[1,2]。随着骨组织工程技术的不断发展,这一问题得到了一定程度的解决。骨组织工程需要可降解的支架材料和合适的种子细胞。可降解支架材料研究的人员越来越多,取得的成果也十分显著,但是种子细胞的选择一直困扰着研究人员。早期研究人员选用骨细胞和骨基质细胞作为种子细胞,但是这种细胞取材困难,体外增殖能力较弱,不易作为真正的种子细胞[3]。随后,研究人员将骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)作为种子细胞应用于骨组织工程,以此来修复骨缺损,并且取得了一定的成效,但是BMSCs的活力及细胞数量与供体年龄呈负相关,限制了其的应用[4-8]。因此,寻找一种替代BMSCs的细胞势在必行。经研究证实分离培养脂肪间充质干细胞(adipose-derived stem cells,ASCs)和脐带间充质干细胞(human umbilical cord mesenchymal stem cells,UC-MSCs)的方法简便,分离培养出的细胞在体外具有较强的增殖能力、多向分化潜能以及低免疫原性等优点[9-12]。因此,ASCs和UC-MSCs被认为是骨组织工程中非常有前景的种子细胞。有研究表明,I型胶原(COL I)是骨组织标志性代表因子,ALP是骨再生早期的代表性因子,骨钙素(OCN)是骨再生后期代表性因子,Osterix是骨再生过程调控骨基质形成的转录因子[13-16]。因此,本研究旨在通过对ASCs、BMSCs和UC-MSCs体外成骨能力的研究寻找优势干细胞种类,为骨组织工程修复骨缺损提供一定的数据支持。
1 材料和方法
1.1 材料
1.1.1主要试剂:DMEM/Ham’sF-12、磷酸缓冲液(Hyclone公司);胎牛血清(百灵公司);青链霉素(华北制药);cck-8(上海同仁);I型胶原酶、胰蛋白酶、碱性磷酸酶试剂盒、茜素红(Sigma);Trizol(Invitrogen公司);real-time PCR试剂盒SYBR Premix Ex TaqTMII、反转录试剂盒PrimScriptTMRT Master Mix(TakaRa公司);CD14-PE、CD34-PE、CD44-PE、CD45-PE、CD90-PE、CD105-PE(BD公司);Ficoll淋巴分离液(GE公司),氯化十六烷基吡啶(上海试剂一厂)。
1.1.2组织:脂肪、骨髓和脐带组织,取自天津市中心妇产科医院。
1.2 方法
1.2.1细胞培养:脂肪间充质干细胞的分离培养:获取无菌的脂肪组织,无菌条件下将脂肪组织剪碎,加入0.075%的I型胶原酶,消化90 min;1500 r/min离心5 min,弃上清和未消化的脂肪组织;磷酸缓冲液重悬沉淀,1500 r/min,离心5 min;完全培养液(DMEM/F-12+10%FBS)重悬沉淀,计数,将细胞以1×106/cm2接种至培养瓶中培养,3d后换液,去除未贴壁的细胞。
脐带间充质干细胞的分离培养:获取无菌的脐带组织,无菌条件下剥离脐带组织的外膜和脐带组织内动、静脉,分离出华通氏胶并剪碎至2~3 mm3,将剪碎的华通氏胶组织块贴于培养瓶底面,2 h后向培养瓶内添加适量完全培养液,1 w之后换液。
骨髓间充质干细胞的分离培养:获取无菌的骨髓,用磷酸缓冲液冲洗骨髓,1500 r/min离心5 min,去上清;加入与沉淀等体积的磷酸缓冲液,混合均匀;按照骨髓:Ficoll=1∶1的体积比例,将骨髓缓慢加入Ficoll液面上,2000 r/min离心20 min;吸取间白膜层单核细胞,加入磷酸缓冲液冲洗,1500 r/min离心5 min,弃上清;用完全培养液重悬沉淀,计数,以1×106/cm2的细胞密度接种至培养瓶中进行培养。
上述3种细胞于37℃,5%CO2的培养箱中培养。
1.2.2细胞增殖能力测定:取P3代上述3种MSCs,并以2×103个/孔接种至96孔板,采用CCK8法连续8d测定其吸光值。
1.2.3细胞表型鉴定:取P3代MSCs,待细胞长至80%~90%时,用0.25%胰蛋白酶+0.02%EDTA室温消化2 min,1500 r/min,离心5 min;收集沉淀,磷酸缓冲液重悬细胞,过40 μm滤网,制成单细胞悬液,计数,加入FBS进行封闭;弃去FBS,用磷酸缓冲液清洗3次;将细胞制成1×108/L的细胞悬液,取100μL分别加入相应量的PE标记鼠抗人抗体CD14、CD34、CD44、CD45、CD90和CD105,避光40 min,离心,磷酸缓冲液清洗1次;上流式细胞仪进行检测分析。
1.2.4细胞成骨诱导后染色鉴定:取P3代MSC以一定密度接种至6孔板中,次日实验组更换为成骨诱导液(10 mmol/Lβ-甘油磷酸、10-7mol/L地塞米松、50 μg/mL抗坏血酸),对照组更换为H-DMEM+10%FBS,3 d更换1次成骨诱导液,成骨诱导9d后做碱性磷酸酶染色;3种MSCs成骨诱导后茜素红染色鉴定:茜素红染色后定量分析时,使用氯化十六烷基吡啶溶解钙结节,570 nm处测OD值。
1.2.5细胞成骨诱导后分子水平鉴定:采用Trizol法提取3种MSCs成骨诱导9 d和18 d后细胞RNA,按照反转录试剂盒合成cDNA,然后进行RT-qPCR。引物设计:按照NCBI GenBank的人COL1、ALP、Osterix、OCN和GAPDH的mRNA序列,排除与人其他基因的同源性后设计、合成引物。

表1 3种骨再生相关基因PCR引物Table 1 The PCR primers of osteogenesis-related genes
RT-qPCR反应条件:95℃预变性5 min;95℃变性30 s;55退火30 s;72延伸45 s;39个循环。
1.3 统计学处理
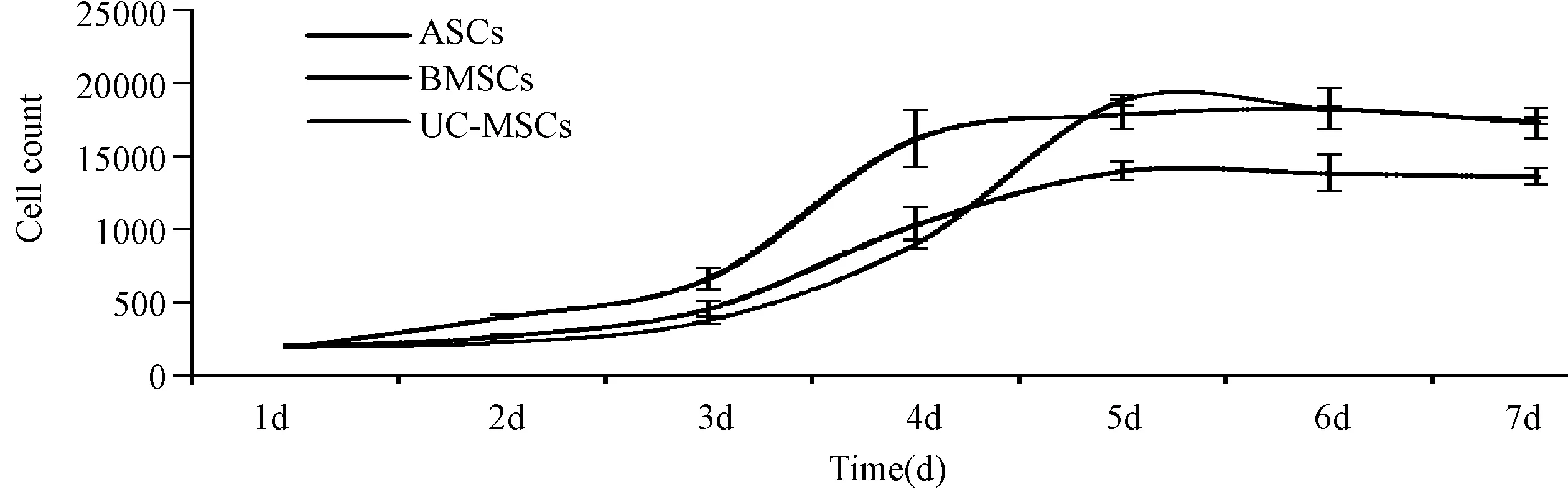
图2 3种MSCs增殖曲线Fig.2 The growth curve of the three MSCs cells

图3 3种MSCs的流式检测A:ASC0s,B:BMSCs,C:UC-MSCsFig.3 The flow cytometry analysis of the three MSCs
2 结果
2.1 细胞培养
P3代三种MSCs倒置显微镜下观察到的细胞形态,细胞均呈长梭状,集落式旋涡式生长。
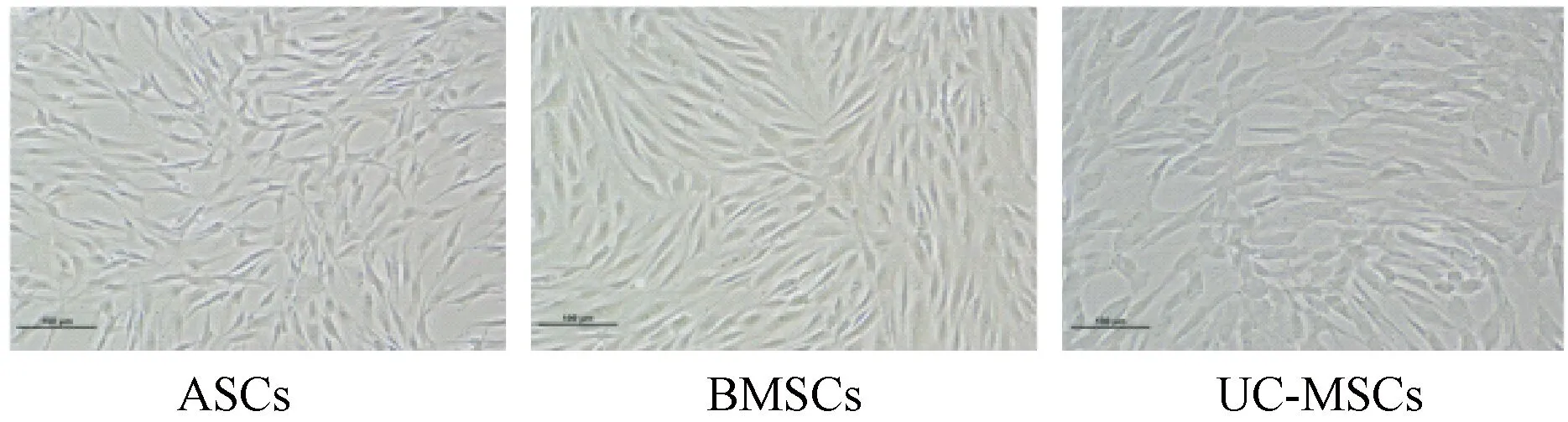
图1 3种MSCs倒置显微镜下观察到的细胞形态(100×)Fig.1 The cell morphology of the three MSCs under phase contract microscope (100×)
2.2 细胞增殖能力比较
3种P3代MSC传代后1~3 d处于潜伏期,此时细胞没有明显的增殖;3~5 d进入对数生长期,此时细胞增殖活跃;5 d之后细胞进入平台期,细胞增殖趋于平缓。
2.3 细胞表型的鉴定
P3代ASCs、BMSCs和UC-MSCs流式鉴定结果,CD14、CD34和CD45表达率均低于1%,CD44、CD90和CD105的表达率均高于97%。

图4 三种MSCs成骨诱导9dALP染色(100×)Fig.4 ALP staining of the three MSCs cells (100×)

图5 3种MSCs成骨诱导18 d茜素红染色(100×)Fig.5 Alizarin red staining of the three MSCs cells (100×)
2.4 细胞成骨诱导后染色鉴定MSCs成骨诱导9 d后染色
2.4.1ALP染色:P3代3种MSCs成骨诱导9d后碱性磷酸酶(ALP)染色,实验组细胞内均有大量成骨分化蛋白ALP表达。
2.4.2茜素红染色:P3代3种MSCs成骨诱导18 d后茜素红染色可以看到实验组有大量矿化钙结节产生(如图5),BMSCs成骨诱导所形成的矿化钙结节与UC-MSCs无显著性差异,但显著性高于ASCs(如图6)。
2.5 细胞成骨诱导后分子水平比较
2.5.1细胞成骨诱导9 d:P3代3种MSCs成骨诱导9 d后,实验组COLI、ALP和Osterix 3种基因均高表达(如图7);3种MSCs成骨诱导9 d后,UC-MSC实验组的COLI基因表达显著性高于BMSCs,ASCs和UC-MSCs实验组的ALP基因表达显著性低于BMSCs,ASCs实验组的Osterix基因表达显著性低于BMSCs,UC-MSCs实验组的Osterix基因表达与BMSCs无显著性差异(如图8)。
2.5.2细胞成骨诱导18 d:P3代3种MSCs成骨诱导18d后,实验组COLI、OCN和Osterix 3种基因均显著性高表达(如图9);ASCs和UC-MSCs实验组的COLI基因表达显著性高于BMSCs,ASCs和UC-MSCs实验组的OCN基因表达显著性低于BMSCs,ASCs实验组的Osterix基因表达与BMSCs无显著性差异,UC-MSCs实验组的Osterix基因表达显著性低于BMSCs(如图10)。

图6 3种MSCs矿化能力的定量分析Fig.6 Quantitative analysis of the mineralization ability in three MSCs*P<0.05 compared with BMSCs group
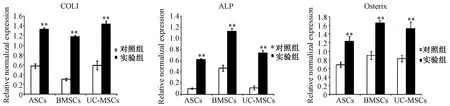
图7 3种MSCs成骨诱导9d后COLI、ALP和Osterix基因表达Fig.7 The gene expressions of Osterix, ALP, and COL1 in three MSCs induced after 9 days**P<0.01compared with control group

图8 比较3种MSCs成骨诱导9d后COLI、ALP和Osterix基因的表达(P<0.05)Fig.8 Comparison of the gene expressions of COLI, ALP, and Osterix among the three MSCs induced after 9 days*P<0.05 compared with BMSCs
3 讨论
自体BMSCs作为骨组织工程治疗骨缺损的金种子细胞,但是自体BMSCs存在着取材难、易对患者带来二次伤害等不足之处[8,9]。本研究希望通过对不同来源MSCs体外成骨能力的比较,找到一种优势干细胞作为骨组织工程的种子细胞。
本研究通过体外实验,发现3种MSCs细胞均呈长梭型,且细胞呈漩涡式生长;3种MSCs的P3代细胞在3~5 d处于对数生长期,说明3种MSCs在体外增殖方面无显著性差异。通过流式细胞仪检测3种MSCs表面标志物,发现3种MSCs细胞表面均表达CD44、CD90和CD105且表达率均高于97%,说明ASCs和UC-MSCs与BMSCs在细胞表面标志物表达方面无显著性差异,均属于MSCs范畴。进一步通过体外染色实验发现3种MSCs成骨诱导后,实验组细胞内均表达成骨分化蛋白ALP和矿化蛋白。茜素红染色后定量分析发现UC-MSCs和BMSCs在钙结节形成方面无显著性差异。
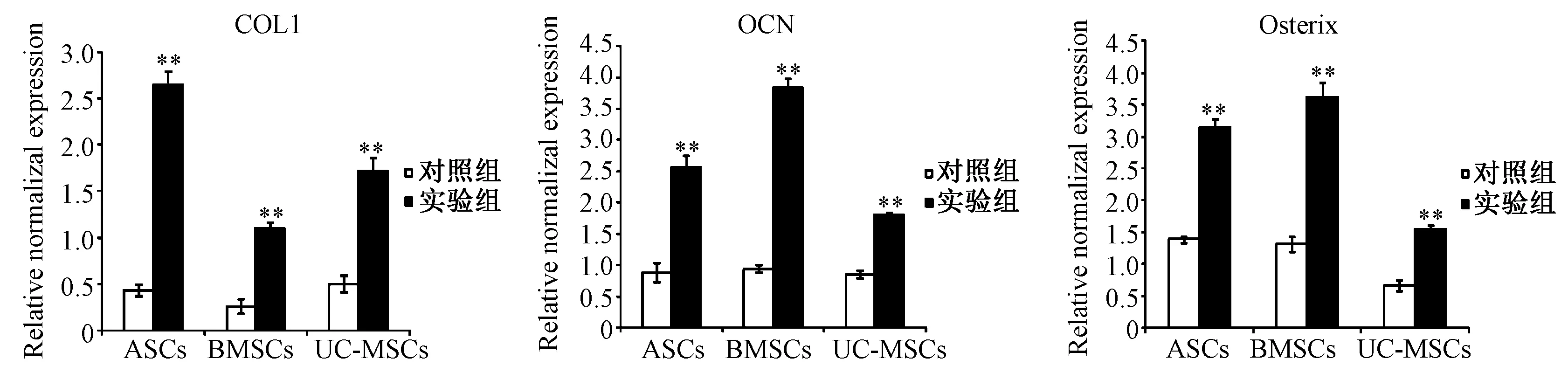
图9 3种MSCs成骨诱导18 d后COLI、OCN和Osterix基因表达Fig.9 The gene expressions of Osterix, ALP, and COL1 in three MSCs induced after 18 days**P<0.01compared with control group
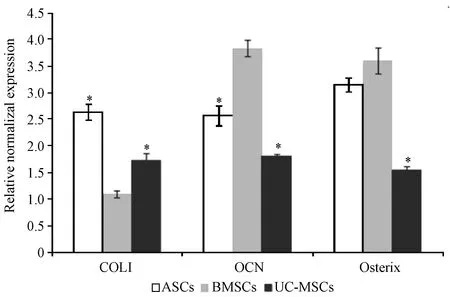
图10 比较3种MSCs成骨诱导18 d后COLI、OCN和Osterix基因的表达Fig.10 Comparison of the gene expressions of COLI, ALP, and Osterix among the three MSCs induced after 18 days*P<0.05 compared with BMSCs
经研究证实骨再生过程经历了早期和后期两个阶段,ALP是骨再生早期的代表性因子,骨钙素(OCN)是骨再生后期的代表性因子,COL1是骨组织再生过程以及骨组织的代表性因子,Osterix基因是在骨再生过程中调控骨基质的形成[17-21]。本研究采用实时荧光定量PCR法比较3种MSCs经成骨诱导后Osterix、ALP、OCN和COLI基因的表达,比较结果发现3种MSCs实验组的四种与骨再生相关的基因均显著性高表达于对照组。而ASCs和UC-MSCs实验组的ALP和OCN基因的表达显著性低于BMSCs组;但是比较COLI基因的表达,发现ASCs和UC-MSCs较BMSCs显著性高表达;比较Osterix基因的表达,发现成骨诱导9d时,ASCs的Osterix基因较BMSCs显著性低表达,但是成骨诱导18d时,ASCs实验组的Osterix基因较BMSCs显著性高表达;由此说明3种MSCs经成骨诱导后,其成骨再生相关基因表达的时序性存在着一定的差异。由此得出ASCs和UC-MSCs经过成骨诱导后,决定成骨再生相关因子的基因与BMSCs诱导组基因表达趋势相一致,进一步说明ASCs和UC-MSCs可替代BMSCs作为骨组织工程的种子细胞来治疗骨缺损。
本研究将为骨组织工程选择种子细胞提供新的思路,为临床上应用骨组织工程治疗骨缺损提供可靠的数据支持,为骨组织工程更好的治疗骨缺损提供帮助。
