雌激素与尾悬吊法导致雄性C57小鼠骨质疏松关系的研究
2017-08-06程强康文博孟嘉李硕刘刚赵建宁
程强 康文博 孟嘉 李硕 刘刚 赵建宁*
1. 南京大学医学院附属金陵医院骨科,江苏 南京 210046; 2. 第四军医大学基础部药理学教研室,陕西 西安 710032
骨质疏松以骨含量下降,骨结构退化为基本特征,往往引发疼痛和骨折[1]。目前大多数研究集中于卵巢切除和绝经后导致的骨质疏松,男性骨质疏松方面的研究较少。男性在青年时期可比女性获得更高的骨量峰值,并且男性出现骨量丢失的开始时间迟于女性,但骨质疏松性骨折给男性患者造成损伤丝毫不逊于女性[2]。过去的观点认为雄激素水平下降在男性原发性骨质疏松过程中发挥了主导作用[3]。最新研究发现,雄激素完全不敏感综合征患者仍具有正常生长体形和骨骼成熟,且单一的雄激素不能弥补由于雄激素受体功能丧失的骨质丢失[4],表明雄激素在维持骨量过程中的作用可能没有我们想象中的那么强大。在雌激素缺乏性骨质疏松模型中,雌激素比雄激素更能有效地反映骨转化水平和骨密度[5,6]。临床研究证实雌激素对绝经后骨质疏松有良好的治疗作用,这一过程主要是通过雌激素受体 (ER)α和β实现对骨骼代谢的调节[7,8],但是其具体作用机制尚未完全明确。
尾悬吊是一种研究失重与废用的方法,最早在1979年由Morey等[9]提出,广泛运用于研究微重力环境下动物肌肉萎缩和骨质疏松方面的研究。不同年龄,性别以及基因背景骨质疏松程度差异性较大,目前以SD或者Wistar大鼠最为常用,但在药物效应评价方面,大鼠骨皮质重建活性较低不利于于评价[10],同为啮齿类动物的小鼠也很常见,其中以个体差异性较小、适应性佳的C57小鼠最为常用[11],处于生长期的小鼠对尾悬吊最敏感[12]。
为了进一步了解雌激素以及雌激素受体在尾悬吊导致的小鼠骨质疏松中的作用,本文在前期建立C57小鼠骨质疏松模型基础上,通过给予雌激素以及雌激素受体拮抗剂ICI182,780干预,探讨雌激素对雄性C57小鼠骨质疏松的作用及其内在机制。
1 材料和方法
1.1 实验分组和造模
32只10周龄雄性C57BL/6J小鼠22~23 g,由第四军医大学实验动物中心提供。小鼠适应性饲养1w后按照随机数表法分为4组,即对照组(control,C),模型组(model,M),雌激素组(estrogen,E2),雌激素+雌激素受体抑制剂组(estrogen+ICI182,780,E+I)。根据之前的方法除对照组外建立小鼠尾悬吊模型[13],所用试剂溶于10%乙醇溶液中,C和M组分别皮下注射10%乙醇溶液50 μL/d天,E2组给予雌激素1 μg/d,E+I组分别给予雌激素1 μ和ICI182,780 100 μg/d,持续两周。本实验相关动物使用遵守“第四军医大学动物实验管理条例”。
1.2 主要试剂
兽用雌二醇注射液(杭州动物药品厂),小鼠麻醉剂(5%水合氯醛溶液),雌激素ELISA试剂盒(武汉博士德生物工程有限公司),小鼠TRAP,OPG,NMDA免疫组化染色试剂盒(中杉金桥),ICI182,780(北京乐博生物科技有限公司),小鼠NR2A、Runx2-抗(美国abcam公司),小鼠来源二抗(西安壮志生物科技有限公司)。
1.3 标本采集
所用实验动物于第15d脱颈致死,取小鼠眼球血后离心得血清置于-20℃保存,用于ELISA试剂盒检测血清中雌激素水平,取双侧股骨用0.9%氯化钠注射液浸润的纱布包裹,保存于-70℃。
1.4 Micro CT扫描及重建分析
显微CT是一种非侵入性评估手段,为骨质疏松程度提供准确的定性及定量分析[14]。每组取4根右侧股骨,用小动物显微CT(Inveon,德国西门子公司)扫描重建。选取股骨髁生长板近端0.5~1.5 mm处和股骨正中1.0 mm区域作为兴趣区(region of interest,ROI)分析小梁骨相对体积(bone volume/total volime,BV/TV)、小梁骨数量(trabecular bone number,Tb.N)、小梁骨分离度(trabecular bone separation,Tb.Sp)、小梁骨厚度(trabecular bone thickness,Tb.Th),皮质骨BMD(bone mineral density),表长度(cortical area,Ct.Ar)、厚度(cortical thickness,Ct.Th)等指标。采用Mimics软件(版本10.0,美国Materialise公司)建立ROI三维图像。
1.5 生物力学检测
每组取4根左侧股骨,利用电子三点弯曲疲劳试验机(型号ELF3520,美国BOSE公司)进行三点弯曲测试,测试股骨中段生物力学性能。参数设置:速度1.2 mm/min,跨距8 mm至股骨断裂。随后使用游标卡尺量取断端内外径以及皮质骨厚度,重复3次取平均值。直接记录最大载荷(nax loading),根据检测结果绘制载荷-变形曲线计算弯曲弹性模量(Elastic modulus)[13]。
1.6 形态学检查
取各组剩余的右侧股骨,固定于4%多聚甲醛溶液中,EDTA脱钙,石蜡包埋[13],沿冠状面切片进行OPG、TRAP以及NMDA免疫组化染色,分别观察成骨、破骨细胞形态以及NR2A受体表达情况。每根股骨各选取三张400倍镜染色图片,使用Image Pro Plus图像分析软件(版本6.0,美国Cybernetics公司)统计骨表面成骨细胞数(N.Ob/BS)以及破骨细胞数(N.Oc/BS)并取平均值,测量三张片子NR2A平均光密度值。
1.7 蛋白免疫印迹(Western blotting)
取各组剩余的左侧股骨,选定股骨远端1.5 mm区域的骨,剔除骨膜,PBS冲洗骨髓腔,用锡箔纸包裹后置于-70℃保存12 h后置于液氮中。用研磨方法提取骨蛋白[15],并转移到PVDF膜上,5%脱脂牛奶洗封闭,NR2A、Runx2一抗孵育过夜,抗鼠二抗孵育1 h以上。β-actin作为内参,将对照组β-actin的光密度值设为1,使用Tanon 5200全自动化学发光成像分析系统进行拍摄和分析。
1.8 统计学处理

2 结果
2.1 一般状况
小鼠一般状态良好,无意外死亡,体重及血清雌激素变化见表1,尾悬吊小鼠3 d后体质量达到最低点,随后缓慢上升,至14 d时M组小鼠体重仍显著低于C组(P<0.05),但是与E+I组相比,差异无统计学意义。M组小鼠血清雌激素水平较C组显著下降,差异有统计学意义(P<0.05),而E+I和E组小鼠血清雌激素含量显著高于C和M组。

表1 不同组小鼠体质量与雌激素水平±s)Table 1 Changes of mice body weight and estrogen level in different groups(±s)
与C组比较,*P<0.05,**P<0.01;与M组比较,#P<0.05,##P<0.01,下同。
2.2 显微CT扫描
显微CT扫描结果见表2,M组小梁骨多数参数下降,与C组相比差异具有统计学意义。E组各项参数显著改善并好于M组,与C组相比差异无统计学意义,E+I组各参数水平与M组类似。M组皮质骨BMD较C组下降明显,E组皮质骨有部分指标好于C组。E+I组的皮质骨指标较C组和E组明显下降,但是与M组相比差异无统计学意义。图1可见M组和E+I组股骨远端骨小梁区域较C组破坏,空洞明显,各组皮质骨结构完整但M组和E+I组明显变薄。

表2 不同组小鼠小梁骨和皮质骨参数±s)Table 2 Changes of trabecular bone parameters in different groups(±s)

图1 不同组小鼠股骨ROI三维重建图像示意图Fig.1 3D pictures of ROI of the femur in different groups
2.3 生物力学检测
生物力学检测结果见表3,尾悬吊导致M组和E+I组的生物学指标显著下降,其中最大载荷、弹性模量等指标较C组显著下降,M组与E+I组相比差异无统计学意义。
2.4 形态学变化
图3为不同组股骨远端形态学示意图,统计各组单位长度内成骨细胞数(表5),发现M组显著低于C组,差异有统计学意义,而E组成骨细胞数较M组显著上升,使用雌激素抑制剂干预之后,成骨细胞数目明显下降;统计各组单位长度内破骨细胞数(表5),M组中破骨细胞数较对照组增多,而E组和E+ICI组中破骨细胞数无明显变化。统计不同组NR2A平均光密度值(表5),M组较C组显著下降,雌激素干预后E组显著上升,应用雌激素受体抑制剂后上升势头得到抑制。

表3 不同组小鼠股骨生物力学指标±s)Table 3 Mechanical properties of the femur in different groups(±s)
2.5 WB
图3A是不同组小鼠骨蛋白的表达示意图,可见尾悬吊2 w后,M组NR2A(图3B)以及Runx2蛋白(图3C)表达显著降低,E组表达升高,使用雌激素受体抑制剂后,上述蛋白表达水平受到抑制。
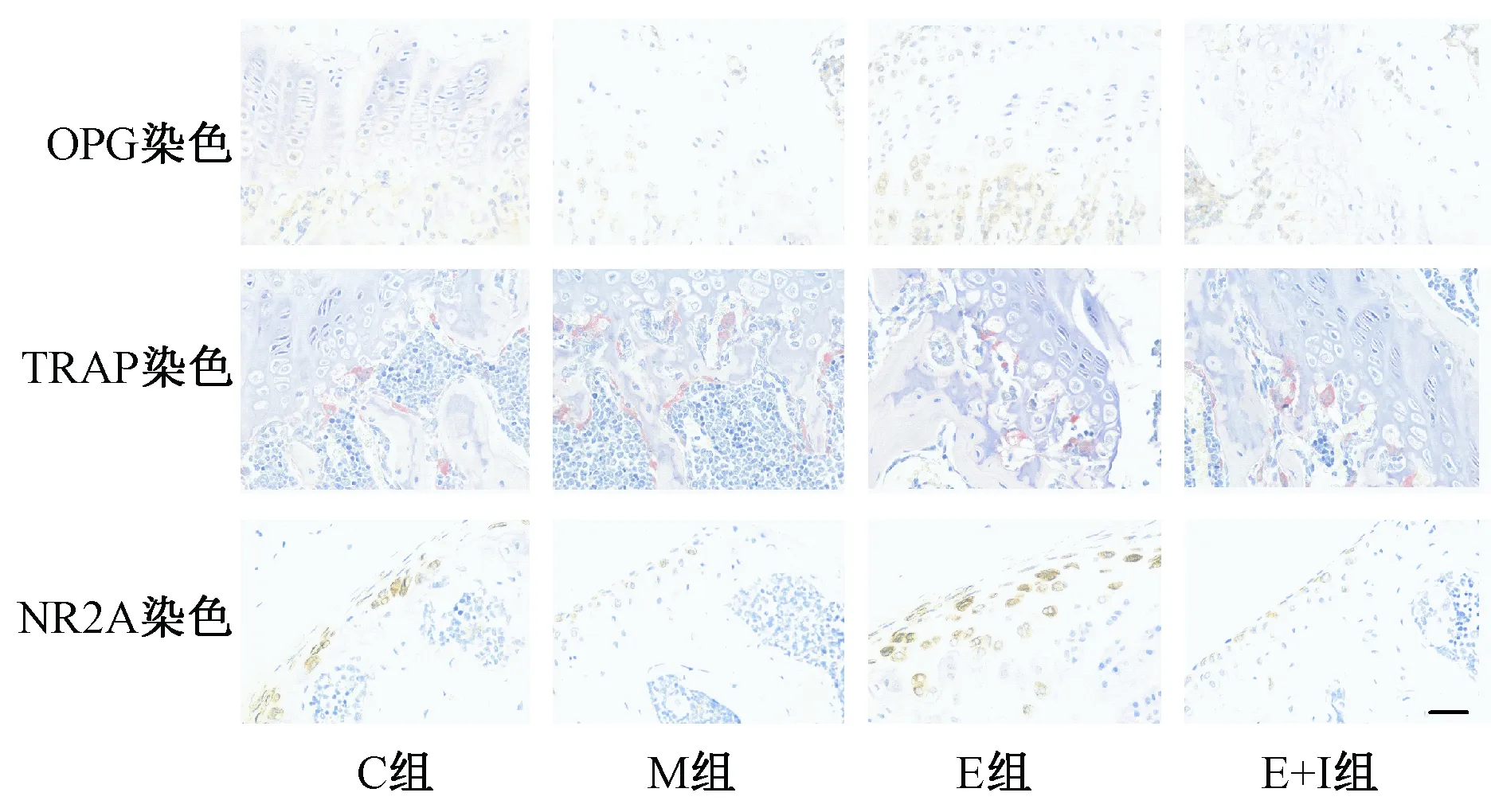
图2 不同组小鼠股骨远端形态学示意图(n=4,比例尺:200 μm)Fig.2 Morphological changes of the distal femur in different groups (n=4, scale bar: 200 μm)
表5 不同组小鼠骨小梁成骨细胞和破骨细胞计数±s)Table 5 Number of osteoblasts and osteoclasts in the trabecular bone in different groups(±s)

图3 不同组小鼠骨相关蛋白表达Fig.3 Expression of osteogenesis-associated proteins in different groups
3 讨论
尾悬吊两周就能引起小鼠骨质的显著丢失,其具体机制尚未完全清楚。雌激素作为一种内源性激素,具有较好的耐受性,对绝经后骨质疏松等高代谢型骨质疏松有较好的治疗效果[16]。研究发现雌激素在雄性体内具有重要作用,且这一过程与雌激素受体的表达水平密切相关[17]。性激素主要来源于睾丸,卵巢,少部分来源于肾上腺。啮齿类动物因其特殊的生理构造,悬尾状态下雄鼠的睾丸会回缩进入腹腔,造成睾酮合成水平下降[18],而雄鼠体内的雌激素大部分由睾酮转化而来,因而悬尾的直接后果导致了体内雌激素水平的明显下降,这与本文的研究结果相符,悬尾两周后M组小鼠雌激素水平较C组下降了50%左右。
雌激素是脂溶性且易被胃酸分解,本文中将雌激素溶于花生油中,并通过皮下注射的方式进行给药,既提高了药物吸收率又避免肌肉注射引起局部组织坏死。在剂量选择方面参照文献[19],该生理剂量的雌激素已经被证实具有较好的骨量、骨显微结构保护作用。ICI182,780是一种非特性雌激素受体抑制剂,能够无差别阻断ERα和β[20]。研究发现雌激素受体缺陷患者,其体内雌激素水平正常,但是骨质流失现象却十分严重[21],而在芳香化酶缺陷的患者中,雄激素正常而雌激素水平偏低,同样也存在此现象,此外ERα、β基因敲除小鼠也出现了骨质疏松[22]。本文发现补充外源性雌激素之后,能较好地抑制骨质流失,较对照组并未出现显著骨容量下降。使用雌激素受体抑制剂干预后骨质流失并未得到显著改善,表明在此过程中雌激素通过雌激素受体发挥骨保护作用。
谷氨酸是一种突触兴奋性递质,通过调节cbfa1/Runx2信号通路促进骨组织中成骨细胞的增殖和分化[23],介导谷氨酸释放的离子型谷氨酸受体NMDA受体的亚型2A(NR2A)表达十分活跃[24]。本文中发现尾悬吊2w后,M组小鼠股骨远端NR2A表达量显著下降,E组表达水平明显回升并超过C组,E+I组的NR2A仍处于较低水平。反映成骨细胞增殖分化活性的重要分子Runx2,其表达趋势与NR2A基本一致,表明雌激素与雌激素受体结合后,可能参与了促进NMDA受体激活和谷氨酸释放的过程,最终引发成骨细胞增殖。
男性随着年龄增长体内雄激素水平逐渐下降,但是雌激素水平在青年与老年时期差别大不,这部分解释了老年男性发生发生骨质疏松的概率低于老年女性[25],因此将雌激素水平作为判定骨质疏松的指标比雄激素更加具有说服力。本文发现使用雌激素受体抑制剂之后,雌激素抗骨质疏松的效应基本丧失,说明雌激素受体在抗骨质疏松中过程中起关键作用,雌激素和雌激素受体两者作用相辅相成,缺一不可。但是长期运用雌激素来的不良反应,大大限制了其在临床的运用。本文发现雌激素发挥骨质疏松作用,可能是通过促进NR2A受体表达刺激谷氨酸释放来实现的,这就为将来寻找新型抗骨质疏松药物提供了思路:直接调节NMDA受体的药物可能具有类雌激素效应,同时也避免了运用雌激素带来的不良反应。
综上,本实验发现在尾悬吊导致的雄性小鼠骨质疏松模型中,雌激素通过雌激素受体,可能参与激活骨组织中的NR2A表达升高,促进成骨细胞增殖和分化,发挥骨保护的作用。本文进一步确认了雌激素在雄性小鼠抗骨质疏松过程中的重要作用,同时为未来寻找适合的骨质疏松药物提供了一个新的思路。
