5种酢浆草属植物对低温胁迫的生理响应及抗寒性评价1)
2017-08-01李文明魏一粟钱燕萍田如男
李文明 魏一粟 钱燕萍 田如男
(南京林业大学,南京,210037)
5种酢浆草属植物对低温胁迫的生理响应及抗寒性评价1)
李文明 魏一粟 钱燕萍 田如男
(南京林业大学,南京,210037)
以5种酢浆草属植物为试验材料,通过人工低温和自然低温处理,观测形态特征,测定相对电导率、丙二醛(MDA)质量摩尔浓度、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、可溶性蛋白质量分数、游离脯氨酸质量分数和叶绿素质量分数等指标,评价其抗寒性。结果表明:在人工低温处理下,随着处理温度的降低,5种植物的生理生化指标变化趋势基本一致,相对电导率呈上升趋势;MDA质量摩尔浓度呈先下降后上升再下降趋势;SOD活性、POD活性、可溶性蛋白质量分数和游离脯氨酸质量分数呈先上升后下降趋势;叶绿素质量分数呈下降或先上升后下降趋势。通过隶属函数法综合评价5种植物的抗寒性可知,在冬季的抗寒性由大到小的顺序为黄花酢浆草、红花酢浆草、大花酢浆草、芙蓉酢浆草、紫叶酢浆草;在春季的抗寒性由大到小的顺序为红花酢浆草、黄花酢浆草、大花酢浆草、紫叶酢浆草、芙蓉酢浆草,这与自然低温处理下观测的结果一致。研究旨在从中筛选出优异抗寒的种质材料,为酢浆草属植物抗寒性研究提供种质材料和理论依据。
酢浆草属;人工低温;生理响应;综合评价;抗寒性
Oxalis; Artificial low temperature; Physiological response; Comprehensive evaluation; Cold resistance
酢浆草属(Oxalis)是酢浆草科最大的属,约有800种植物,广布于世界各地,主要分布在南美洲和非洲南部,尤其是好望角[1]。酢浆草属植物喜向阳、温暖、湿润的环境,抗旱能力强,但不耐寒。鉴于其花色和叶形具有较高的观赏价值,被广泛应用于园林绿化中。从已有资料来看,有关学者从系统分类[2]、繁殖方式[3]、遗传多样性[4]、种质资源保护[5]、ISSR反应体系的建立与优化[6]等方面对酢浆草属植物进行了研究。目前,有关酢浆草属植物的耐旱性和耐盐性研究已有报道[7-8],但有关抗寒性的研究鲜有报道。因此,本试验以5种酢浆草属植物为材料,通过人工低温和自然低温处理,观测形态特征,测定各项生理生化指标,运用隶属函数法综合评价5种酢浆草属植物的抗寒性,旨在从中筛选出优异抗寒的种质材料,为酢浆草属植物抗寒性研究提供种质材料和理论依据。
1 材料与方法
供试材料为红花酢浆草(O.corymbosa)、芙蓉酢浆草(O.purpurea)、黄花酢浆草(O.pes-caprae)、大花酢浆草(O.bowiei)和紫叶酢浆草(O.violacea)的球根繁殖苗,每种植物108盆。8月上旬,将5种植物的球根移栽到口径10 cm、高12 cm的营养钵(盆土为V(泥炭)∶V(珍珠岩)=3∶1的混合基质),置于南京林业大学园林国家级实验教学示范中心通风良好、光照充足的位置,常规养护。植株生长至11月上旬成苗,冠幅≥15 cm。
分别于12月15日和翌年4月6日进行人工低温处理,以未经人工低温处理的为对照。每个处理3盆,重复3次。将试验材料全株带盆放入海尔程控冰箱,在0 ℃处理24 h后,取出第1组样品;继续降温至-3 ℃,停留24 h后取出第2组样品;以此类推,直到降温至-12 ℃,停留24 h后取出第5组样品。取出的样品置于冰箱内解冻4 h,然后置于室温下恢复10 h,观测并记录形态特征,选取成熟叶(去除主脉)测定生理生化指标。
参照李合生[9]的方法,测定相对电导率、丙二醛质量摩尔浓度、可溶性蛋白质量分数、游离脯氨酸质量分数、超氧化物歧化酶活性、过氧化物酶活性、叶绿素质量分数等指标。
半致死温度计算:应用电导法配以Logistic方程Y=K/(1+ae-bx)(Y为人工低温处理下的相对电导率;x为处理温度;K、a、b均为参数)利用方程拐点求得5种植物的半致死温度(LT50)[10]。
抗寒性综合评价:应用模糊隶属函数法综合评价5种植物的抗寒性。指标与抗寒性呈正相关时,采用的公式为X(μ)=(Xij-Xmin)/(Xmax-Xmin);指标与抗寒性呈负相关时,采用的公式为X(μ)=1-(Xij-Xmin)/(Xmax-Xmin)。其中,Xij为某指标的测定值;Xmax为对应指标的最大值;Xmin为对应指标的最小值;X(μ)为隶属函数值[11]。通过主成分分析计算各指标的权重系数,再乘以对应指标的隶属函数值,并累加求和计算综合评定值,其值越大,抗寒性越强。
数据分析:试验数据用Microsoft Excel 2010和SPSS17.0统计软件进行计算和方差分析。
2 结果与分析
2.1 低温处理对5种酢浆草属植物的半致死温度的影响
在人工低温处理下,5种植物的相对电导率随着处理温度的降低呈S型曲线上升。在冬季人工低温处理下,红花酢浆草、芙蓉酢浆草、黄花酢浆草、大花酢浆草、紫叶酢浆草的低温半致死温度分别为-9.74、-7.71、-10.22、-8.41、-6.92 ℃,抗寒性由大到小的顺序为黄花酢浆草、红花酢浆草、大花酢浆草、芙蓉酢浆草、紫叶酢浆草;在春季人工低温处理下;5种植物的低温半致死温度分别为-7.13、-2.61、-7.01、-6.22、-4.33 ℃,抗寒性由大到小的顺序为红花酢浆草、黄花酢浆草、大花酢浆草、紫叶酢浆草、芙蓉酢浆草。从表1可知,5种植物在冬季的低温半致死温度低于春季,表明在冬季的抗寒性较春季强。
2.2 低温处理对5种酢浆草属植物的丙二醛质量摩尔浓度的影响
在人工低温处理下,5种植物的丙二醛质量摩尔浓度随着处理温度的降低总体呈先下降后上升再下降趋势(表2)。在冬季人工低温处理下,红花酢浆草、芙蓉酢浆草、黄花酢浆草和大花酢浆草的丙二醛质量摩尔浓度在-9 ℃时达到最大值,分别比对照组高38.07%、31.97%、44.65%和13.45%;紫叶酢浆草在-6 ℃时达到最大值。在春季人工低温处理下,红花酢浆草和芙蓉酢浆草的丙二醛质量摩尔浓度在-3 ℃时达到最大值,分别比对照组高7.47%和85.94%;黄花酢浆草、大花酢浆草和紫叶酢浆草的丙二醛质量摩尔浓度在-6 ℃时达到最大值,分别比对照组高16.80%、38.93%和35.58%(表2)。

表1 5种植物的低温半致死温度(LT50)及拟合度(R2)
2.3 低温处理对5种酢浆草属植物的可溶性蛋白质量分数的影响
在人工低温处理下,5种植物的可溶性蛋白质量分数随着处理温度的降低呈先上升后下降趋势。在冬季人工低温处理下,芙蓉酢浆草和大花酢浆草的可溶性蛋白质量分数在-3 ℃时达到峰值,分别比对照组高15.00%和18.57%;红花酢浆草、黄花酢浆草和紫叶酢浆草的可溶性蛋白质量分数在-6 ℃时达到峰值,分别比对照组高17.82%、11.98%和17.55%。在春季人工低温处理下,大花酢浆草的可溶性蛋白质量分数在0 ℃时达到峰值,比对照组高43.13%;芙蓉酢浆草和紫叶酢浆草的可溶性蛋白质量分数在-3 ℃时达到峰值,分别比对照组高70.16%和14.08%;红花酢浆草和黄花酢浆草的可溶性蛋白质量分数在-6 ℃时达到峰值,分别比对照组高41.39%和22.95%(表2)。
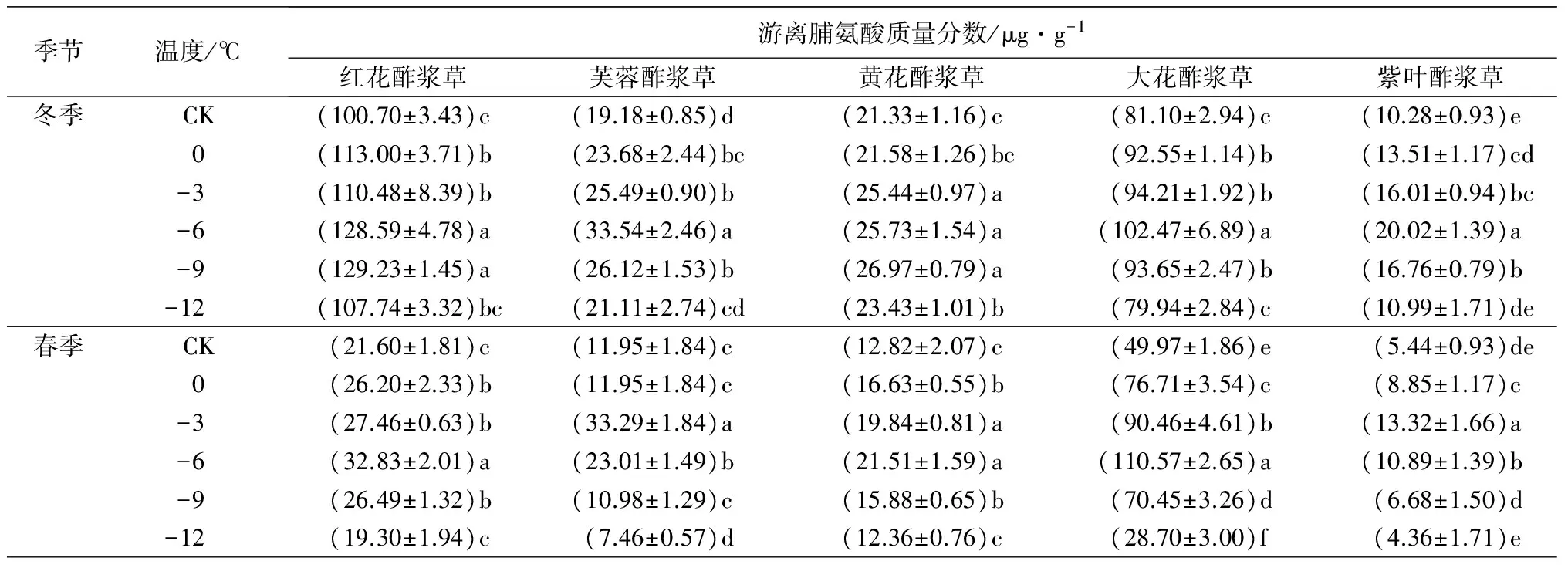
2.4 低温处理对5种酢浆草属植物的游离脯氨酸质量分数的影响
在人工低温处理下,5种植物的游离脯氨酸质量分数随着处理温度的降低呈先上升后下降趋势。在冬季人工低温处理下,芙蓉酢浆草、大花酢浆草和紫叶酢浆草的游离脯氨酸质量分数在-6 ℃时达到峰值,分别比对照组高74.87%、26.35%和94.75%;红花酢浆草和黄花酢浆草的游离脯氨酸质量分数在-9 ℃时达到峰值,分别比对照组高28.33%和26.44%。在春季人工低温处理下,芙蓉酢浆草和紫叶酢浆草的游离脯氨酸质量分数在-3 ℃时达到峰值,分别比对照组高178.58%和144.85%;红花酢浆草、黄花酢浆草和大花酢浆草的游离脯氨酸质量分数在-6 ℃时达到峰值,分别比对照组高51.99%、67.78%和121.27%(表2)。

表2 低温处理对5种酢浆草属植物理化性质的影响

季节温度/℃可溶性蛋白质量分数/mg·g-1红花酢浆草芙蓉酢浆草黄花酢浆草大花酢浆草紫叶酢浆草冬季CK(6.79±0.66)b(3.20±0.27)b(7.26±0.23)c(2.80±0.09)b(8.09±0.02)bc0(7.10±0.64)b(3.57±0.10)a(7.44±0.24)abc(3.30±0.23)a(8.26±0.41)bc-3(7.03±0.20)b(3.68±0.12)a(7.49±0.17)abc(3.32±0.13)a(8.87±0.44)ab-6(8.00±0.05)a(3.58±0.04)a(8.13±0.70)a(3.15±0.12)a(9.51±0.10)a-9(7.26±0.59)ab(3.10±0.12)b(8.08±0.52)ab(3.00±0.11)ab(7.37±0.34)c-12(7.02±0.18)b(2.96±0.16)b(7.32±0.31)bc(2.84±0.18)b(5.16±0.92)d春季CK(7.78±0.42)bc(4.39±0.39)cd(11.46±0.41)b(2.99±0.19)b(7.46±0.37)b0(9.52±0.21)ab(7.05±0.09)a(13.22±1.3)ab(4.28±0.20)a(8.46±0.12)a-3(10.81±0.08)a(7.47±0.14)a(13.27±0.9)ab(4.12±0.19)a(8.51±0.18)a-6(11.00±0.11)a(5.65±0.28)b(14.09±1.84)a(3.95±0.10)a(7.35±0.61)b-9(9.48±0.04)ab(4.88±0.37)c(9.14±0.46)c(2.86±0.13)ab(6.60±0.48)b-12(6.84±0.77)c(4.27±0.16)d(8.33±0.41)c(2.48±0.17)b(4.25±0.38)c
季节温度/℃游离脯氨酸质量分数/μg·g-1红花酢浆草芙蓉酢浆草黄花酢浆草大花酢浆草紫叶酢浆草冬季CK(100.70±3.43)c(19.18±0.85)d(21.33±1.16)c(81.10±2.94)c(10.28±0.93)e0(113.00±3.71)b(23.68±2.44)bc(21.58±1.26)bc(92.55±1.14)b(13.51±1.17)cd-3(110.48±8.39)b(25.49±0.90)b(25.44±0.97)a(94.21±1.92)b(16.01±0.94)bc-6(128.59±4.78)a(33.54±2.46)a(25.73±1.54)a(102.47±6.89)a(20.02±1.39)a-9(129.23±1.45)a(26.12±1.53)b(26.97±0.79)a(93.65±2.47)b(16.76±0.79)b-12(107.74±3.32)bc(21.11±2.74)cd(23.43±1.01)b(79.94±2.84)c(10.99±1.71)de春季CK(21.60±1.81)c(11.95±1.84)c(12.82±2.07)c(49.97±1.86)e(5.44±0.93)de0(26.20±2.33)b(11.95±1.84)c(16.63±0.55)b(76.71±3.54)c(8.85±1.17)c-3(27.46±0.63)b(33.29±1.84)a(19.84±0.81)a(90.46±4.61)b(13.32±1.66)a-6(32.83±2.01)a(23.01±1.49)b(21.51±1.59)a(110.57±2.65)a(10.89±1.39)b-9(26.49±1.32)b(10.98±1.29)c(15.88±0.65)b(70.45±3.26)d(6.68±1.50)d-12(19.30±1.94)c(7.46±0.57)d(12.36±0.76)c(28.70±3.00)f(4.36±1.71)e
季节温度/℃超氧化物歧化酶的活性/U·g-1红花酢浆草芙蓉酢浆草黄花酢浆草大花酢浆草紫叶酢浆草冬季CK(312.16±9.44)c(326.22±6.36)b(335.95±9.95)b(271.26±12.08)b(185.76±5.92)c0(348.15±6.67)ab(360.44±0.63)a(372.74±0.51)a(293.91±6.75)ab(223.56±3.40)b-3(351.41±10.53)ab(367.11±8.754)a(371.56±3.87)a(317.31±17.53)a(261.06±14.28)a-6(359.41±3.70)a(361.78±3.08)a(376.59±0.51)a(313.46±4.84)a(267.31±1.36)a-9(341.03±8.547)b(286.81±3.70)c(373.33±5.55)a(287.98b±2.04)a(227.00±3.47)b-12(272.56±10.48)d(232.19±9.89)d(301.58±5.04)c(207.69±5.44)c(122.51±14.37)d春季CK(263.88±13.51)c(181.49±2.80)b(233.81±9.95)e(245.23±12.0)c(199.70±2.34)d0(308.38±5.34)a(303.33±2.32)a(281.22±0.51)c(345.83±6.75)a(297.60±6.12)b-3(312.76±2.92)a(299.93±2.17)a(294.22±6.94)b(336.86±17.53)a(311.06±2.04)a-6(318.30±2.60)a(192.21±10.52)b(310.70±0.51)a(313.40±4.84)b(215.86±2.04)c-9(280.97±8.10)b(117.86±14.54)c(258.51±5.55)d(114.74±8.40)d(111.54±6.78)e-12(195.15±4.47)d(31.80±4.00)d(162.16±5.04)f(71.15±5.44)e(54.00±7.06)f
续(表2)
季节温度/℃叶绿素质量分数/mg·g-1红花酢浆草芙蓉酢浆草黄花酢浆草大花酢浆草紫叶酢浆草冬季CK(1.21±0.02)ab(1.51±0.02)ab(0.87±0.04)d(0.62±0.01)bc(0.54±0.03)b0(1.25±0.15)ab(1.57±0.15)a(0.91±0.09)cd(0.72±0.12)ab(0.60±0.05)ab-3(1.35±0.01)a(1.64±0.23)a(1.13±0.02)a(0.77±0.04)a(0.74±0.17)a-6(1.33±0.01)a(1.76±0.24)a(1.12±0.04)a(0.76±0.06)a(0.68±0.06)a-9(1.32±0.01)ab(1.24±0.05)bc(1.09±0.01)ab(0.75±0.07)a(0.65±0.05)ab-12(1.15±0.03)b(1.16±0.06)c(0.99±0.03)bc(0.55±0.04)c(0.48±0.03)b春季CK(1.67±0.04)bc(1.55±0.04)a(1.12±0.07)a(0.85±0.07)a(0.88±0.01)a0(1.67±0.10)bc(1.51±0.01)a(1.07±0.04)a(0.79±0.02)a(0.85±0.05)a-3(1.62±0.02)c(1.40±0.01)b(1.11±0.05)a(0.67±0.05)b(0.73±0.08)b-6(1.84±0.04)a(1.14±0.04)c(1.03±0.03)a(0.62±0.02)b(0.52±0.03)c-9(1.74±0.05)ab(1.03±0.05)d(0.93±0.06)b(0.50±0.02)c(0.52±0.04)c-12(1.54±0.05)c(0.93±0.05)e(0.83±0.01)c(0.49±0.01)c(0.49±0.05)c
注:表中数值为平均值±标准差;同列不同字母表示差异显著(P<0.05)。
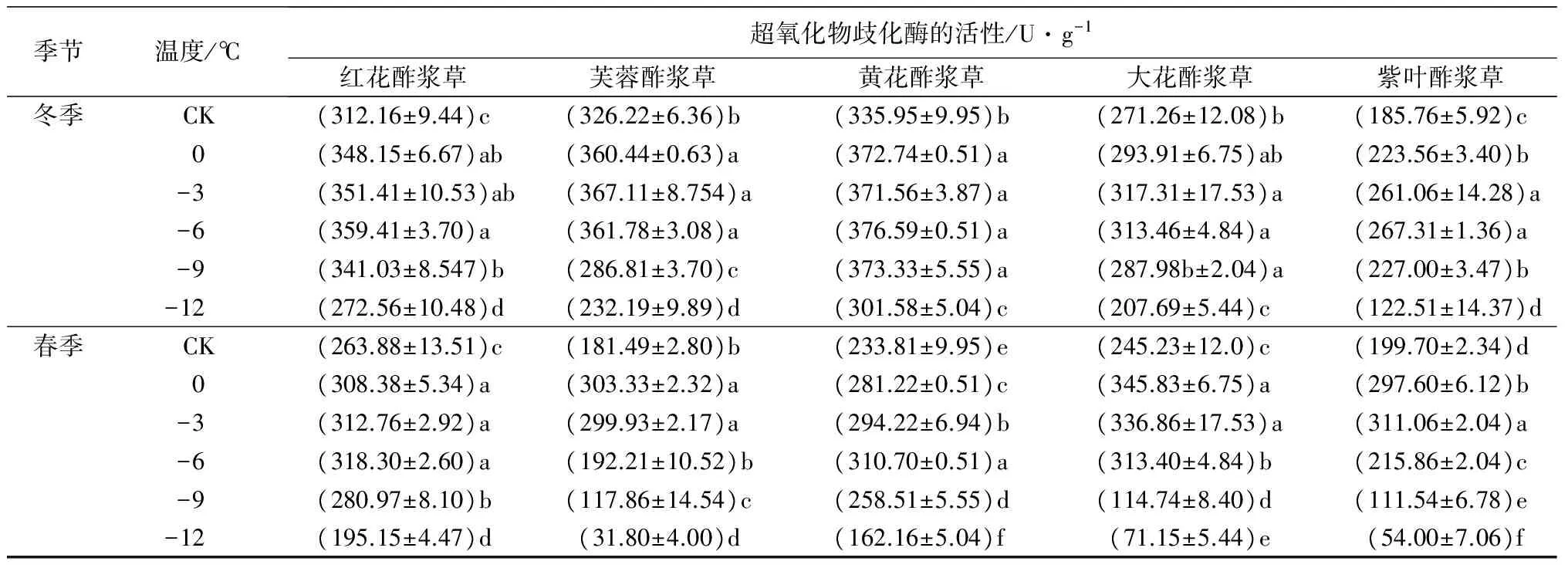
2.5 低温处理对5种酢浆草属植物的超氧化物歧化酶活性的影响
在人工低温处理下,5种植物的SOD活性随着处理温度的降低呈先上升后下降趋势。在冬季人工低温处理下,芙蓉酢浆草和大花酢浆草的SOD活性在-3 ℃时达到峰值,分别比对照组高12.53%和13.98%;红花酢浆草、黄花酢浆草和紫叶酢浆草的SOD活性在-6 ℃时达到峰值,分别比对照组高15.14%、12.10%和43.90%。在春季人工低温处理下,芙蓉酢浆草和大花酢浆草的SOD活性在0 ℃时达到峰值,分别比对照组高67.13%和41.02%;紫叶酢浆草的SOD活性在-3 ℃时达到峰值,比对照组高55.76%;红花酢浆草和黄花酢浆草的SOD活性在-6 ℃时达到峰值,分别比对照组高20.62%和32.80%(表2)。
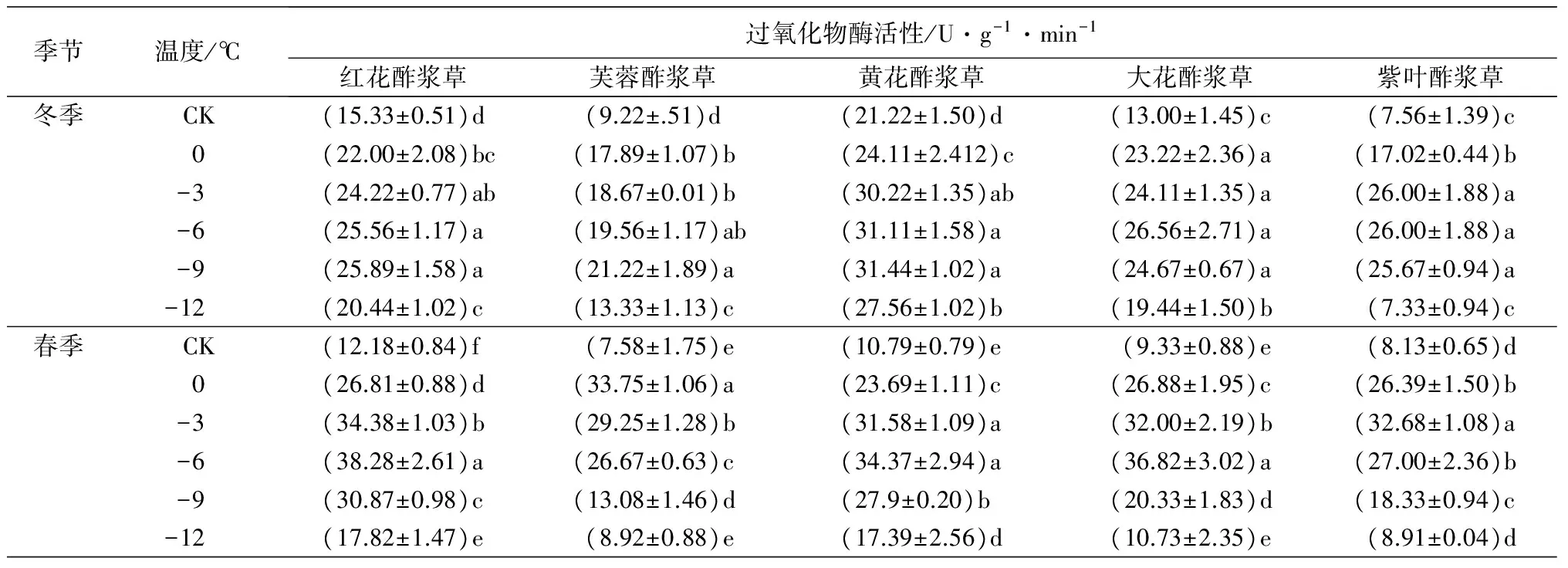
2.6 低温处理对5种酢浆草属植物的过氧化物酶活性的影响
在人工低温处理下,5种植物的POD活性随着处理温度的降低均呈先上升后下降趋势。在冬季人工低温处理下,紫叶酢浆草的POD活性在-3 ℃时达到峰值,比对照组高243.92%;大花酢浆草的POD活性在-6 ℃时达到峰值,比对照组高104.31%;红花酢浆草、芙蓉酢浆草和黄花酢浆草的POD活性在-9 ℃时达到峰值,分别比对照组高68.88%、130.15%和48.16%。在春季人工低温处理下,芙蓉酢浆草的POD活性在0 ℃时达到峰值,比对照组高345.25%;紫叶酢浆草的POD活性在-3 ℃时达到峰值,比对照组高301.97%;红花酢浆草、黄花酢浆草和大花酢浆草的POD活性在-6 ℃时达到峰值,分别比对照组高214.29%、218.54%和294.64%(表2)。
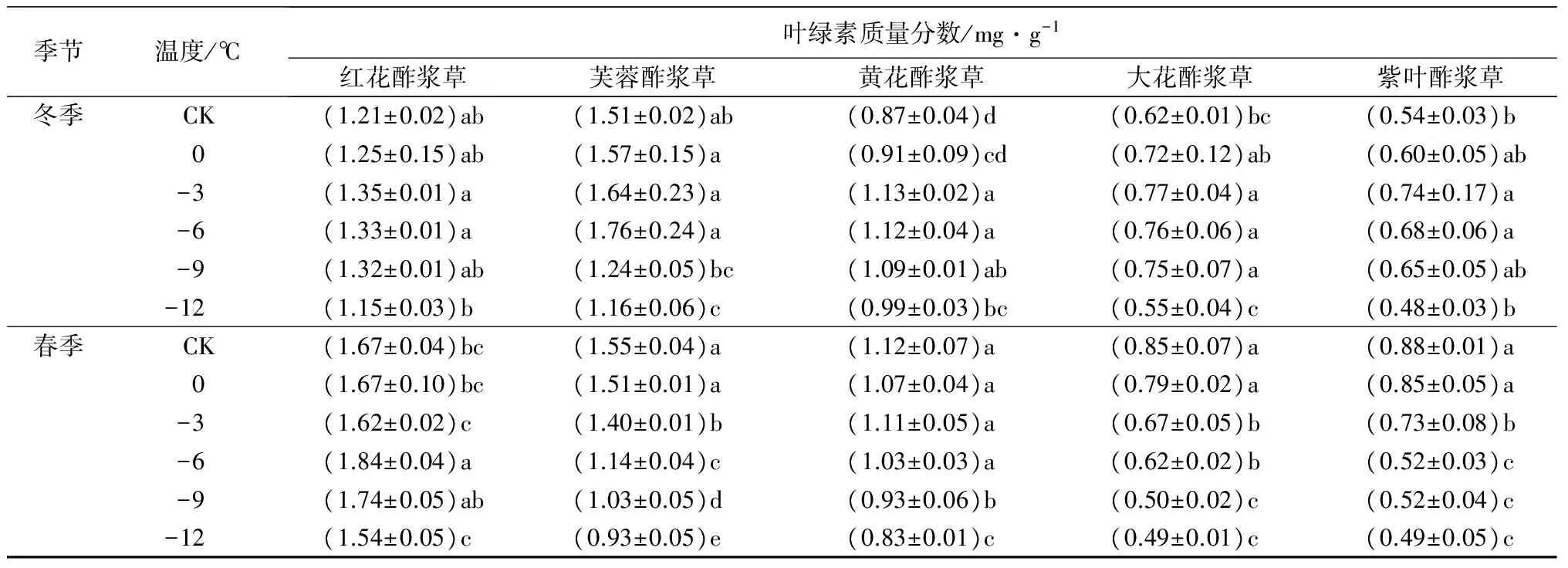
2.7 低温处理对5种酢浆草属植物的叶绿素质量分数的影响
在冬季人工低温处理下,5种植物的叶绿素质量分数随着处理温度的降低呈先上升后下降趋势。红花酢浆草、黄花酢浆草、大花酢浆草和紫叶酢浆草的叶绿素质量分数在-3 ℃时达到峰值,分别比对照组高11.57%、29.89%、24.19%和37.04%;芙蓉酢浆草在-6 ℃时达到峰值,比对照组高16.56%。在春季人工低温胁迫下,红花酢浆草的叶绿素质量分数随着处理温度的降低呈先上升后下降趋势,并在-6 ℃时达到峰值,比对照组高10.18%;其他4种植物的叶绿素质量分数随着处理温度的降低呈下降趋势,并在-12 ℃时达到最小值,分别比对照组低40.00%、25.89%、42.35%和44.32%(表2)。
2.8 5种酢浆草属植物抗寒性综合评价
植物抗寒性是多指标综合作用的结果,因此应用隶属函数法综合评价5种植物的抗寒性。用各指标的相对变化值计算隶属函数值,再乘以对应指标的权重系数,累加求和得出综合评定值,该值越大,抗寒性越强,反之抗寒性越弱。根据综合评定值的大小对5种植物的抗寒性排序(表3)。
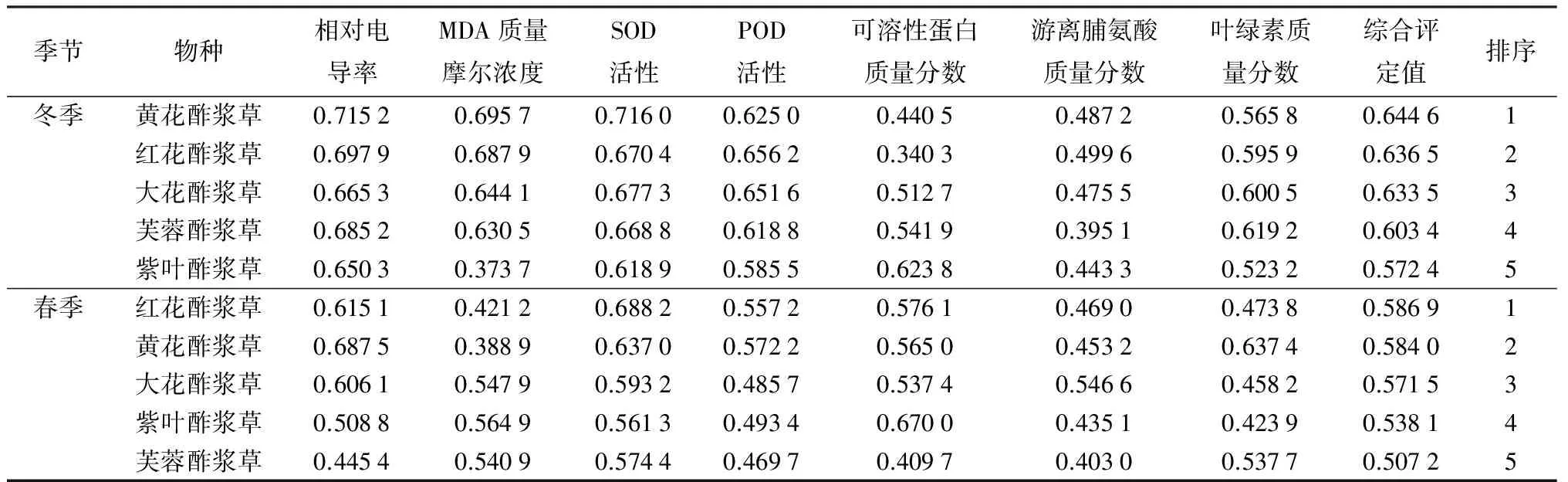
表3 5种植物抗寒性综合评价
3 结论与讨论
在低温胁迫下,植物的外部形态会发生明显变化。因此,可以根据植物在低温胁迫下外部形态变化来判断其抗寒性,这种方法简单而又直接,但需要一定经验。在受冻害初期,5种植物的叶片上出现冻斑,严重时呈萎蔫状;随着胁迫程度的加剧,大部分叶片萎蔫,甚至呈茶色煮熟状,均以抗寒性弱的紫叶酢浆草和芙蓉酢浆草表现较为明显。相对电导率是鉴定植物抗逆性强弱的重要指标,能够反映细胞膜受损程度。逆境胁迫程度越大,细胞膜通透性越强,电解质外渗越多,相对电导率越高[12-13]。在相同逆境胁迫下,相对电导率上升幅度越大,植物抗逆性越弱;反之,抗逆性越强[14]。在人工低温处理下,5种植物的细胞膜通透性随着处理温度的降低而增强,表明温度越低,细胞膜受损越严重,这与田景花等[15]研究的结果一致。
在低温胁迫下,植物体内活性氧自由基积累,引发膜脂过氧化,积累大量膜脂过氧化产物丙二醛,与膜结构上的酶和蛋白质结合、交联而使其失去活性,破坏膜结构[16]。因此,通过丙二醛质量摩尔浓度的变化可以了解膜脂过氧化程度、膜系统受损程度以及植物抗逆性强弱[17-18]。研究表明,在低温处理初期,抗氧化酶活性上升,清除植物体内积累过剩的活性氧自由基,降低膜脂过氧化程度,丙二醛质量摩尔浓度下降;随着处理温度的降低,抗氧化酶的结构和功能受到破坏,活性降低,清除活性氧自由基的能力下降,膜脂过氧化程度加剧,导致丙二醛质量摩尔浓度上升;丙二醛质量摩尔浓度随着低温胁迫的持续加强而下降,可能是代谢紊乱产生的结果[19-20]。雷帅等[21]研究5种花灌木对低温胁迫的生理响应时发现,大花圆锥绣球(Hydrangeapaniculatavar.grandifloraSieb)的丙二醛质量摩尔浓度随着处理温度的降低也呈先下降后上升再下降的趋势。
在逆境胁迫下,植物体内与渗透调节物质相关的基因表达、可溶性蛋白和游离脯氨酸等渗透调节物质质量分数增加,能够清除活性氧自由基,稳定细胞膜结构,提高细胞渗透吸水和保水能力,增强植物的抗逆性[22-23]。在人工低温处理下,5种植物的可溶性蛋白和游离脯氨酸质量分数随着处理温度的降低呈先上升后下降趋势,与此同时,丙二醛质量摩尔浓度呈先下降后上升趋势。这种结果的产生,可能因为低温胁迫初期与渗透调节物质相关的基因表达增强,可溶性蛋白和游离脯氨酸质量分数增加,阻碍膜脂过氧化,丙二醛质量摩尔浓度降低;随着处理温度的降低,与渗透调节物质相关的基因表达受抑制或遭到破坏,渗透调节物质质量分数减少,膜脂过氧化作用加强,导致丙二醛质量摩尔浓度增加[24],这与贺磊等[25]得出的结论一致。
一般情况下,植物体内活性氧的生成与清除处于动态平衡状态,但在逆境胁迫下这种平衡状态会被打破[26]。抗氧化酶能够清除植物体内的活性氧,其活性越高,植物的抗逆性越强[27-28]。在人工低温处理下,5种植物的SOD和POD活性随着处理温度的降低呈先上升后下降趋势,表明低温胁迫可诱发抗氧化酶活性上升,清除过量活性氧,降低细胞膜通透性,保护细胞膜结构完整性;随着处理温度的降低,抗氧化酶活性下降,表明低温胁迫下活性氧过量积累,破坏了活性氧和防御系统的动态平衡,导致酶的结构发生改变或酶的表达受到抑制,从而使酶的活性降低[29-30],这与任俊杰等[31]得出的结论一致。
叶绿素质量分数是鉴定植物抗逆性强弱的重要指标,变化平缓且降解缓慢的植物抗逆性强[32]。在冬季人工低温处理下,5种植物的叶绿素质量分数随着处理温度的降低呈先上升后下降趋势。在春季人工低温处理下,红花酢浆草的叶绿素质量分数随着温度的降低呈先上升后下降趋势,且变化平缓;其他4种植物均呈下降趋势,且变化较大,表明红花酢浆草的抗寒性较其他4种强,这与综合评定的结果一致。
在低温胁迫下,植物体内发生复杂的生理生化变化,孤立地用某一指标很难反映植物对寒冷的综合适应能力。因此,运用隶属函数法综合评价植物的抗寒性,更具科学性和可靠性。许桂芳等[33]运用隶属函数法对4种珍珠菜属植物的抗寒性进行了综合评价,得到了满意的结果。通过综合评价得知,红花酢浆草和黄花酢浆草的抗寒性较强,其次是大花酢浆草,芙蓉酢浆草和紫叶酢浆草的抗寒性较弱,这与自然低温处理下观测的结果一致。入冬前,植物经历了低温锻炼,抗寒性增强;入春后,植物经历了脱锻炼,抗寒性减弱。因此,5种植物在冬季的抗寒性较春季强。另外,5种植物在冬季和春季的抗寒顺序不同,可能与低温锻炼和脱锻炼有关,有待进一步深入研究。
[1] 中国科学院中国植物志编辑委员会.中国植物志(第43卷,第1分册)[M].北京:科学出版社,1998:6-13.
[2] TOSTO D, HOPP E. Characterization of the nuclear ribosomal DNA unit inOxalistuberosa(Oxalidacea) and related species[J]. Electronic Journal of Biotechnology,2008,11(3):1-17.
[3] COSTA J, FERRERO V, LOUREIRO J, et al. Sexual reproduction of the pentaploid, short-styledOxalispes-caprae allows the production of viable offspring[J]. Plant Biology,2014,16(1):208-214.
[4] PISSARD A, ARBIZU C, GHISLAIN M, et al. Congruence between morphological and molecular markers inferred from the analysis of the intra-morphotype genetic diversity and the spatial structure ofOxalistuberosa Mol.[J]. Genetica,2008,132(1):71-85.
[5] MALICE M, MARTIN N, PISSARD A, et al. A preliminary study of the genetic diversity of Bolivian oca (OxalistuberosaMol.) varieties maintained in situ and ex situ through the utilization of ISSR molecular markers[J]. Genetic Resources and Crop Evolution,2007,54(4):685-690.
[6] 胡甦,王永清,陶炼.三角紫叶酢浆草ISSR反应体系的建立与优化[J].草业学报,2011,20(5):142-150.
[7] 陈明林,王友保.水分胁迫下外来种铜锤草和本地种酢浆草的生理指标比较研究[J].草业学报,2008,17(6):52-59.
[8] 陈明林,张云华,严密,等.盐胁迫下外来种铜锤草和本地种酢浆草的生理指标比较研究[J].上海交通大学学报(农业科学版),2007,25(3):282-288.
[9] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2003:37-281.
[10] 朱根海,刘祖祺,朱培仁.应用Logistic方程确定植物组织低温半致死温度的研究[J].南京农业大学学报,1986(3):11-15.
[11] 张文娥,王飞,潘学军.应用隶属函数法综合评价葡萄种间抗寒性[J].果树学报,2007,24(6):849-853.
[12] LYONS J M. Chilling injury in plants[J]. Annual Review of Plant Physiology,1973,24(1):445-466.
[13] MITTLER R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science,2002,7(9):405-410.
[14] 张家洋,郭晖,张莉,等.不同低温胁迫对南京10种道路绿化树木形态及电导率的影响[J].东北林业大学学报,2012,40(5):25-28.
[15] 田景花,王红霞,高仪,等.核桃属4树种展叶期抗寒性鉴定[J].园艺学报,2012,39(1):2439-2446.
[16] 林兴生,林占熺,林冬梅,等.低温胁迫5种菌草的抗寒性评价[J].草业学报,2013,22(2):227-234.
[17] VELIKOVA V, YORDANOV I, EDREVA A. Oxidative stress and some antioxidant systems in acid rain-treated bean plants: protective role of exogenous polyamines[J]. Plant Science,2000,151(1):59-66.
[18] 杜有新,何春林,张乐华,等.庐山若干常绿树种对冬季低温的生理生化响应[J].生态环境学报,2014,23(6):945-949.
[19] 张远兵,刘爱荣,方蓉.外源一氧化氮对镉胁迫下黑麦草生长和抗氧化酶活性的影响[J].草业学报,2008,17(4):57-64.
[20] 王罗霞,赵志光,王锁民.一氧化氮对水分胁迫下小麦叶片活性氧代谢及膜脂过氧化的影响[J].草业学报,2006,15(4):104-108.
[21] 雷帅,蒋倩,汉梅兰,等.五种花灌木对低温胁迫的生理响应及抗寒性评价[J].甘肃农业大学学报,2015,50(5):35-41.
[22] MONROY A F, SANGWAN V, DHINDSA R S. Low temperature signal transduction during cold acclimation: protein phosphatase 2A as an early target for cold-inactivation[J]. The Plant Journal,1998,13(5):653-660.
[23] FRY J D, LANG N S, CLIFTON R G P, et al. Freezing tolerance and carbohydrate content of low-temperature-acclimated and nonacclimated centipedgrass[J]. Crop Science,1993,33(5):1051-1055.
[24] 时振振,李胜,杨柯,等.盐胁迫下豌豆幼苗对内外源NO的生理生化响应[J].草业学报,2014,23(5):193-200.
[25] 贺磊,游凯,李远芳,等.5种典型热带引种园林植物幼苗抗寒性研究[J].中南林业科技大学学报,2011,31(2):65-71.
[26] PRASAD T K. Mechanisms of chilling-induced oxidative stress injury and tolerance in developing maize seedlings: changes in antioxidant system, oxidation of proteins and lipids, and protease activities[J]. Plant Journal,1996,10(6):1017-1026.
[27] RUBIO M C, JAMES E K, CLEMENTE M R, et al. Localization of superoxide dismutases and hydrogen peroxide in legume root nodules[J]. Molecular Plant-Microbe Interactions,2004,17(12):1294-1305.
[28] MILLER A. Superoxide dismutases: active sites that save, but a protein that kills[J]. Science,2004,8(2):162-168.
[29] 田景花,王红霞,张志华,等.低温逆境对不同核桃品种抗氧化系统及超微结构的影响[J].应用生态学报,2015,26(5):1320-1326.
[30] 武雁军,刘建辉.低温胁迫对厚皮甜瓜幼苗抗寒性生理生化指标的影响[J].西北农林科技大学学报(自然科学版),2007,35(3):139-143.
[31] 任俊杰,赵爽,苏彦苹,等.春季低温胁迫对核桃抗氧化酶指标的影响[J].西北农林科技大学学报(自然科学版),2016,44(3):75-81.
[32] 杜永吉,于磊,孙吉雄,等.结缕草3个品种抗寒性的综合评价[J].草业学报,2008,17(3):6-16.
[33] 许桂芳,张朝阳,向佐湘.利用隶属函数法对4种珍珠菜属植物的抗寒性综合评价[J].西北林学院学报,2009,24(3):24-26.
1)国家林业局“948”项目(2012-4-33)、国家自然科学基金项目(30972408)、江苏高校品牌专业建设工程项目(PPZY2015A063)。
李文明,男,1990年9月生,南京林业大学风景园林学院,硕士研究生。E-mail:1522253127@qq.com。
田如男,南京林业大学风景园林学院,教授。E-mail:beike0607@aliyun.com。
2017年1月16日。
S682.2;Q945.78
Evaluation of Cold Resistance and Physiological Response to Low Temperature on Five Kinds of Oxalis Plants//Li Wenming, Wei Yisu, Qian Yanping, Tian Runan(Nanjing Forestry University, Nanjing 210037, P. R. China)//Journal of Northeast Forestry University,2017,45(7):28-33.
责任编辑:任 俐。
In order to evaluate the cold resistance of five kinds ofOxalis, we observed the changes of the indexes including morphological characteristics, relative conductivity, the level of malondialdehyde (MDA), soluble protein, free proline and chlorophyll and the activity of superoxide (SOD) and peroxidase (POD) after the treatments of artificial and natural low temperature. With the artificial temperature decreasing, the changes of physiological and biochemical indexes of five plants were somewhat similar. The activity of SOD and POD, the contents of soluble protein and free proline went up firstly, and then went down, while the relative conductivity was increased and the MDA content had a fall before a rise, and then went down. The content of chlorophyll was decreased or increased firstly and then decreased. Through evaluating the cold resistance of the five kinds of plants by the membership function method, the descending orders of cold resistance in winter and spring, separately, wereO.pes-caprae,O.corymbosa,O.bowiei,O.purpurea,O.violacea, andO.corymbosa,O.pes-caprae,O.bowiei,O.violacea, andO.purpurea, which agreed with the results under natural low temperature conditions.
