食品中常见乳酸菌高效降解发酵性能评价
2017-07-31迟雪梅张庆芳
迟雪梅,张庆芳*
1(大连大学 生命科学与技术学院,辽宁 大连,116622)2(辽宁省海洋微生物工程技术研究中心,辽宁 大连,116622)
迟雪梅1,2,张庆芳1,2*
1(大连大学 生命科学与技术学院,辽宁 大连,116622)2(辽宁省海洋微生物工程技术研究中心,辽宁 大连,116622)
通过接种亚硝酸盐(NO2-)纯培养液及发酵蔬菜,对Streptococcuslastic,Lactobacillusleicmannii,Lactobacillusbrevis等9种食品常见乳酸菌种进行NO2-降解实验,并从NiR降解阶段和H+降解阶段去分析评价该菌降解NO2-的能力。分析认为,Lactobacilluscaseisubsp.rhamnosusmutation,Lactobacillusbrevis具有高效降解NO2-能力,其中Lactobacilluscaseisubsp.rhamnosusmutation在NiR降解阶段降解NO2-能力强,但由于该菌产酸能力较强,使其迅速进入H+降解阶段,而使NO2-降解速度变得缓慢;而Lactobacillusbrevis一直能够处于NiR降解NO2-阶段,能使该菌所处环境中NO2-被迅速分解。分析认为,由于该菌产酸为异型发酵途径,产酸量较低,且Lactobacillusbrevis产生的NiR为同步合成型,能快速产生NiR,该菌产生的H+中和其降解NO2-生成的碱性物质,使发酵环境一直处于NiR最适作用pH值(5.0 ~ 6.0),从而使NO2-被快速降解。
乳酸菌;NO2-降解;性能评价
随着经济的发展,工业生产中形成的氮氧化物(NOx)的排放量及农业生产中氮肥的使用量急剧增加,这些氮源导致环境中NO3-和NO2-的含量显著上升[1],导致蔬菜中含有大量NO3-。蔬菜腌渍发酵过程中,NO3-可被大肠杆菌等细菌还原成NO2-,其反应过程是不可避免的[2]。
研究表明,NO2-能与蛋白质代谢物反应生成强致癌物亚硝胺和亚硝酸钠,后者可通过促进细胞分泌TGF-β1和IL-8,诱导人肝癌细胞SMMC-7721上皮-间质转化,使癌细胞增殖[3]。此外,饮食摄入过多的NO2-会显著提高膀胱癌、大肠癌的患病率[4-6]。
研究发现乳酸菌具有降解NO2-的作用。乳酸菌对NO2-的降解分为酶降解和酸降解2个阶段[7]。在发酵的前期,培养液pH值> 4.5时,乳酸菌对NO2-降解以NiR降解为主;发酵后期,由于乳酸菌本身产生酸,使培养液pH值降低,当pH值< 4.0后,NO2-的降解主要以酸降解为主。乳酸菌发酵是自然发酵过程中的主要发酵过程,在食品中应用广泛,如Streptococcuslastic、Lactobacillusleichmannii、Lactobacilluscasei、Streptococcusthermophilus、Streptococcuscremoris等应用在制作乳饮料、发酵酸奶及酸乳豆产品中[8-11];Lactobacillusplantarun、Lactobacillusbrevis、Lactobacilluscaseisubsp.rhamnosus等应用于奶油、肉类及蔬菜发酵产品中[12-13]。
本课题组同时采用Streptococcuslastic、Lactobacillusleichmannii、Lactobacilluscasei、Streptococcusthermophilus、Streptococcuscremoris、Lactobacillusplantarun、Lactobacilluscaseisubsp.rhamnosus、Lactobacillusbrevis、Lactobacilluscaseisubsp.rhamnosusmutation等9种食品中常见乳酸菌进行降解NO2-研究,并从NiR降解阶段和H+降解阶段去分析评价高效降解NO2-乳酸菌的发酵性能。
1 材料与方法
1.1 试验菌种
Streptococcuslastic(Sl);Lactobacillusleichmannii(Ll);Lactobacillusbrevis(Lb);Lactobacillusplantarun(Lp);Streptococcuscremoris(Sc);Lactobacilluscasei(Lc);Streptococcusthermophilus(St);Lactobacilluscaseisubsprhamnosus(Lk);Lactobacilluscaseisubsprhamnosusmutation(Ln),以上菌株为本研究室保藏。
1.2 蔬菜原料
学校附近农贸市场购买。
1.3 培养基及培养液配方
MRS固体培养基[14]。
液体培养基:不加琼脂,其他成分同MRS固体培养基。
1.3.3 含NO2-的液体培养基
液体培养基中添加入50、100、125、150及250 mg/L的NO2-。
1.4 菌种活化
菌种活化培养基为MRS液体培养基。
一次活化:取纯化后穿刺保藏的各菌种试管,分别穿刺3针接于10 mL液体培养基试管中,重复3次,30 ℃培养48 h。
二次活化:取一次活化各菌种菌液,按10%接种量接种于液体培养基扩大培养,30 ℃培养48 h。
1.5 试剂与仪器
HD-1360超净工作台,北京东联哈尔仪器制造有限公司;THZ-312台式恒温振荡,上海精宏实验设备有限公司;280 型轻便手提压力蒸气消毒器,沈阳市医疗器械二厂;BZ-01显微镜,德国徕卡;UV-120-02紫外可见分光光度计,上海尤尼科科技仪器有限公司;pHB-4p 酸度计,美国哈希HACH公司。
1.6 方法
1.6.1 蔬菜发酵工艺流程
甘兰→清洗→烫漂→沥水→切段→装瓶→压石→注盐水→接种→密封→发酵
1.6.2 蔬菜发酵技术要点
把清洗过的甘兰叶片放在恒温水浴锅中,水温85~90 ℃,烫0.5~1 min,取出后迅速投入冷水中漂洗;把漂洗后的甘兰放在筛筐中沥去表面水分;甘兰叶片切段3~4 cm;切段后的甘兰分别装入灭菌的玻璃瓶(500 mL)中,每瓶装量250 g,并按实;在装紧甘兰的瓶中放一块无菌石块,重约80~100 g,配制2%的盐水溶液,煮沸过滤,晾凉,每瓶注入325 mL;将已培养36 h、OD620值相一致的9种乳酸菌液,各取10 mL,分别加入9个玻璃瓶中,菌液摇匀;无菌瓶盖密封;于25~30 ℃保温发酵。
1.7 测定指标及方法
OD620值:吸光度法。
活菌数:平板菌落计数法。
总酸:酸碱滴定。
pH值:酸度计法。
NO2-:盐酸萘乙二胺法。
标准曲线的绘制:从装置5 μg/mL亚硝酸钠溶液的容量瓶中分别吸取0.2、0.4、0.6、0.8、1.0、2.0 mL于6支25.0 mL的比色管中,加入2.0 mL对氨基苯磺酸溶液,混匀,避光静置5 min,再加入1.0 mL盐酸萘乙二胺溶液,加蒸馏水定容至25.0 mL,混匀,避光静置15 min后,于波长538 nm处测吸光度值并记录。得标准曲线回归方程为:y= 0.138 74x+ 0.001 41,R2= 0.99 9。
样品测定[15]:发酵菜10 g,研磨成匀浆(汤汁10 mL,或含NO2-培养液2 mL)→用150 mL水转移至250 mL容量瓶中→加6 mL饱和硼酸钠→用0.1 moL/L NaOH调至pH9→65℃温度下恒温水浴10 min→冷却→定容静置30 min→过滤→取滤液40 mL→显色→加蒸馏水定容至50 mL→混匀→于波长538 nm处测吸光度值→计算NO2-。同时以等量蒸馏水作空白对照。
NH3:奈斯勒试剂 法。
NO3-:镉柱还原法[16-17]。
2 结果与分析
2.1 乳酸菌发酵特性的研究
将二次活化后Sl、Ll、Lc等9种乳酸菌液,按等量菌数接入pH7.2的液体MRS培养基中,30 ℃恒温培养,定时测定培养液总酸,结果见图1。

图1 乳酸菌不同时间产酸量变化Fig.1 The change of lactic acid bacteria produce acid in different time
如图1可知,Ln、Lp、Lc产酸量明显高于其他6种乳酸菌;Lb、Ll、Lk 稍高于Sl、Sc、St产酸量。
2.2 乳酸菌降解NO2-的研究
2.2.1 乳酸菌降解培养液NO2-含量变化
在含有NO2-(初始浓度为125 mg/L)的MRS液体培养基中,分别接入等量菌数不同乳酸菌种,于30 ℃恒温培养,定时测定发酵液中NO2-的含量,结果见图2。

图2 发酵液中NO2-的含量Fig.2 Content of NO2- in the fermentation broth
从图2、图3、图4可以明显看出,含有NO2-的培养液中接入的9种乳酸菌都能降解NO2-,其中Ln菌种在12 h内降解NO2-能力显著高于其他菌种,降解率高达60%,在24 h后降解NO2-变得较缓慢,60 h接种Ln的培养液仍有NO2-残留;Lb菌种在12 h内降解NO2-能力仅次于Ln,12 h后Lb菌种发酵的培养液NO2-快速被降解,在48 h 时NO2-被全部降解。分别对12h和24 h 9种乳酸菌降解NO2-的降解量进行差异显著性分析,结果表明12 h,Ln菌种降解NO2-能力显著高于其他菌种;24 h,Lb菌种降解NO2-能力显著高于其他菌种。

图3 12 h发酵液中NO2-的残留量Fig.3 Residual amount of NO2- in the fermentation broth at 12 h

图4 24 h发酵液中NO2-的残留量Fig.4 Residual amount of NO2- in the fermentation broth at 24 h
2.2.2 乳酸菌发酵菜汁中NO2-含量变化
分别接种9种乳酸菌,进行蔬菜发酵,定时测定发酵液中NO2-的含量,结果见图5。

图5 发酵菜汁中NO2-的含量Fig.5 The content of NO2- in fermented vegetables juice
由图5可知,接入乳酸菌种不同,汤汁中NO2-变化曲线也不同;亚硝峰出现时间基本相同,但峰值不同。其中接种Lb,St的菌种的发酵菜在整个发酵过程中汤汁中都检测不出NO2-,Sc发酵96 h汤汁中检测不出NO2-,Sl、Ln发酵120 h汤汁中检测不出NO2-。
蔬菜原料中含有大量的NO3-,发酵初期菜中含有能产生NiR的菌大部分为好氧菌,能使NO3-还原为NO2-,随着时间的延长,NO2-的积累逐渐增多;而在水下(兼厌氧环境中)乳酸菌开始活动、大量繁殖,产生NiR和酸,从而导致NO2-被降解,也是“亚硝峰”出现的原因[18-19]。接种发酵能使乳酸菌快速成为优势菌群,NO2-快速被降解,从而使“亚硝峰”的峰值降低;菌种不同,产生NiR及H+的量不同,对“亚硝峰”的峰值大小都会有影响[7-8,20],如图5所示。
2.2.3 乳酸菌降解NO2-的pH值变化
对以上3种情况(无NO2-培养液,含NO2-培养液,发酵菜汤汁)的pH值变化进行分析,如图6~图8。
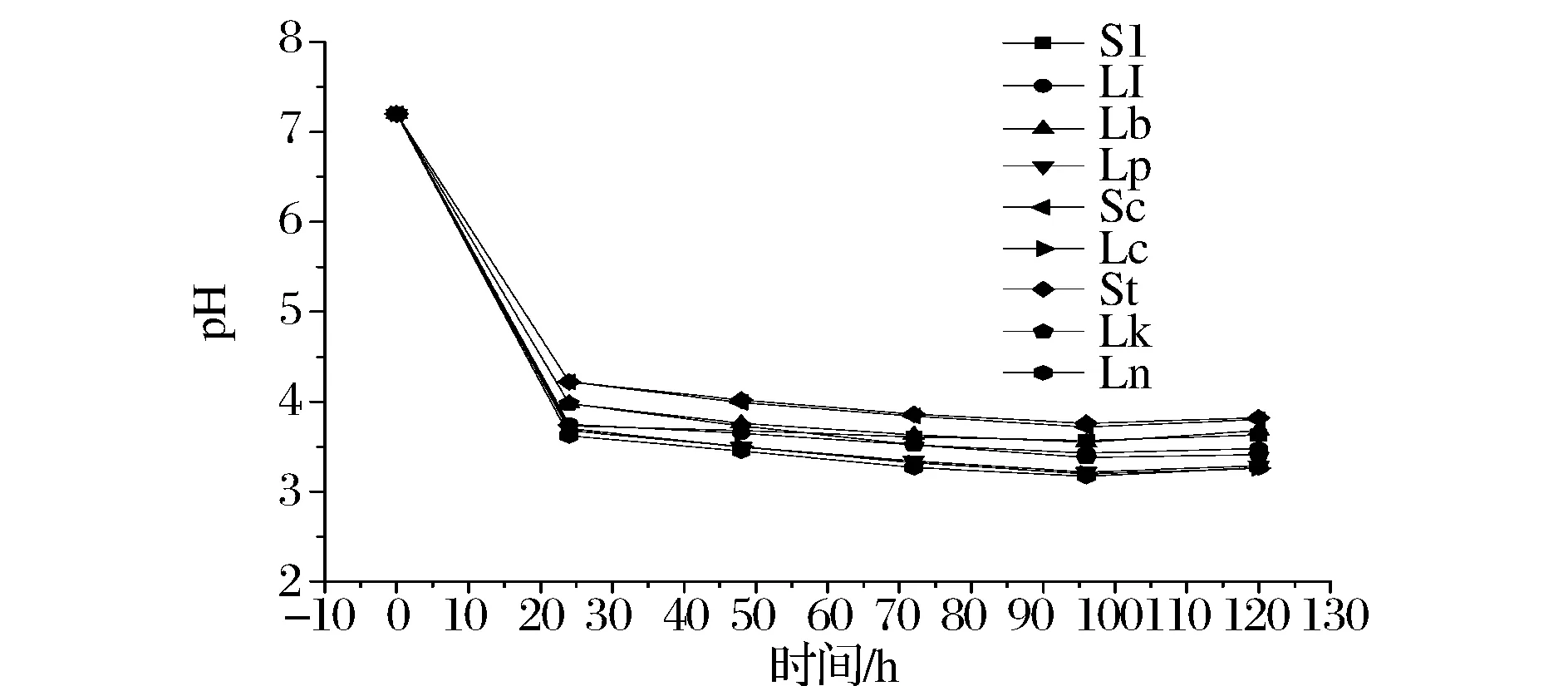
图6 无NO2-发酵液pH值的变化Fig.6 The change of pH in fermentation broth without NO2-
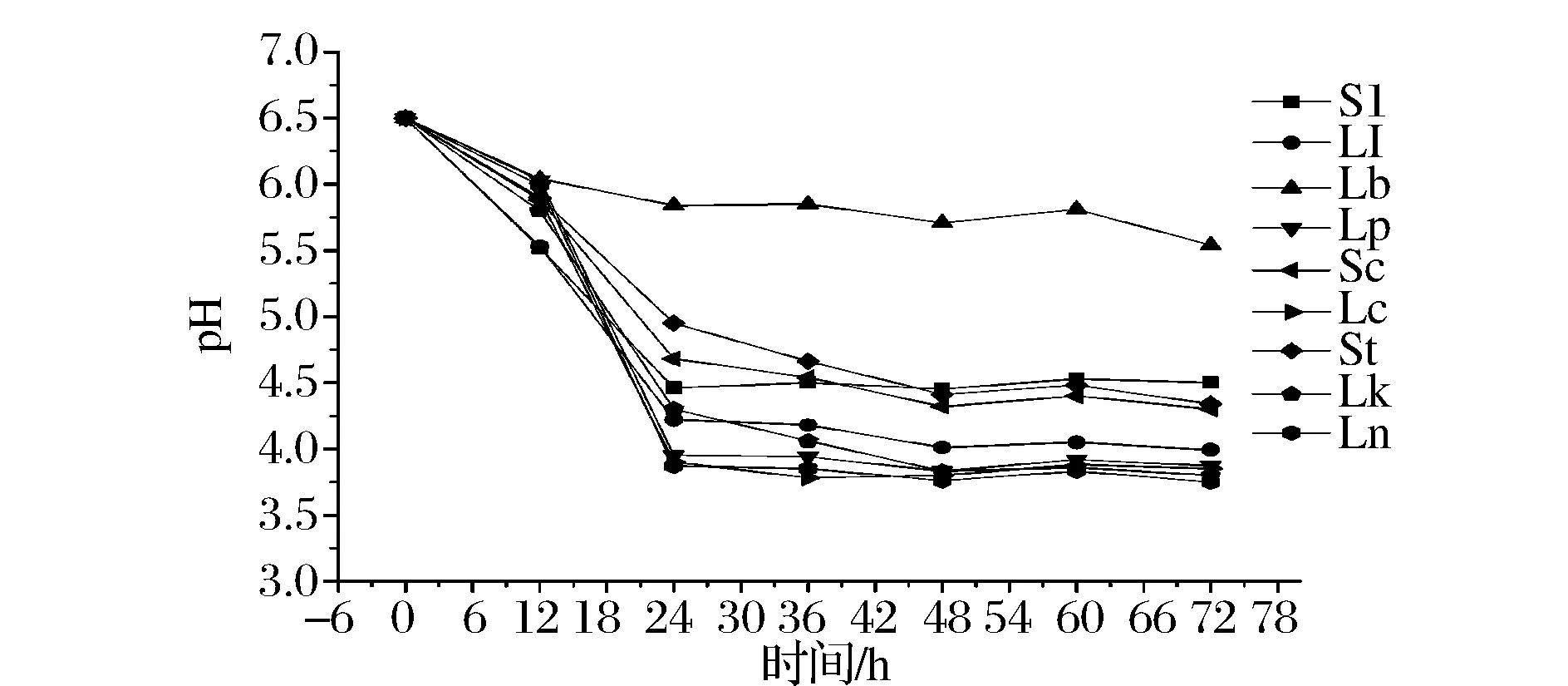
图7 含NO2-发酵液pH值的变化Fig.7 The change of pH in fermentation broth with NO2-

图8 发酵菜汤汁pH值的变化Fig.8 The change of pH in fermented vegetables juice
由图6、图7比较可知,同一菌种接种发酵,含NO2-培养液的pH值都高于不含NO2-培养液的pH值;由图7可知,Lb接种发酵过程中,其环境pH值显著高于其他菌种发酵的环境pH值,pH值一直处于5.5~6.5之间;由图8可知,接种Lb的发酵菜汤汁pH值明显高于接种其他菌种发酵菜汤汁的pH值,且pH值在5.0~6.0之间。
实验中还发现Lactobacillusbrevis无论接种在含有NO2-的培养液中还是在发酵菜中,检测有NH3的生成。
张庆芳[7]等人认为乳酸菌对NO2-的降解分为酶降解和酸降解2个阶段。在发酵的前期,培养液pH值> 4.5时,乳酸菌对NO2-降解以NiR降解为主;发酵后期,由于乳酸菌本身产生酸,使培养液pH值降低,当pH值< 4.0后,NO2-的降解主要以H+降解为主。张庆芳[21]等在相同pH值下,用接种乳酸菌的培养液中NO2-降解量减去未接种乳酸菌中NO2-的降解量,排除了H+对NO2-降解的影响。证明Lactobacillusbrevis产生的NO2-还原酶降解NO2-的最适pH值在5.0 ~ 6.0之间。龚钢明[8]等人2011年将细胞破碎、通过硫酸铵盐析方法从Lb(Lactobacillusbrevis)中提取NiR, 其中NiR最适pH 值为pH5.5,酶的Km值为120.5 μg/mL。
2.2.4Lactobacillusbrevis降解NO2-能力的分析
为进一步探明乳酸菌降解NO2-的能力,分别对含有NO2-浓度为0、50、100 和250 mg/L的培养液接种Lactobacillusbrevis,定时检测培养液中菌数、总酸、pH值和NO2-含量,如图9、图10所示。

1-100 mg/L的降解率;2-lg N;3-0 mg/L总酸;4-50 mg/L总酸;5-100 mg/L总酸;6-200 mg/L总酸图9 菌数、NO2-降解率、总酸的变化曲线Fig.9 The change of the number of bacteria NO2- and total acid
如图9所示,Lb菌种0~2 h为迟缓期,2~24 h为对数期,24~48 h为稳定期,48 h后进入衰亡期。在8~36 h(菌生长的对数期及最大期的前期)不含NO2-的乳酸菌培养液中,酸积累曲线变化幅度非常大,酸大量增加;而含NO2-的乳酸菌培养液在同一时期(NO2-大量降解阶段),酸的积累非常缓慢。36 h以后,不含NO2-的菌液酸变化不大,曲线变化平缓;而含NO2-的菌液在36h以后(NO2-全部被降解),酸才开始积累,48 h后快速上升。96 h以后所有菌液酸的积累都接近一致。
通过图7、图9可看出,在菌的对数期,接有Lb的NO2-培养液,其NO2-降解一直处于NiR降解阶段[7-8]。进而对Lb菌种进行产酶类型分析,见图10。

1-lgN;2-50 mg/L;3-100 mg/L;4-250 mg/L图10 NO2- 培养液中菌数、NO2-降解率曲线比较Fig.10 Comparison of the number of bacteria and NO2- degradation rate
由图10可知,纵坐标与横坐标的比,即曲线的斜率,也是NO2-降解量与时间的比,即为NiR的催化反应速度。而“在底物浓度足够高的情况下,酶催化反应速度与酶浓度成正比”[22]。由图10还可看出在4~36 h ,4条曲线的斜率大小一致,即NO2-降解率曲线与菌生长曲线弹性相同,说明该乳酸菌合成的NiR速度与细胞生长速度紧密联系。由此可推导Lactobacillusbrevis产生的NiR类型为同步合成型[22]。说明Lactobacillusbrevis在生长的对数期产生大量NiR。
3 讨论与结论
3.1 讨论
张庆芳[7]等人认为乳酸菌对NO2-的降解分为酶降解和酸降解2个阶段。在发酵的前期,培养液pH值>4.5时,乳酸菌对NO2-降解以NiR降解为主;发酵后期,由于乳酸菌本身产生酸,使培养液pH值降低,当pH<4.0后,NO2-的降解主要以H+降解为主。张庆芳[20]等人用接种乳酸菌的培养液中NO2-降解量减去不接种的同一pH值下NO2-的降解量,排除了H+对NO2-降解的影响。证明Lb产生的NiR降解NO2-的最适pH在pH5.0~6.0之间。龚钢明[8]等人将细胞破碎、通过硫酸铵盐析方法从Lb(短乳杆菌)中提取NiR,其NiR最适pH 5.5,酶的Km值为120.5 μg/mL。进一步对Lb产生的NiR类型进行分析见图10,Lb菌种产生的NiR类型为同步合成型。该类型菌种合成酶速度与细胞生长速度紧密联系,当细胞进入对数生长期,酶大量生成;当细胞生长进入稳定期后,酶的合成随即停止[22]。我国学者卢海强[23]等人认为NO2-还原酶为诱导酶,诱导酶也是按此模式进行生物合成。
由图9可知,不含NO2-的乳酸菌培养液中,在菌的生长对数期酸快速积累;在同一生长时期,含NO2-的乳酸菌培养液酸积累非常的缓慢。研究发现NO2-在NiR的作用下可产生NH4+[24-27]。另外,无论在含有NO2-的发酵培养液中还是在发酵菜的汤汁中,检测有NH3的生成。因此,比较图7和图6可看出,乳酸菌产生的NiR降解NO2-生成的碱性物质使发酵环境的pH值回升。
在食品中常见乳酸菌高效降解NO2-发酵性能评价研究中,用9种乳酸菌接种的含NO2-的培养液,在发酵12 h时,菌的pH都在pH5.0~6.5之间,其中Ln降解NO2-显著高于其他菌种,且降解率高达60%,在24 h后降解NO2-变得较缓慢,60 h Ln接种的培养液仍有NO2-残留。由图1可知,Ln产酸量高;由图6~图8可知,24 h Ln无论接种在纯培养中还是接种发酵菜,其pH值都小于4.0,此时Ln降解NO2-进入H+降解NO2-阶段[20]。本研究还将Ln接种在用缓冲液配置的pH值分别为pH3.5、pH4.5、pH5.5的含NO2-的培养液中,12 h检测NO2-残留量,见表1。由表1可以看出,该菌种对NO2-降解能力酶降解阶段大于H+降解阶段。

表1 不同pH值下接种发酵液中NO2-残留量
本次实验研究还表明,在发酵中后期,Lb无论是接种在含NO2-的培养液中还是接种发酵菜的汤汁中,其pH值一直处于pH5.0~6.0之间,说明Lb降解NO2-一直处于NiR作用时期[7,8]。从而使得接有Lb菌种的NO2-培养液,NO2-大量降解且48h后NO2-无残留;接种在发酵菜(经烫漂后菜中NO3-含量为895.23 mg/kg)中,在发酵期间汤汁中检测不出NO2-,菜中也无NO2-残留。
3.2 结论
对Streptococcuslastic,Lactobacillusleicmannii,Lactobacillusbrevis等9种食品常见乳酸菌种进行NO2-降解研究,分析认为Lactobacilluscaseisubsp.rhamnosusmutation,Lactobacillusbrevis具有高效降解NO2-能力。Lactobacilluscaseisubsp.rhamnosusmutation在NiR降解阶段降解NO2-能力强,但由于该菌产酸能力较强,使其迅速进入H+降解阶段,而使NO2-降解速度变的缓慢。Lactobacillusbrevis一直能够处于NiR降解NO2-阶段,能使该菌所处环境中NO2-迅速被彻底分解。分析认为:由于该菌产酸为异型发酵途径,产酸量较低,且Lactobacillusbrevis产生的NiR为同步合成型,能快速产生NiR,从而使该菌产生H+中和了NiR降解NO2-生成的碱性物质,使发酵环境一直处于NiR最适作用pH值(5.0 ~ 6.0),从而使NO2-快速被降解。
4 展望
由于NiR的最适作用pH值为pH5.0 ~ 6.0,因此食品级的NiR粗酶液可以作为中性或偏酸性食品的添加剂来去除食品中的NO2-,以提高食品的安全性;精致纯化的NiR液可应用于临床NO2-中毒患者体内NO2-的清除,以达到解毒的功效;如NO2-作为防腐剂或发色剂来腌制红肉制品,在食用之前(灭菌之前)可直接加入类似Lactobacillusbrevis的食用乳酸菌液,来清理残留的NO2-;亦可以采用复合菌剂进行发酵食品生产,如发酵初期可接种类似Lactobacillusbrevis的乳酸菌,使其NO2-大量被降解,发酵一定时间以后,再接种产酸高、风味好的其他食用乳酸菌进行发酵,这样的高酸发酵食品,既风味好又无或少NO2-残留。
[1] 徐少才,周广礼,胡啸.青岛市环境空气中氮氧化物污染状况及对策[J].中国人口资源与环境.2014(S2):155-158.
[2] WANG YD,FU JM,SHI Q,et al.Sodium nitrite induces epithelial-mesenchymal transition of SMMC-7721 cells[J].Acta Pharmaceutica Sinica,2011,46(5):507-512.
[3] FERRUCCI LM,SINHA R,WARD MH,et al.Meat and components of meat and the risk of bladder cancer in the NIH-AARP Diet and Health Study [J].Cancer,2010,116(18):4 345-4 353.
[4] CROSS AJ,FERRUCCI LM,RISCH A,et al.A large prospective study of meat consumption and colorectal cancer risk:an investigation of potential mechanisms underlying this as sociation[J].Cancer Res,2010,70(6):2 406-2 414.
[5] LI JF,JI ZY,LI JZ,et al.Analysis on the influence of nitrate in drinking water ofcentral water supply among different types of underground water and treatments[J].Chin J of Public Health Eng,2016,15(2):125-126.
[6] 潘博.蔬菜中硝酸盐和亚硝酸盐的产生与检[J].科学种养,2016(4):290.
[7] 张庆芳,迟乃玉,郑 燕.乳酸菌降解亚硝酸盐机理的研究[J].食品与发酵工业,2002,28(8):27-31.
[8] 龚钢明,吕玉涛,管世敏.乳酸菌亚硝酸盐还原酶制备及酶学性质[J].中国酿造,2011,226(1):58-60.
[9] SCHOINA V,TERPOU A,ANGELIKA-IOANNA G,et al.Use of Pistacia terebinthu s resin as immobilization support forLactobacilluscasei, cells and application in selected dairy products[J].Journal of Food Science and Technology,2015,52(9):5 700-5 708.
[10] BU Xiu-juan,ZHANG Yan,WANG Zuo-zha,et al.The rapid isolation and identification ofThermophilicstreptococcusLacticfor detection of antibiotics in raw milk[J].Journal of Jilin Teachers Institute of Engineering and Technology,2012,28(8):67-69.
[11] SU Yuan-ning,XIA Yu,LIN Jie,et al.Analysis of protein degradation and aroma-producing capacity of lactic acid bacteria[J].China Brewing,2014,33(3): 36-39.
[12] ZHANG Li-ping,YANG Chen,WANG Cheng-qing,et al.Apply and research ofLactobacilluscaseiin the production of yoghurt[J].CHINA DAIRY INDUSTRY,2007,35(2):23-26.
[13] WANG Shui-quan,BAO Yan,DONG Xi-mei,et al.Physiological function and application ofLactobacillusplantarum[J].Journal of Agricultural Science and Technology,2010,12(4):49-55.
[14] 迟乃玉,张庆芳.微生物学实验技术[M].沈阳:辽宁科学技术出版社,2010.
[15] 张庆芳,董硕,迟乃玉.乳酸菌发酵蔬菜亚硝酸盐含量测定——盐酸萘乙二胺法预处理条件的研究[J].食品工业科技,2009,30(9):298-300.
[16] 穆华荣.食品分析[M].北京:化学工业出版社,2009:62-83.
[17] 食品卫生检验方法(理化部分)注解[M].北京:卫生部食品卫生监督检验所.2003:56-72.
[18] 张庆芳,迟乃玉,纪淑娟,等.接种乳酸菌对大白菜腌渍发酵的影响[J].食品研究与开发,2001,22(1):59-60.
[19] 郭晓红,杨洁彬,张建军.甘兰乳酸发酵过程中亚硝峰消长机制及抑制途径的研究[J].食品与发酵工业,1989(2):29-38.
[20] 李泽丽.应用植物乳杆菌降解亚硝酸盐的研究[D].上海:上海师范大学,2015.
[21] 张庆芳,迟乃玉,郑学仿,等.短乳杆菌(Lactobacillusbrevis)去除亚硝酸盐的研究[J].微生物学通报,2004,31(2):55-60.
[22] 郭勇.酶工艺[M].北京:科学出版社,2013:8-37.
[23] 卢海强,霍文敏,谷新晰,等.产亚硝酸盐还原酶低温乳酸菌的筛选鉴定及发酵特性[J].河北农业大学学报,2015,38(1):89-91
[24] GUO Y,LI Y,et al.Heterotrophic nitrification and aerobic denitrification by a novelHalomonascampisalis[J]. Biotechnology Letters,2013,35(12):2 045-2 049.
[25] GAO H,Schreiber F,Collins G,et al.Aerobic denitrification in permeable Wadden Sea sediments[J].Isme Journal Emultidisciplinary Journal of Microbial Ecology,2010,4(3):417-426.
[26] 吴向华,刘五星.土壤微生物生态工程[M].北京:化学工业出版社,2012:75-82.
[27] 孔健.农业微生物技术[M].北京:化学工业出版社,2005:192-193.

CHI Xue-mei1,2,ZHANG Qing-fang1,2*
1(College of Life Science and Technology, Dalian University, Dalian 116622, China)2(Liaoning Marine Micr-obial Engineering and Technology Center, Dalian 116622, China)

Lactic acid bacteria;NO2-degradation;performance valuation
硕士研究生(张庆芳教授为通讯作者,E-mail:zqf7566@126.com)。
国家高技术研究发展计划“863”(2007AA021306);辽宁省自然科学基金(2014020134)
2016-11-14,改回日期:2017-01-03
10.13995/j.cnki.11-1802/ts.201706013
