动态高压微射流预处理对甘薯叶多酚提取物抗氧化性的影响机制初探
2017-07-31张露卢遇涂宗财谢星沙小梅王辉傅志丰
张露,卢遇,涂宗财, *,谢星,沙小梅,王辉,傅志丰
1(江西师范大学 生命科学学院功能有机小分子教育部重点实验室,江西 南昌,330022)2(南昌大学 食品科学与技术国家重点实验室,江西 南昌,330047)
动态高压微射流预处理对甘薯叶多酚提取物抗氧化性的影响机制初探
张露1,卢遇1,涂宗财1, 2*,谢星2,沙小梅1,王辉2,傅志丰2
1(江西师范大学 生命科学学院功能有机小分子教育部重点实验室,江西 南昌,330022)2(南昌大学 食品科学与技术国家重点实验室,江西 南昌,330047)
动态高压微射流(DHPM)是一种新兴的高压均质技术,有研究表明,DHPM能有效提高甘薯叶提取物的体外抗氧化活性,但其作用机制还不明确,因此文中旨在探索DHPM提高甘薯叶提取物抗氧化活性的作用机制。研究发现,DHPM提取和辅助提取均能有效降低物料颗粒的平均粒度、粒径分布范围,增加颗粒的比表面积和平均孔径,提高甘薯叶多酚和黄酮的得率,增强提取物的DPPH·清除能力和还原能力。而甘薯叶多酚溶液再经DHPM处理对提取液中总酚、总黄酮含量以及体外抗氧化活性无显著影响(P>0.10)。因此,DHPM是通过降低物料粒度、增加物料比表面积和孔径提高甘薯叶总酚和总黄酮的得率,最终提高提取物的体外抗氧化能力,它不会引起甘薯叶中多酚类化合物的氧化降解。
动态高压微射流;甘薯叶;抗氧化;多酚;提取
甘薯是世界上第7大主要粮食作物之一,甘薯叶是甘薯生产和加工的主要副产物,其多酚含量高于甘薯藤、甘薯皮、甘薯块根和大部分食用蔬菜。甘薯叶的抗氧化活性高且富含三、二咖啡酰奎宁酸和香豆酰奎宁酸等酚酸类化合物,以及槲皮素、芦丁、山奈酚等黄酮类化合物[1-4]。甘薯叶提取物具有多种保健效果,如抗诱变、抗癌、抗糖尿病、抗炎、抗氧化和抗高血压活性等[5-6]。
动态高压微射流(dynamic high pressure microfluidization,DHPM)是一种新兴的动态均质技术,通过高频振荡、高速剪切、空穴、瞬时高压和瞬时低压等作用破碎、均质物料,已经被广泛应用于食品组分改性、液体食品、脂质体制备和生物活性成分提取。作为改性方法,DHPM已被广泛应用于蛋白质、糖、淀粉和膳食纤维的改性。例如,增加大豆分离蛋白的溶解性、乳化稳定性、表面疏水性和二硫键的含量[7],促进卵清蛋白的糖基化[8],降低高甲氧基果胶的表观黏度、平均分子质量和粒度[9]。在液体食品加工和脂质体加工方面,CIRON等[10]发现,150 MPa DHPM处理的牛奶具有更小的颗粒粒度,制备的酸奶更易于形成具有脂肪球的蛋白网络结构响;作为辅助提取手段,DHPM是一种新兴的植物中活性成分提取方法,具有提取条件温和、提取率高、提取时间短的优势,它通过降低物料粒度、增加溶剂穿透能力提高目标产物的得率,可增加荷叶多糖和甘薯叶黄酮的得率[11-12]。
本研究以橘色肉型甘薯叶为原料,研究DHPM不同压力(0~160 MPa)2次处理和120 MPa不同处理次数(1~5)提取和辅助提取对甘薯叶中多酚和黄酮的得率、产物抗氧化活性和物料颗粒粒度、比表面积、颗粒孔径的影响,并通过与DHPM相同条件后处理对提取物的多酚含量和抗氧化性的影响相比较,研究DHPM提高甘薯叶多酚得率和抗氧化活性的作用机理。
1 材料和方法
1.1 材料和试剂
2015年10月初,新鲜甘薯叶采集于江西省宜春市,接着用自来水洗干净,45 ℃烘干,粉碎,过200目筛处理后于4 ℃保存。Folin-Ciocalteu试剂、Na2CO3、AlCl3、NaOH、NaNO3、K3[Fe(CN)6]、三氟乙酸(TFA)、FeCl3等:分析纯,阿拉丁;没食子酸、芦丁、ABTS(2,2’-azino-bis (3-ethyl-benzthiazoline-6-sulphonic acid)和1,1-diphenyl-2-picrylhydrazyl(DPPH):分析纯,Sigma。
1.2 仪器与设备
TGL-10C高速台式离心机,上海安亭科学仪器厂;GYB60-6S高压均质机,上海东华高压均质机厂;M-110EH动态高压微射流,美国Microfluidics公司;ML104电子天平,梅特勒托利多仪器(上海)有限公司;T6新世纪紫外-可见分光光度计,北京普析通用仪器有限公司;LA-950激光散射粒度分布分析仪,日本HORIBA公司。
1.3 实验方法
1.3.1 甘薯叶多酚DHPM辅助提取物和DHPM提取
参照李志等[13]的条件提取甘薯叶中的多酚类化合物。取55 g甘薯叶粉末,用2 200 mL体积分数70%乙醇混匀后高压均质机40 MPa处理2次,然后分别量取10份200 mL均质后的悬浮液。其中5份样品分别用DHPM(M-110EH,Microfluidics Company,USA)于60、80、100、120、140和160 MPa处理2次,4份样品分别于120 MPa处理1、3、4和5次,1个样品不做任何处理,为减少冲洗反应腔过程中乙醇对样品的稀释作用,每个样品在DHPM处理后只接收中间100 mL出腔样品。接着将每个样品平均分为2份(每份50 mL),1份于直接4 000 r/min离心10 min,1份于75 ℃浸提2 h后再离心,收集上清液并定容至50 mL。最后分别得到甘薯叶多酚的DHPM提取物和DHPM辅助浸提提取物,并分别简写为DHPME和DHPMAE。提取实验重复3次。
1.3.2 DHPM后处理
取27.5 g甘薯叶粉末,用1 100 mL体积分数70%乙醇混匀后于75 ℃提取2 h,4 000 r/min离心10 min后收集上清液。然后分别量取10份100 mL的提取液,其中5份样品分别于DHPM 80、100、120、140和160 MPa处理2次,4份样品分别于120 MPa处理1、3、4和5次,1个样品为空白对照组。每个样品在DHPM处理后只接收中间50 mL出腔样品,最后将所有样品定容至50 mL。实验重复3次。
1.3.3 总酚含量测定
采用Folin-Ciocalteu法测定提取物中总酚的含量[17]。用0.5 mL体积分数70%乙醇代替样品的体系为空白,用蒸馏水代替Na2CO3的体系为样品空白(扣除样品的颜色)。以没食子酸(10~60 μg/mL)为标品计算总酚含量,结果表示为毫克没食子酸当量每克干物质(mg GAE/g DM)。
1.3.4 总黄酮含量测定
参照李光等的方法[14],采用AlCl3-NaOH-NaNO3法测定样品中总黄酮的含量。2.0 mL体积分数70%乙醇代替样品的体系为空白,用蒸馏水代替AlCl3的体系为样品空白Aj(扣除样品颜色)。以芦丁为标品(0~54.6 μg/mL)绘制标准曲线,结果表示为毫克芦丁当量每克干物质(mg RT/g DM)。
1.3.5 DPPH·清除能力测定
将所有样品用体积分数70%乙醇稀释至2 mg DM/mL,然后根据前期实验采用的方法测定样品对DPPH·的清除能力[2]。IC50是清除50% DPPH·所需要的样品浓度,以BHA为阳性对照,结果表示为毫克BHA当量每克干物质(mg BHA/g DM),所有实验重复3次。
1.3.6 还原能力测定
参照前期研究采用的方法测定所有样品的还原能力[15]。吸光值越大表示样品的还原能力越强。IC0.5指使反应体系的吸光值为0.500所需要的样品浓度,以BHA为阳性对照,结果表示为毫克BHA当量每克干物质(mg BHA/g DM),所有实验重复3次。
1.3.7 粒度和比较面积测定
分别称取1.0 g 1.3.1中离心后得到的DHPM不同压力和次数处理的甘薯叶粉末残渣,用10 mL蒸馏水溶解混匀后,采用LA-950激光散射粒度分布分析仪(HORIBA,日本)测定DHPM处理对甘薯叶粉末颗粒的平均粒度、比表面积和孔径的影响。测定时,取2.0 mL样品于样品池中,折光率设为1.33,溶液循环速度为5次/s,每个样品重复测3次。
1.4 数据分析
所有实验重复3次,结果以(平均值±标准偏差)表示。通过Origin 8.0(OriginLab Co.,US)的多项曲线拟合方程对样品浓度对清除率/吸光值的曲线进行拟合计算DPPH·的半抑制浓度,以及还原能力的IC0.5值。采用一维ANOVA(SPSS 13.0)分析数据间的显著性差异,P<0.05认为数据间存在显著性差异,所有图谱采用Origin 8.0软件绘制。
2 结果与分析
2.1 总酚含量分析
DHPM不同压力和次数辅助浸提(DHPMAE)和DHPM提取(DHPME)对甘薯叶多酚和黄酮提取率的影响如图1所示。
由图1可知,DHPMAE对甘薯叶多酚和黄酮的提取效率高于直接DHPME,处理压力为0~160 MPa时,其多酚得率分别为16.14~18.69和14.04~17.79 mg GAE/g DM,黄酮得率分别为12.91~16.00和15.21~21.90 mg RE/g DM。这可能是因为DHPM提取过程中,物料与萃取溶剂间的接触时间不超过1.5h,物料中的多酚类化合物不能充分溶解到溶剂中[13, 15]。DHPM处理后再70 ℃浸提2 h一方面增加了甘薯叶细胞中多酚类化合物向溶剂中转移的时间,另一方面,DHPM处理使物料颗粒降低,提取温度增加,物料与溶剂接触的表面积增加,细胞中的内容物向溶剂中转移的速度和效率也被大大提高[11],因此,DHPMAE对甘薯叶多酚和黄酮的提取率大大高于DHPME。

图1 DHPM辅助浸提和DHPM提取对甘薯叶多酚(A)、黄酮(B)得率的影响Fig.1 Effect of DHPM assisted-extraction and DHPM extraction on the yield of Ipomoea batatas leaves polyphenols and flavonoids
DHPMAE 60 MPa处理对甘薯叶多酚的提取效率无显著性影响(P>0.05),处理压力为120 MPa时具有最高的多酚得率,为18.62 mg GAE/gDM。当DHPM处理压力由100 MPa升到160 Mpa时,处理压力的变化对总酚的得率不存在显著性影响(P>0.05)。但甘薯叶黄酮的得率随DHPM处理压力的增加(60~100 MPa)逐渐升高,且处理压力达100~160 MPa时,DHPMAE和DHPME两种提取方法对甘薯叶黄酮得率的影响不同,前者逐渐升高,后者无显著性差异(P>0.05),DHPM 160 MPa辅助提取制备的甘薯叶提取物具有最高的总黄酮含量,达21.90 mg RE/g DM,该得率高于前期测得的最大得率(16.51 mg RE/g DM)[2],但低于李志[13]等测得的3.5%~5.44%,这可能是由于原料和提取方法的差异所产生的。
从图1可以看出,当DHPM处理压力为120 MPa时,处理次数对甘薯叶多酚和黄酮的提取效率的影响不同。DHPME提取物中的总酚含量随处理压力的增加逐渐增加,但当处理次数超过2次后,处理次数的增加对总黄酮的得率无显著性影响(P>0.05)。DHPMAE提取物中的总酚含量随处理次数的增加呈先增加后不变的趋势,处理次数超过2次后,总酚和总黄酮的得率均无显著性差异。这可能是因为,对于DHPM提取而言,处理次数越多,溶剂与甘薯叶细胞中的多酚类化合物的置换时间越长;另外,微射流处理次数越多,物料颗粒越小[11, 16],溶剂与物料颗粒的接触面积越大,从而使多酚的得率越高。对于DHPMAE而言,由于0 MPa DHPMAE制备样品中的总酚含量高于DHPME 80~160 MPa 2次处理制备的样品,且总黄酮含量与后者相近,因此,70 ℃,2 h浸提对红薯叶多酚和黄酮的萃取效率高于单独DHPM提取,此时增加DHPM处理压力和次数对提高多酚和黄酮的萃取效果的作用就会减弱,李志等[13]发现,当DHPMAE时间超过90 min后,总黄酮含量的提取率与萃取时间不成正比关系。
2.2 体外抗氧化活性分析
DHPMAE和DHPME处理压力和次数的变化对甘薯叶提取物DPPH·清除能力和还原能力的影响如图2所示。
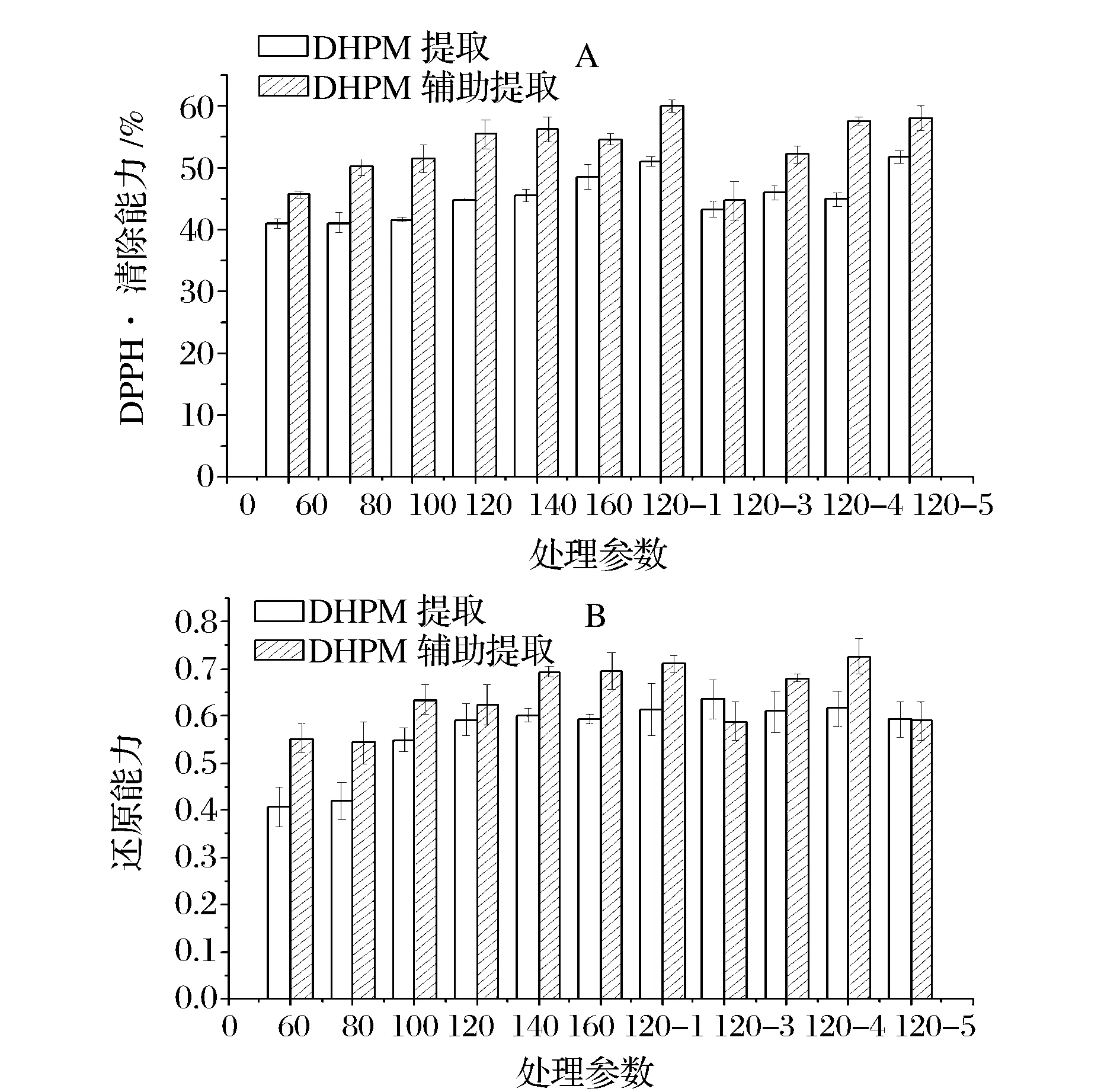
A-DPPH·清除能力;B-Fe3+还原能力图2 DHPM辅助浸提和DHPM提取对甘薯叶提取物体外抗氧化性的影响Fig.2 Effect of DHPM assisted-extraction and DHPM extraction on the antioxidant activities of Ipomoea batatas leaves extracts
由图2可知,随着处理压力和次数的增加,甘薯叶样品的DPPH·清除能力和Fe3+还原能力的变化趋势与提取物中总酚含量的变化趋势相似,其相关系数r分别达0.931和0.843,而与总黄酮含量的相关系数r分别为0.416和0.379。因此,酚酸为甘薯叶中起主要作用的抗氧化成分,这与前期实验的结果一致[2, 17]。甘薯叶提取物的DPPH·清除能力随DHPMAE和DHPME处理压力和次数的增加均呈逐渐上升的趋势,160 MPa 2次处理和120 MPa 5次处理的DHPMAE提取物具有最高的DPPH·清除能力清除能力(P>0.05),清除率分别为60%和58.08%。
由图2-B可知,DHPMAE和DHPME均能提高甘薯叶提取物的还原能力,但2种方法的影响规律不同。提取物的还原能力先随DHPMAE处理压力的增加而上升,压力高于120 MPa后无显著差异,但随处理次数的增加先增加后下降,DHPMAE 120~160 MPa 2次处理和120 MPa 4次处理制备的样品具有最大还原能力(P>0.05)。但是,当DHPME处理压力高于120 MPa后,DHPM处理压力和次数对的变化对甘薯叶DHPME样品的还原能力无显著影响(P>0.05)。
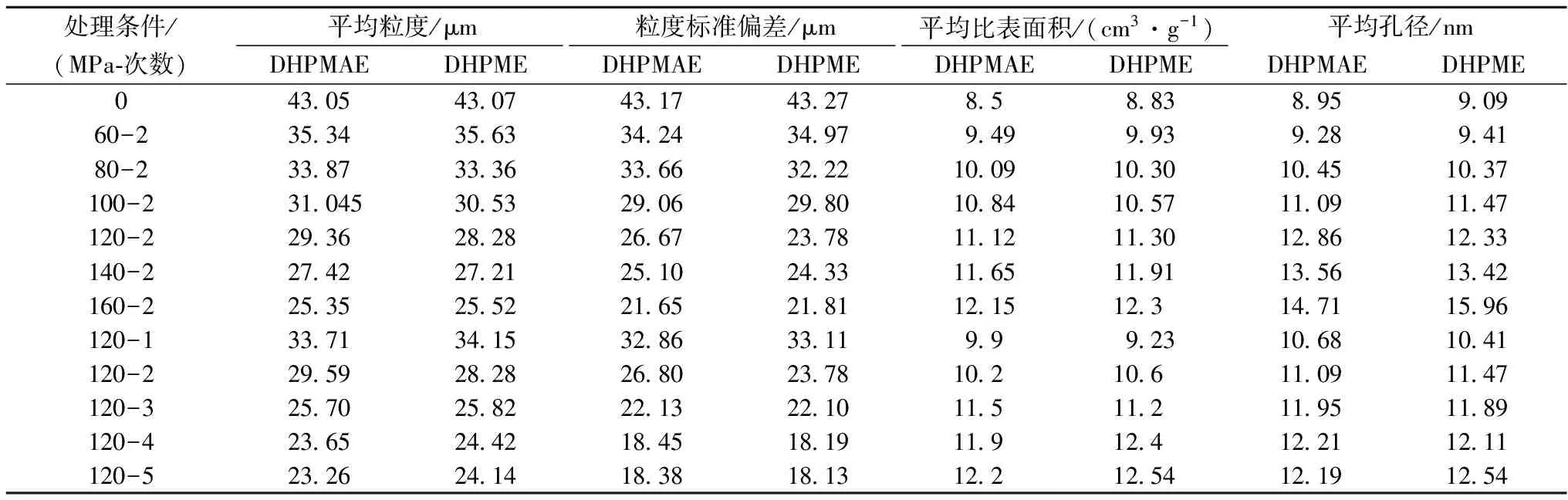
因此,DHPM处理能提高甘薯叶提取液的体外抗氧化能力,这与HUANG[12]和ZHANG[2]等的研究结果一致。甘薯叶提取物的体外抗氧化能力主要取决于提取物中酚酸和和黄酮的含量[2-3, 17],那么,DHPM是通过提高提取液中多酚类化合物的含量,还是通过改变多酚类化合物的组成提高提取液的抗氧化活性?为阐述这一科学问题,本试验采用与DHPM提取相同的条件对70 ℃浸提2 h制备的甘薯叶样品进行处理,并分析DHPM处理对提取液中总酚、总黄酮和体外抗氧化能力的影响。结果如表1所示,由表1可知,DHPM处理压力(60~160 MPa)和次数(120 MPa,1~5次)对提取液中总酚和总黄酮的含量均无显著性影响(P>0.05),对提取物的DPPH·清除能力和Fe3+还原能力的影响很小(0.05 表1 DHPM处理压力和次数对甘薯叶提取物中总酚、黄酮含量以及抗氧化活性的影响 注:同一列右上角的不同字母(a,b,e等)代表样品间的数值具有显著性差异(P<0.05)。 2.3 物料粒度和比表面积分析 DHPM不同处理压力和次数对甘薯叶粉末平均粒度、粒径分布、平均比表面积和平均孔径的影响如表2所示。 表2 DHPM处理压力和次数对甘薯叶物料平均粒度、粒径分布、平均比表面积和平均孔径的影响 由表2可知,随着DHPM处理压力(60~160 MPa)的增加,物料的平均粒度和粒度标准偏差逐渐下降,分别由未处理的43.07 μm和43.27 μm减少到25.52 μm和21.81 μm;平均比表面积和平均孔径逐渐增加,分别由未处理的8.83 cm3/g和9.09 nm增加到12.3 cm3/g和15.96 nm。DHPM 120 MPa处理次数的增加也会降低甘薯叶粉末的粒度,使物料粒度分布更加集中,物料的比表面积和平均孔径增大,但当处理次数超过4次后,处理次数对物料的粒度和平均比表面积的影响较少(P>0.05)。图3更加直观地表示,DHPM处理压力和次数的增加可使甘薯叶粉末粒度分布更加集中,平均粒度下降。因此,甘薯叶粉末的比表面积和平均孔径越大,溶剂与物料的接触面积越大,使多酚类化合物越容易溶解到溶剂中,从而提高了多酚和黄酮的得率,最终提高提取液的抗氧化能力。 图3 DHPM处理压力和次数对甘薯叶粉末粒度分布的影响Fig. 3 Effect of DHPM processing pressures and times on the particle size distribution of Ipomoea batatas leaves powders DHPM技术细化物料的机理可能是,当甘薯叶悬浊液加速进入DHPM反应腔时,瞬时高压和空化效应产生的高速剪切作用使甘薯叶颗粒破碎;当物料从反应腔喷出时,瞬时低压、湍流碰撞与摩擦进一步使颗粒剪切破碎,同时,高速射流与腔壁发生高速碰撞,强化粉碎效果[18]。HUANG等[12]通过扫描电镜发现,DHPM处理能破坏甘薯叶粉末的细胞壁结构,降低颗粒粒度、增加物料的比表面积,并使物料更加蓬松。ZHANG等的研究[15]也表明,DHPMAE能降低荷叶粉末的粒度,使物料表面更加蓬松,从而提高多糖的得率。 随着DHPM处理压力(60~160 MPa)和次数(120 MPa,1~5次)的增加,多酚和黄酮的得率总体上先逐渐增加后不变;提取液的DPPH·清除能力逐渐增强,而还原能力呈先增加后不变的趋势。DHPM 120 MPa处理2次辅助提取的样品具有最高的总酚和还原能力,160 MPa处理两次辅助提取的样品具有最高的总黄酮含量和DPPH·清除能力,样品的抗氧化能力主要取决于提取物中多酚的含量。甘薯叶粉末的平均粒度、粒径分布范围随处理压力和次数的增加逐渐下降,粉末的比表面积和平均孔径逐渐增加。而DHPM后处理对甘薯叶多酚浸提液中总酚、总黄酮含量无显著影响(P>0.05),对样品的体外抗氧化活性影响不大(P>0.10)。因此,DHPM主要是通过细化物料,提高总酚和总黄酮的得率来提高样液的体外抗氧化能力,它不会引起甘薯叶中多酚类化合物的氧化降解,亦不会改变其结构。因此,DHPM技术可以作为一种有效的天然植物活性成分提取的方法。 [1] THU N N, SAKURAI C, UTO H, et al. The polyphenol content and antioxidant activities of the main edible vegetables in northern Vietnam[J]. Journal of Nutritional Science and Vitaminology, 2004, 50(3):203-210. [2] ZHANG L, TU Z-C, WANG H, et al. Comparison of different methods for extracting polyphenols fromIpomoeabatatasleaves, and identification of antioxidant constituents by HPLC-QTOF-MS 2[J]. Food Research International, 2015, 70:101-109. [3] LUO C, WANG X, GAO G, et al. Identification and quantification of free, conjugate and total phenolic compounds in leaves of 20 sweetpotato cultivars by HPLC-DAD and HPLC-ESI-MS/MS[J]. Food Chemistry, 2013, 141(3):2 697-2 706. [4] CARVALHOI S, CAVACO T, CARVALHO L M, et al. Effect of photoperiod on flavonoid pathway activity in sweet potato (Ipomoeabatatas(L.) Lam.) leaves[J]. Food Chemistry, 2010, 118(2):384-390. [5] SUN H, MU T, XI L, et al. Sweet potato (IpomoeabatatasL.) leaves as nutritional and functional foods[J]. Food Chemistry, 2014, 156:380-389. [6] 张彧, 吴祎南, 陈莉, 等. 红薯茎叶化学组成的研究进展[J]. 食品科学, 2006, 27(3):252-256. [7] SHEN L, TANG C-H. Microfluidization as a potential technique to modify surface properties of soy protein isolate[J]. Food Research International, 2012, 48(1):108-118. [8] HUANG X, TU Z, WANG H, et al. Glycation promoted by dynamic high pressure microfluidisation pretreatment revealed by high resolution mass spectrometry[J]. Food Chemistry, 2013, 141(3):3 250-3 259. [9] CHEN J, LIANG R, LIU W, et al. Degradation of high-methoxyl pectin by dynamic high pressure microfluidization and its mechanism[J]. Food Hydrocolloids, 2012, 28(1):121-129. [10] CIRON C, GEE V, KELLY A, et al. Comparison of the effects of high-pressure microfluidization and conventional homogenization of milk on particle size, water retention and texture of non-fat and low-fat yoghurts[J]. International Dairy Journal, 2010, 20(5):314-320. [11] HUANG X, TU Z, JIANG Y, et al. Dynamic high pressure microfluidization-assisted extraction and antioxidant activities of lentinan[J]. International Journal of Biological Macromolecules, 2012, 51(5):926-932. [12] HUANG X, TU Z, XIAO H, et al. Dynamic high pressure microfluidization-assisted extraction and antioxidant activities of sweet potato (IpomoeabatatasL.) leaves flavonoid[J]. Food and Bioproducts Processing, 2013, 91(1):1-6. [13] 李志, 涂宗财, 毛沅文, 等. 动态超高压微射流技术提取甘薯叶黄酮[J]. 食品科学, 2010,31(24):83-86. [14] 李光, 余霜, 邓银, 等. 甘薯叶总黄酮含量的测定[J]. 食品与发酵工业, 2011, 37(12):152-154. [15] ZHANG L, TU Z, WANG H, et al. Response surface optimization and physicochemical properties of polysaccharides from Nelumbo nucifera leaves[J]. International Journal of Biological Macromolecules, 2015, 74:103-110. [16] TU Z, CHEN L, WANG H, et al. Effect of fermentation and dynamic high pressure microfluidization on dietary fibre of soybean residue[J]. Journal of Food Science and Technology, 2014, 51(11):3 285-3 292. [17] ZHANG L, TU Z, YUAN T, et al. Antioxidants and α-glucosidase inhibitors from Ipomoea batatas leaves identified by bioassay-guided approach and structure-activity relationships[J]. Food Chemistry, 2016, 208:61-67. [18] 吴雪, 刘斌, 冯涛.微射流均质机的超微粉碎机理分析[J]. 食品与机械, 2009(3):65-68. Mechanism of dynamic high pressure microfluidization assisted-extraction on the effect of antioxidant activities of polyphenols fromIpomoeabatatasleaves ZHANG Lu1, LU Yu1, TU Zong-cai1, 2*, XIE Xing2, SHA Xiao-mei1, WANG Hui2, FU Zhi-feng2 1 (Key Laboratory of Functional Small Organic Molecule, Ministry of Education, College of Life Science, Jiangxi Normal University, Nanchang 330022, China)2 (State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China) Dynamic high pressure microfluidization (DHPM) is an emerging homogenization technique with high pressure. Previous research indicated that DHPM could obviously improve theinvitroantioxidant activities (AAs) ofIpomoeabatatasleaves extracts, but the mechanism is still unknown. Therefore, this research was to investigate how DHPM increases AAs ofIpomoeabatatasleaves extracts. Results indicated that DHPM treatment could significantly decrease the average particle size and particle size distribution, and increase the specific surface area and average pore diameter ofIpomoeabatatasleaves powder. The yield of total phenolics and total flavonoids, as well as the DPPH radical scavenging ability and ferrous ion reducing power were also greatly enhanced. When the solution ofIpomoeabatatasleaves polyphenols was subjected to DHPM processing, insignificant difference was observed on the total phenolic and total flavonoids content, along with tested AAs among the post-treated samples(P>0.10). Therefore, DHPM assisted-extraction improves AAs of extracts through the increased of total phenolics and flavonoids yield, the decrease of particle size, and the increase of the specific surface area and pore diameter. The process will not cause oxidative degradation of the polyphenols inIpomoeabatatasleaves. dynamic high pressure microfluidization;Ipomoeabatatasleaves; antioxidant activity; polyphenols;extraction 博士,讲师(涂宗财教授为通讯作者,E-mail:Tuzc_mail@aliyun.com)。 国家自然科学基金(21276118);江西省教育厅一般项目(GJJ150331) 2016-10-10,改回日期:2016-11-07 10.13995/j.cnki.11-1802/ts.201706028

3 结论
