奶豆腐来源植物乳杆菌的益生特性评价
2017-07-31吕冠薇段翠翠高磊栾畅赵玉娟牛春华李盛钰
吕冠薇,段翠翠,高磊,栾畅,赵玉娟,牛春华,李盛钰*
1(长春医学高等专科学校 临床医学部,吉林 长春,130031)2(吉林省农业科学院 农产品加工研究所,吉林 长春,130033)
奶豆腐来源植物乳杆菌的益生特性评价
吕冠薇1,段翠翠2,高磊2,栾畅2,赵玉娟2,牛春华2,李盛钰2*
1(长春医学高等专科学校 临床医学部,吉林 长春,130031)2(吉林省农业科学院 农产品加工研究所,吉林 长春,130033)
以奶豆腐来源的3株植物乳杆菌(Lactobacillusplantarum)为研究对象,分析了菌株的耐酸耐胆盐能力、表面疏水性和体外抗氧化能力,旨在评价菌株的益生特性。结果表明:植物乳杆菌对强酸和高胆盐具有较好的耐受能力,能保持较高的活性;供试菌株均对二甲苯的疏水性作用较强,而对三氯甲烷的疏水作用较弱;3株菌株均具有较好抗氧化活性。
益生菌;植物乳杆菌;耐受;抗氧化
益生菌(probiotic)是一类对人体有益的活性微生物,可作为食品添加剂加入食品中直接食用,定植于人体肠道、生殖系统内,调节肠道菌群结构,改善宿主微生态平衡,促进机体健康[1]。随着对益生菌研究的不断深入,越来越多的益生性发酵食品得到人们的认可。将益生菌添加到食品中,不仅可以增加食品的保健功效,而且还可以改善口感、质地和风味[2]。目前,市场上的益生菌功能食品种类很多,如酸奶、奶酪、饮料等,但是不同来源的菌株的功能特性存在很大的差异,因此筛选优良益生特性和功能特性的乳酸菌新菌株,对益生菌的应用和产品开发至关重要。本研究主要通过对传统发酵食品奶豆腐源植物乳杆菌菌株的耐酸耐胆盐特性、抗氧化能力、蛋白水解活性等进行测定,着力于筛选出具有潜在益生特性的优良菌株,为今后开发新型功能性益生菌制品奠定基础。
1 材料与方法
1.1 试验菌株
试验菌株C12、C26和C40为内蒙古传统奶豆腐中分离的新菌株。上述菌株经API50 C生化鉴定盒及16S rDNA序列比对分析,均鉴定为植物乳杆菌(Lactobacillusplantarum)。菌种保存于吉林省农业科学院农产品加工所。使用前连续活化传代培养2代后,按3%量接种于MRS液体培养基中,连续培养16 h,离心(6 000 r/min,10 min,4 ℃),灭菌生理盐水洗涤2次,离心(6 000 r/min,10 min,4 ℃),菌泥用灭菌生理盐水调整菌数为1010CFU/mL,置4 ℃冰箱备用。
1.2 培养基
MRS(de Man,Rogosa and Sharpe,MRS)液体培养基:蛋白胨10.0 g/L,牛肉膏10.0 g/L,酵母浸粉5.0 g/L,K2HPO42.0 g/L,无水乙酸钠5.0 g/L,柠檬酸钠5.0 g/L,MgSO40.2 g/L,MnSO40.05 g/L,葡萄糖20.0 g/L,吐温80 1.0 mL/L,加水至1 000 mL,调pH至pH6.6±0.2,115 ℃灭菌15 min。
MRS固体培养基:每升MRS液体培养基中加入琼脂20 g。
MRS-THIO液体培养基:每升MRS液体培养基中加入巯基乙酸钠2 g。
1.3 试剂
蛋白胨、牛肉膏、酵母浸粉、葡萄糖、D-山梨醇、琼脂粉(分析纯),北京奥博星生物技术有限责任公司;脱脂乳粉(食品级),新西兰进口;胆酸-脱氧胆酸钠盐混合物(产品编号:48305),SIGMA-ALDRICH公司;其余试剂均为分析纯。
1.4 仪器与设备
高压蒸汽灭菌锅,日本Sanyo公司;超低温冰箱,Thermo Electron公司;无菌超净工作台,哈尔滨东联电子技术开发有限公司;HZQ-Q型电热恒温培养箱,上海一恒实验设备有限公司;紫外可见分光光度计,美国Varian公司;全自动凯氏定氮仪,丹麦Foss公司。
1.5 试验方法
1.5.1 菌株耐酸性能的测定
分别将菌株接种于pH 2.0、pH 3.0和pH 6.6的MRS液体培养基中,分别培养1、2和3 h。培养后,各取0.5 mL菌液,无菌生理盐水稀释至适宜梯度,取50 μL涂布在MRS固体培养基中,37 ℃培养箱中静置培养48 h后菌群计数[3-5]。每个稀释度做3个平行,按公式(1)计算存活率:
(1)
1.5.2 菌株耐胆盐性能的测定
分别将菌株接种于胆盐质量分数为0.3%、0.5%和1.0%的MRS液体培养基中,分别培养1、2和3 h,以不含胆盐的MRS培养基为对照。培养后,各取0.5 mL菌液,无菌生理盐水梯度稀释后,取50 μL接种在MRS固体培养基中,37 ℃培养箱中静置培养48 h后菌群计数[6-7]。每个稀释度做3个平行,按公式(1)计算。
1.5.3 菌株表面疏水性的测定
采用细菌黏着物质法(bacterial adhesion substance,BATS)测定疏水性。菌泥用PBS溶液(pH 7.2)清洗2次后用PBS溶液重悬,调整菌悬液浓度为1×108CFU/mL,测定其在600 nm处的吸光度值(A0)。各取菌悬液3 mL,分别加入1 mL二甲苯酯、乙酸乙酯和三氯甲烷混合,静置10 min,漩涡振荡2 min后再静置30 min,在600 nm处测水相吸光度值(A1)[8]。试验重复3次。按公式(2)计算菌株疏水性:
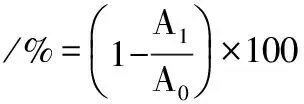
(2)
1.5.4 羟自由基清除能力的测定
采用Fenton法进行测定[9-10]。在试管中依次加入1 mL 0.435 mmol/L的亮绿溶液,2 mL 0.5 mmol/L的FeSO4溶液和1.5 mL 3%(体积分数)的H2O2溶液后,分别加入1 mL 1×109和1×1010CFU/mL浓度的菌株悬液。混匀后,于37 ℃恒温水浴锅中静置20 min,离心(6 000 r/min,10 min,4 ℃),624 nm波长下测定吸光度。按公式(3)计算菌株清除羟自由基的能力:
(3)
式中:As,样品加亮绿和Fenton试剂(Fe2+与过氧化氢构成的氧化体系称为Fenton试剂)的OD值;Ao,无样品加亮绿和Fenton试剂的OD值;A,无样品只加亮绿的OD值。
1.5.5 DPPH清除能力的测定
避光条件下,向2 mL 0.5 mmol/L的DPPH甲醇溶液中加入1 mL菌株混悬液,充分混合,静置30 min后,离心(6 000 r/min,10 min,4 ℃),517 nm处测定吸光度[11-12]。空白组以等体积甲醇溶液代替DPPH甲醇溶液,对照组以等体积无菌水代替无细胞提取液。试验重复3次。按公式(4)计算菌株清除DPPH自由基的能力:

(4)
式中:A样品,样品只加DPPH的OD值;A空白,样品只加甲醇的OD值;A对照,无样品只加DPPH的OD值。
1.5.6 超氧阴离子清除能力的测定
向1 mL不同浓度的菌株混悬液中依次加入2.8 mL 3 mmol/L的二乙三胺五乙酸溶液和0.2 mL 1.2 mmol/L的邻苯三酚溶液。混匀后,于25 ℃恒温水浴锅中静置10 min,在325 nm波长条件下测定吸光度值[13]。按公式(5)计算乳酸菌清除超氧阴离子的能力:

(5)
式中:A11,样品加二乙三胺五乙酸和邻苯三酚的吸光度值;A10,样品只加二乙三胺五乙酸的OD值;A01,无样品加二乙三胺五乙酸和邻苯三酚的OD值;A00,无样品只加二乙三胺五乙酸的OD值。
1.6 数据统计分析
2 结果与分析
2.1 菌株的酸耐受能力
由表1分析可知,在pH 6.6的条件下菌株均能良好生长,3株菌存活数随着培养时间的增加呈上升趋势。在pH 3.0的条件下,3株菌对酸性环境的耐受性很好,菌株培养3 h后的存活率均能达到70%以上,其中C26的存活率较低,耐酸能力较低,C40的存活率最高,为72.71%。在pH 2.0条件下,C26培养3 h后的活菌数为5.65 lg CFU/mL,存活率最高为70.98%,C12、C40的活菌数都在5 lg CFU/mL以下。试验结果表明,这3株菌在酸性条件下耐受性良好,仍保持较高的菌株存活数,其中植物乳杆菌C26在pH 2.0 条件下具有较强的耐酸性,植物乳杆菌C40在pH 3.0条件下具有较强的耐酸性。耐酸能力是植物乳杆菌重要的特征之一,其耐受力的高低意味着该菌株在胃肠道中的存活能力的高低。HECHARD等[14]研究结果表明,干酪乳杆菌212.3、F19和L.rhamnosusGG均不能耐受pH 2.0的酸度。MARAGKOUDAKIS等[15]报道乳杆菌能够在pH 2.5~3.0的环境中定植,但对更低pH的酸度均不耐受。与已报道菌株相比,本实验3株乳酸菌对低pH具有较强的耐受能力。

表1 菌株的耐酸性
2.2 菌株胆盐耐受能力
益生菌必须能耐受机体消化道内的胆盐环境,才能定植于肠道发挥益生作用。本研究通过模拟机体消化环境下的胆盐浓度,考察菌株在肠道中的存活能力。由表2结果可见,供试菌株在不含胆盐的MRS培养基中,培养3 h后的菌数均能达到8 lg CFU/mL以上,在含0.3%、0.5%、1.0%的牛胆盐培养基中,生长状况良好,有不同程度的耐胆盐性。在0.3%胆盐浓度的培养基中培养3 h后,C12和C26菌株活菌数均高于7 lg CFU/mL,C40菌株活菌数最低且菌株存活率最低。在胆盐浓度为0.5%和1.0%时,培养3 h后,C12、C26活菌数都在6 lg CFU/mL以上,菌株存活率均在78%以上,说明这两株菌的胆盐耐受能力较强。相比之下,C40在胆盐浓度为0.5%和1.0%的培养基中活菌数较低,难以维持较高的存活率。结果表明,供试菌株均随着胆盐浓度的增加,活菌数有不同程度的降低,菌株C12和C26具有较强的胆盐耐受能力,能适应人体内的胆盐环境,定植于肠道中发挥有益作用。这与一些植物乳杆菌具有较强的胆盐耐受能力相一致。例如王欢[16]考察了植物乳杆菌的耐胆盐能力,结果表明植物乳杆菌对0.3%胆盐有较强的耐受能力,菌株存活率可达到77.19%。JULIUS[17]研究发现传统发酵乳制品中分离出的乳杆菌,在0.3%胆盐的培养基中存活率能达到50%~84%。

表2 菌株的耐胆盐性
2.3 菌株表面疏水性
疏水性能反映出细菌和肠道上皮细胞相互作用能力的强弱。研究表明,植物乳杆菌对宿主肠道的黏附能力与表面疏水性呈正相关性。试验中采用二甲苯和乙酸乙酯用于检测菌株表面对电子的接受能力,三氯甲烷用于检测菌株表面蛋白供给电子能力。结果表明,各菌株对二甲苯的疏水性较高并对三氯甲烷的疏水性较低,说明所有菌株的接受电子能力均强于供给电子能力。图1结果显示,供试菌株对二甲苯、氯仿和乙酸乙酯3种有机溶剂的表面疏水性存在较大差异。菌株LGG对二甲苯、乙酸乙酯和三氯甲烷的疏水性分别为24.37%、18.16%和30.95%。与对照菌株鼠李糖乳杆菌(L.rhamnosus)LGG相比,供试菌株对二甲苯均有较好的疏水性(P<0.05),疏水率均高于45%。与LGG相比C40对乙酸乙酯的吸附能力较低(<20%),表明其接受电子的能力较弱,C12、C26的疏水率分别为17.45%、24.77%,但均低于对二甲苯的疏水率。供试菌株对三氯甲烷的吸附能力均较低(<25%)。

图1 菌株的疏水性Fig.1 The hydrophobic ratio of L. plantarum strains注:数据上标含有*、#或&表示与LGG组相比差异较显著(P<0.05);含**表示与LGG组相比差异极显著(P<0.01)。
2.4 菌株羟自由基清除能力
羟自由基是一种对机体毒性最强、危害最严重的活性氧自由基,它通过电子之间的转移、脱氢以及加成等方式与机体多种分子作用,损伤细胞大分子进而影响细胞的正常生理功能[18-19]。因此物质对羟自由基清除能力能够反映其抗氧化性能。本研究采用Fenton反应测定供试菌株对羟自由基的清除能力,并与LGG进行比较。结果如图3所示,3株供试菌株和LGG对羟自由基均具有一定的清除作用,但各菌株对羟自由基的清除能力存在较大差异。随着菌株浓度的增加,对羟自由基清除能力增加,当菌液浓度为109CFU/mL时,供试菌株对羟自由基的清除率在18.26%~31.15%之间不等,均明显低于LGG(50.77%)的清除率(P<0.05)。随着菌液浓度增加,菌株清除羟自由基的能力增强,当菌液浓度为1010CFU/mL时,试验菌株的清除率在40.44%~50.15%之间,而LGG的清除率为53.50%。低浓度的C40对羟自由基的清除较明显,高浓度的C26对羟自由基的清除率明显。
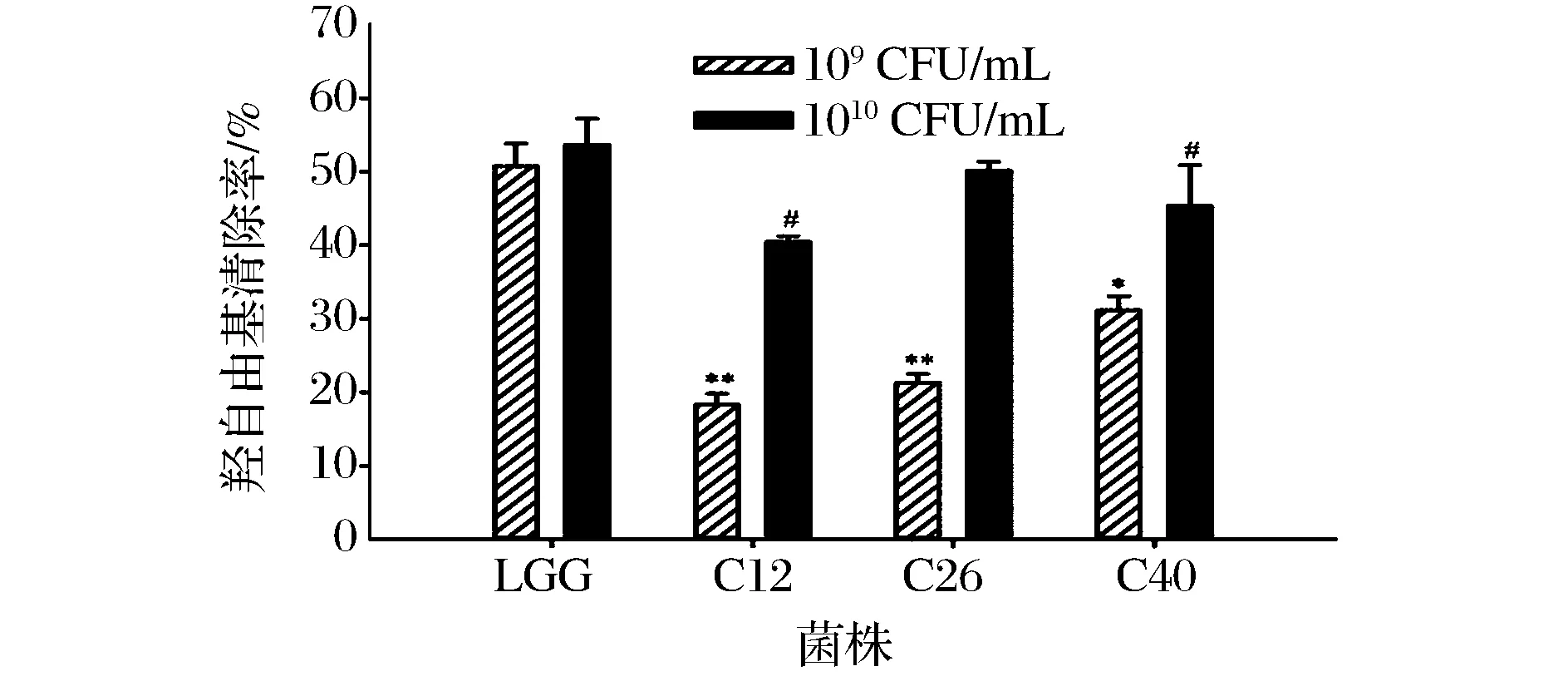
图3 菌株清除羟自由基的能力Fig.3 Hydroxyl radical scavenging ability of L. plantarum strains注:数据上标含有*或#表示与LGG组相比差异较显著(P<0.05);含**或##表示与LGG组相比差异极显著(P<0.01)。
2.5 菌株DPPH清除能力
DPPH是一种稳定存在于有机溶剂的自由基,乳酸菌对DPPH自由基的清除率,能反映出菌株对过氧化自由基、烷自由基或脂质自由基的清除能力[10,20-22]。由图4分析可知,供试菌株和LGG对DPPH自由基均具有一定的清除作用。随着菌株浓度的增加,对DPPH清除能力增加,当菌液浓度为109CFU/mL时,菌株DPPH清除率在9.39%~22.60%之间不等,对照菌株LGG的清除率为11.72%,C40对DPPH自由基的清除作用显著高于LGG(P<0.05),清除率最低的菌株是C26,其清除率为9.39%。菌液浓度为109CFU/mL相比,菌液浓度为1010CFU/mL时3株供试菌株的DPPH清除作用明显提高。当菌液浓度为1010CFU/mL时,DPPH清除率在31.09%~46.03%之间不等,菌株C26的DPPH自由基清除能力低于LGG(37.42%),其他2株菌清除能力高于LGG,其中C40的清除能力显著高于LGG(P<0.05),DPPH自由基清除率46.03%。

图4 菌株清除DPPH自由基的能力Fig.4 DPPH free radical scavenging ability of L. plantarum strains注:数据上标含有*或#表示与LGG组相比差异较显著(P<0.05);含**或##表示与LGG组相比差异极显著(P<0.01)。
2.6 菌株超氧阴离子清除能力
由图5分析可知,供试菌株和LGG对超氧阴离子均具有一定的清除作用。随着菌株浓度的增加,对超氧阴离子清除能力增加,当菌液浓度为109CFU/mL时,LGG的清除率为28.74%,3株供试菌株的清除率在5.50%~17.97%之间不等,C26对超氧阴离子的清除率较高;当菌液浓度为1010CFU/mL时,供试菌株对超氧阴离子的清除率明显提高,清除率在17.99%~38.17%之间不等,其中C26的清除能力(38.17%)高于LGG。

图5 菌株清除超氧阴离子的能力Fig.5 Superoxide anion scavenging ability of L. plantarum strains注:数据上标含有*或#表示与LGG组相比差异较显著(P<0.05);含**或##表示与LGG组相比差异极显著(P<0.01)。
3 结论
本文分析了3株奶豆腐来源植物乳杆菌的益生特性,结果表明3株实验菌株对强酸和高胆盐具有较强的耐受能力,并具有较强的表面疏水性。功能特性分析表明3株菌株具有较好抗氧化活性。综上所述,植物乳杆菌C12、C26、C40均具有较好的益生特性,可作为今后开发功能性产品的潜在益生菌资源。
[1] GUARNER F, SCHAAFSMA G J. Probiotics[J]. International Journal of Food Microbiology, 1998, 39(3): 237-238.
[2] 郭壮, 王记成, 闫丽雅, 等. 益生菌LactobacilluscaseiZhang对酸奶风味、质地及感官特性的影响[J]. 中国乳品工业, 2009, 37(1): 14-20.
[3] CLAIRE L, VERNAZZA, GLENN R, et al. Carbohydrate preference, acid tolerance and bile tolerance in five strains ofBifidobacterium[J]. Journal of Applied Microbiology, 2006, 100(4): 846-853.
[4] BAO Y, ZHANG Y C, ZHANG Y, et al.Screening of potential probiotic properties ofLactobacillusfermentum isolated from traditional dairy products[J]. Food Control, 2010, 21(5): 695-701.
[5] PEREIRA D I A, GIBSON G. Cholesterol assimilation by lactic acid bacteria and bifidobacterian isolated from the humangut [J]. Applied and Environmental Microbiology, 2002, 68(68): 4 689-4 693.
[6] VINDEROLA C G, REINHEIMER J A. Lactic acid starter and probiotic bacteria: a comparative “invitro” study of probiotic characteristics and biological barrier resistance[J]. Food Research International, 2003, 36(9/10): 895-904.
[7] DENG K, CHEN TT, WU QL, et al.Invitroandinvivoexamination of anticolonization of pathogens byLactobacillusparacaseiFJ861111.1[J]. Journal of Dairy Science, 2015, 98(10): 6759-6766.
[8] KOS B, SUSKOVIC J, VUKOVIC S, et al. Adhesion and aggregation ability of probiotic strainLactobacillusacidophilusM92[J]. Journal of Applied Microbiology, 2003, 94(6): 981-987.
[9] WANG Y C, YU R C, CHOU C. Antioxidative activities of soymilk fermented with lactic acid bacteria andBifidobacteria[J]. Food Microbiology, 2006, 23(2): 128-135.
[10] LI S Y, ZHAO Y J, ZHANG L, et al.Antioxidant activity ofLactobacillusplantarumstrains isolated from traditional chinese fermented foods[J]. Food Chemistry, 1914, 135(3): 1 914-1 919.
[11] LIN MY, CHANG FJ. Antioxidative effect of intestinal bacteriaBifidobacteriumlongumATCC 15708 andLactobacillusacidophilusATCC 4356[J]. Digestive Diseases and Sciences, 2000, 45(8): 1 617-1 622.
[12] YANG J, JI Y, PARK H, et al.Selection of functional lactic acid bacteria as starter cultures for the fermentation of Korean leek (AlliumtuberosumRottlerexSprengel.)[J]. International Journal of Food Microbiology, 2014, 191(6): 164-171.
[13] LUO D, FANG B. Structural identification of ginseng polysaccharides and testing of their antioxidant activities[J]. Carbohydrate Polymers, 2008, 72(3): 376-381.
[14] HECHARD Y, DHERBOMEZ M, CENATIEMPO Y, et al. Antagonism of lactic acid bacteria from goats milk against pathogenic strains assessed by the ‘sandwich method’[J]. Letters in Applied Microbiology, 1990, 11(6): 185-188.
[15] MARAGKOUDAKIS P A, ZOUMPOPOULOU G, MIARIS C, et.al. Probiotic potential ofLactobacillusstrains isolated from dairy products[J]. International Dairy Journal, 2006, 16(3): 189-199.
[16] MATHARA J M, SCHILLINGER U, GUIGAS C, et al. Functional characteristics ofLactobacillusspp. from traditional Maasai fermented milk products in Kenya[J]. International Journal of Food Microbiology, 2008, 126(1/2): 57-64.
[17] ZENG X, PAN D, GUO Y. The probiotic properties ofLactobacillusbuchneriP2[J]. Journal of Applied Microbiology, 2010, 108(6): 2 059-2 066.
[18] 陈路清, 李青青, 马鎏镠等.体外筛选降胆固醇双歧杆菌实验[J]. 工业科技,2010, 31(7): 333-335.
[19] KAUSHIK JK, KUMAR A,DUARY RK, et al. Functional and probiotic attributes of an indigenous isolate ofLactobacillusplantarum[J]. PLoS ONE. 2009, 4(1): 1-11.
[20] GEORGIEVA R, HAERTLE T, CHOBERT J M, et al. Technological properties of candidate probioticLactobacillusplantarumstrains[J]. International Dairy Journal, 2009, 19(6): 696-702.
[21] 吕加平, 骆承痒, 刘凤民, 等. 乳酸菌蛋白水解力的测定及研究[J]. 东北农业大学学报, 1999, 30(1): 68-74.
[22] MOJTABA S, TAYEBE M K, MAHBOUBEH A S, et al.Probiotic and antioxidant properties of selenium-enrichedLactobacillusbrevisLSe isolated from an Iranian traditional dairyproduct[J]. Journal of Trace Elements in Medicine and Biology, 2017, 40(2): 1-9.
Probiotic properties ofLactobacillusplantarumstrains isolated from Dairy Toufu
LYU Guan-wei1, DUAN Cui-cui2, GAO Lei2, LUAN Chang2,ZHAO Yu-juan2, NIU Chun-hua2, LI Sheng-yu2*
1(Clinical Medicine Department, Changchun Medical College, Changchun 130031, China)2(Institute of Agro-food Technology, Jilin Academy of Agricultural Sciences, Changchun 130033, China)
ThreeLactobacillusplantarumstains isolated form Dairy Toufu were taken as the object of this study. It analyzed the acid and bile salt resistance, surface hydrophobicity and anti-oxidation activityinvitroso as to evaluate their probiotic properties. The results showed that the three strains presented better tolerances to acid and bile salt and could maintain higher activities. All the strains manifested stronger hydrophobicity to p-xylene but weak hydrophobicity to chloroform. All the three strains possessed preferable antioxidant activity.
probiotics;Lactobacillusplantarum; tolerance;anti-oxidant activity
硕士研究生(李盛钰教授为通讯作者,E-mail:lisy720@126.com)。
国家现代农业(奶牛)产业技术体系建设专项(CARS-37);长春市产学研协同创新示范点建设专项项目(16CX20);吉林省科技型中小企业创新创业资金项目(20160308089HJ);吉林省重点科技攻关项目(20170204030N Y)
2017-01-05,改日期:2017-03-14
10.13995/j.cnki.11-1802/ts.201706022
