发酵液中水溶性热凝胶提取工艺的优化
2017-07-31丁含梁赢朱莉高敏杰林莉詹晓北
丁含,梁赢,朱莉,高敏杰,林莉,詹晓北*
1(江南大学 生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)2(江苏瑞光生物科技有限公司,江苏 无锡,214125)
发酵液中水溶性热凝胶提取工艺的优化
丁含1,梁赢1,朱莉2,高敏杰1,林莉1,詹晓北1*
1(江南大学 生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)2(江苏瑞光生物科技有限公司,江苏 无锡,214125)
为提取纯化发酵液中水溶性热凝胶,首先采用单因素结合响应面分析方法优化Sevag法去除发酵液中的蛋白,在单因素优化基础上,根据中心组合实验设计(Central Composite Design)实验原理,设计3因素5水平的响应面分析实验,最终得到最优去蛋白工艺:氯仿与正丁醇体积比为3.5的Sevag试剂,按发酵上清液与Sevag试剂体积比3.75的比例加入上述试剂,振荡混匀后静置33 min,重复上述操作5次;此条件下蛋白去除率为85.73%,水溶性热凝胶回收率为90.29%。对去蛋白后的处理液进行有机溶剂法的最佳提取工艺优化,优化得到乙醇为最佳提取试剂,加入乙醇至终浓度为90%,混匀后静置4 h,最后得到水溶性热凝胶的提取率为40.12%,纯度为89.10%。
水溶性热凝胶;脱蛋白;单因素优化;响应面分析;多糖提取
热凝胶是一种水不溶性、由β-1,3-糖苷键将葡萄糖残基连接而成的无分支微生物胞外多糖[1]。1996 年,热凝胶被美国食品药品监督管理局(Food and Drug Administration,FDA)批准作为食品添加剂,同时大量实验也证明了热凝胶的安全性[2],其在食品、医药及生命科学领域有着十分广泛的应用。有研究表明,随着热凝胶分子量降低,其与细胞表面作用的机会更大[3],因此,热凝胶的分子量与其生物活性密切相关。同时热凝胶分子量的降低也会提高其在水中的溶解度,溶解度的增加也拓宽其在生命科学领域的应用范围。
近年来的研究也越来越重视β-葡聚糖在癌症和传染病治疗中的应用[4]。水溶性热凝胶作为无分支均一的一种微生物胞外多糖,产品具有更大的利用价值。β-1,3-低聚糖具有抗肿瘤活性[5]、诱导动物产生细胞因子[6]、提高人体免疫力等功能。针对目前有关低分子量β-1,3-葡聚糖的制备研究较少,本文以土壤杆菌和哈茨木霉混合发酵的发酵液为研究对象,进行可溶性热凝胶的提取工艺研究。
共培养发酵结束后发酵液中主要存在水溶性热凝胶、哈茨木霉分泌的β-1,3-葡聚糖酶以及少量未被酶解的大分子不溶性热凝胶。因此,对发酵液的主要处理在于离心去除不溶物后,脱去上清液中蛋白。多糖去蛋白的方法主要有Sevag法(氯仿和正丁醇按一定体积混合)[7]、三氟三氯乙烷法(TTF法)、三氯乙酸法(TCA法)等。Sevag法是经典温和的去蛋白方法,但该方法需要多次重复操作才能达到较好效果;TCA法沉淀效果比Sevag法好,但有机酸会造成多糖降解,导致多糖损失率高[8],该法常用于植物多糖。本研究选择Sevag法去除发酵液中的蛋白,并采用单因素结合响应面分析的方法优化Sevag法。
去蛋白后的发酵液上清中大部分为可溶性热凝胶。对于水溶性胞外多糖,可根据其溶于水而不溶于一些有机溶剂的特点,降低其在溶液中的溶解度从而析出以达到分离的目的。主要的方法有有机溶剂沉淀法和盐析法[9],其中常用的有机溶剂有小分子醇类(如甲醇、乙醇、异丙醇)或丙酮等。
低分子量的水溶性热凝胶是一类新型功能性低聚糖,它具有特殊的生理活性,正在被广泛研究。但是目前国内对其研究相对较少,本文是在了解热凝胶结构及性质的基础上,针对目前涉及较少的可溶性热凝胶的制备进行了研究,为水溶性热凝胶的推广应用奠定了基础。
1 材料与方法
1.1 材料与试剂
土壤杆菌(Agrobacteriumsp.)ATCC 31749 ,哈茨木霉(Trichodermaharzianum) GIM 3.442均由江南大学糖化学与生物技术研究中心保藏。
土壤杆菌斜面培养基(g/L):葡萄糖 40.0,酵母粉 5.0,CaCO310.0,琼脂粉 20.0,pH 7.0。
种子培养基(g/L):葡萄糖20.0,酵母膏1.0,MgSO40.5,KH2PO41.74,pH 7.0。
发酵培养基(g/L):葡萄糖 80.0,酵母膏1.0,KH2PO42.7,(NH4)2SO42.0,MgSO40.5,无机盐浓缩液10 mL,pH 7.0。
哈茨木霉种子培养基(g/L):葡萄糖 20.0,酵母粉 15.0,KH2PO46.0,(NH4)2SO42.5,MgSO40.5,pH 6.0;发酵培养基(g/L):葡萄糖 30.0,米糠 20.0,KH2PO45.0,MgSO40.5,无机盐浓缩液10 mL,pH 6.0。
无机盐浓缩液(g/L):FeCl31.0,NaCl 1.0,MnCl21.0,CaCl21.0。
1.2 实验方法
1.2.1 发酵液的制备
斜面保存的哈茨木霉和土壤杆菌在相应的种子
液中分别培养18 h和16 h,然后以5%的接种比接入相应的发酵培养基单独培养18 h最后按照/(土壤杆菌)∶/(哈茨木霉发酵液)=5∶4,将哈茨木霉发酵液离心弃去上清,沉淀接入到土壤杆菌发酵液中,继续培养126 h,获得含有水溶性热凝胶的发酵液。
1.2.2 水溶性热凝胶提取工艺流程
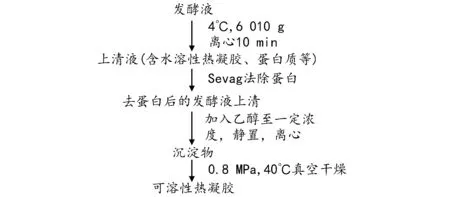
1.2.3 Sevag法去蛋白单因素优化策略(表1)

表1 去蛋白单因素优化策略
1.2.4 Sevag法去蛋白响应面优化策略
通过单因素实验,确定响应面实验设计的因素与水平,选取氯仿与正丁醇的体积比(A)、发酵液上清与Sevag试剂的体积比(B)、萃取静置时间(C)的最优实验点为中心点,对3个显著因子进行中心组合设计(Central Composite Design,CCD)优化。通过Design-Expert V 8.0.6辅助设计,根据CCD实验设计原理,进行3因素5水平的响应面分析实验,实验设计如表2所示[10]。

表2 中心组合设计实验中的因素及水平
1.2.5 水溶性热凝胶提取优化(表3)

表3 水溶性热凝胶提取优化
1.2.6 蛋白含量和去除率测定
采用考马斯亮蓝法[11]测定去蛋白后的发酵液中残留蛋白质含量。取1 mL稀释至合适浓度的待测液,加入5 mL考马斯亮蓝试剂,室温反应5 min,选择波长595 nm测其吸光度,并测定去蛋白前发酵液中总蛋白。根据标准曲线方程y=4.275 7x+0.002 94(R2=0.999)计算相应的蛋白质含量,按照公式(1)计算蛋白质的去除率。
(1)
1.2.7 水溶性热凝胶含量和提取率测定
采用蒽酮-硫酸法[12]测定去蛋白后的发酵液中总糖含量。取1 mL稀释至合适浓度的待测液,加入4 mL浓H2SO4,酸解5 min后加入0.5%的蒽酮-乙酸乙酯试剂1 mL,摇匀后沸水浴10 min,选择波长600 nm测其吸光度,并测定去蛋白前发酵液中总糖含量。根据标准曲线方程y=0.003 9x-0.000 5(R2=0.999)计算相应的糖含量,最后按照式(2)计算水溶性热凝胶的回收率。
(2)
1.2.8 水溶性热凝胶纯度的测定
采用国家标准推荐的方法[13],即苯酚-硫酸法测定最终获得的可溶性热凝胶纯度。取1 mL稀释至合适浓度的待测液,加入1 mL质量分数5%的苯酚溶液和5 mL浓H2SO4,混匀后立即冷却,在波长490 nm处测其吸光度,与相同浓度葡萄糖标准溶液比较,最后按照式(3)计算水溶性热凝胶的纯度。
(3)
2 结果与分析
2.1 Sevag法去蛋白单因素优化结果
Sevag试剂是氯仿和正丁醇(或戊醇)按一定比例混合得到的。其中,氯仿能使蛋白质变性,与蛋白质形成一种溶胶类型的复合物,正丁醇可以抑制泡沫的形成,因此,氯仿与正丁醇的比例对其蛋白去除效果影响较大。
氯仿与正丁醇体积比的优化结果如图1所示。随着氯仿添加量的增加,蛋白去除效果也越佳,当氯仿与正丁醇比例大于4∶1后,其去除蛋白质的能力达到饱和,继续加入氯仿蛋白的去除率并未增加,氯仿的加入也会造成多糖的损失。因此,选择V(氯仿)∶V(正丁醇)=4∶1的Sevag试剂进行后续的蛋白去除,此条件下的蛋白去除率为56.18%,可溶性热凝胶回收率为92.06%。

图1 氯仿与正丁醇体积比对去蛋白影响Fig.1 Effect of chloroform and n-butanol volume ratio on deprotentinizaiton
Sevag试剂与发酵上清液体积比的优化结果如图2所示。Sevag试剂添加量越大,蛋白去除率越高,但是水溶性热凝胶的损失率也越大。综合考虑,选择V(Sevag试剂)∶V(发酵液上清)=1∶5,该条件下,蛋白去除率为60.39%,可溶性热凝胶回收率为94.88%。

图2 Sevag试剂与发酵液上清体积比对去蛋白影响Fig.2 Effect of Sevag reagent and treatment solution volume ratio on deprotentinizaiton
萃取静置时间的优化结果如图3所示。静置时间延长,蛋白去除率也越高,静置30 min后,蛋白去除率也不再增加,并且时间的延长会导致变性的蛋白胶体吸附多糖沉降[14]。因此,振摇后静置30 min最佳,此时蛋白去除率为68.42%,可溶性热凝胶回收率为93.87%。

图3 萃取静置时间对去蛋白影响Fig.3 Effect of extraction times on deprotentinizaiton
萃取次数的优化结果如图4所示。随着萃取次数的增多,蛋白去除效果也越好,当萃取次数超过5次时,蛋白去除率不再增大,并且萃取次数的增多也会造成可溶性热凝胶的损失,导致回收率降低。在氯仿与正丁醇体积比为4∶1,Sevag试剂与样液体积比1∶5,振摇后静置30 min,重复5次的条件下进行去蛋白实验,最终蛋白去除率为76.54%,可溶性热凝胶的回收率为93.87%。

图4 萃取次数对去蛋白的影响Fig.4 Effect of extraction times on deprotentinizaiton
2.2 Sevag法去蛋白响应面优化结果
2.2.1 实验设计方案
利用Design-Expert软件进行3因素的中心组合实验设计,按照表2编码要求,生成实验方案见表4,其中每组实验做3个平行实验,结果取3个平行实验的平均值,将实验结果记入表4中。

表4 中心组合设计的实验方案及响应值
2.2.2 结果分析
通过Design-Expert软件对表2 的实验结果进行响应面分析,建立多元二次回归方程如下,Y1= -3.245 72+3.307 76×A+8.454 06×B+3.601 80 ×C-0.081 570×A×B-0.034 088×A×C+0.22 403×B×C+0.263 68×A2-1.943 12×B2-0.066 882×C2,Y2=+89.556 21+22.417 90×A-12.468 55×B-0.656 80×C+0.866 94×A×B-0.244 66×A×C+1.213 33×10-3×B×C-2.930 51×A2+1.011 29×B2+0.023 854×C2。分别对Y1、Y2两个方程进行方差分析,结果如表5、表6所示[15]。

表5 二次模型方差分析结果(蛋白去除率)

表6 二次模型方差分析结果(可溶性热凝胶回收率)

图5 不同因素对蛋白去除率影响的等高线图和响应面图Fig.5 Contours and response surfaces between different variables on the rate of deprotentinizaiton
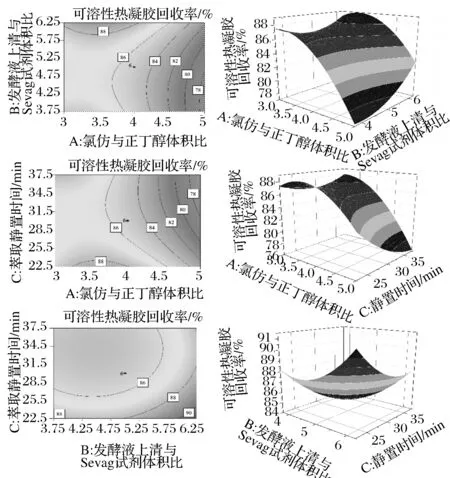
图6 不同因素对水溶性热凝胶回收率影响的等高线图和响应面图Fig.6 Contours and response surfaces between different variables on therecovery of water-soluble curdlan

利用Design-Expert软件求解方程Y1和Y2,以蛋白去除率和可溶性热凝胶回收率两者为指标,求解当蛋白去除率和可溶性热凝胶回收率都最高时,得到最佳工艺:氯仿与正丁醇体积比3.52,发酵液上清与Sevag试剂体积比3.75,静置时间32.81 min,此条件下的蛋白去除率为84.75%,多糖回收率为87.09%。
方便起见,将氯仿与正丁醇体积比设为3.5,发酵液上清与Sevag试剂体积比3.75,静置33 min,重复5次,进行工艺验证,实际测得响应面优化条件下蛋白去除率85.73%,水溶性热凝胶回收率为90.29%,这与理论预测值相比无显著差异,因此采用CCD的中心组合实验设计优化的水溶性热凝胶去蛋白工艺条件可靠。
2.3 水溶性热凝胶提取优化结果
以4倍体积的溶剂进行水溶性热凝胶的提取,提取溶剂的种类对提取率的影响如图7所示。由图7可以看出,在4倍体积提取溶剂的浓度下,乙醇和丙酮提取效果较好,提取率分别为22.0%和22.8%。对该数据进行方差分析可知,乙醇和丙酮对水溶性热凝胶的提取率无显著性差异(P=0.826>0.05)。考虑到乙醇更加安全、可靠[18],而且在提取过程中也发现乙醇脱除发酵液中色素能力明显优于丙酮,因此选择乙醇作为水溶性热凝胶的最佳提取试剂[19]。
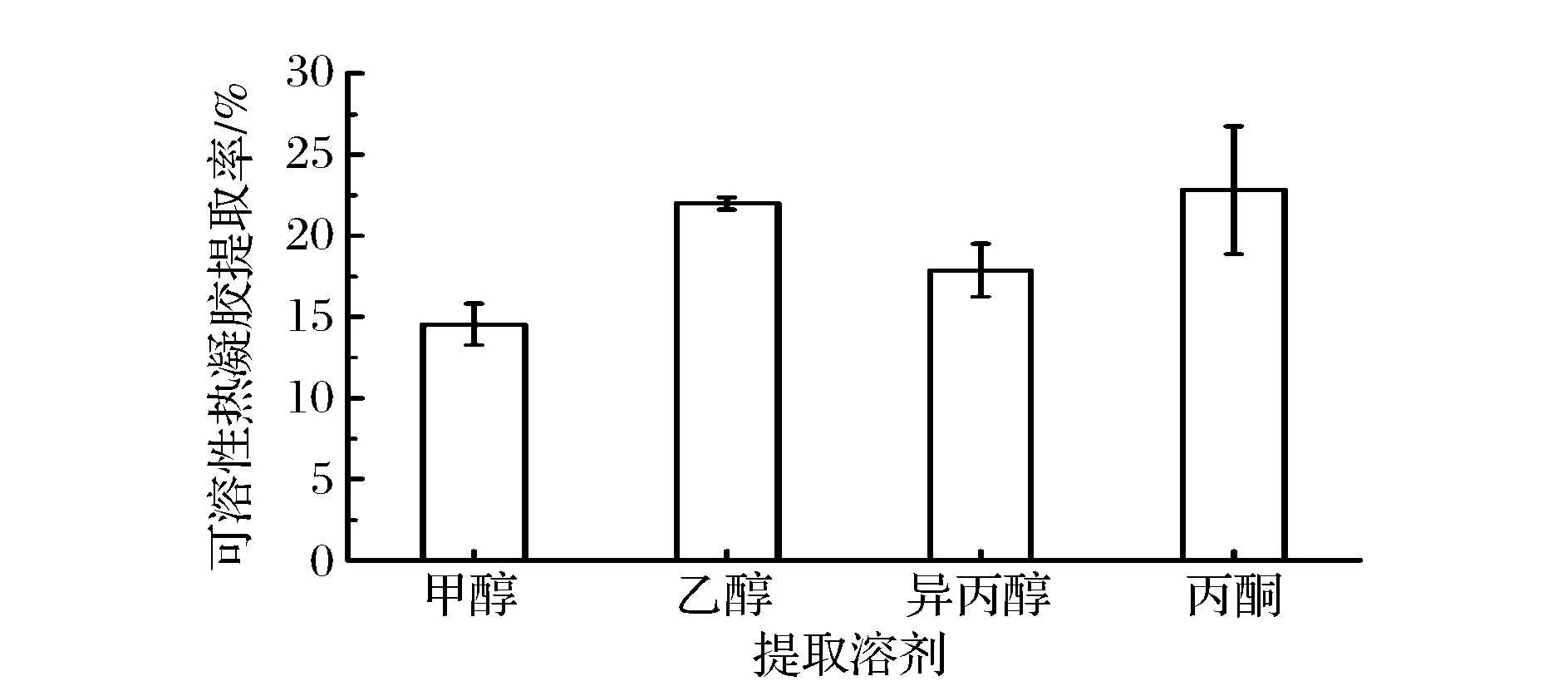
图7 不同提取溶剂的影响Fig.7 Effect of different extraction solutions
终体积分数为50%、60%、70%、80%、90%的乙醇对水溶性热凝胶的提取率如图8所示,随着乙醇的加入,越来越多的糖会析出,当乙醇体稷分宭达到90%时,水溶性热凝胶的提取率可达32.41%。

图8 乙醇终浓度的影响Fig.8 Effect of different final ethanol concentration
以终体积分数为90%的乙醇对去蛋白后的样液进行处理,分别静置1、2、3、4、5 h后水溶性热凝胶的提取率如图9所示。从图9中可以看出,1 h后多糖基本全部析出。但在静置过程中发现,加入乙醇后,多糖会慢慢沉淀至底部,1 h时体系中的多糖并未完全沉降至底部,到4h时,多糖全部沉降至底部,可直接将上清倾倒出来,减少了离心的次数,简化工艺。因此选择静置4 h为水溶性热凝胶的提取时间,此时水溶性热凝胶提取率为40.12%,得到水溶性热凝胶纯度为89.10%。

图9 提取时间的影响Fig.9 Effect of different extraction time
3 结论
热凝胶不溶于中性和酸性溶液,仅溶于pH大于12的碱性溶液和少数有机溶剂(如DMSO)中,因此发酵过程中热凝胶的提取多采用酸沉碱溶的方法。通过共培养发酵所得的热凝胶多糖可溶于水中,发酵结束后多糖溶于发酵液中,无法通过调节pH的方法提取,因此可溶性热凝胶的提取需要探索出一种新的方法。本研究建立了一种从发酵液中提取纯化β-1,3-低聚糖(水溶性热凝胶)的方法。单因素结合响应面优化Sevag法去除发酵液上清中的蛋白,配制氯仿与正丁醇的体积比3.5∶1的Sevag试剂,按Sevag试剂与发酵上清液的体积比3.75∶1的比例进行萃取,振摇后静置33 min,重复去除5次,最终发酵液中蛋白去除率达到85.73%,可溶性热凝胶回收率为90.29%;然后,在脱蛋白后的处理液中加入乙醇至终浓度90%,混合均匀后静置4 h,弃去上清,离心回收沉淀,真空干燥得到可溶性的热凝胶多糖,提取率达40.12%,纯度达到89.10%。
可溶性热凝胶作为一种功能性低聚糖,具有活性强、毒副作用低的特点,是目前多糖领域中比较重要的一种。本文建立了一种可溶性热凝胶的提取纯化工艺,得到的低分子量热凝胶可复溶于水中,拓宽了热凝胶在生命科学领域的应用,为其后续在生理方面的应用奠定了基础。
[1] ZHAN X,LIN C,ZHANG H.Recent advances in curdlan biosynthesis, biotechnological production, and applications[J].Applied Microbiology and Biotechnology, 2012,93(2):525-531.
[2] 李晶.热凝胶制备β-1,3-葡聚寡糖及其诱导抗真菌功能的研究[D].无锡: 江南大学,2014.
[3 ] METHACANON P,WEERAWATSOPHON U,TANJAK P,et al. Interleukin-8 stimulating activity of low molecular weight β-glucan depolymerized by γ-irradiation[J]. Carbohydrate Polymers,2011(86):574-580.
[4] MANTOVANI M S,Bellini M F, Angeli J P F, et al. β-Glucans in promoting health: Prevention against mutation and cancer[J]. Mutation Research/reviews in Mutation Research, 2008,658(3):154-161.
[5] 王英杰. 低分子量水溶性 β-1,3-葡聚糖的制备及其活性研究[D]. 济南: 齐鲁工业大学, 2014.
[6] HIDA T H, ISHIBASHI K, MIURA N N,et al.Cytokine induction by a linear 1,3-glucan, curdlan-oligo, in mouse leukocytesinvitro[J]. Inammation Research, 2009,58(1):9-14.
[7] SEVAG M G, LACKMAN D B, SMOLENS J. The isolation of the components of streptococcal nucleoproteins in serologically active form[J]. Paleoceanography, 1938,13(1):42-49.
[8] 修爱慧.土壤杆菌ZX09胞外多糖的制备和结构解析以及生物学功能的研究[D].南京:南京理工大学, 2011.
[9] Garcíaochoa F, SANTOS V E, CASAS J A, et al. Xanthan gum: production, recovery, and properties[J]. Biotechnology Advances, 2000, 18(7):549-579.
[10] 蒙哥马利·道格拉斯. 实验设计与分析[M].第6版.北京:人民邮电出版社, 2009.
[11] 陈毓荃. 生物化学实验方法和技术[M].科学出版社, 2002.
[12] 刘晓涵, 陈永刚, 励林, 等. 蒽酮硫酸法与苯酚硫酸法测定枸杞子中多糖含量的比较[J].食品科技,2009,34(9):270-272.
[13] 中华人民共和国卫生部.GB 28304—2012食品安全国家标准食品添加剂可得然胶[S]. 北京: 中国标准出版社, 2012.
[14] 王珊,黄胜阳.植物多糖提取液脱蛋白方法的研究进展[J].食品科技,2012,37(9):188-191.
[15] DONG C H,XIE X Q,WANG X L,et al.Application of Box-Behnken design in optimisation for polysaccharides extraction from cultured mycelium ofCordycepssinensis.[J]. Food & Bioproducts Processing, 2009, 87(2):139-144.
[16] Richard F.Gunst. Response surface methodology:process and product optimization using designed experiments[J]. Technometrics, 1996, 38(3):284-286.
[17] 黄新仁. 响应面法在生物过程优化中的应用[D].长沙: 湖南大学, 2011.
[18] 栾庆祥, 赵杨, 周欣, 等. 单因素试验结合响应面分析法优化杜仲最佳提取工艺[J].药物分析杂志,2013,33(5):859-865.
[19] ZHAO L,DONG Y,CHENG G,et al.Extraction, purification, characterization and antitumor activity of polysaccharides fromGanodermalucidum[J]. Carbohydrate Polymers,2010, 80(3):783-789.
The optimal extraction of soluble curdlan from fermentation liquid
DING Han1,LIANG Ying1,ZHU Li2,GAO Min-jie1,LIN Li1,ZHAN Xiao-bei1*
1(Key Laboratory of Carbohydrate Chemistry and Biotechnology of Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China)2(Jiangsu Rayguang Biotech Co. Ltd., Wuxi 214125, China)
In order to extract and purify the water-soluble curdlan from the fermentation broth, the single-factor experiment combined with response surface analysis was used to optimize the Sevag method to remove the protein in the fermentation broth. Based on the results of single-factor tests and the Central Composite Design experimental design principles, a response surface methodology which has three factors and five levels was designed to optimize the process. The optimal conditions for deprotenizing by these methods were found to be five treatment cycles with a mixture of chloroform and n-butyl alcohol (3.5∶1,V/V) at a solid-to-solvent ratio of 3.75∶1(V/V) for 33 minutes. Under these conditions, the rate of deprotentinizaiton and polysaccharide recovery was 85.7307% and 90.2974%, respectively. Then, the optimum extraction technology of the organic solvent was optimized. The ethanol was added as the best extraction reagent to the final concentration of 90%. After the mixture was left to stand for 4 hours,extraction rate of water-soluble curdlan could reach 40.12%.
water-soluble; curdlan deprotentinizaiton; single-factor experiment; response surface analysis; extraction of polysaccharides
硕士研究生(詹晓北教授为通讯作者,E-mail:xbzhan@yahoo.com)。
江南大学自主科研计划-重点项目( JUSRP51632A);国家自然科学基金(31171640);江苏省自然科学基金(BK20151122)
2017-01-06,改回日期:2017-02-24
10.13995/j.cnki.11-1802/ts.201706018
