pH和NaCl浓度对花椒籽仁分离蛋白乳化性的影响
2017-07-31李超蒲彪罗松明刘兴艳徐丹萍付本宁潘姝璇蒋培基王春霞李强
李超,蒲彪,罗松明,刘兴艳,徐丹萍,付本宁,潘姝璇,蒋培基,王春霞,李强
(四川农业大学 食品学院,四川 雅安,625014)
pH和NaCl浓度对花椒籽仁分离蛋白乳化性的影响
李超,蒲彪*,罗松明,刘兴艳,徐丹萍,付本宁,潘姝璇,蒋培基,王春霞,李强
(四川农业大学 食品学院,四川 雅安,625014)
以花椒籽仁分离蛋白为原料,测定不同pH和NaCl浓度条件下花椒籽仁分离蛋白的乳化活性、乳化稳定性、乳化颗粒粒径分布,并用光学显微镜观察乳化液的显微结构以及SDS-PAGE凝胶电泳检测具有乳化作用蛋白质条带。结果表明,pH和NaCl对花椒籽仁分离蛋白的乳化特性具有显著影响,随着pH值的增大,乳化活性、乳化稳定性均呈现出先减小后增大的趋势,在pH=3时都达到了最低值,具有较高的一致性;相反乳化颗粒平均粒径(D4,3)则是先增大后减小,pH=3时乳化颗粒粒径最大(D4,3=1.87 μm)。NaCl的添加对花椒籽仁分离蛋白的乳化活性、乳化稳定性有减弱作用,促进了乳化颗粒的絮集,增大乳化颗粒的平均粒径(D4,3)。通过对乳化液的显微结构观察,在pH=3和NaCl浓度达到1.2 mol/L时,乳化颗粒大且存在明显絮集现象。此外,通过SDS-PAGE凝胶电泳得出具有乳化作用的蛋白质有3个条带,分子质量分别约为5、7、21 kDa。
花椒籽仁;分离蛋白;pH;NaCl;乳化性
花椒籽,中医名椒目,球型,是花椒的主要副产物,可分为籽皮与籽仁两部分,其中籽仁质软色白,含有丰富的油脂和蛋白质[1]。花椒籽仁中粗蛋白含量为41.17%[2],高于南瓜籽[3],核桃[4-5],鹰嘴豆[6-8]等,与大豆蛋白的蛋白质含量接近[9]。而且其氨基酸组成较为全面,含有人体必需的8种氨基酸[2],是一种优质的蛋白质资源。
乳化性是蛋白质主要的功能性质之一,在食品、营养、医药等领域都扮演着重要的角色,尤其应用于诸多食品的配方,例如黄油、牛奶、冰淇淋[10-11]。蛋白质乳化性除了受到自身理化性质的影响,包括分子构象、溶解性、疏水性等[12-14]以外,还受环境因素的影响,如温度、pH、NaCl浓度、蛋白质浓度、油相体积分数[15-20]。由于植物蛋白具有良好的乳化性和脂肪吸附能力,更多的应用于食品加工中[21]。近年来许多研究者以南瓜籽蛋白[16, 22]、枣椰树种子蛋白[23]、油菜籽蛋白[17]、甘薯蛋白[18]等新型植物蛋白质资源作为实验原料,研究不同因素对其乳化性的影响。有关花椒籽蛋白质乳化性的研究甚少,寇明钰[24]和杨令叶[2]以乳化活性(emulsifing activity index, EAI)及乳化稳定性(emulsifing stability index, ESI)作为分析指标,分别对花椒籽全籽蛋白和花椒籽仁蛋白的乳化性进行了初步的研究。本实验通过分析EAI、ESI、乳化颗粒粒度、乳化颗粒分布,较为全面地研究pH和NaCl浓度对花椒籽仁分离蛋白乳化性的影响并测定了参与乳化作用蛋白质分子质量分布。
1 材料与方法
1.1 材料与试剂
花椒籽,蛋白质含量约为22.67%,四川省洪雅县幺麻子食品有限公司;大豆油,雅安市吉选超市;十二烷基硫酸钠(SDS),美国Sigma公司; SDS-PAGE凝胶电泳试剂盒、蛋白质MARKER,上海源叶生物科技有限公司;考马斯R-250,美国Sigma公司;NaCl、HCl、乙醇、醋酸、NaOH、蔗糖等均为AR。
1.2 仪器与设备
CP225D型电子天平,德国Sartorius公司;LGJ-18S型冷冻干燥机,宁波新艺超声设备有限公司;KDN-C型凯氏定氮仪,上海新嘉电子有限公司;FJ200-SH型数显高速分散均质机,上海标本模型厂制造;MICROMAX型高速离心机,美国Thermo公司;Varionskan flash型全波长酶标仪,美国Thermo fisher公司;Rise2008型激光粒度分析仪,济南润之科技有限公司;CX31RTSF型生物显微镜,日本Olympus公司;1658000小型垂直电泳仪,Geldoc XR System型凝胶成像系统,美国Bio-rad公司。
1.3 实验方法
1.3.1 样品的制备
(1)原料预处理。花椒籽经破碎去壳、烘干、粉碎至过40目筛,以石油醚作为提取剂在料液比为1∶13(g∶mL)的条件下脱去花椒籽仁中的油脂,脱脂后的花椒籽仁再次烘干并粉碎至80目备用;
(2)盐提法提取花椒籽仁蛋白质。脱脂后的花椒籽仁按照1∶20(g∶mL)的料液比加入1.2 mol/L NaCl溶液,并用0.1 mol/L的NaOH溶液调节pH值至11,50 ℃气浴振荡提取35 min,在此条件下蛋白质提取率为88.77%。离心(4 000 r/min, 20 min)后取上清液透析72 h,再经真空冷冻干燥制得分离蛋白样品,并按照GB5009.5-2010测得蛋白质纯度为93.17%,存放4 ℃备用;
(3)取上述花椒籽仁分离蛋白样品于室温下分别溶解于不同pH值(1、3、5、7、9、11、13)和不同NaCl浓度(0、0.2、0.4、0.6、0.8、1.0、1.2 mol/L)溶液中,涡旋混匀后调至蛋白质质量浓度为10 g/L的溶液;
(4)取3 mL蛋白质溶液与1 mL大豆油混合,经高速均质(16 000 r/min, 60 s),得到新鲜乳化液。
1.3.2 pH和NaCl浓度对花椒籽仁分离蛋白乳化活性及乳化稳定性的影响
采用浊度法,参照PEARCE 等[25]并做改进。均质后立即取5 μL乳化液,加入1 g/L的SDS至5 mL并混匀,于500 nm处测定吸光值,记为A0。10 min后另取5 μL乳化液体再次测定,记为A10。EAI与ESI的计算如公式(1)、(2):
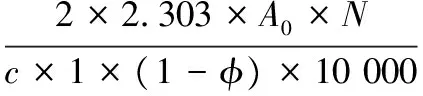
(1)
(2)
式中:c,蛋白质溶液浓度,g/mL;1,光径,cm;φ,油相体积分数,25%;t,静置时间,10 min;N,稀释倍数,1 000;A0,均质后0 min乳化液吸光值;A10,均质后10 min乳化液吸光值。
1.3.3 pH和NaCl浓度对花椒籽仁分离蛋白乳化颗粒粒径分布的影响
取1.3.1蛋白质乳化液1 mL用10 g/L的SDS溶液稀释到10 mL并混匀,测定乳化颗粒粒径分布,以乳化颗粒的平均粒径(D4,3)作为分析指标。
1.3.4 pH和NaCl浓度对花椒籽仁分离蛋白乳化液的微观结构的影响
取1.3.1蛋白质乳化液1 mL加入1 g/L的SDS溶液稀释到5 mL,混匀后采用光学显微镜观察并拍照处理。
1.3.5 界面蛋白质分子量的测定
将1.3.1蛋白质乳化液与500 g/L蔗糖溶液等体积混合,从底部吸取混合液2 mL置于7 mL 50 g/L的蔗糖溶液,涡旋后离心(4 000 r/min, 30 min),-20 ℃放置24 h;取乳化液滴层与适量10 g/L的SDS溶液混合,做SDS-PAGE分析[18]。
2 结果与分析
2.1 pH和NaCl浓度对花椒籽仁分离蛋白EAI及ESI的影响
2.1.1 pH对花椒籽仁分离蛋白EAI及ESI的影响
pH对花椒籽仁分离蛋白EAI及ESI均有显著影响(P<0.05)。如图1所示,随着pH的增大,花椒籽仁分离蛋白EAI先减小后增大,pH=3时,乳化活性(EAI=56.58 m2/mg)相对较差。
这可能是因为 pH的变化引起蛋白质表面净电荷的变化,改变溶解度的大小,从而引起乳化性的变化。杨令叶[2]的研究得出花椒籽仁等电点在3.5~4,pH=3接近其等电点,溶解度低,参与乳化作用的蛋白质量少,EAI也小;pH值偏离等电点使得埋藏在蛋白质分子内部的官能团暴露出来,蛋白质溶解性增加,参与乳化作用的蛋白质量增大,EAI随之增大。LESTARI等[13]、YULIANA等[26]、FIDELIS NNADOZIE[27]分别研究了麻风树种子蛋白、腰果壳蛋白、甜瓜籽蛋白的乳化性,也得出随着pH值的增大,EAI有先减小后增大的趋势,并猜测这与蛋白质的溶解性关联较大。相比于酸性条件,碱性条件下花椒籽仁分离蛋白具有更好的乳化活性,这可能是花椒籽仁蛋白质在碱性条件下发生改性,增强了与油相之间的作用[28]。
随pH值的变化,花椒籽仁分离蛋白ESI与EAI整体变化趋势一致,总体呈现出先减小后增大的趋势,这与LESTARI等[13]、郑亚军等[29]、AKASHA等[23]研究结果一致。蛋白质作为大分子的乳化剂,可在油滴表面生成大分子的薄膜,稳定O/W乳液,蛋白质变性后可被吸附在界面形成单分子层,其中所含氨基酸残基的疏水集团指向油相,而亲水性基团指向水。pH=3时,花椒籽仁分离蛋白质溶解度减小,O/W界面处吸附得蛋白质变少,稳定界面的薄膜受破坏,容易絮集在一起甚至发生合并,ESI小。pH值偏离等电点,更多的蛋白质吸附到O/W界面处,被吸附的蛋白质一层层的堆积在油滴外,结构紧密,防止了合并作用的发生,提高了乳化稳定性。
2.1.2 NaCl浓度对花椒籽仁分离蛋白EAI及ESI的影响
如图2所示,NaCl的添加使花椒籽仁分离蛋白EAI及ESI降低且影响显著(P<0.05)。
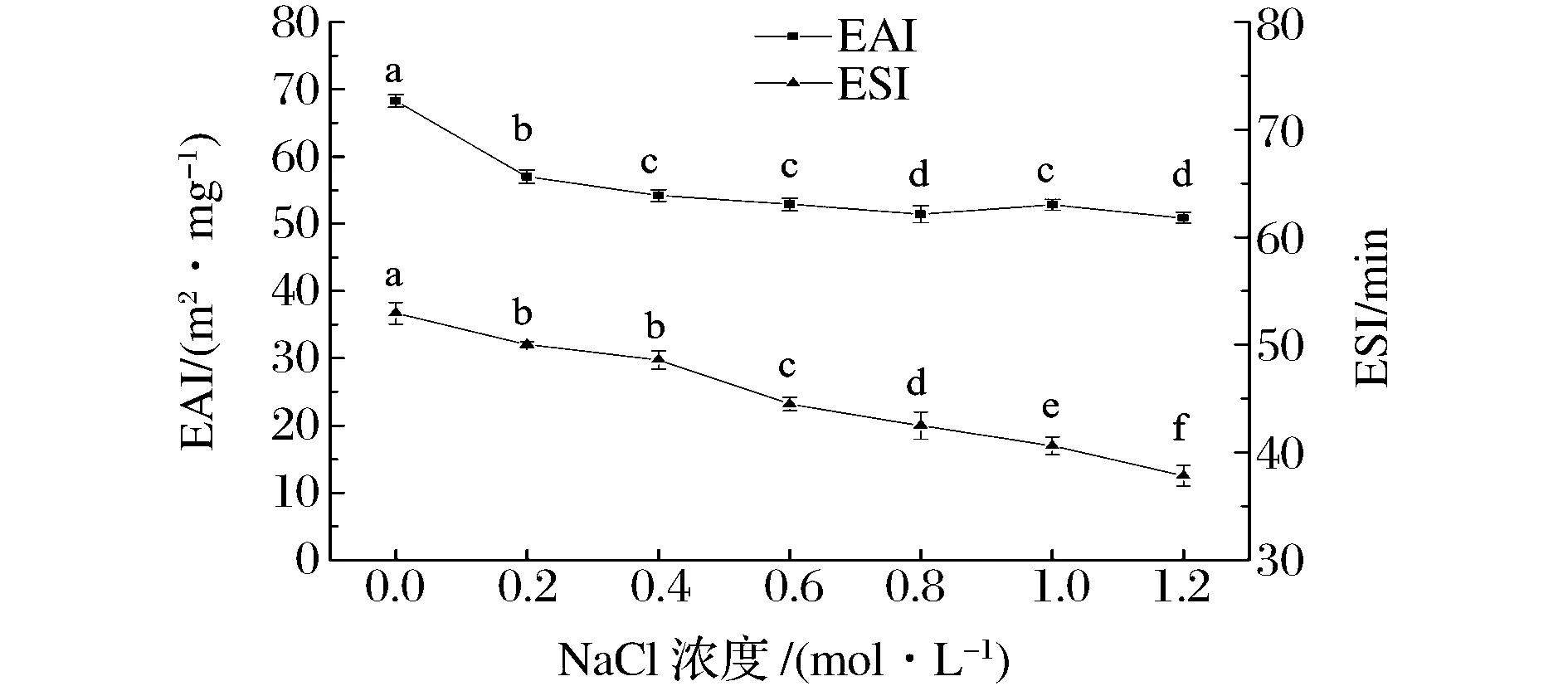
图2 NaCl对花椒籽仁分离蛋白乳化活性(EAI)和乳化稳定性(ESI)的影响Fig.2 Emulsification activity and stability indices for Zanthoxylum bungeanum Maxim seed kernel protein isolate as a function of NaCl concentration
未添加NaCl时,乳化活性高(EAI=68.26 m2/mg),乳化液稳定(ESI=52.94 min)。NaCl浓度从0到0.2 mol/L,EAI显著降低,随着NaCl浓度不断增大,其乳化活性略有下降并逐渐趋于平稳。NaCl添加使蛋白质表面电荷减少[30],蛋白质之间的静电排斥力减小,发生了盐析作用,与油滴结合的蛋白质量降低,EAI减小;稳定O/W界面的薄膜稳定性变差。同时较高浓度NaCl可能破坏了油滴表面的大分子薄膜,导致了乳化颗粒合并作用的发生,ESI减小。ZHANG等[31]通过研究NaCl浓度对鹰嘴豆蛋白乳化性影响,得出NaCl的添加会降低鹰嘴豆蛋白质EAI及ESI。
2.2 pH和NaCl浓度对乳化颗粒粒径分布的影响
2.2.1 不同pH对乳化颗粒的粒径分布的影响
乳化颗粒粒径分布的测定以乳化颗粒平均直径(D4,3)表示。蛋白质与油脂发生乳化作用,形成的乳化颗粒D4,3越小,蛋白质的乳化性越好。pH对乳化颗粒D4,3影响显著(P<0.05),如图3所示,在pH值为3时达到最大值,远离pH=3,D4,3逐渐减小,整体表现为先增大后减小趋势,对乳化性的影响则是乳化性先增大后减小,这与乳化活性所测结果相吻合。这可能是因为在pH=3时,吸附在油滴表面的蛋白质含量最少,且蛋白质表面电荷减少,相互之间的静电排斥力减小,少量吸附在油滴表面的蛋白质通过范德华力使乳化颗粒絮集在一起,此时D4,3最大。当溶液pH远离等电点时,更多的蛋白质吸附到吸附到油滴表面,形成更加稳定的大分子薄膜,同时蛋白质之间静电排斥力增大,防止了絮集与合并的发生,D4,3较小。LIANG等[14]研究发现豌豆蛋白在pH=5时乳化作用形成乳化颗粒D4,3最大,远离pH=5时D4,3减小。

图3 pH对花椒籽仁分离蛋白乳化颗粒平均粒径的影响Fig.3 The emulsified particles volume-weighted mean diameters (D4,3) of Zanthoxylum bungeanum Maxim seed kernel protein isolate as a function of pH
2.2.2 不同NaCl浓度对乳化颗粒粒径分布的影响

图4 NaCl浓度对花椒籽仁分离蛋白乳化颗粒平均粒径的影响Fig.4 The emulsified particlesvolume-weighted mean diameters (D4,3) of Zanthoxylum bungeanum Maxim seed kernel protein isolate as a function of NaCl concentration
NaCl浓度对乳化颗粒粒径分布的影响如图4所示。在NaCl浓度为0、0.2、0.4、0.6、0.8、1.0、1.2 mol/L时,D4,3分别为1.77、1.83、1.85、1.85、1.92、1.98、2.06 μm,呈现逐渐增大趋势,其原因是NaCl降低使吸附在油滴表面蛋白质减少,油滴表面起保护作用的薄膜遭到破坏,乳化颗粒絮集在一起甚至合并,D4,3增大。这与ETTOUMI等[32]、HOSSEINI-PARVAR等[33]的研究结果一致。
2.3 pH和NaCl浓度对乳化液的微观结构的影响
pH对乳化液微观结构影响如图5-I所示,在pH值较低的环境中乳化颗粒大小不一,pH值逐渐增大乳化颗粒趋于均一。在pH值为3时,可清晰看到较大的乳化颗粒,且整体之间大小差异大,由于蛋白质表面电荷接近于0乳化颗粒容易絮集在一起,乳化颗粒粒径大,这与以上测定结果相符。pH=13时,乳化颗粒小,大小均一,蛋白质之间静电排斥力最大,分散的最开。
NaCl浓度对乳化颗粒的影响如图5-II所示,随着NaCl浓度增高,乳化颗粒逐渐增大,并且乳化颗粒有絮集在一起的趋势。NaCl浓度达到1.2 mol/L时,乳化颗粒大小不一并发生明显的聚集。

(Ⅰ-A、Ⅰ-B、Ⅰ-C、Ⅰ-D、Ⅰ-E、Ⅰ-F、Ⅰ-G)分别代表pH(1、3、5、7、9、11、13)(Ⅱ-A、Ⅱ-B、Ⅱ-C、Ⅱ-D、Ⅱ-E、Ⅱ-F、Ⅱ-G)分别代表(0、0.2、0.4、0.6、0.8、1.0、1.2 mol/L)NaCl溶液图5 pH值和NaCl浓度对花椒籽仁分离蛋白乳化液微观结构影响(40×)Fig.5 Microphotographs at various pH(I) and NaCl(II) concentration of Zanthoxylum bungeanum Maxim seed kernel protein isolate emulsion microstructure(40×)
2.4 界面蛋白质分子质量的测定
如图6所示,在β-巯基乙醇存在的条件下,花椒籽仁分离蛋白共有6个条带,分子质量分布广泛,其中分子质量为7 kDa的条带带宽目色深,可以推测其所占比例相对大。在油滴上解吸附出来的界面蛋白质,主要有3个条带,分子质量分别为5、7、21 kDa,表明花椒籽仁分离蛋白中参与乳化作用的蛋白质集中在这3个条带上,因此可以在本试验的研究基础上对这3个分子质量的蛋白质进一步分离纯化,得到乳化性能更好的蛋白质,这或许能开发成为食品加工中一种新型的乳化添加剂,从而提高花椒籽的利用价值。
3 结论
pH和NaCl浓度的改变对花椒籽仁分离蛋白的乳化性具有显著的影响。在pH=3时,花椒籽仁蛋白质的乳化活性和乳化稳定性最小、乳化颗粒平均粒径最大;相比于酸性条件,花椒籽仁蛋白质在碱性环境中乳化活性更好。NaCl的添加降低花椒籽仁蛋白质的乳化活性性和乳化稳定性、增大了乳化颗粒的平均粒径。通过SDS-PAGE凝胶电泳得出具有乳化作用的蛋白质共有3个条带,分别在分子量分别约为5、7、21 kDa,通过进一步的研究或许能开发成为食品加工中一种新型的乳化添加剂,从而提高花椒籽的利用价值。
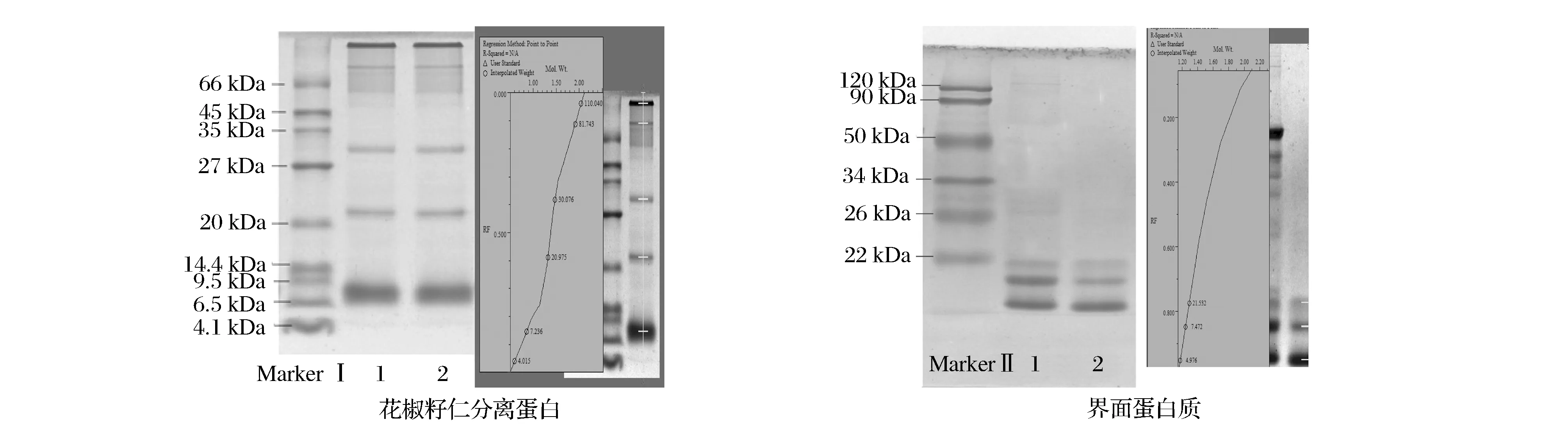
图6 花椒籽仁分离蛋白与界面蛋白质SDS-PAGE凝胶电泳Fig.6 SDS-PAGE patterns of Zanthoxylum bungeanum Maxim seed kernel protein isolate and protein absorbed at o/w interface
[1] ZHAO Liang-cheng, WANG Yu-fei, LIU Chang-jiang, et al. Climatic implications of fruit and seed assemblage from Miocene of Yunnan, southwestern China[J]. Quaternary International, 2004,117(1):81-89.
[2] 杨令叶.韩城大红袍花椒籽种仁蛋白质分离提取和性能的研究[D].西安:陕西师范大学,2008.
[3] LI Quan-hong, FU Cai-li. Application of response surface methodology for extraction optimization of germinant pumpkin seeds protein[J]. Food Chemistry, 2005,92(4):701-706.
[4] 张建华,黎其万,杨晓洪,等.大姚核桃的主要营养成分分析[J].西南农业学报,2008,21(4):1 048-1 053.
[5] 毛晓英.核桃蛋白质的结构表征及其制品的改性研究[D].无锡:江南大学,2012.
[6] SAINI H S, WEDER J K P, KNIGHTS E J. Inhibitor activities of chickpeas (CicerarietinumL) against bovine, pocine and human trypsin and chymotrypsin[J]. Journal of the Science of Food and Agriculture, 1992,60(3):287-295.
[7] CAI R, KLAMCZYNSKA B, BAIK B K. Preparation of bean curds from protein fractions of six legumes[J]. J Agric Food Chem, 2001,49(6):3 068-3 073.
[8] SINGH D K, RAO A S, SINGH R, et al. Amino acid composition of storage proteins of a promising chickpea (CicerarietinumL) cultivar[J]. Journal of the Science of Food & Agriculture, 1988,43(4):373-379.
[9] 李吕木.大豆分离蛋白及其制取[J].粮食与食品工业,2004,12(2):7-10.
[10] ZHANG Bei, GUO Xiao-na, ZHE Ke-xue, et al. Improvement of emulsifying properties of oat protein isolate-dextran conjugates by glycation[J]. Carbohydrate Polymers, 2015,127:168-175.
[11] FOEGEDING E A, DAVIS J P. Food protein functionality: A comprehensive approach[J]. Food Hydrocolloids, 2011,25(8):1 853-1 864.
[12] KAUSHAL P, KUMAR V, SHARMA H K. Comparative study of physicochemical, functional, antinutritional and pasting properties of taro (Colocasiaesculenta), rice (Oryzasativa) flour, pigeonpea (Cajanuscajan) flour and their blends[J]. LWT - Food Science and Technology, 2012,48(1):59-68.
[13] LESTARI D, MULDER W J, SANDERS J P M. Jatropha seed protein functional properties for technical applications[J]. Biochemical Engineering Journal, 2011,53(3):297-304.
[14] LIANG Han-ning, TANG Chuan-he. Pea protein exhibits a novel pickering stabilization for oil-in-water emulsions at pH 3.0[J]. LWT - Food Science and Technology, 2014,58(2):463-469.
[15] GONG Kui-jie, SHI Ai-min, LIU Hong-zhi, et al. Emulsifying properties and structure changes of spray and freeze-dried peanut protein isolate[J]. Journal of Food Engineering, 2016,170:33-40.
[16] CHEUNG L, WANASUNDARA J, NICKERSON M T. Effect of pH and NaCl on the emulsifying properties of a napin protein isolate[J]. Food Biophysics, 2015,10(1):30-38.
[17] TAN S H, MAILER R J, BLANCHARD C L, et al. Emulsifying properties of proteins extracted from Australian canola meal[J]. LWT - Food Science and Technology, 2014,57(57):376-382.
[18] GUO Qing, MU Tai-hua. Emulsifying properties of sweet potato protein: Effect of protein concentration and oil volume fraction[J]. Food Hydrocolloids, 2011,25(1):98-106.
[19] 崔珊珊,木泰华,孙红男,等.NaCl浓度和pH对甘薯蛋白肽乳化特性的影响[J].中国农业科学,2016,49(9):1 778-1 786.
[20] PENG Wei-wei, KONG Xiang-zhen, CHEN Ye-ming, et al. Effects of heat treatment on the emulsifying properties of pea proteins[J]. Food Hydrocolloids, 2016,52:301-310.
[21] JOSHI M, ADHIKARI B, ALDRED P, et al. Interfacial and emulsifying properties of lentil protein isolate[J]. Food Chemistry, 2012,134(3):1 343-1 353.
[23] AKASHA L, CAMPBELL L, LOMCHAMP J, et al. The major proteins of the seed of the fruit of the date palm (PhoenixdactyliferaL.): Characterisation and emulsifying properties[J]. Food Chemistry, 2016,197:799-806.
[24] 寇明钰. 花椒籽蛋白质分离提取及功能性质的研究[D].重庆:西南大学,2006.
[25] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: Evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978,26(3):716-723.
[26] YULIANA M, CHI T T, HUYNH L H, et al. Isolation and characterization of protein isolated from defatted cashew nut shell: Influence of pH and NaCl on solubility and functional properties[J]. LWT - Food Science and Technology, 2014,55(2):621-626.
[27] FIDELIS NNADOZIE E. Effects pH and NaCl on the protein solubility, emulsifying and foaming properties of germinated and ungerminated Melon (colocynthiscitrullus) seed flour[J]. International Journal of Nutrition and Food Sciences, 2015,4(2):173-177.
[28] LAWAL O S, ADEBOWALE K O, OGUNSANWO B M, et al. On the fuctional properties of globulin and albumin protein fractions and flours of African locust bean (Parkiabiglobossa).[J]. Food Chemistry, 2005, 92(4):681-691.
[29] 郑亚军,查朦涛,李艳,等.pH、离子强度等因素对椰子分离蛋白溶解性和乳化性的影响[J].热带作物学报,2011,32(8):1 464-1 468.
[30] CHEUNG L, WANASUNDARA, NICKERSON MT. The Effect of pH and NaCl levels on the physicochemical and emulsifying properties of a cruciferin protein isolate[J]. Food Biophysics, 2014,9(2):105-113.
[31] ZHANG Tao, JIANG Bo, MU Wan-meng, et al. Emulsifying properties of chickpea protein isolates: Influence of pH and NaCl[J]. Food Hydrocolloids, 2009,23(1):146-152.
[32] ETTOUMI Y L, CHIBANE M, ROMERO A. Emulsifying properties of legume proteins at acidic conditions: Effect of protein concentration and ionic strength[J]. LWT - Food Science and Technology, 2016,66:260-266.
[33] HOSSEINI-PARVAR S H, OSANO J P, MATIA-MERINO L. Emulsifying properties of basil seed gum: Effect of pH and ionic strength[J]. Food Hydrocolloids, 2016,52:838-847.
Emulsifing properties ofZanthoxylumbungeanumMaxim seed kernel protein isolate: effect of pH and NaCl concentration
LI Chao, PU Biao*, LUO Song-ming, LIU Xing-yan, XU Dan-ping, FU Ben-ning, PAN Shu-xuan, JIANG Pei-ji, WANG Chun-xia, LI Qiang
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
The effect of pH and NaCl concentration on the properties of stabilized emulsions ofZanthoxylumbungeanumMaxim seed kernel protein isolates were investigated by measuring the characters of emulsifying activity, emulsifying stability, droplet size, optical microscopy measurements and SDS-PAGE gel electrophores. The results showed that pH and NaCl concentration have significant influence on the above parameters: with the increase of pH value, emulsifying activity and emulsion stability decreased first and then increased at pH 3. In contrast, emulsion particle size (D4, 3) increased first and then decreased, and reached the maximum (D4, 3=1.87 μm) at pH 3. The NaCl content decreased the emulsifying activity and emulsifying stability, which caused the flocculation of emulsified particles and increased the average particle size (D4, 3). Optical microscopy clearly demonstrated that droplet aggregates formed at pH=3 and c (NaCl)=1.2 mol/L. In addition, SDS-PAGE gel electrophoresis showed that there were three proteins having emulsifying effect, and their molecular weight was 5、7、21 kDa. This will provide reference for the application ofZanthoxylumbungeanumMaxim seed kernel protein in food processing.
ZanthoxylumbungeanumMaxim seed kernel; protein isolate; pH; NaCl; emulsifing properties
硕士研究生(蒲彪教授为通讯作者,E-mail:pubiao2002@163.com)。
国家林业局林业公益性行业科研专项(201304703);国家林业局 行业标准制修订项目(2015-LY-184)
2016-10-14,改回日期:2017-03-09
10.13995/j.cnki.11-1802/ts.201706015
