海洋脂肪酶YS2071的固定化及酶学性质研究
2017-07-31姜峻颖马子宾孙晶晶郝建华刘均忠王跃军孙谧
姜峻颖,马子宾,孙晶晶,郝建华,刘均忠,王跃军,孙谧*
1(中国水产科学研究院 黄海水产研究所,海洋国家实验室海洋药物与生物制品功能实验室,山东 青岛,266071)2(上海海洋大学 食品学院,上海,201306)
海洋脂肪酶YS2071的固定化及酶学性质研究
姜峻颖1,2,马子宾1,孙晶晶1,郝建华1,刘均忠1,王跃军1,孙谧1*
1(中国水产科学研究院 黄海水产研究所,海洋国家实验室海洋药物与生物制品功能实验室,山东 青岛,266071)2(上海海洋大学 食品学院,上海,201306)
为提高脂肪酶的利用效率,更好应用于工业化生产,研究了脂肪酶YS2071的固定化技术,筛选最优载体,通过单因素实验法对脂肪酶固定化的条件进行优化,并对其性质进行了研究。采用MI-BSI伯胺功能基吸附树脂为载体,京尼平为交联剂,吸附-交联的方法,分析了加酶量、吸附时间、吸附温度、初始pH、交联剂的浓度、交联时间等因素对脂肪酶固定化效果的影响,并通过PB实验和响应面实验,确定了最佳固定化条件:加酶量为8 mg,吸附时间8 h,吸附温度为20 ℃,初始pH 8.6,交联剂质量浓度为0.48 g/L,交联时间为1 h时,固定化效率最高,酶活回收率达到60% 以上。
脂肪酶;固定化;酶学性质
脂肪酶(Lipase, EC3.1.1.3,甘油酯水解酶)是催化三酯酰甘油水解的一类酶的总称,是一类特殊的酯键水解酶。其天然底物是长链脂肪酸酯,可以在油-水界面上催化油脂水解生成甘油、脂肪酸和甘油二酯或甘油单酯。
脂肪酶作为生物催化剂在不同的体系下,可以催化部分酯类物质的氨解、酯化、转酯化、水解和醇解等化学反应[1],且反应不需要辅酶,反应条件温和,副产物少。因此,脂肪酶的应用十分广泛,在食品工业、医药卫生、化学化工、环境保护、能源开发等领域均有研究应用[2-3]。产脂肪酶的微生物种类很多,海洋微生物作为海洋中一种重要的生物资源,能产生许多陆地微生物不能产生的活性物质,如高温酶和低温酶,这将大大拓展脂肪酶的应用范围,为一些有机合成及生物技术提供新方向。
游离脂肪酶用途广泛、催化技术较成熟,但回收利用率低,易受外界环境影响,难以实现连续化操作。酶固定化后一般稳定性增加,酶活损失较小,易从反应系统中分离,能反复多次使用[4]。固定化脂肪酶的性能主要取决于其固定化所使用载体材料的性质和固定化方法,传统的固定化方法有以下4种:包埋法、吸附法、共价结合法和交联法。一些新的固定化方法如双重固定化、定向固定化和无载体固定化等,可以提高固定化的效率。双重固定法将2种传统的方法联用,克服单一方法的缺陷,减少酶活力的损失,重复使用性和操作稳定性较好。交联酶聚集体是一种较常用的无载体固定化酶技术,无需载体、空间效率高,但机械强度较差。姜艳军[5]等将交联酶聚集体与仿生硅化技术结合,京尼平为交联剂,制得的固定化酶酶活达897 U/g,有机溶剂耐受能力、重复使用性能等方面明显提高。定向固定化通过酶分子表面远离活性中心的特异性基团与载体共价交联实现固定化,酶稳定性增强,但方法较为复杂,应用范围受到限制[6]。本文采用吸附-交联双重固定的方法,将脂肪酶YS2071固定在MI-BSI伯胺功能基酶载体树脂上,并对其固定化条件和酶学性质进行研究,旨在寻找一种适合YS2071的固定化方法,提高固定化的效率与稳定性,更好的用于工业化生产。
1 材料与方法
1.1 材料与试剂
海洋脂肪酶YS2071由黄海水产研究所海洋产物资源与酶工程课题组自行制备,京尼平(纯度>98%):之信生物科技公司;对硝基苯酚(p-nitrophenol,pNP):sigma公司;对硝基苯基月桂酸酯(p-nitropHenyl laurate,pNP-lauate)、磷酸二氢钠、磷酸氢二钠、异丙醇、叔丁醇、乙醇:分析纯,国药集团化学试剂有限公司;曲拉通TritonX-100:分析纯,上海麦克林生物科技有限公司;树脂:山东鲁抗立科药业有限公司、杭州创科生物科技有限公司。
1.2 仪器与设备
LGJ-10D型冷冻干燥机,北京四环科学仪器厂;CR21G Ⅲ日立高速冷冻离心机,日本HITACHI公司;H1650-W台式高速离心机,湖南湘仪实验室仪器开发公司;LKB2219恒温水浴锅,瑞典BROMMA;ORION Model 818 pH计,美国奥立龙;THZ-C-1全温振荡器,苏州培英实验设备有限公司;Infinite M200Pro多功能微孔板检测仪,瑞士帝肯(Tecan)公司。
1.3 实验方法
1.3.1 脂肪酶酶活测定方法
参照HATZINIKOLAOU[7]和李忠磊[8]的方法并改进,底物为pNP-lauate。
反应体系:A液:83.3 mgpNP-lauate 溶于异丙醇中,定容至25 mL。
B液:0.1 mol/L pH 8.0的磷酸缓冲液加入0.4% TritonX-100,定容至1 L。
将0.1 mL A液与1.5 mL B液混匀后,40 ℃恒温水浴锅中预热4 min,随后加入0.1 mL待测酶液(对照组为等量煮沸8 min灭活的酶液),继续孵育8 min,取出,加入2 mL乙醇冰浴终止反应,在410 nm处测定吸光值。固定化酶酶活力测定在游离酶基础上,将游离酶替换成固定化酶(对照组为等量煮沸8 min灭活的固定化酶)。
酶活力单位(U)定义为在:40 ℃,pH 8.0条件下,游离酶或固定化酶每分钟催化底物水解产生1.0 μmol/LpNP 需要的酶量。
1.3.2 固定化脂肪酶的制备
准确称取1 g MI-BSI 伯胺功能基酶载体树脂,加入4 mL脂肪酶YS2071酶液(2 mg/mL)于具塞三角瓶中,一段时间后,加入4 mL交联剂,在25 ℃,200 r/min摇床上振荡摇匀,振荡结束后,静置,取出上清液,用缓冲液清洗树脂,冻干,4 ℃保存备用。
1.3.3 固定化脂肪酶酶学性质
根据响应面实验确定的最优条件,对脂肪酶YS2071进行固定化后,冷冻干燥,得到固定化酶备用。测定其性质,分析固定化脂肪酶的最适温度及热稳定性,最适pH及pH稳定性,金属离子的影响,有机试剂的影响,储存稳定性和重复使用性。
1.3.3.1 最适温度及热稳定性
将固定化酶和游离酶置于20、30、40、50、60、70 ℃的恒温水浴锅中测定酶活力,确定最适反应温度。将固定化酶和游离酶置于不同温度下处理2 h,取出测定酶活力,分析热稳定性。
1.3.3.2 最适pH及pH稳定性
将固定化酶和游离酶置于pH 4、5、6、7、8、9、10、11、12的缓冲液配制的底物中测定酶活力,确定最适pH。将固定化酶和游离酶置于不同pH的缓冲液中处理2 h,取出测定酶活力,分析pH稳定性。
1.3.3.3 金属离子的影响
将固定化酶和游离酶置于5 mmol/L的Al3+、Cu2+、Fe2+、Mg2+、Ca2+、K+、Fe3+、Zn2+、Mn2+等9种金属离子中处理2 h,取出测定酶活力,分析金属离子对酶活力的影响。
1.3.3.4 有机溶剂的影响
将固定化酶和游离酶置于乙醇、正己烷、石油醚、叔丁醇、冰乙酸、乙酸乙酯及丙酮等7种有机溶液中处理2 h,取出测定酶活力,分析有机溶剂对酶活力的影响。
1.3.3.5 重复使用性
将固定化酶与底物在最适反应条件下催化反应,测定酶活力。反应结束后,将固定化酶从反应体系中分离出来,重复上述反应,总计10次。以首次测定的酶活力为100%,研究其重复使用性。
1.3.3.6 储存稳定性
将固定化酶与游离酶在4 ℃放置0、5、10、15、20、25、30 d,分别测定固定化酶和游离酶的酶活力。以首次测定的酶活力为100%,研究其储存稳定性。
2 结果与分析
2.1 单因素法优化固定化条件
2.1.1 加酶量对固定化脂肪酶酶活力的影响
考察不同的加酶量下,脂肪酶固定化效果。由图1可知,随着加酶量的增加,酶活力随之增加,当加酶量达到一定程度,酶活力趋于平衡。可能是因为载体的载酶量有限,当加酶量为80 mg时,载体承载酶的能力趋于饱和。酶活回收率随着加酶量的增加呈现先增加后降低的趋势,加酶量为8 mg时,酶活回收率最大,在63%以上。加酶量增加,但酶与载体的结合位点有限,大量的酶重叠,降低了酶与底物结合的能力,酶的回收率降低[9]。因此,选择8 mg为最佳加酶量。

图1 加酶量对酶活的影响Fig.1 Effects of amount of enzyme on relative activity of immobilized lipase
2.1.2 温度对固定化脂肪酶酶活力的影响
酶是一种蛋白质,温度对酶的影响比较敏感[10]。考察不同的温度下,脂肪酶固定化效果。由图2可知,随着温度的升高,酶活先增加后降低,20 ℃酶活达到最高。因为酶吸附到载体上是一个吸热过程,温度太低,分子的热运动较慢,不利于酶与载体的结合,酶的吸附率较低;温度过高会导致部分酶的失活,吸附率下降。因此,选择20 ℃为最佳固定化温度。
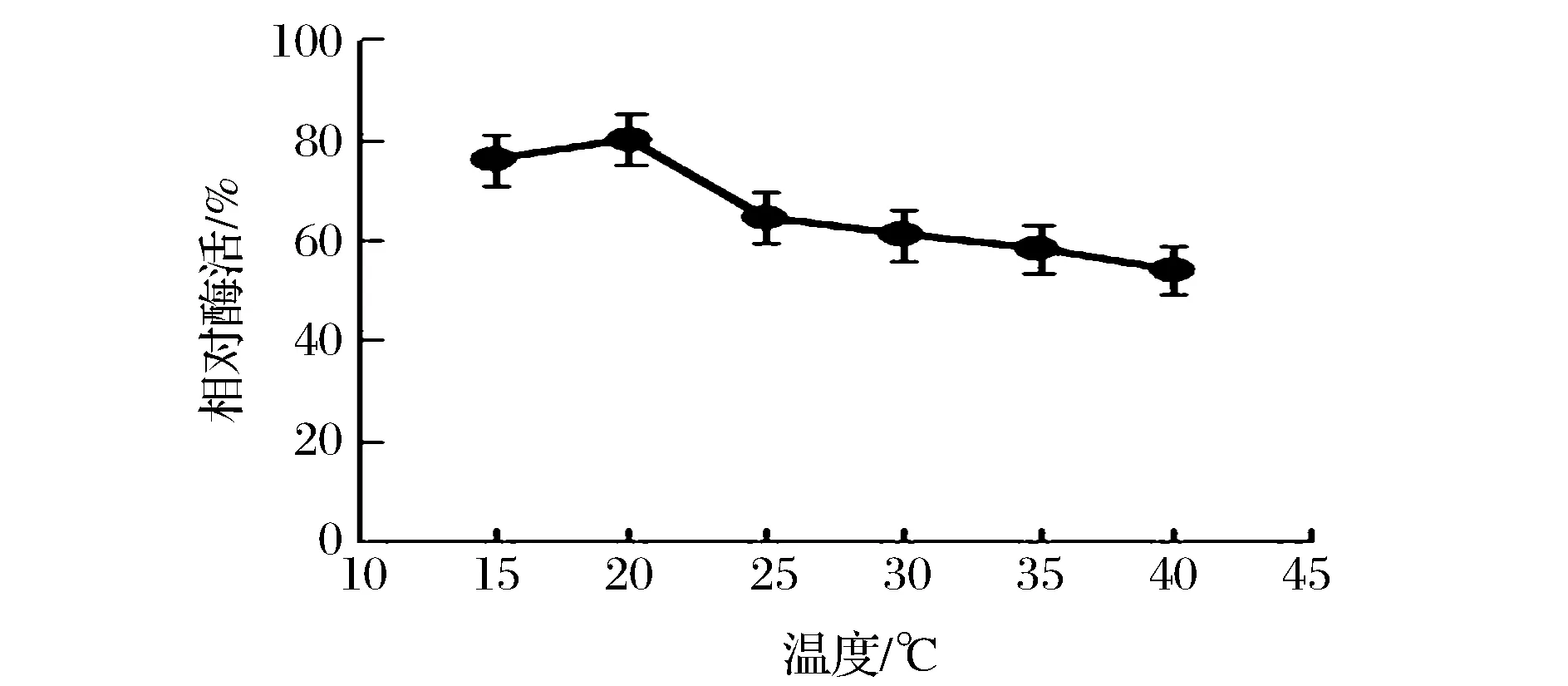
图2 温度对酶活的影响Fig.2 Effects of temperature on relative activity of immobilized lipase
2.1.3 吸附时间对固定化脂肪酶酶活力的影响
吸附时间是影响固定化酶活和载体吸附蛋白量的重要因素之一。考察不同的吸附时间,脂肪酶固定化效果。由图3可知,2~8 h时,随着时间的增加,酶活逐渐增加,8 h时酶活最大,可能是因为吸附时间较短,载体承载的酶量较少,传质的动力较大,吸附迅速[11];8~16 h,随着时间的增加,酶活逐渐降低,可能是长时间的吸附导致部分酶失活,并且载体的载酶量有限,吸附时间过长导致酶的空间增大,固定化酶的酶活位点被掩盖,酶活降低。因此,选择8 h为最佳吸附时间。

图3 吸附时间对酶活的影响Fig.3 Effects of adsorption time on relative activity of immobilized lipase
2.1.4 pH对固定化脂肪酶酶活力的影响
在固定化过程中,缓冲液的pH会改变酶分子和孔壁表面的离子化状态,影响酶与载体的结合程度,进而影响固定化酶的酶活力[12]。考察不同的缓冲液pH,脂肪酶固定化效果。由图4可知,pH 9时,酶活最大。可能是过酸、过碱的环境会对部分酶的活性有一定的抑制作用,也可能是pH值影响酶分子周围的微环境,在特定的pH环境下,酶分子的活性处于适合于载体结合的状态,pH过高或过低,酶分子的活性处于不适合与载体结合的状态。因此,选择pH 9为最佳缓冲液的pH。

图4 pH对酶活的影响Fig.4 Effects of pH on relative activity of immobilized lipase
2.1.5 交联剂浓度对固定化脂肪酶酶活力的影响
京尼平作为一种生物交联剂,可以连接酶和载体,增强固定化酶的机械强度,但也会对酶蛋白分子有一定的毒性,致使酶活力降低,其用量是影响固定化酶活力的重要因素之一[13]。考察不同的交联剂浓度,脂肪酶固定化效果。由图5可知,交联剂浓度在0.2~0.4 g/L时,相对酶活力随着浓度的增加而增大,可能是因为交联剂浓度较低,载体表面活性基团较少,不能将更多的载体与酶交联,且酶易脱落,酶活力较低;交联剂浓度在0.4~6 g/L时,相对酶活力随着浓度的增加而减小,交联剂浓度过高,可能会对酶分子以及载体产生毒害作用,酶活力降低。因此,选择0.4 g/L为最佳交联剂浓度。
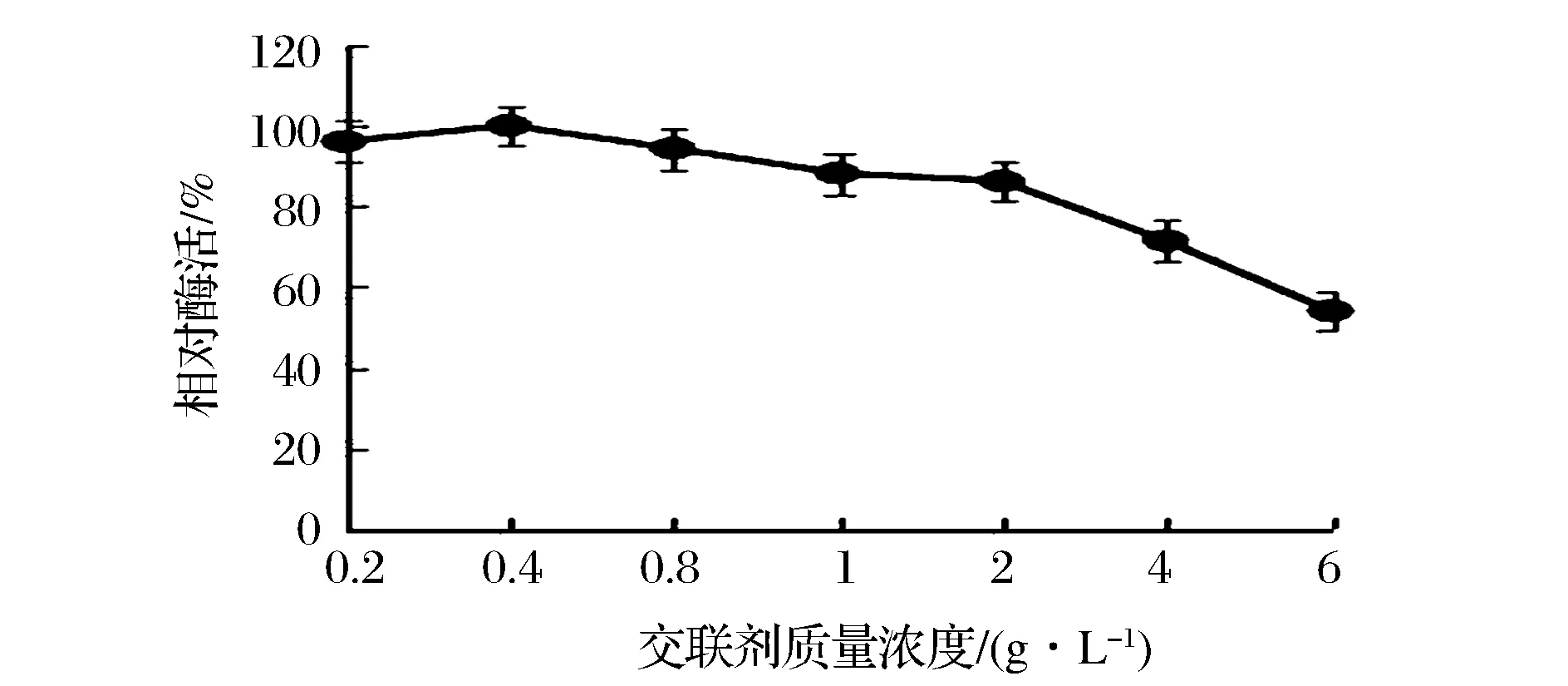
图5 交联剂浓度对酶活的影响Fig.5 Effects of concentration of crosslinker on relative activity of immobilized lipase
2.1.6 交联时间对固定化脂肪酶酶活力的影响
考察不同的交联时间,脂肪酶固定化效果。由图6可知,交联时间对酶活的影响。0.5~1 h,随着交联时间的增加,酶活力增加,可能是交联时间较短,交联剂不能将较多的酶与载体结合,酶活力较低;1~4 h,随着交联时间的增加,酶活力降低,可能是交联时间过长,降低酶分子的灵活性。因此,选择1 h为最佳交联时间。

图6 交联时间对酶活的影响Fig.6 Effects of crosslinking time on relative activity of immobilized lipase
2.2 响应面法优化固定化条件
2.2.1 Plackett-Burman法筛选主要影响因子
对加酶量、吸附时间、吸附温度、pH、交联时间、交联剂浓度等6个因素进行了优化,在此基础上,通过PB试验筛选主要影响因子,设计见表1。

表1 试验筛选主要影响因素的实验设计及结果
由表2可以看出,吸附时间、pH、交联剂浓度P<0.05,为显著因素且3者的贡献值之和为95.14%,因此3者是固定化条件中的主要影响因素。
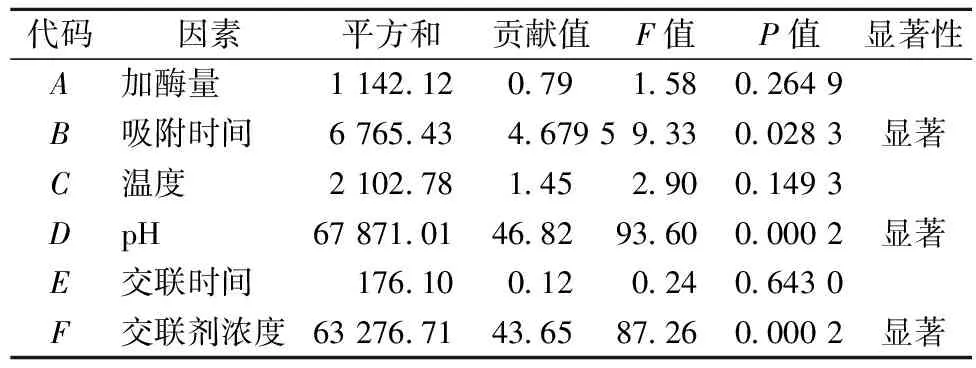
表2 PB试验设计分析
2.2.2 响应面法中心组合设计确定固定化最优条件
根据PB试验确定吸附时间、pH、交联剂浓度为3个显著影响因子,采用Box-Behnken设计原理,进行3因素3水平的响应面分析试验,进一步探讨3因素对固定化脂肪酶酶活力的影响,并确定最优的固定化条件,每组做3次平行。中心组合试验设计如表3。

表3 中心组合设计及结果
用Design-Expert V8.0.6 数据分析软件对数据进行回归分析,P值0.000 3<0.05,说明该模型是显著的,失拟向P=0.117 2>0.05,表明该模型的失拟向不显著。综上,该模型能较好的解释酶活力的变化,回归方程对数据有较好的拟合,二次多项式回归方程如下:
Y=885.85+21.66A+17.60B-16.04C-2.94AB+2.95AC+1.12BC-55.73A2-127.82B2-129.64C2
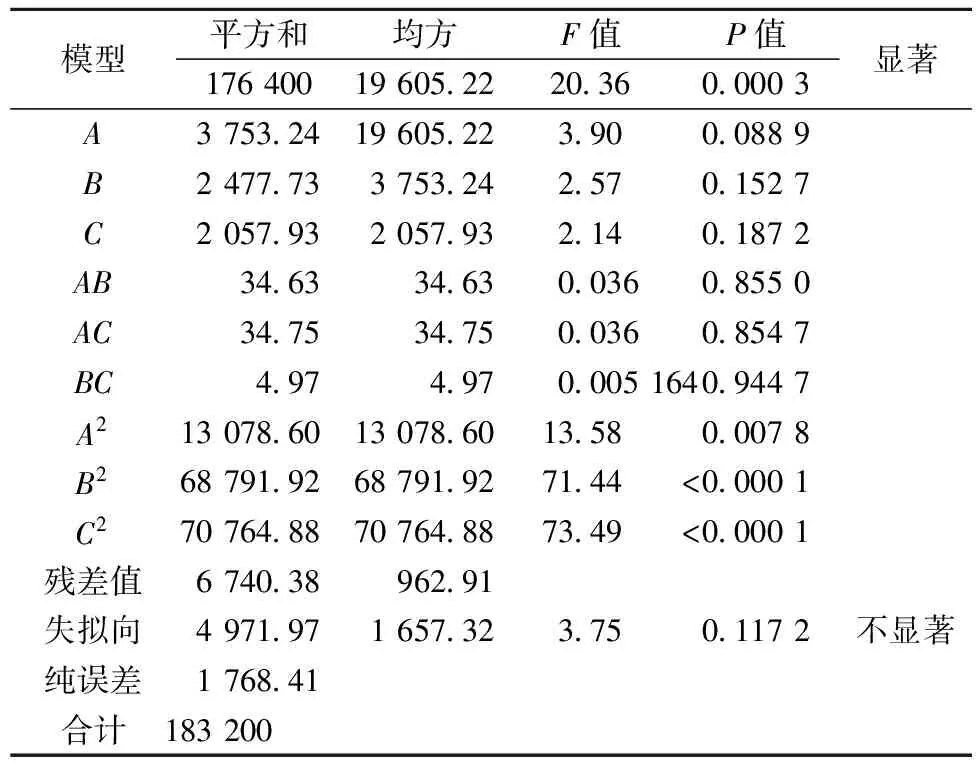
表4 响应面模型方差分析表
用Design-Expert V8.0.6 数据分析软件进行分析,各因素的交互作用对固定化酶酶活力的影响如图7所示。

图7 响应面三维图及等高线图Fig.7 3D and contour plot of various factors
2.2.3 验证试验
对回归方程求导得到极值点,理论吸附时间为8.19 h,pH为8.6,交联剂质量浓度为0.48 g/L,酶活的响应值达到最大,其理论值为948.97 U/g。
为操作简便,选定交联时间8 h,pH为8.6,交联剂质量浓度为0.48 g/L时,实际试验结果的酶活为936.71 U/g,与理论值相符,证明该模型是可靠的,可以用于优化脂肪酶的固定化条件。
2.3 固定化脂肪酶的酶学性质
2.3.1 固定化酶和游离酶的最适温度
将固定化酶和游离酶置于20~70 ℃的恒温水浴锅中测定酶活力,确定最适反应温度。由图8可以看出,固定化酶与游离酶的最适反应温度均为40 ℃,说明固定化并没有改变脂肪酶的适应范围,但可以看出,随着温度的升高,固定化酶的酶活力高于游离酶的酶活力,酶的热稳定性有所提高。

图8 固定化酶和游离酶的最适温度Fig.8 The optimal temperature of immobilized lipase
2.3.2 固定化酶和游离酶的温度稳定性
将固定化酶和游离酶于20~70 ℃的恒温水浴锅中处理2 h,取出测定酶活力,分析热稳定性。由图9可以看出,随着温度的增加,固定化酶与游离酶的热稳定性均呈现下降的趋势,但在20~40 ℃,酶活力下降缓慢;40~70 ℃,酶活力明显下降,固定化酶在70 ℃时,残余酶活40%左右,而游离酶的残余酶活仅为20%。说明固定化提高了酶的热稳定性,可能是因为酶与载体结合后,载体对酶分子起到了一定的保护作用,维持其结构的稳定性。

图9 固定化酶和游离酶的热稳定性Fig.9 The temperature stability of immobilized lipase
2.3.3 固定化酶和游离酶的最适pH
将固定化酶和游离酶置于pH 4~12下测定酶活力,确定最适反应pH。由图10知,固定化酶和游离酶的最适pH均为9,随着pH的增加,固定化酶和游离酶的酶活变化趋势相同,固定化并没有改变脂肪酶pH的适应范围,但固定化后酶活力均高于游离酶的酶活力,说明固定化提高了脂肪酶对酸碱的耐受性。
2.3.4 固定化酶和游离酶的pH稳定性
将固定化酶和游离酶置于pH 4~12下2 h后测定酶活力,确定pH稳定性。由图11可知,随着pH的增加,固定化酶与游离酶的活力均先增加后减少,但pH 7~10时固定化酶与游离酶的稳定性相差不大,pH 4~6、pH 11~12时,固定化酶的酶活力明显高于游离酶的酶活力,说明固定化后,脂肪酶对酸和碱的耐受性增强。

图11 固定化酶和游离酶的pH稳定性Fig.11 The pH stability of immobilized lipase
2.3.5 金属离子的影响
将固定化酶和游离酶置于5 mmol/L的9种金属离子中处理2 h,取出测定酶活力,分析金属离子对酶活力的影响。由图12可知,金属离子对固定化酶的影响较小,可能是固定化后,酶的空间更加稳定。Al3+、Cu2+、Fe2+、Fe3+、Zn2+对酶活有抑制作用,Al3+、Cu2+的抑制作用较明显。Mg2+、Ca2+、K+、Mn2+对酶活有促进作用,Ca2+、K+的促进作用较明显。

图12 金属离子对酶活的影响Fig.12 Effects of metal ion on relative activity of immobilized lipase
2.3.6 有机溶剂的影响
将固定化酶和游离酶置于7种有机溶液中处理2 h,取出测定酶活力,分析有机溶剂对酶活的影响。由图13可知,有机试剂对固定化酶的影响小于游离酶。乙酸、乙酸乙酯的影响较大,乙醇、叔丁醇、丙酮的影响较小,且叔丁醇的空间位阻大,不易与其他成分发生反应[14],可以作为催化反应的溶剂,为脂肪酶的应用提供了思路。

图13 有机溶剂对酶活的影响Fig.13 Effects of organic solvents on relative activity of immobilized lipase
2.3.7 重复使用性
将固定化酶与底物在最适反应条件下催化反应,测定酶活力,重复10次,分析固定化酶的重复使用性。由图14可知,重复使用10次后,固定化酶的残余酶活力仍保留在30%以上,固定化酶具有良好的操作性,可以进行下一步研究。

图14 重复次数对酶活的影响Fig.14 Effects of repeat times on relative activity of immobilized lipase
2.3.8 储存稳定性
将固定化酶与游离酶在4 ℃放置0、5、10、15、20、25、30 d,分别测定酶活力,分析其储存稳定性。由图15可知,随着储存时间的增加,固定化酶与游离酶的酶活力均下降,但固定化酶酶活力下降的趋势更平缓。储存30 d后,固定化酶的酶活仍在60%以上,而游离酶的酶酶活仅有30%左右,说明经过固定化,脂肪酶YS2071的稳定性能得到了提高。

图15 储存天数对酶活的影响Fig.15 Effects of storage days on relative activity of immobilized lipase
3 结论
通过吸附法和交联法相结合的方法,将脂肪酶YS2071固定在MI-BSI伯胺功能基载体树脂上,采用单因素法和响应面法对固定化条件进行优化,并对酶学性质进行研究,结论如下:
(1)通过单因素实验、PB实验和响应面实验,对影响酶活的因素进行筛选,并确定最佳固定化条件:加酶量为8 mg,吸附时间8 h,吸附温度为20 ℃,初始pH 8.6,交联剂质量浓度为0.48 g/L,交联时间为1 h时,固定化效率最高,最大酶活可达到936.71 U/g,酶活回收率达到60%以上。
(2)对固定化酶酶学性质进行研究,与游离酶相比,固定化酶的最适温度和最适pH均没有改变,但热稳定性与pH稳定性均有明显的提高,固定化酶使用10次后,相对酶活仍在30%以上。储存30 d,相对酶活在60%以上。说明脂肪酶YS2071经固定化后,具有良好的操作性,可进一步进行应用研究。
[1] JAEGER K, EGGERT T.Lipases for biotechnology[J].Curr Opin Biotech,2002,13(4): 390-397.
[2] 张开平,惠明,田青,等.微生物脂肪酶的应用领域及研究进展[J].河南工业大学学报(自然科学版),2012,33(1):90-94.
[3] ZIVKOVIC L T I,ZIVKOVIC L S,BABIC B M,et al.Immobilization ofCandidarugosalipase by adsorption onto biosafe meso/macroporous silica and zirconia[J].Biochemical Engineering Journal,2015(93):73-83.
[4] QUILLES J C J,BRITO R R,BORGES J P,et al.Modulation of the activity and selectivity of the immobilized lipases by surfactants and solvents[J].Biochemical Engineering Journal,2015(93):274-280.
[5] 姜艳军,王旗,王温琴,等.交联酶聚集体与仿生硅化技术结合制备固定化脂肪酶[J].催化学报,2012,33(5):857-862.
[6] 刘涛.磁性纳米颗粒定向固定固定化脂肪酶及其应用研究[D].武汉:华中科技大学,2013.
[7] HATZINIKOLAOU D G,KOURENTZI E,STAMATIS H,et al.A novel lipolytic activity ofRhodotorulaglutiniscells:production,partial characterization and application in the synthesis of esters[J].Journal of Bioscience and Bioengineering,1999,88(1):53-56.
[8] 李忠磊,王跃军,盛军,等.Bohaisea-9145海洋耶氏酵母碱性脂肪酶基因的克隆、异源表达和重组酶酶学性质[J].海洋与湖沼,2012,43(2):230-236.
[9] 李明廓,陈光,王刚.固定化脂肪酶载体的筛选研究[J].现代农业科技,2012(5):24-26.
[10] 刘媛媛,郑永杰,田景芝.改性硅藻土对脂肪酶固定化研究[J].化学工程师,2014(3):14-17.
[11] 刘自琴.脂肪酶和胰蛋白酶的固定化及共固定化研究[D].广州:华南理工大学,2012.
[12] 张育淇,刘晓贞,李云,等.氨基功能化大孔SiO2固定化漆酶[J].宁波大学学报(理工版),2015,28(2):108-113.
[13] 孙玉英,张继泉.吸附交联法和包埋法固定化混合酶研究[J].淮海工学院学报(自然科学版),2013,22(3):82-88.
[14] 辛嘉英,柳眉,张蕾,等.有机相脂肪酶催化合成阿魏酸乙酯[J].食品科学,2007,28(9):137-140.
The immobilization and enzymatic properties of lipase YS2071
JIANG Jun-ying1,2,MA Zi-bin1,SUN Jing-jing1,HAO Jian-hua1, LIU Jun-zhong1,WANG Yue-jun1,SUN Mi1*
1(Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Laboratory for Marine Drugs and Bioproducts of Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China)2(College of Food Sciences & Technology, Shanghai Ocean University, Shanghai 201306, China)
Free lipase is difficult to achieve continuous operation. In order to improve the efficiency of lipase and apply it to the industrialized production, the technology of immobilized lipase YS2071 was studied by screening the optimal carrier and using single factor experiment method to optimize lipase immobilized conditions. Using MI-BSI resin as carrier and genipin as cross-linking agent, adsorption-crosslinking method was employed to maintain relative high enzyme activity. Immobilized conditions were studied by using PB experiment and the response surface design. The optimal conditions of immobilized lipase YS2071 were as followes: the enzyme dosage was 8 mg, the adsorption time was 8 h, the adsorption temperature was 20 ℃, the initial pH was 8.6, the concentration of genipin was 0.48 g/L, the crosslinking time was 1 h. Under these conditions, the recovery rate of immobilized enzyme was up to 60%.
lipase; immobilization; enzymatic properties
硕士研究生(孙谧为通讯作者,E-mail: sunmi@ysfri.ac.cn)。
NSFC-山东联合资助海洋研究中心项目(U1406402-5);国际科技合作与交流专项 (2014DFG30890);国家实验室-鳌山科技计划(2015ASKJ02-06);国家863计划(2014AA093516)
2016-12-12,改回日期:2017-03-01
10.13995/j.cnki.11-1802/ts.201706007
