基于在线参数动态调控的双酶法生产葡萄糖酸钠新工艺
2017-07-31苏立宇赵伟杭海峰储炬
苏立宇,赵伟,杭海峰*,储炬*
1(华东理工大学,生物反应器工程国家重点实验室,上海,200237) 2(山东福洋生物科技有限公司,山东 德州,253100)
基于在线参数动态调控的双酶法生产葡萄糖酸钠新工艺
苏立宇1,赵伟2,杭海峰1*,储炬1*
1(华东理工大学,生物反应器工程国家重点实验室,上海,200237) 2(山东福洋生物科技有限公司,山东 德州,253100)
采用葡萄糖酸钠生产过程中在线参数氧消耗速率(OUR)和溶氧(DO)作为调控参数,开发出阶段性实时动态补加葡萄糖氧化酶的双酶法生产葡萄糖酸钠新型工艺,酶催化过程中葡萄糖氧化酶酶活始终不是限制因素。50 L反应器初始葡萄糖浓度在330 g/L条件下,能够有效将生产时间从原始工艺的17.0 h缩短至11.6 h,得率由1.167(g/g)提高至1.176(g/g),最终消耗的葡萄糖氧化酶的量也由2 100 U/g葡萄糖缩减到1 444 U/g葡萄糖。与生物发酵相比,改进后的酶法工艺也更具优越性,生产时间缩短了42.85%,得率提升了4.91%。改进后的双酶法生产葡萄糖酸钠新工艺具有更广阔的市场应用前景。
葡萄糖氧化酶;葡萄糖酸钠;在线参数;工艺优化
葡萄糖酸钠(Sodium Gluconate, SG)是一种易溶于水,微溶于醇,不溶于醚的多羟基羧酸钠[1],它作为葡萄糖酸的重要衍生物之一,在建筑、医药、食品、化工等行业都发挥着的重要作用[2-5]。现今葡萄糖酸钠的生产方法大致可分为5类:多相催化氧化法、均相氧化法、电催化方法、生物发酵法和酶催化法[6-8]。现今工业上大批量生产葡萄糖酸钠大多采用的是生物发酵法(主要以黑曲霉深层发酵为主)和双酶法直接催化。生物发酵和双酶法涉及的反应机理可简化如图1所示。

图1 葡萄糖酸合成途径Fig.1 Gluconic acid synthesis pathway
葡萄糖氧化酶催化葡萄糖脱氢生成1分子葡萄糖-δ-内酯和1分子过氧化氢。过氧化氢在过氧化氢酶作用下分解成水和氧气,葡萄糖-δ-内酯则在内脂酶作用下或自发水解形成葡萄糖酸[9]。最后通过流加氢氧化钠溶液调节pH,同时也生成葡萄糖酸钠。
相比于黑曲霉生物发酵而言,双酶法直接催化具有如下优势:1.由于没有了制备种子的时间,且酶促反应快速高效,可以显著缩短生产所用时间。2.由于双酶法没有菌体生长,且副产物少,所以得率相对更高[10]。3.最终产品白度好、质量高且稳定[11]。但是双酶法同时也存在以下的缺陷,导致了它还未大规模取代黑曲霉深层发酵成为葡萄糖酸钠发酵的首选:1.酶法生产所用的关键酶,葡萄糖氧化酶的价格始终居高不下,这就导致了最终生产成本高于黑曲霉深层发酵。而成本因素在工业生产上是判断一项工艺好坏的重要指标之一。2.由于酶本质上是蛋白质,不能够进行高温灭菌操作,所以染菌问题也是困扰双酶法的问题之一。双酶法不适宜进行多次带放或者不灭罐的多次反应。
现阶段采用酶法生产葡萄糖酸钠的操作过程是在开始时向原料液内投加所有的葡萄糖氧化酶和过氧化氢酶,中途不进行任何补料补加酶的举措,等生产结束时进行放罐到下游分离提取葡萄糖酸钠[12]。本研究以生产过程中在线摄氧率(Oxygen uptake rate,OUR)、溶氧(Dissolved oxygen, DO)的相关性变化为依据,研究并开发了阶段性实时动态补加葡萄糖氧化酶的新型双酶法生产葡萄糖酸钠新工艺。
1 材料与方法
1.1 材料与试剂
本研究所用黑曲霉(Aspergillusniger)由山东福洋生物科技有限公司提供。
葡萄糖氧化酶(Glucose oxidase, GOD),过氧化氢酶(Catalase, CAT,)均为工业级液态粗酶液,购自诺维信(中国)有限公司。其中葡萄糖氧化酶酶活为6.5×105U/mL。
1.2 仪器与设备
本实验采用上海国强生化装备有限公司的15 L和50 L搅拌式生物反应器,同时配备有Omega公司的温度电极和Mettler公司的溶氧及pH电极。发酵尾气通过尾气质谱仪(MAX300-LG,Extrel,USA)进行在线检测。所有的数据处理及相关分析通过华东理工大学国家生化工程技术研究中心(上海)自行开发的上位机软件包《发酵过程检测系统BIORADR 2.0》完成。
1.3 培养基
菌种活化培养基(g/L):葡萄糖60,尿素0.2,KH2PO40.13,MgSO40.15,玉米浆1.0,CaCO35.0,琼脂1.0。
15 L种子培养基(g/L):葡萄糖250,KH2PO40.5,(NH4)2HPO41.8,MgSO40.19,玉米浆2.1。消泡剂0.2ml/L。
50 L发酵培养基(g/L):葡萄糖330,KH2PO40.17,(NH4)2HPO40.25,MgSO40.2。消泡剂0.2ml/L。
50 L酶法培养基(g/L):葡萄糖330,消泡剂0.2 ml/L。
所有培养基在配制完成后用1 mol/L NaOH溶液将pH调节至pH7.0,115℃高温灭菌20 min。
1.4 发酵方法
1.4.1 生物发酵
用50 mL无菌水洗下茄子瓶培养好的黑曲霉孢子斜面,接种到含有9 L培养基的15 L发酵罐中,发酵18 h。过程中通气比、搅拌转速、温度、罐压分别控制在0.8 vvm,500 r/min, 38 ℃, 0.1 MPa,pH通过流加7.5 mol/L NaOH溶液维持在pH5.8。
在种子培养18.0 h之后,将4.5 L的种子培养液转接到含有30.0 L新鲜培养基的50 L发酵罐中,维持通气量、搅拌转速、温度、罐压分别在1.2 vvm,550 r/min,38.0 ℃,0.1 MPa,pH通过流加7.5 mol/L NaOH溶液维持在pH5.2。当发酵液中检测出的残余葡萄糖浓度低于10.0 g/L时,发酵结束。
1.4.2 原工艺双酶法生产
50 L发酵罐工作体积30 L,初始葡萄糖浓度控制在330 g/L。初期加入9.25×106U过氧化氢酶粗酶液(950 U/g葡萄糖),2.02×107U葡萄糖氧化酶粗酶液(2100 U/g葡萄糖),过程中不再补入酶液。过程中控制条件与生物发酵法相同。
1.4.3 根据在线参数变化趋势实时阶段性补入酶液的双酶法工艺
50 L发酵罐工作体积30 L,初始葡萄糖浓度控制在330 g/L。发酵初期加入1.11×107U过氧化氢酶粗酶液之后过程中不再补加,再加入7.8×106U葡萄糖氧化酶粗酶液,过程中出现OUR下降,DO上升时,及时补加6.5×105U葡萄糖氧化酶酶液。其他的控制条件与初始酶法发酵相同。
1.5 分析检测方法
1.5.1 葡萄糖浓度检测
取发酵液过滤所得清液,稀释到适当浓度,用试剂盒对残糖含量进行测定[13]。
1.5.2 葡萄糖酸钠(SG)浓度检测
SG浓度通过高效液相色谱(HPLC)法测定。具体测定条件为:色谱分离柱为C18柱(4.6 mm×250 mm,5 μm) ;流动相V(甲醇)∶V(磷酸)=1∶1(10%甲醇,2.4%磷酸);检测波长为210 nm;流速为1 mL/min;柱温为26 ℃;进样量为20 μL[14]。
1.5.3 葡萄糖氧化酶酶活检测
在反应试管中依次加入2.4 mL 0.21 mol/L的邻联茴香胺,0.5 mL 0.1%的葡萄糖溶液以及0.1 mL 0.1 mg/mL的辣根过氧化物酶。待溶液充分混匀之后,放置于35 ℃恒温水浴锅内加热保温5 min。测样时取提前预热的0.1 mL 待测样品加入到保温试管内,迅速混匀后倒入比色皿中。每隔30 s记录下紫外分光光度计A500 nm下的吸光度数值。最后用吸光度对时间作图,找出其斜率ΔA/min。根据公式(1)计算葡萄糖氧化酶的酶活。
定义葡萄糖氧化酶在1 h内催化生成1 μL氧气为1个酶活单位(U)。
葡萄糖氧化酶活性(U·mL-1)=

(1)
其中,7.5为氧化型邻联茴香胺的消光系数。ΔA/min为吸光度对时间作图所得斜率。
1.6 二氧化碳消耗速率CER和摄氧率OUR的检测及呼吸商RQ的计算
在线生理参数CER、OUR通过过程质谱仪对发酵尾气进行检测,并由BioStar软件依据公式(2)、(3)、(4)进行计算[15]:

(2)

(3)

(4)
上述方程中,Fin为进气的流量,mmol/L;V为发酵罐的体积,L;CCO2in为进气中氧气浓度(20.95%);CO2in是进气中二氧化碳的浓度(0.03%);Cinertin是进气中惰性气体氮气的浓度;CO2out为尾气中氧气浓度;CCO2out为尾气中二氧化碳的浓度;Tin是温度;h是尾气的湿度;Pin是进气的压力。
2 结果分析
2.1 黑曲霉深层分批发酵法生产SG
常规的SG发酵工艺以黑曲霉作为生产菌株。经过多次参数优化后黑曲霉深层发酵生产SG的过程如图2所示。整个发酵过程持续20.5 h 左右。在发酵初期,CER、OUR随着菌体生长逐渐升高,DO也在这一阶段快速下降,前期限制反应速度的因素可能是菌体浓度。菌体量不够导致了无法合成足量的发酵过程所需要的3种关键酶葡萄糖氧化酶(GOD)、过氧化氢酶(CAT)和内脂酶(LAC)。氧气在黑曲霉深层发酵中主要有两个去处,参与呼吸作用和生成产物SG。在呼吸作用中,1分子葡萄糖经呼吸链彻底氧化需要6分子氧气,同时生成6分子二氧化碳。所以菌体呼吸作用耗氧速率在数值上应该与二氧化碳生成速率相等。在图2发酵过程初期,与CER相比OUR数值始终较高,说明此时氧气除了用作菌体呼吸之外,也已经开始参与产物SG的合成[16]。而合成所需要的3种酶,GOD,LAC和LAC在种子罐阶段就已经开始合成并糖基化附着在黑曲霉菌体细胞壁上[17],随着种子液进入发酵罐直接开始利用葡萄糖进行发酵生产。当发酵进行到5 h左右,CER开始出现回落,但是OUR和DO并未受到影响依旧分别持续上升和下降,说明原先用于菌体呼吸的那部分氧气此时已经被用来生成SG。当DO跌落到30%左右时,此时OUR也达到了整个过程中的最大值不再上升,说明DO可能已经达到了临界氧浓度。同时可以看出,在高的OUR条件下葡萄糖浓度下降很快,而SG浓度也提升迅速。基于以上实验结果,可以得出以下结论:当菌体量足够可以合成过量的3种关键酶GOD,CAT和LAC,限制反应的因素就是设备的供氧能力OTR。任何能够提高OTR水平的操作都能够增加产物的合成[18]。最终整个发酵过程在初始葡萄糖330 g/L浓度下转化生成了327.7 g/L SG,最大OUR达到了54.53 mmol/(L·h),平均耗糖速率16.1 g/(L·h),平均SG成速率15.9 g/(L·h),得率为 1.141(g/g)。
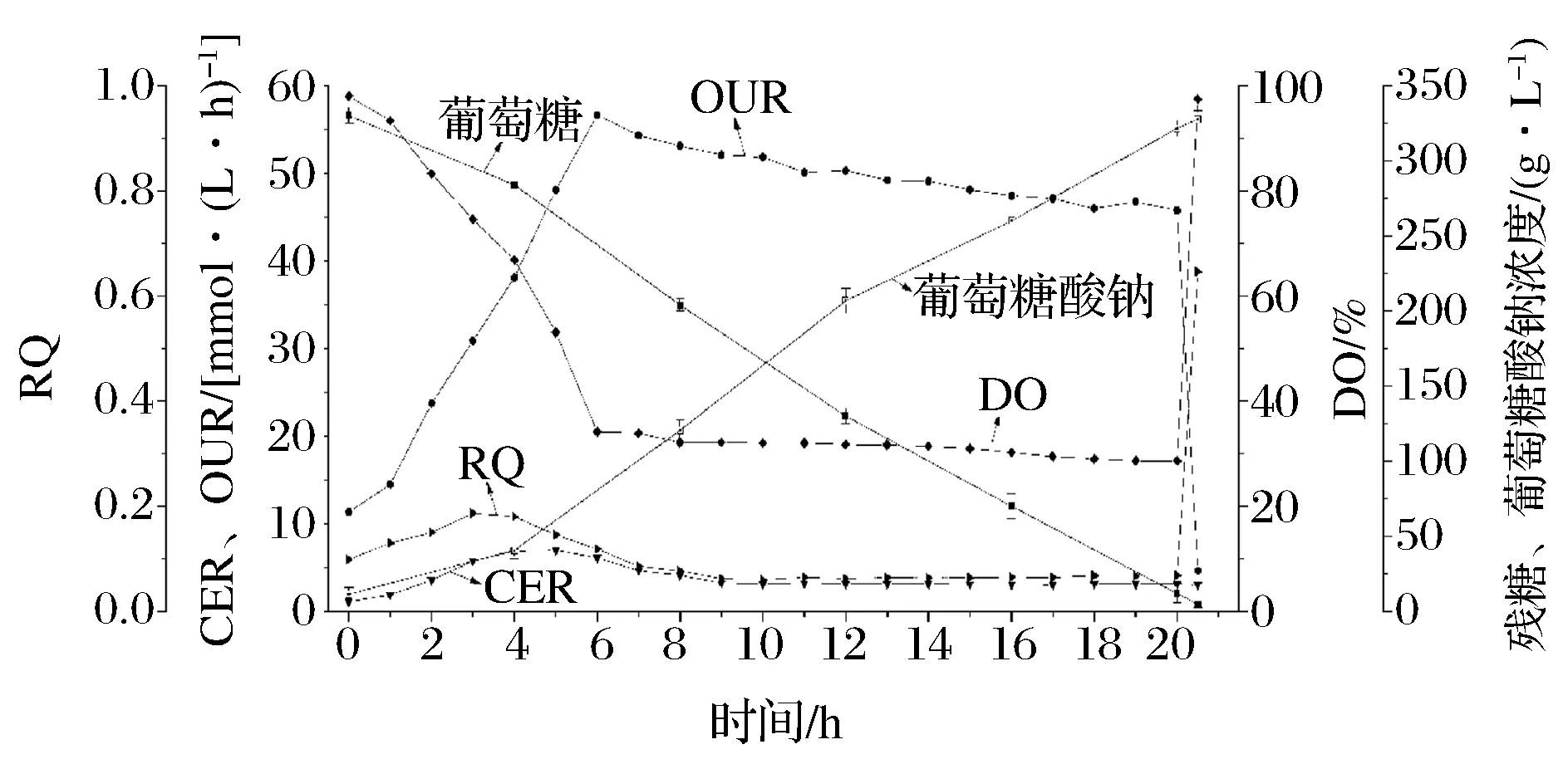
图2 黑曲霉深层发酵生产葡萄糖酸钠参数图Fig.2 Time course of on-line and off-line data of the SG fermentations process by Aspergillus niger
2.2 原始双酶法(GOD和CAT)生产SG
由于SG的生产过程本质上就胞外酶促反应,所以为直接利用葡萄糖氧化酶和过氧化氢酶进行生产SG提供了可能。按照所用酶使用说明,初始双酶法工艺保证在初期投加完所有酶液之后,能消耗完反应器内所有的葡萄糖,同时在反应结束时,关键的葡萄糖氧化酶的酶活也接近于零。反应初期,在50 L的发酵体系内初期一次性加入2.02×107U的葡萄糖氧化酶粗酶液和9.25×106U过氧化氢酶粗酶液,反应过程中不再补加任何粗酶液。整个生产过程中参数变化如图3所示。由于过程中过氧化氢酶量始终处于过量的状态,所以在整个过程中过氧化氢酶始终不是限制反应的因素。整个生产周期约为17.0 h,较图2过程缩短了3.0 h。
与黑曲霉深层发酵生产SG不同,利用双酶法生产SG不需要利用任何菌体。在反应初期加入过量的2种粗酶液之后,发酵液中所测得的酶活达到了过程的最大值,约为6 800.0 U/mL。同时OUR也升至72.7 mmol/L/h。在高的OUR条件下,反应器内底物葡萄糖快速消耗,分解成葡萄糖内酯并水解成葡萄糖酸。相应地,由于OUR数值很高,所以DO降到了整个过程的最低点,约在20.0%左右。可以注意到的是,与图2黑曲霉深层发酵过程相比,双酶法所能达到的DO的最低值更小(20.0%比30.0%),最大OUR更高(72.7 mmol/(L·h)比55.1 mmol/(L·h)),表明直接利用双酶法生产葡萄糖酸钠的临界氧浓度更低,过程中的OTR与黑曲霉深层发酵相比更高。这可能是由于直接加入反应体系内的酶蛋白在发酵液中均匀分散,而且它们直接与发酵液中的氧气接触,这大大提升了液固两相的接触面积,从而提高了过程的OTR水平[19]。
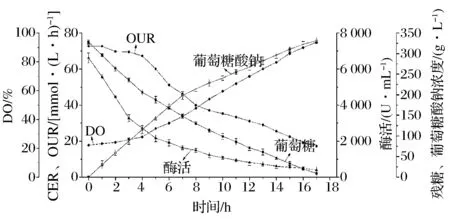
图3 原始双酶法(GOD和CAT)生产葡萄糖酸钠参数图Fig.3 Time course of comparative data of initial SG production using enzymes of GOD and CAT
如图3所示,在初期一次性加入生产所需的全部粗酶液之后,DO、OUR和酶活均达到了整个过程的最值。随着时间的推移,酶活水平不断降低,当酶活下降到2 500.0 U/mL至3 000.0 U/mL范围时,OUR开始逐渐下降,DO也逐步回升。这说明在此时的反应条件下,葡萄糖氧化酶的酶量已经开始成为了此时反应的限制性因素。而且从图3看出,当酶活成为限制性因素之后,底物葡萄糖的消耗速率以及产物SG的合成速率均有所放缓。以上几点说明,在反应初期一次性投加的葡萄糖氧化酶的酶量是过量的,大部分酶因为氧气限制并没有参与反应但是随着时间推移酶活也逐步降低,这就不可避免地造成了葡萄糖氧化酶的浪费。而酶活与OUR和DO存在一定的相互对应关系,所以提出以在线参数OUR和DO为参考标准的过程补加葡萄糖氧化酶粗酶液的双酶法生产新工艺。
2.3 利用在线参数阶段性加入葡萄糖氧化酶生产SG的双酶法新工艺
在图3所示的原始双酶法生产SG过程中,反应初期一次性投加所有的葡萄糖氧化酶,过程中前期葡萄糖氧化酶是过量的,随时间推移酶活逐渐降低,当酶活降低到一定程度时葡萄糖氧化酶的酶活会成为限制酶反应的因素。此时OUR出现回落,DO开始逐步上升。基于此点,开发了以在线参数OUR和DO为调控指标的阶段性加入葡萄糖氧化酶的双酶法生产SG的新工艺。由于现在市场过氧化氢酶价格低廉,所以在反应初期一次性加入过量的过氧化氢酶,保证在整个生产过程中过氧化氢酶不会成为反应的限制因素。而初期选择加入适量的葡萄糖氧化酶,保证在当前操作参数条件下加入葡萄糖氧化酶的量能够使OUR升至的最高点,DO跌至最低点。这时候限制反应的条件是OTR而非葡萄糖氧化酶的酶量。随着生产的进行葡萄糖氧化酶逐渐失活,OUR回落而DO上升,此时表明葡萄糖氧化酶酶活成为了反应的限制条件,此时应及时补加适量的葡萄糖氧化酶,来保证在当前设备所能提供的最大OTR条件下,最大限度达到高的OUR。
在图3中明显看出酶活低于2 500 U/mL时OUR开始明显下降,那么只要将初始酶活保持在3 000 U/mL左右就不会出现酶量限制。因此反应初期一次性添加GOD酶液7.8×106U,使初期酶活达到3 000 U/mL左右。此时可保证反应一开始便是处于供氧限制。在生产过程中出现DO逐步回升、OUR开始下降时,补充6.5×105U葡萄糖氧化酶至反应器中,随后OUR和DO快速响应,恢复至与初期相当的水平。完整生产过程如图4所示。

图4 利用在线参数阶段性加入GOD的葡萄糖酸钠生产过程Fig.4 Enzyme reaction for SG production bystepwiseaddition of GOD solution based on on-line parameters
整个反应过程中OUR始终维持在70.0 mmol/(L·h)左右,DO也稳定在20.0%上下,酶活水平始终高于2 500 U/mL。可以认为在这种操作模式下,SG始终是以当前设备供氧条件下最大的速率合成。最终整个生产过程持续12.0 h。且过程中所添加了葡萄糖氧化酶的量由原先酶法的2 100 U/g葡萄糖缩减到1 444 U/g葡萄糖,减少了31.2%。显然,改进后的双酶法生产工艺较之前的原始工艺更具优势。同时,此新工艺也已经成功推广到了工业规模,最终效果与上述结果相差无几,与生物发酵和原始酶法相比,缩短了发酵时间,提高了最终SG的得率。
2.4 生物发酵、原始双酶法和改进双酶法生产SG结果对比
3种不同的生产工艺对比如表1所示。新工艺双酶法相较于原工艺双酶法和生物发酵法,优势巨大。生产时间降低至(11.6±0.5) h,而原工艺酶法生产和生物发酵分别需要(17±0.5) h和(20.3±0.4) h,对比生产时间分别降低了31.67%和42.85%。双酶法生产中葡萄糖氧化酶均匀分撒在发酵液中,提高了液固之间传质的面积,从而提高了反应过程的OTR水平,使最大OUR能够达到72.70 mmol/(L·h)左右,而相比之下生物发酵法最大OUR只能够达到55.12 mmol/(L·h),比双酶法低了24.18%。新工艺双酶法由于始终处于操作参数条件下最大的反应速率,因此耗糖速率和产物生成速率均是3者中最高。值得注意的是,虽然2种双酶法工艺OUR峰值基本相同,但是原先工艺初期所添加的葡萄糖氧化酶是过量的,在初始葡萄糖浓度330 g/L条件下,通过合理调节过程中葡萄糖氧化酶的添加量添加时间,所需的葡萄糖氧化酶的量由原先的2 100 U/g葡萄糖缩减到1 444 U/g葡萄糖,用量减少了31.2%。由于生物发酵法中葡萄糖不仅作为底物生成葡萄糖酸,而且还要被菌体利用维持自身基本的生理代谢,所以最终得率较原始双酶法和新工艺双酶法,分别低了3.94%和4.68%。

表1 不同工艺计算的参数对比
注:发酵液的体积变化已经计算在内。
3 讨论
本文主要研究了利用在线参数OUR和DO的相关性变化,在生产过程中实时阶段性加入葡萄糖氧化酶生产葡萄糖酸钠的双酶法新工艺。新工艺避免了初期过多的葡萄糖氧化酶的浪费,阶段性地补加酶液也使整个过程酶活始终不受限,在过程中始终维持了稳定快速的耗糖速率。在50L体系初始葡萄糖浓度为330 g/L条件下,生产时间由原先酶法的17±0.5h缩短到(11.6±0.5) h,缩短了31.76%。添加葡萄糖氧化酶酶量也能由2 100 U/g葡萄糖缩减到1 444 U/g葡萄糖。过程中耗糖速率、SG生成速率和得率分别为28.55±0.70 g/(L·h)、30.66 g/(L·h)和1.176±0.009 (g/g),较原先工艺分别提高了48.31%、52.08%和0.77%。而与生物发酵相比,新工艺酶法也更有优势。整个生产时间缩短42.85%,过程中耗糖速率、SG生成速率和得率分别提高了78.55%、92.59%和4.91%。
双酶法生产SG的可行性已经得到验证,较之原生的生物发酵更具有应用前景。同时利用在线参数的相关性变化,实现了对整个生产过程实时理性的控制优化。但是现今酶液价格居高不下,成为双酶法应用到大规模工业生产中的最大障碍。生产过程阶段改善葡萄糖氧化酶的添加量和添加时间只是双酶法工艺优化中的一个方面,而过程中葡萄糖氧化酶的失活机理是一个值得关注的焦点,具有继续探究的价值。
[1] 冯文红,周生民,赵伟.发酵法生产葡萄糖酸钠过程中参数检测[J].生物加工过程,2014,12(4):20-23.
[2] 马保国,谭洪波,许永和,等.葡萄糖酸钠对水泥水化微观结构的影响[J].武汉理工大学学报,2008,30(11):50-53.
[3] TAKANO H, KONDOU R. Sodium gluconate and potassium gluconate as substitutes for sodium chloride in breadmaking[J]. Food Science and Technology Research, 2002, 8(1): 75-79.
[4] 王如伟,夏亚君,徐洪明.反相离子对色谱法测定葡萄糖酸钠含量与有关物质[J].医药导报,2008 (10):1 060-1 061.
[5] 李光兴,陈兵.葡萄糖酸盐产品研究、生产及应用[J].化学工程师,1994,(5):28-31.
[6] 陈建初,徐润秋. 我国葡萄糖酸衍生物20年的发展[J].淀粉与淀粉糖,2008(4):6-14.
[7] ANASTASSIADIS S, MORGUNOV I. Gluconic acid production[J]. Recent Patents on Biotechnology, 2007, 1(2): 167-180.
[8] MOYER A, WELSS P, STUBBS J, Herrick H, et al.Gluconic acid production development of inoculum and composition of fermentation solution for gluconic acidproduction by submerged mold growths under increasedair pressure[J]. Ind Eng Chem,1937, 29(7):777-781.
[9] HATZINIKOLAOU D, MACRIS B. Factors regulating production of glucose oxidase byAspergillusniger[J]. Enzyme and Microbial Technology, 1995, 17(6): 530-534.
[10] 李秋红,王一,崔强,等.双酶法生产葡萄糖酸钠的新工艺[J].食品工业,2016 (7): 162-164.
[11] 从浩,张兵团,罗文杰,等.酶法生产葡萄糖酸钠研究[J].现代农业科技,2014(18):263-264.
[12] 王道会,武玉民,张云鹏,等.葡萄糖酸钠酶法生产工艺研究[J].中国酿造,2015, 34(9):34-36.
[13] TIAN Xi-wei, WANG Yong-hong, CHU Ju, et al. Enhanced l-lactic acid production inLactobacillusparacaseiby exogenous proline addition based on comparative metabolite profiling analysis[J]. Applied Microbiology and Biotechnology, 2016, 100(5): 2 301-2 310.
[14] LU Fei, WANG Ze-jian, ZHAO Wei, et al. A simple novel approach for real-time monitoring of sodium gluconate production by on-line physiological parameters in batch fermentation byAspergillusniger[J]. Bioresource technology, 2016, 202: 133-141.
[15] WANG Zejian, WANG Huiyuan, LI Yongliang, et al. Improved vitamin B12 production by step-wise reduction of oxygen uptake rate under dissolved oxygen limiting level during fermentation process[J]. Bioresource Technology, 2010, 101(8): 2 845-2 852.
[16] LU Fei, LI Chao, WANG Ze-jian, et al. High efficiency cell-recycle continuous sodium gluconate production byAspergillusnigerusingon-line physiological parameters association analysis to regulate feed rate rationally[J]. Bioresource Technology, 2016, 220: 433-441.
[17] LU Fei, PING Kang-kang, WEN Ling, et al. Enhancing gluconic acid production by controlling the morphology ofAspergillusnigerinsubmerged fermentation[J]. Process Biochemistry, 2015, 50(9): 1 342-1 348.
[18] GARCIA-OCHOA F, GOMEZ E. Bioreactor scale-up and oxygen transfer rate in microbial processes: An overview[J]. Biotechnology Advances, 2009, 27(2):153-176
[19] BODIZS L, TITICA M, FARIA N, et al. Oxygen control for an industrial pilot-scale fed-batch filamentous fungal fermentation[J]. Journal of Process Control, 2007, 17(7):595-606.
A novel approach for sodium gluconate production using two-enzyme method by on-line parameter monitoring and dynamic regulation
SU Li-yu1, ZHAO Wei2, HANG Hai-feng1*, CHU Ju1*
1(State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology, Shanghai 200237, China)2(Shandong Fuyang Biological Technology Company, Dezhou 253100, China)
In this paper, much attention was paid on the on-line parameters oxygen uptake rate (OUR) and dissolved oxygen (DO) monitoring and control. Based on the changing trends of these parameters, a novel approach of sodium gluconate production was proposed by stepwise addition of glucose oxidase solution dynamically, and the activity of glucose oxidase was kept at an unlimited level during the whole production period. The results showed that in the 50 L reactor with 330 g/L initial glucose concentration, the production time was shortened form 17.0 h to 11.6 h, the yield was enhanced from 1.167 g/g to 1.176 g/g and the overall dosage of used glucose oxidase declined from 2 100 U/g glucose to 1 444 U/g glucose respectively. Compared to the biological fermentation, the novel direct enzymatic reaction displayed significant advantages. The production time was cut down by 42.85% and the yield was 4.91% higher than the traditional biological fermentation. The improved direct enzymatic production had more potential value in the further industrial application.
glucose oxidase; sodium gluconate; on-line parameters; process optimization
硕士研究生(杭海峰、储炬为通讯作者,E-mail:hanghaifeng@ecust.edu.cn;juchu@eucst.edu.cn)。
国家重点基础研究发展计划(2013CB733600);国家高技术研究发展计划(2015AA021005)
2016-12-28,改回日期:2017-02-04
10.13995/j.cnki.11-1802/ts.201706004
