Paenibacillusbovis sp. nov.BD3526作为益生菌的潜力
2017-07-31徐佳王沂翁新楚吴正钧
徐佳,王沂,翁新楚,吴正钧
1(上海大学 生命科学学院,上海,200444)2(光明乳业股份有限公司 乳业研究院,上海乳业生物工程技术研究中心,乳业生物技术国家重点实验室,上海,200436)
Paenibacillusbovissp. nov.BD3526作为益生菌的潜力
徐佳1,2,王沂1*,翁新楚1,吴正钧2
1(上海大学 生命科学学院,上海,200444)2(光明乳业股份有限公司 乳业研究院,上海乳业生物工程技术研究中心,乳业生物技术国家重点实验室,上海,200436)
对Paenibacillusbovissp. nov. BD3526作为益生菌的潜力进行了体外活性初步研究。采用模拟胃液、肠液、不同浓度的胆盐环境,测定BD3526菌株在酸性及高胆盐环境的存活率,并测试BD3526对金黄色葡萄球菌、藤黄、枯草芽孢杆菌的抑制作用。结果表明,BD3526可以耐受pH值为2.0、3.0、4.0的人工胃液、pH8.0的模拟肠液以及0.1%、0.2%、0.3%的胆盐环境;对金黄色葡萄球菌、藤黄、枯草芽孢杆菌有显著的抑制能力。说明BD3526在人工消化液环境中具有良好的存活能力,不具有溶血作用;可引起敏感菌细胞渗漏,达到杀灭部分细菌,包括金色葡萄球菌的作用,因此,该菌具备作为益生菌应用的潜力。
类芽孢杆菌BD3526;人工消化液;拮抗作用;益生菌
益生菌 (probiotics)是以活菌形式摄入一定数量后,对宿主健康具有明确改善作用的单一或组成确定的混合微生物(WHO/FAO,2002)。作为益生菌,必须无毒性、无致病作用,能耐受胃酸和胆盐,以活菌形式到达肠道,并能在消化道表面定殖。
研究表明,抗生素的广泛使用导致了抗生素相关腹泻(AAD)、抗药性等一系列不良后果。益生菌通过调节免疫、改善肠道微生态平衡、提高机体抵抗力以及治疗AAD,可以有效地减少抗生素在预防感染性疾病等方面的使用量。较其他益生菌而言,类芽孢杆菌作为益生菌具有更大的优势,如应用的安全性、抗菌活性强[1]、生长速度快、稳定性高[2]等优点,目前,我国允许使用的类芽孢杆菌数量较少,因此,开发具有益生功能的新型类芽孢杆菌成为热点。
本研究中使用的Paenibacillusbovissp. nov.BD3526(牛类芽孢杆菌)是从中国西藏的牦牛生奶中分离得到,基于16S rRNA和全基因组序列比较的系统发育分析表明,该菌株属于类芽孢杆菌属的一个新种[3]。BD3526利用麸皮可以产生具有高活力的凝乳酶,在干酪生产中具有很好的应用潜力[4],BD3526可以合成大量的左聚糖苷(levan),该多糖可以促进淋巴细胞增殖和调节细胞因子的表达,表明其具有作为天然免疫调节剂的潜力[5]。本研究采用模拟胃肠液和胆汁环境,测定BD3526菌株在胃酸和高胆盐环境下的耐受性,并对其安全性及抑菌作用进行初步研究。
1 材料与方法
1.1 实验材料
1.1.1 菌种
本研究所用菌种为Paenibacillusbovissp. nov.BD3526(CGMCC 8333=DSM 22170),指示菌为金黄色葡萄球菌(Staphylococcusaureus)CGMCC1.879,藤黄微球菌(Micrococcusluteus) CGMCC1.1848,枯草芽孢杆菌(Bacillussubtilis)CMCC63501,均由乳业生物技术国家重点实验室提供,单增李斯特菌(Listeriamonocytogenes)CGMCC1.9136。
1.1.2 培养基
TYC培养基(g/L):胰蛋白胨15,酵母抽提物5,蔗糖50,乙酸钠20,NaCl 1,NaHCO32,无水Na2SO40.1,L-胱氨酸0.2,Na2HPO4·12H2O 2。
BHI培养基(g/L):蛋白胨10、脱水小牛脑浸粉12.5、脱水牛心浸粉5.0、C6H12O62、NaCl 5、Na2HPO42.5。
营养肉汤(g/L):蛋白胨10,牛肉膏3,NaCl 5。
LB培养基(g/L):蛋白胨10,酵母抽提物5,NaCl 10。
MRS肉汤(g/L):蛋白胨10,牛肉浸膏10,酵母膏5,C6H12O620,C6H17N3O72,乙酸钠5,吐温-80 1 mL,MgSO4·7H2O 0.58,MnSO4·4H2O 0.19,K2HPO42。
TPY培养基(g/L):胰蛋白胨15,酵母提取物4、C6H12O610、KH2PO46、K2HPO4·3H2O 2、Na2CO32、NaCl 2。
TSB培养基(g/L):胰蛋白胨17.0,大豆胨3.0。
固体培养基加入1.5%的琼脂粉,培养基121 ℃高压灭菌15 min 后备用。
1.1.3 仪器与设备
PB-10 pH计,美国Sartorius公司;AVANTI J30I高速冷冻离心机,美国BECKMAN COULTER公司;HZQ-X 500C恒温振荡器、HZQ-X500C摇床,上海一恒科学仪器有限公司;恒温水浴槽,英国Grant公司;Sorvall Stratos台式高速冷冻离心机,美国Thermo公司;Bioscreen C,上海谓载商贸发展有限;Spectra M5酶标仪,美国Molecular Devices公司;HVE-50高压蒸汽灭菌锅,HIRAYAMA公司。
1.2 实验方法
1.2.1 最适生长培养基的筛选
Paenibacillusbovissp. nov.BD3526以相同接种量接种于不同培养基中,每隔30 min用Bioscreen C测定OD600值,共测24h。以培养时间为横坐标,OD600为纵坐标绘制生长曲线。
1.2.2 胃液肠液耐受性试验
10%的HCl加PBS(g/L,NaCl 8、KCl 0.2、Na2HPO41.44 和KH2PO40.24),使pH 值分别为2、3、4, 在100 mL PBS溶液中加0.3 g胃蛋白酶(800~2 500 U/mg,Sigma,USA),充分溶解后用0.22 μm的微孔滤膜过滤除菌作为人工胃液[6]。每100 mL PBS(pH 7.8)中加入0.1 g胰蛋白酶(250 U/mg,Sigma,USA)充分溶解后用0.22 μm微孔滤膜过滤除菌作为模拟小肠液[7]。
将收集的细胞重悬于无菌生理盐水(0.85% NaCl,w/v)中。将细胞数调节至1×109CFU/mL至模拟胃液(pH 3.0)。在37℃下孵育1、2和3 h。胃液处理3 h后,将1 mL培养物转移到9 mL模拟肠液(pH 8.0)中,并在37℃孵育。为了评价小肠运输耐受性,在2、4和8 h后取出1 mL培养物,进行活菌计数[8],按公式(1)计算存活率,其中每个样品做3个重复。
(1)
式中:A1,胃液/肠液处理组的活菌数;A0,初始时的活菌数。
1.2.3 最低胆盐抑菌浓度(MIC)的测定
将BD3526接种至胆盐含量为0.1%~1%的TYC固体培养基,30 ℃好氧培养,观察其生长状况。
1.2.4 胆盐耐受性
在生理盐水中添加浓度分别为0.1%、0.2%、0.3%的猪胆盐[9],过滤除菌后,加入新鲜制备的BD3526菌悬液,调节活菌浓度在1×108CFU/mL左右,37℃下孵育6 h。按一定时间取样,进行10倍系列稀释,采用TYC琼脂30℃培养48 h,进行活菌计数。按公式(2)计算BD3526在不同浓度胆盐的存活率,每个样品做3个重复。
(2)
式中:B1,添加特定浓度胆盐后处理组的活菌数;B0,在该浓度胆盐BD3526的初始活菌数。
1.2.5 溶血性试验[10]
将保存在-80℃的Paenibacillusbovissp. nov. BD3526采用TYC固体培养基30 ℃,24 h活化,活化3代后,接种于血平板,30 ℃好氧培养24 h,观察是否有溶血圈出现。
1.2.6 抑菌活性的测定
采用双层琼脂平板法对Paenibacillusbovissp. nov. BD3526进行抑菌活性的测定。将BD3526点种在特定平板中央,培养24 h后,将混有指示菌的半固体培养基覆盖在其表面,使最终指示菌浓度为106CFU/mL左右,37℃培养24 h,观察结果。
1.2.7Paenibacillusbovissp. nov. BD3526对金黄色葡萄球菌生长的抑制作用
向蜂窝板中分别加入TSB液体培养基150 μL,接入处于对数生长期的BD3526菌液25 μL(108CFU/mL),金黄色葡萄球菌菌液25 μL(108CFU/mL)。BD3526对金黄色葡萄球菌生长采用Bioscreen C系统以及与之相连的EZExperiment软件来监测。在Bioscreen C系统中将细菌培养温度设定为37℃,每隔30 min记录1次OD600值。
1.2.8 细胞外核酸蛋白的检测
取培养至对数期的Paenibacillusbovissp. nov. BD3526种子液10 mL,离心取上清,用0.22 μm微孔滤膜过滤除菌作为样品。取培养至对数期的金黄色葡萄球菌10 mL,离心收集菌体,重悬于BHI培养基中。然后将5 mL BD3526种子液上清、5 mL金黄色葡萄球菌菌悬液与10 mL BHI培养基在100 mL的三角瓶中混合,调整金黄色葡萄球菌菌浓度为108CFU/mL,以无菌水代替BD3526种子液上清作对照,37 ℃恒温培养。每30 min取1 mL菌液,离心取上清,用酶标仪测定OD260和OD280值,共测量6 h。以时间为横坐标,OD值为纵坐标,绘制核酸/蛋白释放曲线。
1.2.9 数据统计分析
采用Excel进行数据前处理,用SPSS 12. 0统计软件进行统计分析。
2 结果与分析
2.1Paenibacillusbovissp. nov.BD3526最适生长培养基的筛选
通过比浊法对BD3526在不同的培养基中的生长状况进行比较,以培养时间为横坐标,OD600为纵坐标绘制生长曲线,筛选出最适合BD3526生长的培养基,如图1,BD3526在TYC培养基中生长状态最佳,8 h左右进入对数期,18 h左右进入稳定期,到24 h培养结束。通过活菌计数,TYC、BHI培养基中活菌浓度可以达到109CFU/mL,活菌数高于其他培养基,而BD3526在TSB中出现缓慢的生长,在MRS培养基中则不生长。因此,在后续研究BD3526耐受人工消化液及抑菌作用中,选取TYC、BHI和TSB作为主要的培养介质。

图1 P.bovis sp. nov. BD3526在不同培养基中的生长曲线Fig.1 Growth curve of P.bovis BD3526 in different media
2.2 耐胃酸、肠液试验结果
人体消化道的正常pH值范围为2~8[11],其中,胃液的pH值在进食前后变化很大,空腹时的极端pH值可低至1.5。因此,作为益生菌,首先需要具有耐受胃酸环境的能力。人体的消化过程一般为4 h左右,其中,食物在胃部的排空时间为2 h左右,因此,选取3种不同pH值的胃液(pH2~4)处理3 h,来观察BD3526在人工胃肠液中的存活性能。
食物由胃进入小肠后,即开始小肠内的消化,小肠内消化是整个消化过程中重要的阶段, 也是各种益生菌制剂发挥作用的场所。小肠液的pH约为pH7.6,益生菌只有经受住小肠液的作用、保持一定数量的存活菌数时才能发挥作用。本实验取处理3 h后pH3的胃液0.5 mL,加入4.5 mL模拟小肠液,从而考察BD3526对肠道环境的耐受性,经过肠液处理4h,观察BD3526存活情况。
表1试验结果表明:在低pH值胃液中,随着处理时间延长,BD3526的活菌数呈减少趋势,pH值越低,BD3526活菌数下降越明显。经pH4.0的胃液处理3h后,BD3526存活率达到93.14%,pH3条件下,存活率达到90.36%,pH2条件下,存活率达到87.97%,说明BD3526对胃酸环境具有一定的耐受性。将经过不同pH值胃液处理后的BD3526细胞,进一步采用人工肠液处理,结果见表2。随着处理时间的增加,BD3526的活菌数变化并不明显,表明BD3526具有良好的肠道耐受性能。

表1 不同pH模拟胃液中P.bovis sp. nov. BD3526的存活情况

表2 人工肠液中P.bovis sp. nov. BD3526的存活情况
2.3 耐胆盐试验结果
2.3.1 MIC值
表3试验结果表明,BD3526在不同胆盐添加量的TYC固体平板上生长5d后,其在0.1%~0.5%胆盐含量范围内均可以生长;而高于0.5%胆盐含量,菌体的生长则被抑制。因此,BD3526菌体最多可以耐受0.5%的胆盐含量。
2.3.2 胆盐耐受性
BD3526摄入后必须经过人体的高胃酸环境和十二指肠的高胆盐环境,才能充分发挥它们的益生效应,维持人体肠道菌群平衡[12]。十二指肠的胆盐浓度为0.3~3 g/kg[13],而食物通过十二指肠的时间相对极短,因此人的胃肠道属于高酸高胆汁盐环境[14]。胆盐为人体肝脏分解胆固醇时所产生的一种表面活性剂,其功能为帮助脂肪及脂溶性维生素的消化吸收,但胆盐浓度过高会抑制体内微生物的生长活动。对益生菌而言,耐受体内高胆盐环境、以活菌形式进入肠道是一个非常关键的特性。

表3 胆盐的最低抑菌浓度值
人体不同部位胆汁酸的浓度会有一定的变化,通常为0.3%~0.5%,因此,通常将耐受0.3%胆盐含量作为选择益生菌的标准之一。人体内存在多种类型的胆盐,主要为牛磺胆盐和甘氨胆盐。该实验模拟人体的高胆汁环境,设定培养时间6 h,研究BD3526对胆盐环境的耐受性。

表4 不同浓度胆盐环境中P.bovis sp. nov.BD3526的存活情况
试验结果如表4所示,在不同胆盐添加量下,BD3526经胆盐处理,活菌数较对照组有下降趋势,但下降并不明显,在0.3%胆盐环境下处理6 h后,BD3526存活率仍高达90.13%。结果表明BD3526对人体消化系统的高胆盐环境具有一定的耐受力,可以到达并定殖于动物肠道,从而发挥其促进作用。
2.4 溶血性
检测Paenibacillusbovissp. nov. BD3526的溶血性。由图2可见,BD3526菌落周围没有出现溶血圈,初步表明其具有一定的安全性。
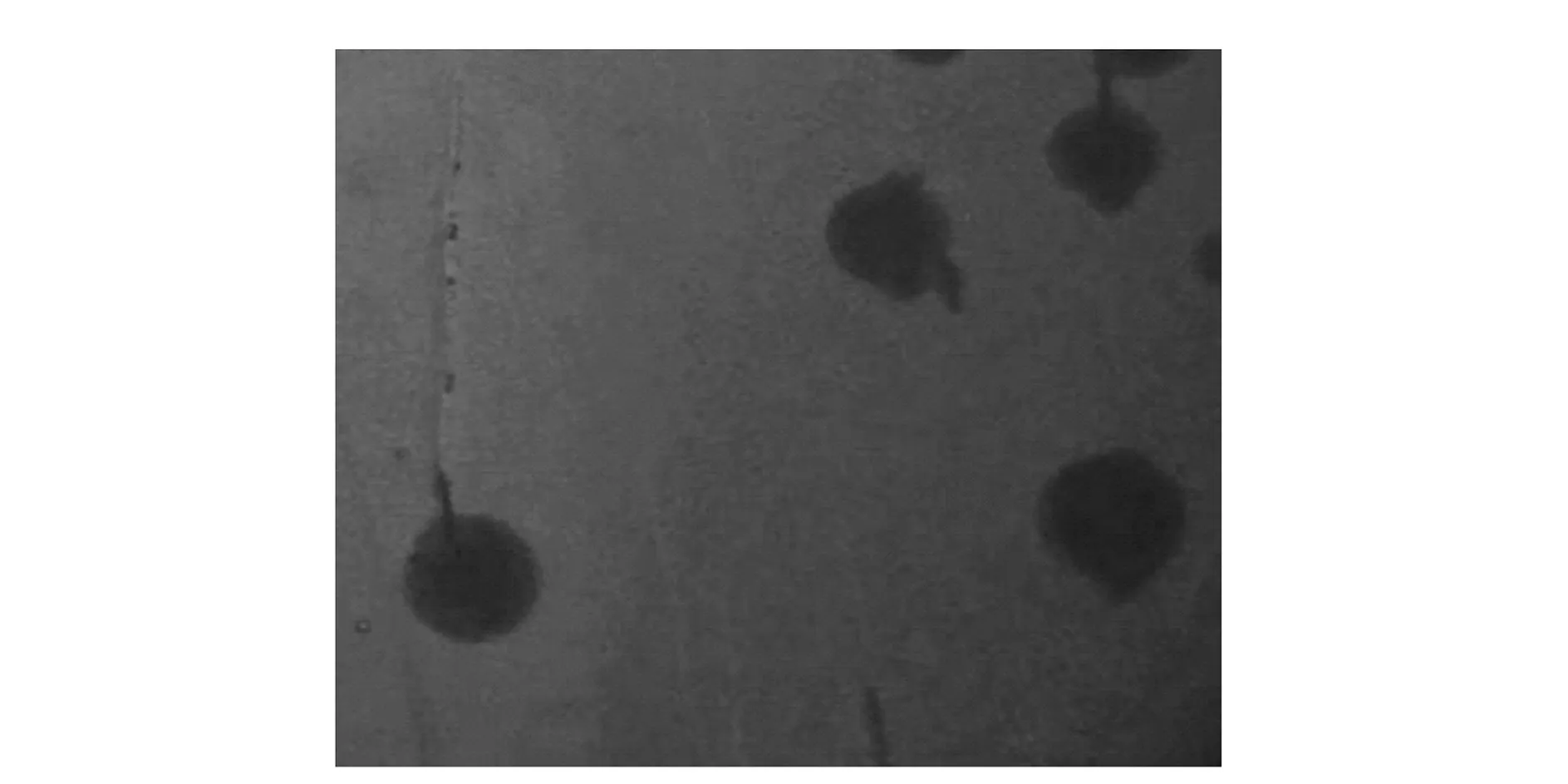
图2 P.bovis sp. nov. BD3526不产生溶血现象Fig.2 No hemolytic activity was observed for P.bovis BD3526 on blood agar
2.5 抑菌性
2.5.1 抑菌活性的测定
采用双层琼脂平板法,将BD3526点种在平板中间,调整指示菌浓度在106CFU/mL,恒温培养24h,观察其抑菌效果。由图3可见:BD3526对金黄色葡萄球菌、藤黄微球菌、枯草芽孢杆菌、单增李斯特菌均有明显的抑制效果。
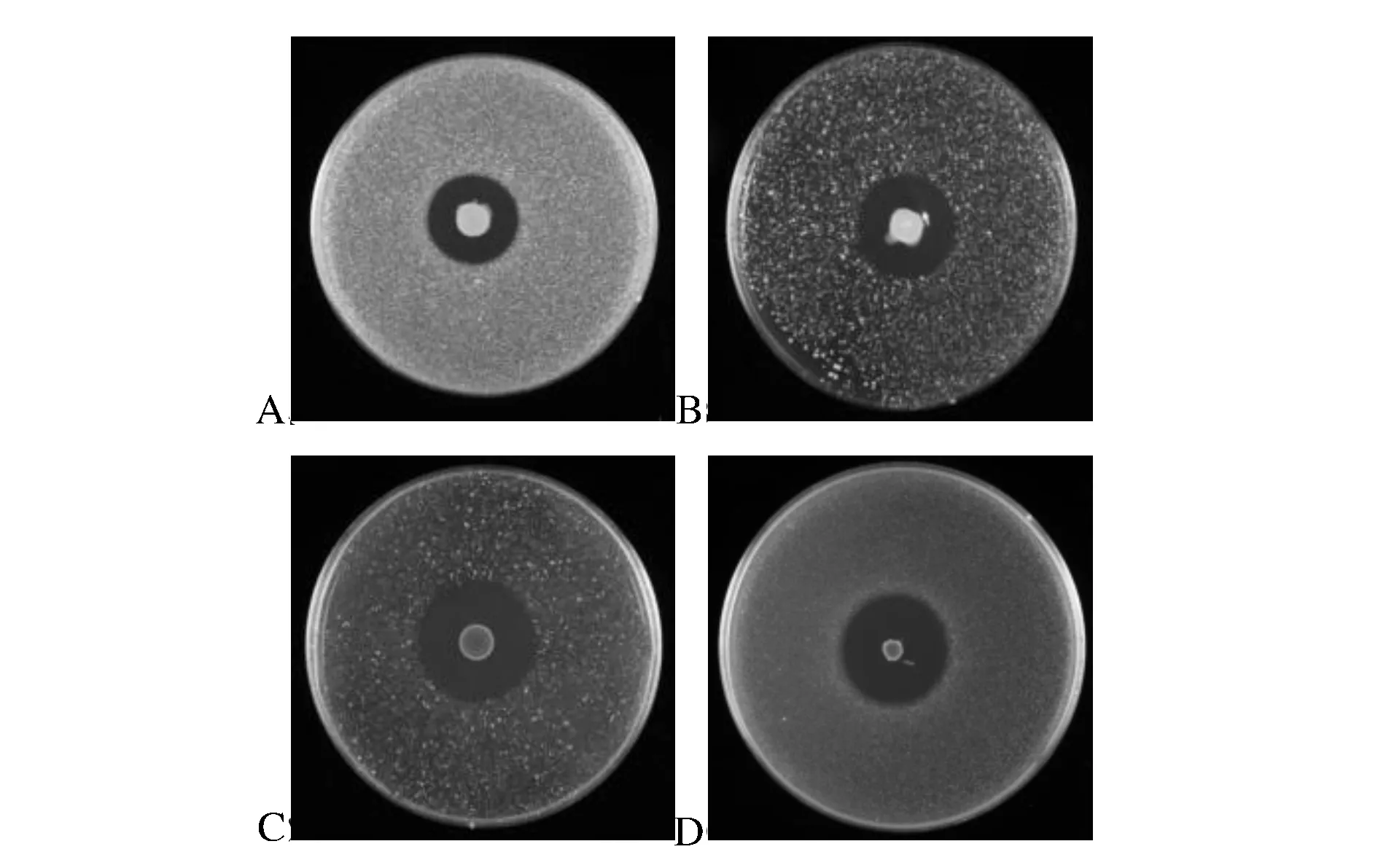
A-金黄色葡萄球菌;B-藤黄微球菌;C-枯草芽孢杆菌;D-单增李斯特菌图3 P.bovis sp. nov. BD3526对不同细菌的拮抗作用Fig.3 Antagonistic activity of P.bovis BD3526 against some other bacteri
2.5.2 对金黄色葡萄球菌生长的影响
益生菌可以通过多种方式拮抗其他微生物。目前认为,在肠道微生态系统中,益生菌可通过产生有机酸、细菌素及过氧化氢等物质抑制病原菌,或通过空间占位、营养竞争、替代和排斥等方式,减少肠道病原菌对肠道上皮组织的吸附,从而降低肠道疾病的发生。刘玉娟[15]等研究表明,Paenibacillusbovissp. nov. BD3526可以产生一种细菌素类的物质抑制藤黄球菌的生长。图4表明,在TSB培养基中,当BD3526与金黄色葡萄球菌共培养时表现出明显的拮抗作用,可以抑制金黄色葡萄球菌的生长。

图4 P.bovis sp. nov. BD3526对金黄色葡萄球菌生长的影响Fig.4 P.bovis BD3526 influence on the growth of Staphylococcus aureus
2.6 细胞外核酸蛋白的检测
经上清处理后的胞外核酸和蛋白含量变化曲线见图5。在0~1.5 h,与对照组相比,OD260与OD280值均无明显变化,表明在此阶段金黄色葡萄球菌菌体细胞膜仍然保持完整性,胞内物质没有外泄;1.5 h后,OD260与OD280明显上升趋势,表明在此阶段菌体细胞膜可能受到破坏,导致细胞内的核酸和蛋白质外漏。由此得出,BD3526可能是通过作用金黄色葡萄球菌的细胞膜,使其形成孔洞,造成细胞内物质外泄,从而起到杀菌的作用。

图5 胞外核酸、蛋白含量的变化Fig.5 Changes of extracellular nucleic acid and protein
3 讨论
益生菌是指当摄入足够量时能对人体产生有益作用的活的微生物,益生作用包括缓解乳糖不耐受、调节胃肠道菌群平衡、降低血液胆固醇水平、调节机体免疫力等。根据世卫组织(WHO/FAO)对益生菌的定义,只有满足如下要求的菌株才能称之为益生菌,包括:胃酸耐受性、胆汁酸抗性、对黏液或人上皮细胞的黏附能力、对潜在致病菌的抑菌能力、降低病原菌在表面黏附的能力、胆汁盐水解能力等。
益生菌要进入消化道起作用,首先应该能够耐受较低pH值的酸性环境。由肝脏分泌到十二指肠的高浓度胆盐具有抗菌活性,对细胞膜有很强的破坏力,它的疏水作用可导致膜蛋白离解和细胞膜破裂。故益生菌要顺利进入动物肠道,除具有可耐受胃中低pH值的能力外,还需具备耐受小肠中胆汁等形成的高渗透压环境的能力,小肠中胆汁盐含量在0.03%~0.3%波动。本试验中BD3526对胃酸、肠液和胆盐都表现出较强的耐受性,将能够存活到达肠道。
溶血性是体外评价菌株安全性的重要指标之一[16]。根据菌株不同的溶血特征可将溶血性分为两类:α溶血,其特点是菌落周围出现草绿色溶血圈,对人体的致病力差;β溶血,其特点是菌落周围出现透明的溶血圈,对人体的致病力强。若未有溶血性,则是没有溶血圈出现的γ溶血。本实验发现BD3526无溶血圈出现,说明BD3526不具有溶血性。ARGYRI[17]的试验发现4株乳杆菌虽具有较强的生物活性,但出现α溶血,不具备安全性,不可以作为益生菌使用。
在前期刘玉娟[15]等报道的基础上,本研究进一步探索了BD3526对胃酸、人工消化液耐受性、溶血作用及对部分细菌的拮抗作用。结果表明,BD3526不具有溶血作用,初步表明其具有较高的安全性;同时,BD3526表现出良好的耐受胃肠道环境的性能,可以通过使敏感菌细胞渗漏,具有抑制或杀灭包括金色葡萄球菌在内的部分细菌。因此,Paenibacillusbovissp. nov. BD3526具备作为益生菌的潜力。
[1] HONG H A, LE H D, CUTTING S M. The use of bacterial spore formers as probiotics[J]. Fems Microbiology Reviews, 2005, 29(4):813-835.
[2] 郭小华,赵志丹.饲用益生芽孢杆菌的应用及其作用机理的研究进展[J].中国畜牧兽医,2010,37(2):27-31.
[3] GAO Cai-xia,HAN Jin,LIU Zhen-min,et al.Paenibacillusbovissp. nov., isolated from raw yak (Bos grunniens) milk[J]. International Journal of Systematic and Evolutionary Microbiology,2016,66(3):1 413-1 418.
[4] HANG Feng,HONG Qing,TAO Yuan,et al.High milk-clotting activity expressed by the newly isolatedPaenibacillusspp. strain BD3526[J].Molecules, 2016,21(1):73.
[5] XU Xiao-fen,GAO Cai-xia,LIU Zhen-min, et al. Characterization of the levan produced byPaenibacillusbovissp. nov BD3526 and its immunological activity.[J].Carbohydrate Polymers,2016,144:178-186.
[6] 中华人民共和国卫生部.中华人民共和国药典[M].广州:广东科技出版社,1995 .
[7] HUANG Y,ADAMS M C.Invitroassessment of the upper gastrointestinal tolerance of potential probiotic dairy propionibacteria.[J]. International Journal of Food Microbiology, 2004, 91(3):253-260.
[8] GUO Zhuang,WANG Ji-cheng,Yan Li-ya,et al.Invitrocomparison of probiotic properties ofLactobacilluscasei, Zhang, a potential new probiotic, with selected probiotic strains[J]. LWT - Food Science and Technology,2009,42(10):1 640-1 646.
[9] Marie-Agnès T,Cissé S,Séverine Z,et al.Deconjugatedbile salts produced by extracellular bile-salt hydrolase-like activities from the probioticLactobacillusjohnsoniiLa1 inhibit giardia duodenalisinvitrogrowth[J].Frontiers in Microbiology,2016,7.ooL:10.3389/fnucb.2016.01453.
[10] 苏本宪.乳杆菌对Staphypococcusaureus和Streptococcuspyogenes抑菌作用的研究[D].哈尔滨:东北农业大学,2014:47.
[11] 王素英,王翠英,王敏.耐胆酸盐、降胆固醇乳酸菌的筛选[J].中国乳品工业,2004,32(2):14-16.
[12] SHEEHAN V M,Ross P,Fitzgerald G F.Assessing the acid tolerance and thetechnological robustness of probiotic cultures for fortification infruit juices[J]. Innovative Food Science and Emerging Technologies,2007,8(2):279-284.
[13] 曾小群,潘道东,杨瑶,等.一株高效降解胆固醇乳酸菌的筛选鉴定及其益生潜能初探[J].食品科学,2009,30(21):241-245.
[14] GUGLIELMOTTI D,MARCO M B,VINDEROLA C,et al. SpontaneousLactobacillusdelbrueckiiphage-resistant mutants with acquiredbile tolerance[J].International Journal of Food Microbiology,2007,119(3):236-242
[15] 刘玉娟,韩瑨,吴江,等.类芽孢杆菌BD3526抑菌活性物质的初步分离及性质测定[J].天然产物研究与开发,2015,27(7):1 176-1 180.
[16] 孟祥晨,李雪,姚蕾,等.两株植物乳杆菌作为潜在益生菌的体外评价[J].东北农业大学学报,2015,46(9):44-51.
[17] ARGYRI A A,ZOUMPOPOULOU G,KARATZAS K A G,et al.Selection of potential probiotic lactic acid bacteria from fermented olives byinvitrotests[J].Food Microbiology,2013,33(2):282-291.
Assessment ofPaenibacillusbovissp.nov. BD3526 as a potential probioticsinvitro
XU Jia1,2,WANG Yi1*,WENG Xin-chu1,WU Zheng-jun2
1(School of Life Sciences,Shanghai University,Shanghai 200444,China)2(State Key Laboratory of Food Science and Technology,Shanghai Engineering Research Center of Dairy Biotechnology,Research Institute of Bright Dairy and Food Co. Ltd.,Shanghai 200436,China)
To investigate the potential ofPaenibacillusbovissp.nov. BD3526 as a probioticsinvitro, the growth of the strain BD3526 in different media, i.e. TYC and BHI broths was investigated. The survivals of BD3526 cells under different levels of bile salts (0.1% to 0.3% (w/v)), in simulated gastric juice with varied pH values (pH 2 to 4) and in simulated intestinal juice were determined. Furthermore, the mechanism involved in the antagonistic activity of the strain BD3526 againstStaphylococcusaureusthrough lysis of the indicator cells was also assayed. BD3526 displayed strong antagonistic activity to some bacteria including opportune pathogen, e.g.Staphylococcusaureusand good survival ability in simulated gastric juice as well as intestinal juice. No hemolytic activity was observed for the strain BD3526 on blood agar.Paenibacillusbovissp.nov. BD3526 was demonstrated to be a potential probiotics.
Paenibacillusbovissp.nov. BD3526;simulated gastrointestinal juice;antagonistic;probiotics
硕士研究生(王沂博士为通讯作者,E-mail:wangyi201@163.com)。
“十二五”国家科技支撑计划课题:发酵乳制品乳酸菌菌种与发酵剂的研究与开发(2013BAD18B01) ;上海市科委项目:上海乳业生物工程技术研究中心(16DZ2280600);上海市闵行区重大产业技术攻关项目:无添加发酵乳的研究与开发(2015MH093)
2017-01-11,改回日期:2017-02-08
10.13995/j.cnki.11-1802/ts.201706003
