酿酒酵母孢子表面展示系统的构建及应用*
2017-07-31乔颍鑫李子杰中西秀树高晓冬
乔颍鑫,李子杰,中西秀树,高晓冬
(江南大学 生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)
酿酒酵母孢子表面展示系统的构建及应用*
乔颍鑫,李子杰,中西秀树,高晓冬*
(江南大学 生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)
旨在建立1种酿酒酵母孢子表面展示系统,并将其应用于稀有糖合成。表面展示系统是运用微生物自身功能把外源蛋白或多肽展示在细胞表面,文中用磷酸甘油氧化酶(GPO)来验证酿酒酵母孢子表面展示系统的可行性。将编码肺炎链球菌来源的GPO的基因glpo与信号肽序列(ss)融合后连接到载体pRS424-TEFpr上,将重组质粒pRS424-TEFpr-ss-glpo转化至酿酒酵母野生型及缺陷型菌株中并进行产孢,通过荧光观察、western blot分析以及酶活测定,表明酿酒酵母缺陷型孢子可以实现蛋白的表面展示。通过对GPO孢子表征,表明GPO孢子在pH为7.0、温度为30℃时活性最高,该孢子作为催化剂可以重复使用,当使用第3次时,活性可达最大活性的40%。最后将GPO孢子应用于“一锅四酶法”进行稀有糖L-果糖的合成,转化率为12%。
孢子表面展示;磷酸甘油氧化酶;酿酒酵母;稀有糖
表面展示系统是运用微生物自身功能把外源蛋白或多肽展示在细胞表面,从最早的噬菌体表面展示到细菌、杆状病毒,再到目前应用广泛且安全性高的酵母表面展示,表面展示系统取得了较大进展[1-2]。而关于利用酿酒酵母孢子来进行表面展示的方法还未见报道。
酿酒酵母在以醋酸盐为唯一或主要碳源,并辅以缺乏氮源等特定条件下,就会以孢子生殖的方式进行繁殖,在胞内形成孢子[3]。孢子壁具有4层结构,由里到外依次为甘露糖蛋白层、葡聚糖层、壳聚糖层以及二酪氨酸层[4-5]。较酿酒酵母营养细胞壁来说,孢子壁外层多壳聚糖层和二酪氨酸层,由于壳聚糖层的蛋白交联作用及致密网状结构二酪氨酸层的拦截作用,在酵母孢子中表达分泌蛋白或带有分泌型信号肽的非分泌蛋白时,蛋白会被固定到孢子表面[6](如图1)。孢子壁的合成是有顺序的,比如最外层二酪氨酸层只有在次外层壳聚糖层形成后才开始合成[7-8]。利用孢子壁合成的这一特点,实验室前期构建了一系列研究孢子壁的缺陷型菌株,本实验中利用dit1缺陷型菌株来构建孢子表面展示系统,基因DIT1参与二酪氨酸层合成途径中的第1步反应,当敲除该基因就会导致孢子二酪氨酸层的消失[9],将壳聚糖层暴露在孢子表面,形成“孢子壳聚糖球”[6]。
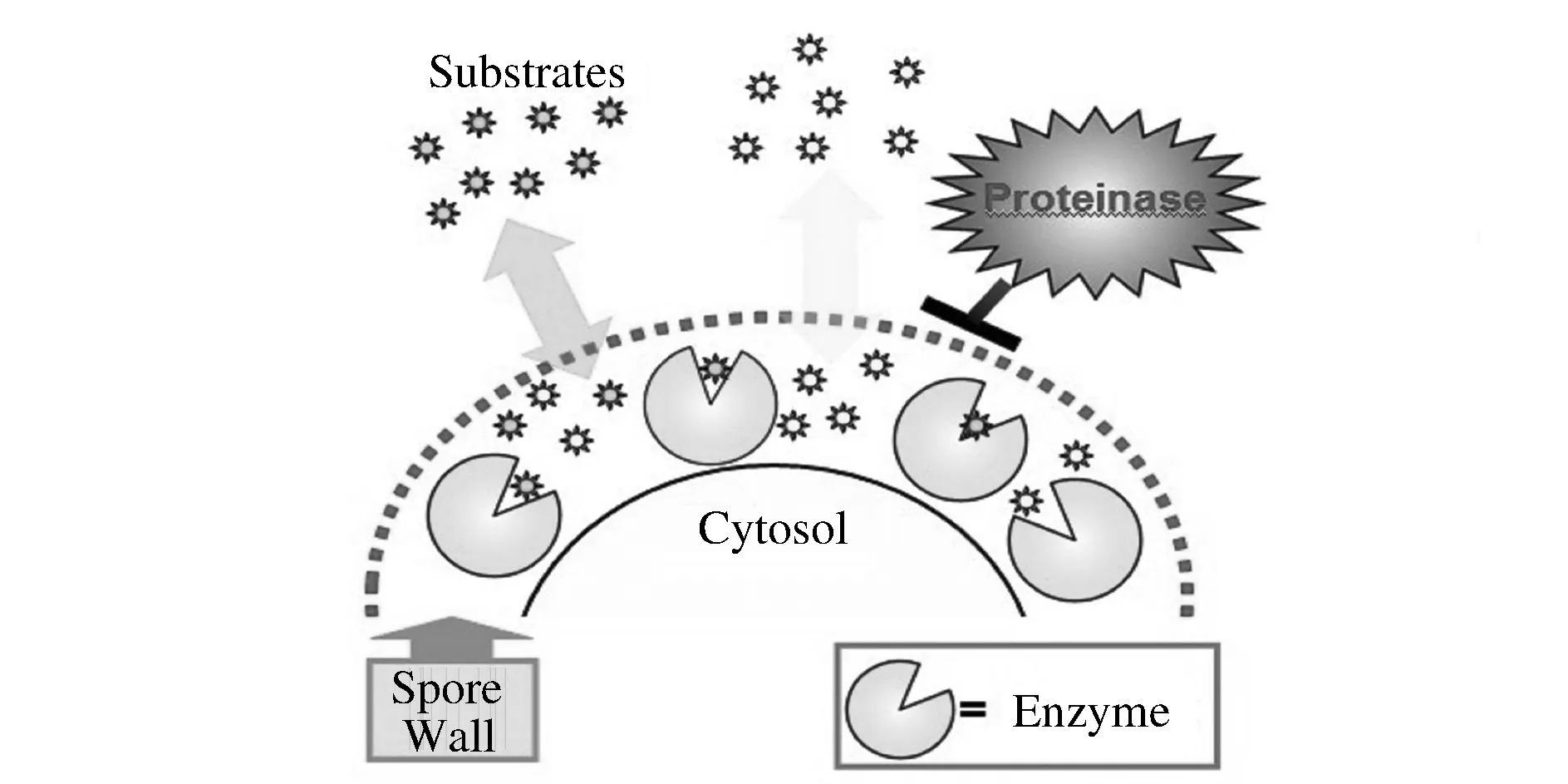
图1 酿酒酵母孢子壁的固定原理图Fig.1 The immobilization theory of S. cerevisiae spore wall
磷酸甘油氧化酶(glycerophosphate oxidase, GPO, E.C 1.1.3.21)能够专一地催化L-3-磷酸甘油的氧化,生成磷酸二羟丙酮(dihydroxyacetone phosphate, DHAP)。GPO普遍存在于链球菌、乳酸菌、大肠杆菌及昆虫飞行肌等[10]。国内对GPO的研究甚少,国外主要研究了来自于粪链球菌、肠球菌等的GPO的特性、结构、固定化等[11-15]。
稀有糖为自然界中存在但含量很低的单糖及其衍生物[16],在食品、医药、保健等领域具有广泛的应用前景[17-18]。据推测,自然界中约存在50种稀有糖,目前发现的约有34种。研究的较多的有L-果糖、L-塔格糖、D-阿洛酮糖、D-山梨糖。这些稀有糖非常适用于糖尿病和肥胖症患者[19-20],可以用来作为功能性的甜味剂[21-23],都可作为前体物质用于工业合成,生产医药及化妆品等有生物活性的化合物[24-26],另外,L-果糖还可以作为各种糖苷酶的抑制剂[27]。在前期工作中,我们基于包括GPO和DHAP依赖型醛缩酶在内的“一锅四酶法” 策略进行了一系列稀有糖的合成[28-30]。本研究拟以肺炎链球菌来源的GPO作为模型,利用酵母dit1Δ突变菌株初步构建GPO孢子表面展示系统并研究其在稀有糖合成中的应用。
1 材料与方法
1.1 菌株和质粒
实验中所用菌株和质粒分别见表1和表2。

表1 实验所用的酿酒酵母菌株

表2 实验所用的质粒
1.2 培养基
(1)SD培养基:无氨基酸酵母氮源(YNB)6.7 g/L,色氨酸缺陷型粉末2 g/L,葡萄糖 20 g/L,琼脂粉20 g/L(固体培养基),湿热灭菌(121℃,20 min);
(2)YPACe培养基:酵母膏20 g/L,蛋白胨10 g/L,腺嘌呤30 mg/L,乙酸钾20 g/L,湿热灭菌(121℃,20 min);
(3)乙酸钾液体培养基:乙酸钾 20 g/L。
1.3 主要仪器与试剂
超声破碎仪南京新辰生物科技公司;SDS-PAGE 凝胶电泳仪、半电转仪购,美国伯乐公司;ImageQuantTMLAS 400 mini,美国GE;荧光倒置显微镜,日本尼康公司;冷冻干燥机,日本EYELA;BSZ-100自动部份收集器、HL-2恒流泵,上海沪西分析仪器厂;冷却水循环装置CCA-1111、旋转蒸发仪、冷冻干燥机,日本东京理化公司。
限制性内切酶、DNA T4连接酶及KOD DNA 聚合酶购于TaKaRa公司(大连);DL-3-磷酸甘油(DL-glycerol 3-phosphate magnesium salt hydrate)、磷酸甘油脱氢酶(GDH)、酸性磷酸酶(acid phosphatase from sweet potato)、过氧化氢酶 (catalase)购于Sigma-Aldrich;ClarityTMWestern ECL Substrate 显色剂、还原型辅酶Ⅰ二钠盐(NADH)购于碧云天生物技术研究所;Rabbit anti-FLAG 一抗、Goat anti-rabbit IGg,HRP 二抗购于北京全式金生物技术有限公司;氧气购于新南气体;L-鼠李树胶糖-1-磷酸醛缩酶(L-rhamnulose-1-phosphate aldolase, RhaD)为实验室前期纯化。
1.4dit1Δ菌株的构建
DIT1基因的敲除过程如下:以pFAa-HIS3MX6为模板,AATTTGTTAATATCCTAATTCGGTAAA ̄G ̄C ̄T ̄T ̄T ̄G ̄T ̄C ̄G ̄AGACATTAACAAAACGGATCC ̄C ̄C ̄G ̄G ̄G ̄T ̄T ̄A ̄A ̄T ̄T ̄AA和TGTTTAAGTAAAAGAACAAAAAGGT ̄A ̄G ̄A ̄C ̄C ̄AATGTAGCGCTCTTACTTTAGAATTCGA ̄G ̄C ̄T ̄C ̄G ̄T ̄T ̄T ̄A ̄AAC为引物进行PCR,将得到的PCR片段整合到单倍体AN117-4B和AN117-16D中,涂布在选择性平板SD-HIS上,选择菌落提基因组进行验证。敲除成功后,将获得的缺陷型单倍体菌株融合为二倍体。验证引物为CATAAATTGTGCTCCTCCGC和CA ̄T ̄T ̄G ̄C ̄A ̄G ̄TGT ̄C ̄T ̄C ̄G ̄A ̄A ̄A ̄CC。
1.5 酵母产孢及孢子破碎
将含有相应重组质粒的酵母转化子,接种到5 mL 相应的SD液体培养基中,在30 ℃下摇床过夜培养,然后取3 mL过夜培养液转接到30 mL YPAce培养基中,在30 ℃下摇床培养20 h,然后离心收集所有菌体,用无菌去离子水洗涤2次,转接到20 mL 2% 乙酸钾培养基中,30 ℃下摇床振荡培养1 d左右得到成熟的孢子。
为了得到单个的孢子,需要将上述培养好的子囊孢子进行酶处理和超声破碎。具体过程如下:5 000 r/min 离心1 min收集子囊孢子,将所有细胞重悬于2 mL 原生质体缓冲液(50 mmol/L pH 7.5 的PBS,1.4 mol/L山梨醇和40 mmol/L β-巯基乙醇)中,充分混匀后,加入20 μL β-葡聚糖酶溶液(5 mg β-葡聚糖酶溶在500 μL 50% 甘油),30 ℃摇床振荡2 h。8 000 r/min 离心1 min 收集处理过的细胞,弃掉上层清液,得到的细胞沉淀用原生质体缓冲液洗涤2次,重悬于原生质体溶液中充分混匀,最后用超声破碎仪破碎获得单个孢子。将超声破碎得到的单个孢子进行离心,用无菌水洗涤2遍,最后溶于适量无菌水,进行冷冻干燥得到干燥的孢子粉末。
1.6 孢子荧光观察
取500 μL成熟孢子的培养液置于1.5 mL离心管中,5 000 r/min离心30 s,弃掉上清,用1×PBS洗涤2次,最后用1 mL 1×PBS重悬,取5 μL 酵母孢子重悬液滴于纯净的载玻片上,盖上盖玻片,倒置于尼康荧光倒置显微镜下,使用100×油镜观察。图像利用NIS-Element AR软件分析。
1.7 Western blot 分析GPO在孢子细胞表面的表达
(1)蛋白样品的获得。将含有质粒pRS424-TEFpr-ss-glpo-flag的野生型菌株接种到5 mL SD-TRP液体培养基中,30 ℃下摇床过夜培养,取2 mL培养液转接到 20 mL SD-TRP中,培养20 h,测其OD值,计算总菌体数量,离心收集菌体及发酵液;同时取3 mL培养液转接到 30 mL YPAce培养基中,在30 ℃下摇床培养20 h,测其OD值,取与营养细胞相同菌体量离心收集,用无菌去离子水洗涤2次,转接到20 mL 2% 乙酸钾培养基中,30 ℃下摇床振荡培养1 d,离心收集孢子和产孢发酵液。dit1Δ菌株孢子获得方法与野生型相同。将野生型及dit1Δ子囊孢子参考1.4的方法得到分散的孢子;
将上述破碎后得到的单个湿孢子及野生型营养细胞,用1×PBS(0.01 mol/L, pH 7.4)洗涤2次后重悬于500 μL 1×PBS ,加入适量玻璃珠,振荡破碎,破碎1 min,立即放置于冰上1 min,反复进行10次左右。5 000×g离心5 min,收集上清液,将3种上清液用1×PBS调整到相同体积800 μL,并将营养细胞发酵液和产孢发酵液用超滤管浓缩至相同体积,从而获得所需的蛋白样品;
(2)取10 μL蛋白样品上样进行SDS-PAGE电泳,电泳条件:90 V,30 min;120 V,1 h;
(3)将剪好的尺寸合适的PVDF 膜在甲醇溶液中浸泡5 s进行活化,然后将剪好的滤纸、活化后的PVDF膜及电泳完的凝胶浸在转膜缓冲液中;
(4)按照由下到上滤纸、PVDF膜、凝胶、滤纸的顺序叠放于电转仪(1.0 A,25 V,30 min);
(5)电转完成后,将PVDF膜用5%的脱脂奶粉TBST溶液封闭3 h;
(6)用TBST清洗2次,将其放置于含有一抗(Rabbit anti-FLAG,1∶3000稀释)的封闭液中,4℃过夜;
(7)TBST清洗3次,将其放置于含有二抗(Goat anti-rabbit IgG HRP,1∶5000稀释)的封闭液中,37℃处理2 h;
(8)TBST清洗3次后用ECL显色试剂盒进行显色。
1.8 GPO孢子的活性测定
GPO孢子的活性以50 mmol/LDL-3-磷酸甘油为底物,在氧气过量条件下测定。向1 mL 50 mmol/LDL-3-磷酸甘油水溶液中加入30 mg孢子,30℃反应1 h后终止反应。由于GPO能够催化L-3-磷酸甘油生成DHAP,GPO的氧化活性通过DHAP生成量来测定。DHAP在甘油磷酸脱氢酶(GDH)的作用下生成3-磷酸甘油,此过程会消耗NADH,因此可以通过NADH的消耗量得出DHAP的生成量。检测DHAP的反应体系如下:GPO孢子反应液10 μL, NADH(20 mmol/L) 3 μL, Tris-HCl( pH 7.5 ) 284 μL, 用酶标仪测340 nm下的吸光度值,然后加入3 μL GDH (50 U/mL),25℃反应10 min,再次测其340 nm下的吸光度值,以2次吸光度的差值及NADH标准曲线计算DHAP的量。由于DHAP在高温下不稳定,所以采用低温隔绝氧气法终止反应。
为了测定pH对GPO孢子酶活的影响,使用4种缓冲液在30 ℃下,采用不同pH值测定酶活。4种缓冲液分别为醋酸缓冲液(100 mmol/L, pH 4.0, 5.0, 5.4, 5.8)、磷酸缓冲液(100 mmol/L, pH 5.8, 6.0, 7.0, 8.0)、Tris-HCl 缓冲液(100 mmol/L, pH 7.0, 8.0, 9.0)和甘氨酸缓冲液(100 mmol/L, pH 9.0, 10.0, 10.6)。为了测定温度对GPO孢子酶活的影响,反应以100 mmol/L Tris-HCl(pH 7.0)作为缓冲液在不同温度下(10~60 ℃)测定GPO孢子酶活。酶活的相对活性定义为最大酶活的百分比。
dit1Δ缺陷型GPO孢子的重复使用情况,以50 mmol/L DL-3-磷酸甘油为底物,以30 mgdit1Δ 缺陷型GPO孢子进行反应,100 mmol/L Tris-HCl(pH 7.0)作为缓冲液,1 mL反应体系30 ℃反应1 h后,将孢子收集,用超纯水洗两遍,再以相同的条件进行反应,重复多次。
1.9 “一锅四酶法”反应体系合成L-果糖
反应体系(10 mL):DL-3-磷酸甘油 (548.78 mg,2.4 mmol),L-甘油醛(0.187 mol/L, 5.34 mL, 1.0 mmol),dit1Δ缺陷型GPO孢子(400 mg),过氧化氢酶 (1 000 U,1.18 μL),醛缩酶RhaD(终质量浓度为0.5 mg/mL),补加无菌水使反应总体积为10 mL,上述所有物质都加入到250 mL圆底烧瓶中,通入氧气,30 ℃,150 r/min 反应22 h。反应过程中每隔一段时间取样1 μL进行TLC(薄层层析)检测,使用V(正丁醇)∶V(乙酸)∶V(水)=2∶1∶1 作为展开剂,并使用茴香醛染液进行染色。当L-甘油醛消耗完全或者酮糖-1-磷酸不再增加时,用6 mol/L的HCl将pH调为4.6,向其中加入酸性磷酸酶(10 μL),37 ℃,150 r/min 反应1 d,反应液分别取1 μL进行TLC检测,使用V(乙酸乙酯)∶V(异丙醇)∶V(水)=9∶3∶1作为展开剂。
1.10L-果糖的分离纯化
1.10.1 硅胶纯化
(1)样品的预处理。向反应液中加入一定量的甲醇将蛋白沉淀完全,然后10 000 × g 离心20 min,将得到的上清液转入100 mL 圆底烧瓶中,将圆底烧瓶连接到旋转蒸发仪上,在40 ℃下减压蒸发浓缩样品。待样品浓缩至较少体积(约5 mL)时,向其中加入适量的硅胶摇晃均匀,继续旋转蒸发,当硅胶粉全部呈粉末状后,可结束旋蒸。
(2)装柱及上样纯化。将闪式层析柱底部填入少量棉花,防止硅胶漏,然后固定于铁架台上。取适量硅胶粉,用乙酸乙酯混匀,倒入层析柱中,使最终的硅胶大约达到柱子的1/3高度,然后使用双联球加压,反复2次,硅胶面不再改变时,准备上样。将旋蒸后的硅胶粉用漏斗加到层析柱中,双联球加压。先以乙酸乙酯为流动相,除掉一些非极性小分子,然后用V(乙酸乙酯)∶V(异丙醇)∶V(水)=9∶3∶1为流动相进行纯化,将洗脱液按顺序收集到试管中。
(3)目的产物洗脱液的鉴定及浓缩。用毛细管蘸取试管中的洗脱液,将其滴到硅胶层析板上进行TLC检测,用低温吹风机吹干,显色,通过硅胶板上是否有目的产物显色初步判断哪些试管洗脱液中含有目的产物。然后将含有目的产物的试管用对应的稀有糖为标准品,以V(乙酸乙酯)∶V(异丙醇)∶V(水)=9∶3∶1为展开剂再次做TLC检测,使洗脱液中的物质在层析板上分离开,进一步确定哪些试管含有目的产物。将那些含有目的产物的试管合并,倒入250 mL圆底烧瓶中,并用旋转蒸发仪将其浓缩至1~2 mL用于P-2凝胶排阻层析待用。
1.10.2 P-2凝胶排阻层析
(1)P-2 填料的预处理与装柱。P-2填料的预处理参照P-2凝胶的说明进行操作。然后将P-2玻璃柱子(1.5 cm ×90 cm)垂直固定于铁架台上,倒入适量去离子水并关闭出水口。将P-2填料混匀,将适量填料倒入柱子,待其沉积一定的高度后,可打开出水口,不断加入填料,待填料沉积后,再加入,直至胶面高度合适(离柱子上边缘约10 cm),使用蠕动泵将脱气后的去离子水泵入入水口来平衡柱子,设置合适的流速,平衡过夜。
(2)上样与分离。将平衡好的柱子的入水口关闭,打开出水口,让水液面自然下降,当液面刚刚下降至胶面处时将出水口关闭。此时把硅胶纯化后得到的目的产物的浓缩液(1~2 mL)均匀地加入到胶面上,打开出水口,当浓缩液完全进入到胶面时,向其中加入适量去离子水,接通入水口,设置合适的流速,开始分离,同时用自动收集器进行收集。目的产物的鉴定同上。最后将那些含有目的产物的试管合并,用冷冻干燥机冻干,称重计算产率,并对所得到的L-果糖进行1H NMR鉴定。
2 结果与讨论
2.1 酿酒酵母孢子表面展示系统的验证
我们拟采用生物法利用酵母dit1Δ缺陷型菌株在产孢过程中将GPO酶展示到“孢子壳聚糖球”的表面。为了验证GPO是否展示到孢子表面,构建GPO和绿色荧光蛋白的融合蛋白。通过荧光可以看到,如图2所示。
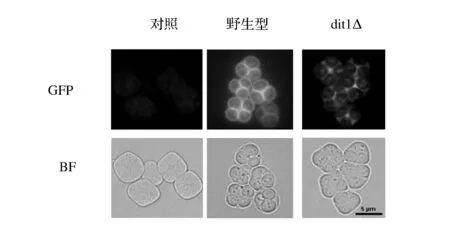
图2 质粒pRS424-TEFpr-ss-glpo-GFP在不同菌株中表达后孢子荧光图Fig.2 GFP fluorescence of different spores harbouring pRS424-TEFpr-ss-glpo-GFP(注:BF-Bright Field,亮视野; GFP-绿色荧光蛋白)
野生型孢子和dit1Δ均可以显示出荧光在孢子壁上的清晰轮廓。由于野生型孢子具有完整的二酪氨酸层,能够将蛋白紧密地包裹在孢子壁上,故荧光较强些。而dit1Δ缺陷型菌株不含有二酪氨酸层,没有二酪氨酸层的拦截作用,有部分蛋白分泌到胞外,所以荧光较弱些,但其优势便是可以将蛋白更大程度地展示在孢子表面,便于和不同底物进行接触反应。
为了进一步验证孢子酶固定化,构建了带有flag标签的重组质粒,将其在酵母和营养细胞中表达,通过Western blot检测,由图3可以得出,固定化效果显著,营养细胞培养过程中,大部分的GPO蛋白都分泌到发酵液中,留在细胞上的很少,而野生型孢子固定的蛋白量很大,产孢发酵液中只含有少量蛋白,dit1Δ孢子固定的蛋白量较野生型略少,但与营养细胞中的残留蛋白相比显著增多。另外由于GPO本身存在N糖基化位点,因此Western blot可以检测出2条带。
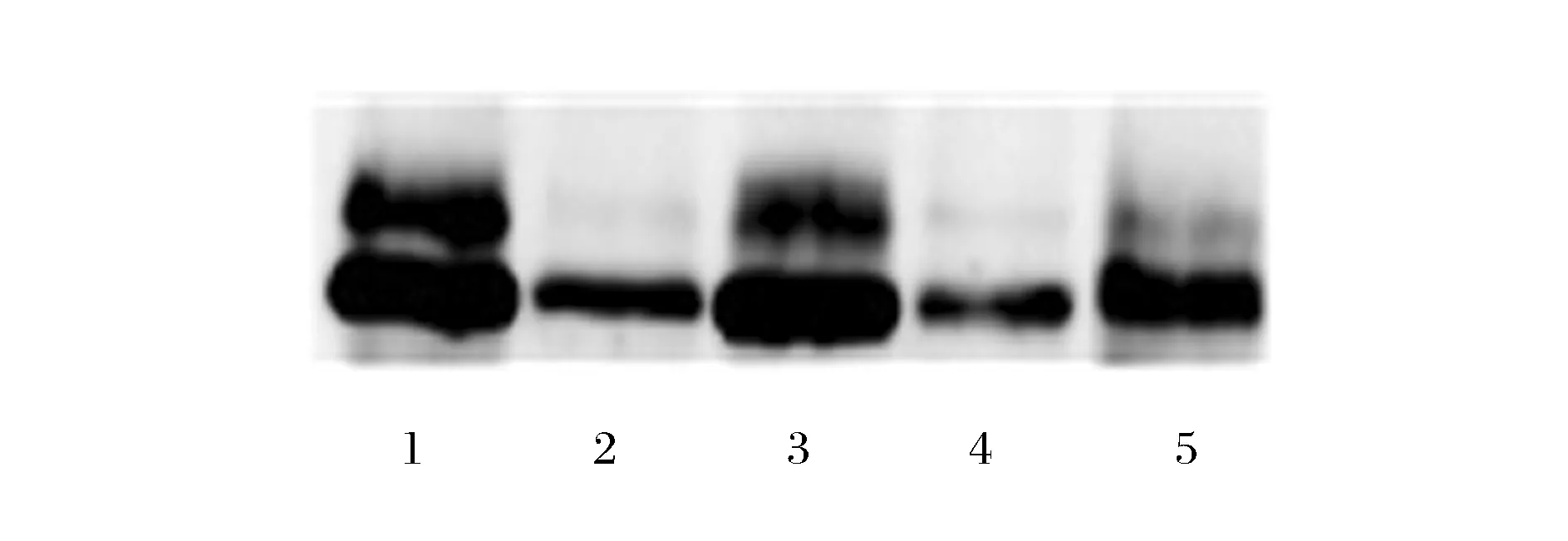
1-营养细胞发酵液上清;2-营养-细胞;3-野生型孢子;4-产孢发酵液上清;5-dit1Δ孢子图3 质粒pRS424-TEFpr-ss-glpo-flag在孢子和营养细胞中表达后的Western blot检测Fig.3 Western blot analysis of pRS424-TEFpr-ss-glpo-flag expressed in spore and vegetative cell
通过荧光观察和Western blot检测,说明酿酒酵母孢子可以将蛋白固定在孢子壁上,为了验证dit1Δ孢子的表面展示效果,选择以磷酸甘油氧化酶(GPO)的活性作为验证指标,因为甘油磷酸氧化酶的底物L-3-磷酸甘油微溶,且另一个底物为氧气,其活性的高低可以作为蛋白是否展示到孢子表面的有力指标。分别取30 mg野生型孢子、dit1Δ孢子以及只含有空载(pRS424TEF)的野生型孢子(作为对照),在30 ℃下反应1 h测定其活性,结果如图4所示,dit1Δ孢子的活性较野生型孢子高出1.5倍,说明该dit1Δ孢子表面展示系统构建成功。
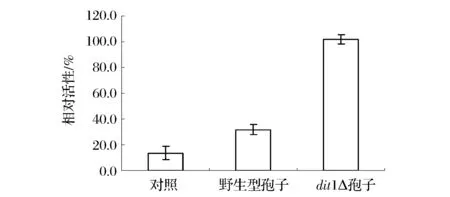
图4 酵母孢子GPO活性测定Fig.4 GPO activity assay of different spores
2.2 pH及温度对GPO孢子活性的影响
pH对GPO孢子活性的影响如图5所示,总体来说,GPO孢子能够耐受较广的pH值。当使用pH为7.0的Tris-HCl缓冲液时,酶活最高,此外,当使用磷酸缓冲液时,pH为8.0时的酶活最高,可能是由于磷酸根对GPO酶活的影响。在pH 7.0(Tris-HCl缓冲液)条件下测定了温度对GPO孢子活性的影响,由图6可知,GPO孢子的最适温度约为30 ℃,但不耐高温,在60 ℃时活性几乎丧失。
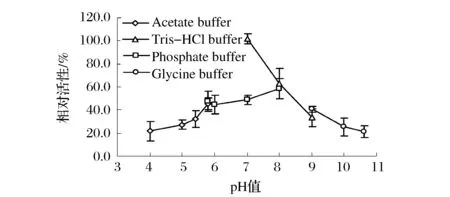
图5 pH对GPO孢子活性的影响Fig.5 Effect of pH on the activity of GPO spores
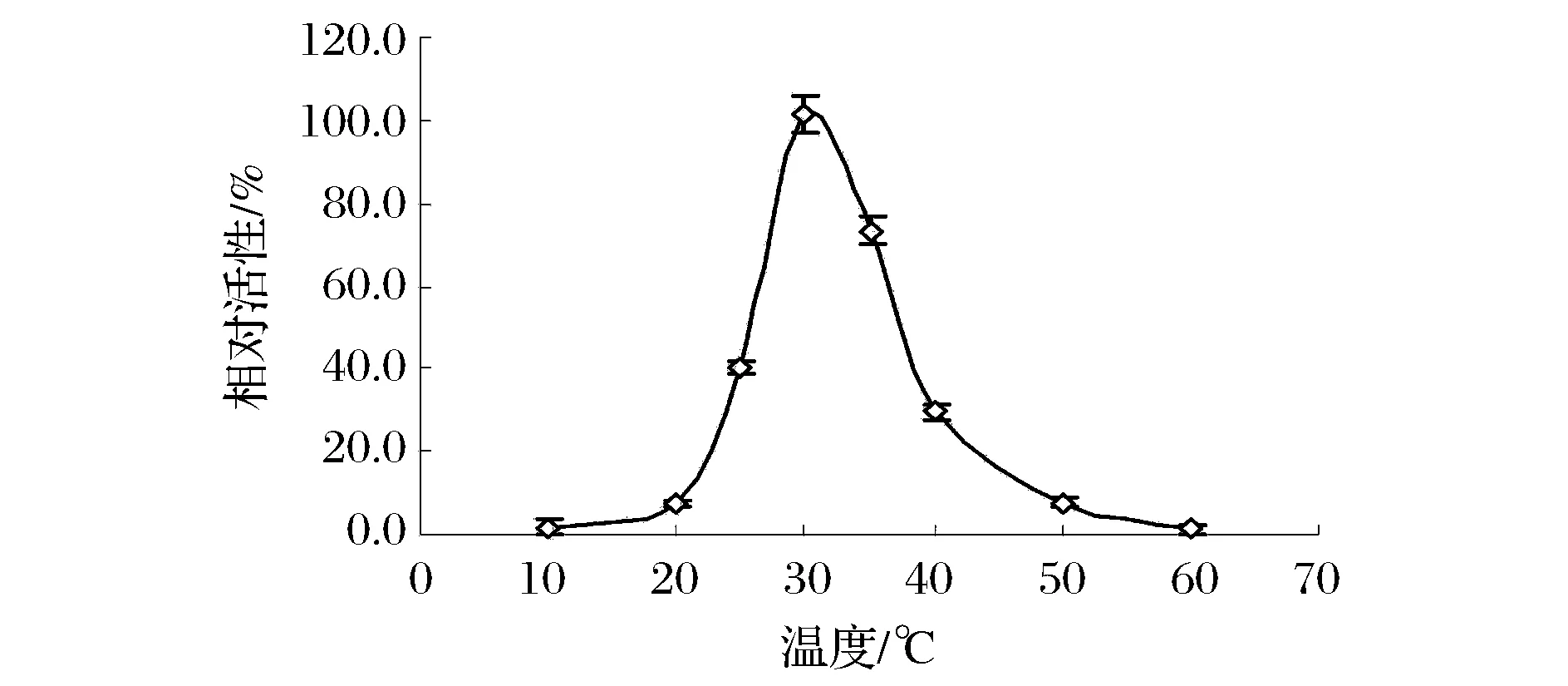
图6 温度对GPO孢子活性的影响Fig.6 Effect of temperature on the activity of GPO spores
2.3 GPO孢子的重复利用性
孢子表面展示系统的一个优点即可以作为催化剂重复利用,GPO孢子的重复使用后相对酶活如图7所示,将第1次使用的酶活定义为100%,第2次使用时活性可达到60%,第3次约为40%。因此,当使用次数控制在3次以内时,活性还是相当可观的。

图7 孢子重复使用性测定Fig.7 Repeated enzymatic assays of spores
2.4 利用GPO孢子合成L-果糖
利用“一锅四酶法”体系进行稀有糖L-果糖的合成,经纯化后得到L-果糖22.1 mg,产率约为12.3%(由于L-3-磷酸甘油过量,产率根据L-甘油醛的量计算),纯化后的L-果糖进行了1HNMR鉴定如图8示。
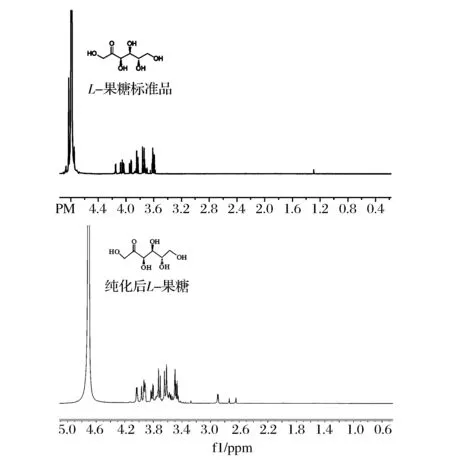
图8 化后产物L-果糖的1H NMR鉴定Fig.8 Characterization of the product L-fructose after purification by 1H NMR
3 结语
本文通过磷酸甘油氧化酶的酿酒酵母孢子表面展示并将其成功用于稀有糖的合成,得出孢子表面展示系统作为一种新的基因操作技术,通过分子生物学的方法使目标酶蛋白展示到孢子壳聚糖层的表面,保持相对独立的空间结构和生物活性,并且无需蛋白纯化和固定化操作以及能够重复使用等,在医药、保健及食品等方面具有广泛的应用价值。本研究中,由于验证该表面展示系统的可行性,所以选择磷酸甘油氧化酶作为外源蛋白,在实际应用中,该展示系统适用于各式各样的分泌蛋白以及连接有分泌型信号肽的非分泌型蛋白,应用广泛,具有广阔的发展前景。
[1] 叶波,林影,韩双艳.酵母细胞表面展示系统的研究进展及其应用[J].工业微生物,2007,37(6):53-58.
[2] 郭波,谢佩蓉,邹强等.酵母表面展示系统研究进展[J].生物化学与生物物理进展,2002,29(1):19-22.
[3] KUPIEC M, BYERS B, ESPOSITO R E, et al. Meiosis and sporulation inSaccharomycescerevisiae[J]. Cold Spring Harbor Monograph Archive, 1997, 21: 889-1 036.
[4] BRIZA P, ELLINGER A, WINKLER G, et al. Chemical composition of the yeast ascospore wall. The second outer layer consists of chitosan [J]. J Biol Chem, 1988, 263(23): 11 569-11 574.
[5] BRIZA P, WINKLER G, KALCHHAUSER H, et al. Dityrosine is a prominent component of the yeast ascospore wall. A proof of its structure [J]. J Biol Chem, 1986, 261(9): 4 288-4 294.
[6] ZHANG H N, GAO X D, NAKANISHI H. Applied usage of yeast spores as chitosan beads [J]. Applied and Environmental Microbiology, 2014. 80 (15): 80(16): 5098-105.
[7] PAMMER M, BRIZA P, ELLINGER A, et al. DIT101 (CSD2, CAL1), a cell cycle-regulated yeast gene required for synthesis of chitin in cell walls and chitosan in spore walls [J]. Yeast, 1992, 8(12): 1 089-1 099.
[8] WAGNER M, BRIZA P, PIERCE M, et al. Distinct steps in yeast spore morphgenesis require distinct SMK1 MAP kinase thresholds [J]. Genetics,1999, 151(4):1 327-1 340.
[9] LIN C P-C, KIM C, SMITH S O, et al. A highly redundant gene network controls assembly of the outer spore wall in S. cerevisiae [J]. PLoS genetics, 2013, 9(8): e1003700.
[10] COLUSSI T, PARSONAGE D, BOLES W, et al. Structure of R-Glycerophosphate Oxidase fromStreptococcussp.: A Template for the Mitochondrial R-Glycerophosphate Dehydrogenase [J]. Biochemistry,2008, 47: 965-977.
[11] Casey M F, Charrier V, Claiborne A, et al. Crystallization and preliminary crystallographic analysis of the soluble α-glycerophosphate oxidase fromStreptococcussp. [J].Acta Cryst, 2002, D58: 165-166.
[12] PARSONAGE D, LUBA J, MALLET T.C, et al. The Soluble a-glycerophosphate Oxidase fromEnterococcuscasseliflavus[J]. Journal of Biological Chemistry, 1998, 273: 23 812-23 822.
[13] CHARRIER V, LUBA J, PARSONAGE D, et al. Limited proteolysis as a Structural Probe of the Soluble R-Glycerophosphate Oxidase fromStreptococcussp [J]. Biochemistry, 2000, 39: 5 035-5 044.
[14] CLAIBORNE A. Studies on the structure and mechanism of Streptococcus faecium L-alpha-glycerophosphate oxidase [J]. Journal of Biological Chemistry, 1986, 261(31): 14 398-14 407.
[15] TIMOTHY M C. Structural and biochemical studies ofStreptococcussp. α-Glycerophosphate Oxidase [D].North Carolina:Wake Forest University, 2009.
[16] OH D-K., KIM N-H, KIM H-J, et al.D-Psicose production fromD-fructose using an isolated strain,Sinorhizobiumsp. [J]. World J Microbiol Biotechnol, 2007, 23: 559-563.
[17] POONPERM W, TAKATA G, ANDO Y, et al. Efficient conversion of allitol to D-psicose byBacilluspallidusY25 [J]. J Biosci Bioeng, 2007:103,282-285.
[18] LI Z J, GAO Y H, NAKANISHI H, et al. Biosynthesis of rare hexoses using microorganisms and related enzymes [J]. Beilstein J Org Chem, 2013, 9: 2 434-2 445.
[19] SUN Y, HAYAKAWA S, OGAWA M, et al. Influence of a rare sugar, d-Psicose, on the physicochemical and functional properties of an aerated food system containing egg albumen[J]. J Agric Food Chem, 2008, 56(12):4 789-4 796.
[20] MATSUO T, SUZUKI H, HASHIGUCHI M, et al.D-psicose is a rare sugar that provides no energy to growing rats[J]. J Nutr Sci Vitaminol (Tokyo) , 2002, 48(1):77-80.
[21] OSHIMA H, KIMURA I, IZUMORI K. Synthesis and structure analysis of novel disaccharides containingD-psicose produced by endo-1,4-beta-D-xylanase fromAspergillussojae[J]. J Biosci Bioeng, 2006, 101(3): 280-283.
[22] RAO D,GULLAPALLI P, YOSHIHARA A. et al. Direct production ofL-tagatose fromL-psicose byEnterobacteraerogenes[J]. J Biosci Bioeng, 2008, 106(5):473-480.
[23] YOSHIHARA A, HARAGUCHIS S, GULLAPALLIP P, et al. Isomerization of deoxyhexoses: green bioproduction of 1-deoxy-D-tagatose fromL-fucose and of 6-deoxy-D-tagatose fromD-fucose usingEnterobacteragglomeransstrain 221e[J]. Tetrahedron Asymmetry, 2008, 19(6): 739-745.
[24] NOMA A, SATO M, TSUZUKI Y. Taste effectiveness of anomers of sugars and glycosides as revealed from hamster taste responses[J]. Comp Biochem Physiol A Comp Physiol, 1974, 48(2):249-262.
[25] LEVIN G V, ZEHNER L R, SAUNDERS J P, et al. Sugar substitutes: their energy values, bulk characteristics, and potential health benefits[J]. Am J Clin Nutr, 1995, 62(5): 1 161-1 168.
[26] DHAWALE M R, SZAREK W A, HAY G W, et al. Preparation ofL-fructose andD-sorbose by the bacterial oxidation ofL-mannitol andL-glucitol, respectively[J]. Carbohydr Res, 1986, 155: 262-265.
[27] MUNIRUZZAMAN S, PAN Y T, ZENG Y, et al. Inhibition of glycoprotein processing byL-fructose andL-xylulose[J]. Glycobiology, 1996, 6(8):795-803.
[28] LI Z J, CAI L, QI Q S, et al. Synthesis of Rare Sugars withL-fuculose-1-phosphate aldolase (FucA) fromThermusthermophilusHB8 [J]. Bioorg Med Chem Lett, 2011, 21(17): 5 084-5 087.
[29] LI Z J, CAI L, WEI M H, et al. One-pot four-enzyme synthesis of ketoses with fructose 1,6-bisphosphate aldolases fromStaphylococcuscarnosusand rabbit muscle [J]. Carbohydrate Research, 2012,357: 143-146.
[30] LI Z J, CAI L, QI Q S, et al. Enzymatic Synthesis ofD-Sorbose andD-Psicose with Aldolase RhaD: Effect of Acceptor Configuration on Enzyme Stereoselectkivity [J]. Bioorg Med Chem Lett, 2011, 21(23): 7 081-7 084.
[31] NEIMAN A M. Prospore membrane formation defines a developmentally regulated branch of the secretory pathwany in yeast [J]. J Cell Biol, 1998, 140(1):29-37.
[32] LONGTINE M S, MCKENZIE A, DEMARINI D J, et al. Additional modules for versatile and economical PCR-based gene deletion and modification inSaccharomycescerevisiae[J]. Yeast, 1998, 14(10): 953-961.
Construction and application of a novel surface display system on yeast spore
QIAO Ying-xin, LI Zi-jie, NAKANISHI Hideki, GAO Xiao-dong
(Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122 China)
In this paper, a novel surface display system on yeast spore and its application for rare sugar synthesis were studied. Surface display system was used by microorganisms to display the exogenous proteins or peptides on their cell surface. Glycerophosphate oxidase (GPO) was used to verify the feasibility of the novel surface display system. The gene glpo GPO fromStreptococcuspneumoniaewas fused with signal sequence and inserted into pRS424-TEFpr vector. The recombinant plasmid pRS424-TEFpr-ss-glpowas transformed into wild type and auxotroph ofS.cerevisiaeto sporulate. The results from fluorescence analysis, western blot detection and activity assays showed thatS.cerevisiaespore surface display system was successfully constructed. The GPO spores were characterized and their optimum pH and temperature were 7.0 and 30℃, respectively. Moreover, the spores could be reused with activity of about 40% of the maximum activity at the third time. Finally, GPO spores were employed in the one-pot four-enzyme system for synthesis of rare sugarL-fructose with yield of about 12%.
spore surface display; glycerophosphate oxidase;Saccharomycescerevisiae; rare sugar
硕士研究生(高晓冬教授为通讯作者,E-mail:xdgao@jiangnan.edu.cn)。
国家自然科学基金(21302069);中央高校基本科研业务费专项基金资助(JUSRP1003);教育部科学技术研究重大项目(313027)
2014-12-04,改回日期:2015-02-06
10.13995/j.cnki.11-1802/ts.201706002
