连续离子交换法分离发酵液中的L-精氨酸
2017-07-31黄根树徐美娟杨套伟张显饶志明许正宏
黄根树,徐美娟,杨套伟,张显,饶志明*,许正宏
1(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122)2(江南大学 生物工程学院,江苏 无锡,214122)
连续离子交换法分离发酵液中的L-精氨酸
黄根树1,徐美娟1,杨套伟1,张显1,饶志明1*,许正宏2*
1(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122)2(江南大学 生物工程学院,江苏 无锡,214122)
相比传统的固定床离子交换提取工艺,连续离子交换工艺分离发酵液中L-精氨酸具有连续、稳定、高效等优点。钝齿棒杆菌是1株具有自有知识产权的高产L-精氨酸工业用菌株,产量达74.5 g/L。该研究通过静态吸附及解吸实验,筛选得到最优树脂D155,可在30 min内达到吸附平衡,平衡吸附量达121.31 mg/g。通过固定床实验,确定了最佳进料流速为6 mL/min,穿透时间为29 min,半饱和时间为59 min,饱和时间86 min,穿透吸附容量为134.7 mg/g,半饱和吸附容量为193.8 mg/g,饱和吸附容量为261.2 mg/g,为最佳洗脱剂为2 mol/L的氨水,洗脱率为97.14%。通过30柱连续离子交换实验,确定了交换区、交换后水洗区、洗脱区、洗脱后水洗区、顶水区最佳进料流速分别为6、6、5、10、3 mL/min。在各区最佳进料流速下,各出口浓度呈周期性变化。该工艺提高了L-精氨酸分离工艺的连续性、稳定性及分离效率,有效地降低了分离过程中的耗水量、耗碱量及劳动力投入,为发酵生产L-精氨酸提供了更科学有效的分离工艺。
发酵液;L-精氨酸;静态吸附;固定床;连续离子交换
L-精氨酸是一种人体和动物体内的半必需氨基酸,也是天然氨基酸中碱性最强,含氮量最高的氨基酸[1]。它有许多特殊的生理生化功能,因此在食品和医药领域中具有广泛的应用[2-4]。目前L-精氨酸的生产方法主要有水解法和发酵法[5-6],水解法收率低且污染大,而发酵法成本低,污染小,且更安全。随着生物技术的发展,L-精氨酸生产菌株的生产能力也逐渐提高,发酵法逐渐成为生产L-精氨酸的主要方法[7-9]。 许虹等通过双阶段供氧策略使钝齿棒杆菌发酵L-精氨酸产量达36.6 g/L[10], 徐美娟等[11]通过在钝齿棒杆菌中过量表达L-精氨酸合成途径中的基因簇将L-精氨酸5 L罐发酵水平提升至45.3 g/L。满在伟等[8]通过敲除钝齿棒杆菌产H2O2的黄素还原酶降低胞内的氧化还原水平,再通过优化胞内ATP的供应将L-精氨酸5 L罐发酵水平提升至57.3 g/L, 随后通过对菌株进行系统的代谢改造进一步将产量提升至74.5 g/L[12]。
不同的菌株,不同的培养条件所得的发酵液,其理化性质相差较大,因而对分离纯化工艺的影响也较大。732阳离子交换树脂,被广泛应用于发酵液中氨基酸的提取与分离[13-15]。但由于应用732所得的洗脱液颜色较深,因此需要消耗大量的粉末活性炭以脱除其中残留的色素,才能保证最终产品的质量。故有必要筛得一种对发酵液中L-精氨酸选择性更强的离子交换树脂,以减少活性炭的用量。此外,传统的固定床操作需要厂房利用率低,操作过程消耗大量的酸碱及水,且消耗大量的人力,产品质量也不稳定[16-17]。为此,自连续离子交换技术出现后,已广泛应用于工业生产中,包括发酵产品在内的多种产品的分离纯化[18-21]。
本研究通过实验以期筛选得到一种对发酵液中L-精氨酸的选择性更强,交换容量更大的离子交换树脂,以减少提取精制过程中活性炭的用量,并将连续离子交换系统应用于发酵液中L-精氨酸的提取以减少碱液、水及人力的消耗,提高厂房空间利用率和产品质量的稳定性。
1 材料与方法
1.1 材料与试剂
盐酸,氢氧化钠,氨水,乙酸钠,β-巯基乙醇,四氢呋喃,三乙胺,浓硫酸:均为分析纯,上海国药集团;乙腈、甲醇:色谱纯,百灵威科技。发酵液为本实验室采用钝齿棒杆菌SYPA5-5经30 L发酵罐发酵所得(所用发酵液均为同一批发酵所得)。阳离子交换树脂732,JK006,HZ016,D001, D155,HD-2,HD-8,JK116均购于华东理工大学上海华震科技有限公司。
1.2 仪器与设备
陶瓷/管式膜小试设备Ceramen-0100、连续离子交换系统Star-Sep-30025,厦门世达膜科技有限公司;2.5 cm×25 cm玻璃层析柱,上海之信有限公司;多用离子浓度计BANTE930,上海般特仪器制造有限公司;蠕动泵BT300-2J,兰格泵业有限公司;高效液相色谱仪Agilent1260,安捷伦科技有限公司。
1.3 实验方法
1.3.1 发酵液预处理
发酵结束后,采用装有孔径为0.1 μm的陶瓷膜的陶瓷膜小试设备Ceramen-0100,以除去菌体发酵液中的菌体,加水量约为发酵液体积的20%。采用高效液相色谱OPA柱前衍生法测定滤液中的氨基酸含量,并用生工改良型Bradford 蛋白浓度测定试剂盒测定其中的蛋白含量,其中的SO42-、NH4+浓度用多离子浓度计测定。
1.3.2 树脂的预处理
树脂用3 BV乙醇浸泡 24 h,充分溶胀后,用去离子水将乙醇洗净,再依次用4倍树脂体积的 1 mol/L盐酸洗→去离子水洗至pH 4以上→ 4倍树脂体积的1 mol/L NaOH溶液洗→去离子水洗至pH 9以下→4倍树脂体积 2 mol/L氨水转为氨型,最后用去离子水洗至中性。
1.3.3 静态吸附及洗脱实验
称取一定量已处理好的各种阳离子交换树脂, 加入经预处理后的发酵液,置于恒温调转摇床中,定时取样,L-精氨酸浓度采用OPA柱前衍生高效液相色谱法[22]测定,并计算各种树脂在该条件下的平衡交换容量;再过滤收集吸附饱和的树脂并用去离子水清洗,后加入解吸剂,在420 nm下测定解吸液透光度(1 cm比色杯)其L-精氨酸浓度。
1.3.4 固定床离子交换实验
称取一定量最优的离子交换树脂装入层析柱中,保证树脂层无气泡,用蠕动泵将处理好的发酵液以一定的流速从层析柱顶部泵入,每隔一段时间从层析柱底部的流出液中取样测定其中的L-精氨酸浓度,并以出口处精氨酸浓度与入口处精氨酸浓度的比值C/C0对时间t作图,绘制穿透曲线。
层析柱中的离子交换树脂吸附饱和后用去离子水冲洗至无明显颜色,用一定浓度的氨水以一定的流速从层析柱顶部泵入,定时从柱底的流出液中取样,测定其中的L-精氨酸浓度,并绘制洗脱曲线。
1.3.5 连续离子交换实验
根据连续离子交换系统中各区的设计和要求,分别对各区采用不同流速进行实验,通过测定不同流速下各出口料液的浓度或性质,确定各区最佳进料流速。
1.3.6 计算
平衡交换容量计算公式如下:
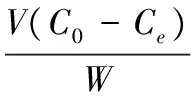
(1)
式中:Qe是平衡交换容量,mg/g;V是发酵液体积,mL;C0、Ce分别是吸附前和吸附后溶液中L-精氨酸质量浓度, g/L;W是树脂的质量,g。
解析率计算公式如下:
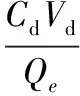
(2)
式中:η是解析率,无量纲;Cd是解吸液中L-精氨酸含量,g/L;Vd解吸液体积,mL;Qe是平衡交换容量,mg/g。
2 结果与分析
2.1 发酵液理化性质分析
发酵结束后,发酵液中L-精氨酸的质量浓度为74.5g/L,湿菌体含量约为7.3%(w/v),经陶瓷膜过滤后,滤液透光率为1%~3%,pH为6.7~6.8,滤液中的组分如表1所示。
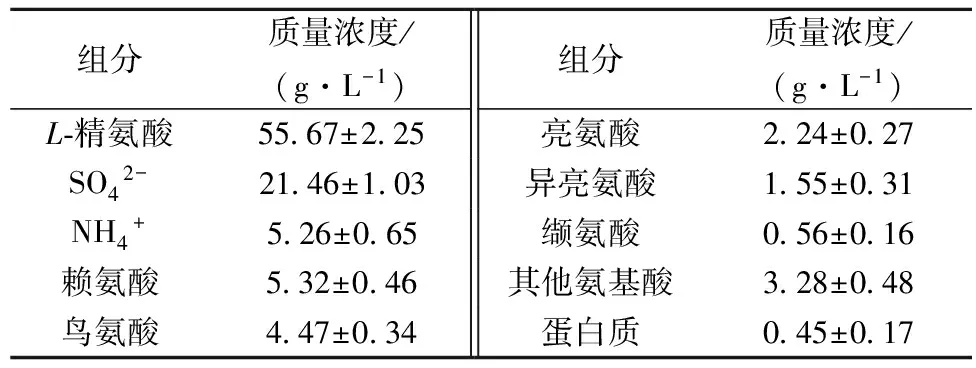
表1 发酵液经陶瓷膜过滤后的滤液主要组分分析
2.2 不同离子交换树脂对发酵液中L-精氨酸的吸附情况的比较
精确称取5.0 g经预处理的 8种干树脂732、JK006、HZ016、D001、 D155、HD-2、HD-8和JK116,分别放入 250 mL 的锥形瓶中,加入50 mL精氨酸发酵液,放入25 ℃、200 r/min摇瓶床中,每隔5 min取样100 μL测定其L-精氨酸浓度,记录达到吸附平衡所需的时间并计算平衡交换容量。收集吸附饱和的树脂,加入30 mL 3 mol/L 的氨水进行解吸,测定解吸效果。
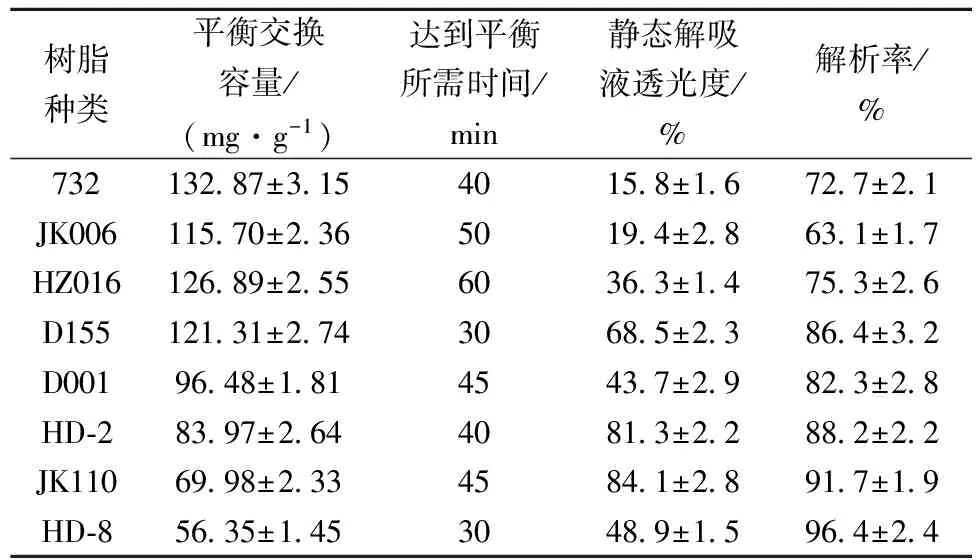
表2 不同树脂对发酵液中L-精氨酸的吸附及解吸效果比较
由表2可知,在这8种树脂中,732、JK006、HZ016和D155对发酵液中L-精氨酸的平衡交换容量相对高于其他树脂,其中732吸附量最高,为132.87 mg/g, HD-8最低,为56.35 mg/g。在选择树脂时,不仅应考虑树脂对目的产物的吸附量,还应考虑其对目的产物的选择性及洗脱的难易程度。所得解吸液中JK110对应的解吸液透光率最高,达84.1%, 而732树脂对应的解吸液透光率最低,为15.8%。结果表明,JK001树脂对发酵液中色素的吸附能力最弱,而732最强。解吸液透光率越低,说明解吸液中含有的色素就越多,后续脱色工序所需消耗的活性炭就越大。在相同解吸剂及相同浓度下解吸各树脂中吸附的L-精氨酸,解析率越高说明,被吸附的精氨酸越容易解吸,故洗脱过程中解吸剂的消耗量就越小,比较各树脂对应的解析率可知,HD-8吸附的L-精氨酸最容易被解吸,而JK001最难。综合考虑,本研究选择D155用于提取发酵液中的L-精氨酸。
2.3 离子交换过程的条件优化
2.3.1 进料流速的优化
称取70.0 g已处理好的D155树脂装入层析柱中,将处理好的发酵液分别以4.0、6.0、8.0 mL/min以一定的流速从层析柱顶部进入,穿透曲线如图1所示。随着流速的增加,穿透点逐渐提前,达到床层达到饱和的时间也逐渐提前,穿透曲线逐渐变陡。如表2所示,随流速的增加,料液在树脂床层中停留时间就随之缩短,从而导致穿透体积、穿透交换容量和饱和交换容量均随之下降。在实际生产中,若流速过慢,虽然可提高树脂的吸附量,但会延长生产周期,增加能耗,若流速过快,则容易造成树脂利用率低,酸碱消耗量增大,从下降的幅度可以看出,当流速由6 mL/min增至8 mL/min时,穿透交换容量和饱和交换容量均出现大幅度的下降。综合考虑,应选择6 mL/min作为进料流速。

图1 不同流速下的穿透曲线Fig.1 Breakthrough curve at different flow rates
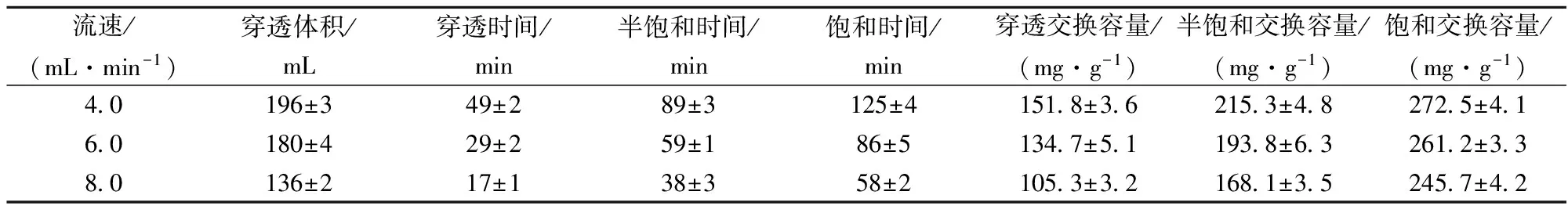
表3 不同流速下的D155固定床离子交换吸附发酵液中L-精氨酸的情况
2.3.2 洗脱过程的优化
本实验采用氨水作为洗脱剂,在洗脱的同时又可以将树脂转为氨型,残留在洗脱液中的氨可通过真空蒸发除去,以质量浓度分别为1.0、1.5、2.0 mol/L的氨水作为洗脱剂对层析柱中已达到饱和的树脂进行正向洗脱,定时取样测定洗脱液中L-精氨酸浓度。如图2所示, 随着洗脱剂浓度的增加,洗脱峰逐渐变陡,洗脱过程中的最大浓度逐渐升高,洗脱时间逐渐缩短,且洗脱剂浓度越低,拖尾现象越明显。

图2 不同洗脱剂浓度下的洗脱曲线 Fig.2 Desorption curve at different concentration of eluent
如表4所示,当氨水浓度从1.0 mol/L增加至2 mol/L时,洗脱时间从75 min缩短至48 min, 收集的洗脱液体积也逐渐减小。用2 mol/L氨水洗脱时,解析率接近100%。故应选择2 mol/L的氨水作为洗脱剂。

表4 固定床实验中不同浓度氨水的洗脱效果
2.4 连续离子交换提取工艺设计及优化
2.4.1 连续离子交换工艺设计
根据固定床单根柱实验结果,为提高树脂的利用率,以树脂床层达到半饱和为准,发酵液中L-精氨酸质量浓度为55.67 g/L、进料流速6 mL/min、步行时间20 min。连续离子交换系统分区设计如图3所示:5—13#为交换区:采用正进料的方式5—7#并联,8—10#并联,11—13#并联,5—7#出口接入二次进料槽;1—4#为交换后水洗区:采用单串正进料的方式,4#出口接入二次进料槽;14—15#和29—30#为分别为交换前顶水区和洗脱前顶水区,均为反向顶水;21—28#为洗脱区,21—22#并联,23—24#并联,25—26#并联,27—28#并联,21—22#出口接入二级洗脱剂槽;16—20#为洗脱后水洗区,单串正进料方式连接,20#出口含高浓度洗脱剂的流出液接入二级洗脱剂槽。

图3 连续离子交换工艺设计图Fig.3 Design of continuous ion-exchange process
2.4.2 交换后水洗区的流速选择
1#~ 4# 为交换后水洗区, 目的在于用去离子水洗出残留在树脂床层的料液并回收其中含有的L-精氨酸,减少损失。 在不同流速下, 当设备连续运转24h 后, 分别对 1# 和 4# 出口进行检测, 在 1 个周期内(步行周期 20 min)每隔3 min 取样,测定L-精氨酸质量浓度。 由表 5可以看出,进水流速的快慢会影响出口L-精氨酸质量浓度, 随着步行时间的增加, 各流速下出口处L- 精氨酸质量浓度逐渐降低,流速为 10 mL/min 时, 第 19 min 4#出口L-精氨酸质量浓度仅为 4.42 g/L; 而当流速为 4 mL/min 时,出口质量浓度为 25.18 g/L。由于4#出口接入二级进料槽,水洗流速过快会导致耗水量也会增加,且会导致出口L-精氨酸质量浓度太小,从而导致二级进料浓度过低,树脂利用率下降。但流速过小,又不能完全将柱中残留的发酵液洗出,从而影响洗脱液质量。故综合比较选取 6 mL/min 为交换后水洗最佳流速。
2.4.3 顶水区流速的选择


表5 水洗流速对1#和4#出口处L-精氨酸质量浓度的影响
注:“N.d”表示未检测到。
注:"—"表示加入氯化钡溶液未见浑浊;"+" 表示加入氯化钡溶液出现浑浊。

表7 不同流速对交换前顶水区的顶水效果
注:“N.d”表示未检测到。
2.4.4 洗脱后水洗流速的选择
16#-20# 为洗脱后水洗区,目的在于用去离子水洗出并回收氨水。 在不同流速下, 当设备连续运转24 h 后,分别对 16# 和 20# 出口进行检测, 在1个周期内(步行周期 20 min)每隔 3 min 取样,测定氨浓度。由表8可知,随着水洗流速的增加,相同步行时间内16#和20#出口氨浓度逐渐降低,流速为14、12 mL/min时,在步行周期末,16#出口检测不到氨。由图3可知,为提高洗脱剂的利用率,减少用水,20# 出口分为两个方向,步行周期前期浓度高的部分进入二级洗脱槽作为二级洗脱剂,后期浓度低的部分则进入洗脱剂配料罐。为保证保证二级及三级洗脱区的洗脱效果,二级洗脱槽中的洗脱剂的浓度不能太低,故综合比较,选取 10 mL/min 为再生后水洗区最佳进水流速,并将20#出口处前9 min的流出液流入二级洗脱槽中,后期的流出液则进入洗脱剂配料罐,用于配置初始洗脱剂。

表8 洗脱后水洗区流速对水洗效果的影响
注:“N.d”表示未检测到。
2.4.5 洗脱区流速的选择
21#-28# 为洗脱区,目的在于用氨水将吸附于树脂中的L-精氨酸洗出并将树脂转为氨型。在不同流速下,当设备连续运转24 h 后,在 1 个周期内(步行周期 20 min)每隔 3 min 在21#出口进行取样, 测定L-精氨酸浓度。 由表 9可知, 随着步行时间的增加, 各流速下出口处L-精氨酸浓度逐渐降低,相同步行时间下,出口L-精氨酸浓度随着洗脱剂的进料流速的增加而下降,在流速为7 mL/min时,在6 min时所吸附的L-精氨酸几乎已全部洗脱,而流速为3 mL/min时,在步行周期末仍能检测到1.52 g/L的L-精氨酸,综合考虑洗脱效率及洗脱剂的消耗,应选取5 mL/min 为洗脱区最佳进料流速。
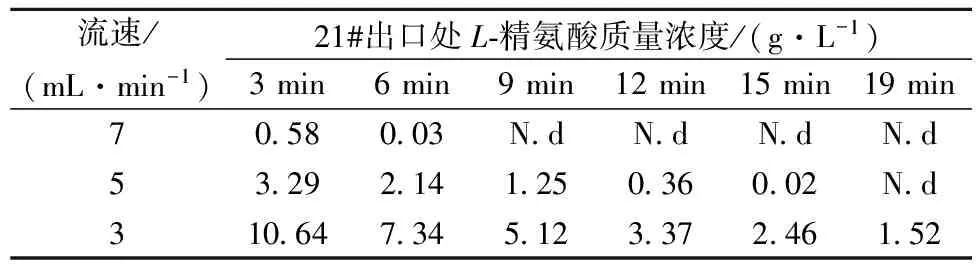
表9 交换后水洗区对21#流出液中L-精氨酸浓度的影响
注:“N.d”表示未检测到。
2.4.6 连续离子交换系统在各区最优流速下的稳定性
按各区最佳进料流速调整好流速, 连续运转 24 h后连续 100 min 检测各出口浓度变化情况, 以确定其稳定性和连续性。 由表10可以看出,11# 出口均未检测到L-精氨酸,无L-精氨酸穿透,15#出口无吸附后废液流出, 30# 出口无产品流出,20#出口无L-精氨酸残留。由图10可以看出, 交换后水洗区和洗脱区出口浓度呈周期性稳定变化, 连续性和稳定性优于固定床离子交换工艺。从表11中的对比结果可知, 处理等量的发酵液,连续离子交换工艺与固定床间歇离子交换工艺相比可节省约61%的耗水量,耗碱量减少约68%,树脂利用率提高了约33%。

表10 连续运转24 h后100 min内各出口检测结果
注:“N.d”表示未检测到;"—" 表示加入氯化钡溶液未见浑浊。
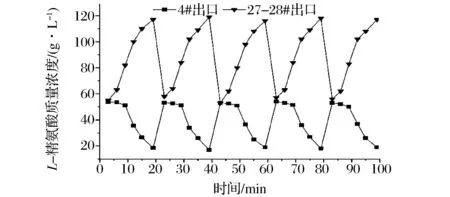
图10 连续运转24 h后100 min内4#和27#-28#出口检测结果Fig.10 Measured concentrations at outlet of 4# and 27#-28# within 100 min after 24 h of continuous operation
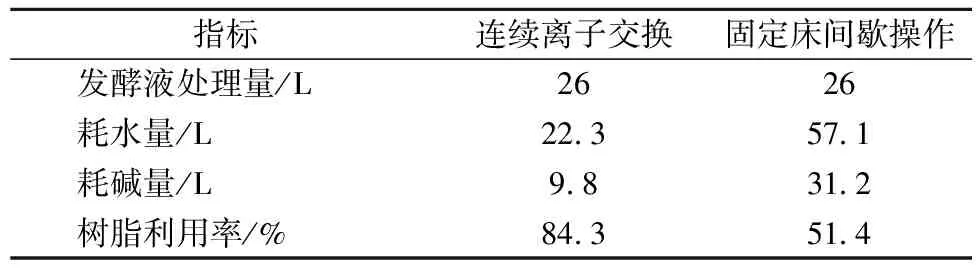
表11 连续离子交换与传统固定床操作的比较
3 结论
本研究通过静态吸附及解吸实验,筛选得到最优树脂D155,可在30miin内达到吸附平衡,平衡吸附量达121.31 mg/g。通过固定床实验,确定了最佳进料流速为6 mL/min,穿透时间为29 min,半饱和时间为59 min,饱和时间86 min,穿透吸附容量为134.7 mg/g,半饱和吸附容量为193.8 mg/g,饱和吸附容量为261.2 mg/g,最佳洗脱剂为2 mol/L的氨水,洗脱率为97.14%。在固定床离子交换参数的基础上,设计30柱连续离子交换系统并优化各区的进料流速,在各区最佳进料流速下,系统可连续稳定地运行,与固定床间歇操作相比可节省约61%的耗水量,耗碱量减少约68%,树脂利用率提高了约33%。
[1] 张义萍, 张伟国, 郝刚. 离子交换法从发酵液中提取L-精氨酸[J]. 食品与发酵工业, 2005,31(9):67-69.
[2] CHEW B P, EISENMAN J R, TANAKA T S. Arginine infusion stimulates prolactin, growth hormone, insulin, and subsequent lactation in pregnant dairy cows1[J]. Journal of Dairy Science, 1984,67(11):2 507-2 518.
[3] GURIDI J, BORGATELLO C, SCREMIN O U. Arginine NO-dependent and NO-independent effects on hemodynamics[J]. European Journal of Pharmacology, 2014,729:138-143.
[4] ROGERS N E, IGNARRO L J. Constitutive nitric oxide synthase from cerebellum is reversibly inhibited by nitric oxide formed fromL-arginine[J]. Biochemical and Biophysical Research Communications, 1992,189(1):242-249.
[5] 于向鹏.L-精氨酸高产菌株选育与发酵工艺研究[D]. 杭州:浙江师范大学, 2012.
[6] 陈雪岚.钝齿棒杆菌精氨酸生物合成基因簇的研究[D].无锡:江南大学,2005.
[7] XU M, RAO Z, YANG J, et al. Heterologous and homologous expression of the arginine biosynthetic arg C~H cluster fromCorynebacteriumcrenatumfor improvement ofL-arginine production[J]. Journal of Industrial Microbiology & Biotechnology, 2012,39(3):495-502.
[8] MAN Z, RAO Z, XU M, et al. Improvement of the intracellular environment for enhancingl-arginine production ofCorynebacteriumglutamicumby inactivation of H2O2-forming flavin reductases and optimization of ATP supply[J]. Metabolic Engineering,2016,38:310-321.
[9] PARK S H, KIM H U, KIM T Y, et al. Metabolic engineering ofCorynebacteriumglutamicumforL-arginine production[J]. Nature Communications, 2014,5:4 618.
[10] XU H, DOU W, XU H, et al. A two-stage oxygen supply strategy for enhanced l-arginine production byCorynebacteriumcrenatumbased on metabolic fluxes analysis[J]. Biochemical Engineering Journal, 2009,43(1):41-51.
[11] XU M, RAO Z, YANG J, et al. Heterologous and homologous expression of the arginine biosynthetic arg C-H cluster fromCorynebacteriumcrenatumfor improvement ofL-arginine production[J]. Journal of Industrial Microbiology & Biotechnology, 2012,39(3):495-502.
[12] MAN Z, XU M, RAO Z, et al. Systems pathway engineering ofCorynebacteriumcrenatumfor improvedL-arginine production[J]. Scientific Reports, 2016,6:28629.
[13] 龚雨顺, 黄建安, 刘仲华, 等. 732阳离子交换树脂对茶氨酸的吸附性能研究[J]. 湖南农业科学, 2008(4):67-69.
[14] 武彩莲, 郭长江. 离子交换法与氨基酸的分离纯化[J]. 氨基酸和生物资源, 2005(4):50-53.
[15] XIE Y, JING K, LU Y. Kinetics, equilibrium and thermodynamic studies ofL-tryptophan adsorption using a cation exchange resin[J]. Chemical Engineering Journal, 2011,171(3):1 227-1 233.
[16] 徐昌洪,方家骥.连续离子交换色谱分离在赖氨酸精制过程中的应用[J].精细与专用化学品,2008,16(20):18-20.
[17] 于力涛.连续离子交换在L-乳酸分离中的应用[D]. 合肥:合肥工业大学, 2012.
[18] 李玉波.离子交换树脂连续式移动床提取VC过程的研究[D]. 天津:天津大学, 2003.
[19] 姜绍通, 于力涛, 李兴江, 等. 连续离子交换法分离L-乳酸的工艺设计及优化[J]. 食品科学, 2012(12):69-74.
[20] 陈路萍, 樊继宽. 连续离子交换系统在山梨醇生产中的应用[J]. 连云港职业技术学院学报, 2002,15(4):10-11.
[21] 崔光水, 李贵伶, 陈洪景, 等. 连续式离子交换法生产葡萄糖酸内酯的工艺设计与优化[J]. 山东化工, 2015(6):107-110.
[22] VENKATAKRISHNAN A, ABEL M J, CAMPBELL R A, et al. Whole blood analysis of gluconeogenic amino acids for estimation of de novo gluconeogenesis using pre-columno-phthalaldehyde derivatization and high-performance liquid chromatography[J]. J Chromatogr B Biomed Appl, 1996,676(1):1-6.
Recovery ofL-arginine in the fermentation broth by continuous ion exchange
HUANG Gen-shu1, XU Mei-juan1, YANG Tao-wei1, ZHANG Xian1, RAO Zhi-ming1*, XU Zheng-hong2*
1(The Key Laboratory of Industrial Biotechnology of Ministry of Education, School of Biotechnology,Jiangnan University, Wuxi 214122, China)2(School of Pharmaceutical Sciences, Jiangnan University, Wuxi 214122, China)
Compared with the conventional fixed bed ion exchange process, continuous ion exchange process is better in continuity, stability and efficiency.Corynebacteriumcrenatum, a excellentL-arginine producer with domestic autonomous intellectual property right, is able to produceL-arginine with a production of 74.5 g/L. In this study, D155 was proved to be the most competent resin to recover theL-arginine in fermentation by static adsorption and desorption tests. Adsorption equilibrium could be achieved within 30 min with the equilibrium capacity of 121.31 mg/g. The optimal feed flow rate obtained from the fixed bed tests was 6 mL/min, at which the breakthrough time, subsaturation time, saturation was 29, 59, 86 min, respectively. The corresponding breakthrough capacity, subsaturation capacity and saturation capacity was 134.7, 193.8, 261.2 mg/g, respectively. The optimal eluent was 2 mol/L NH3·H2O, which could result in elution rate of 97.14%. Based on the optimal conditions obtained in fixed bed experiments, continuous ion exchange system consisted of 30 columns was designed, and the optimal flow rates of adsorption zone, rinsing zone after adsorption, desorption zone, rinsing zone after desorption, excluding water zone were 6, 6, 5, 10, 3 mL/min, respectively. The designed continuous ion exchange system could operate steady at the optimal flow rates, and the outlet concentration of each zone changed periodically. A more scientific recovery process ofL-arginine in industrial fermentation was obtained herein, which not only improved the process continuity, stability and efficiency, but also reduced the consumption of water, base and labour.
fermentation broth;L-arginine; static adsorption; fixed bed; continuous ion exchange
硕士研究生(饶志明教授、许正宏教授为通讯作者,E-mail:raozhm@jiangnan.edu.cn;zhenghxu@jiangnan.edu.cn)。
国家高技术研究发展计划(863计划)(2015AA021004);国家自然科学基金(31300028);江苏省自然科学基金(BK20150002;BK20130137);教育部重点研究项目(113033A)
2017-02-08,改回日期:2017-03-24
10.13995/j.cnki.11-1802/ts.201706001
