E16.5 d胚胎小鼠皮肤细胞作为毛囊重建模型种子细胞的可行性研究
2017-07-31夏学颖张碧芳李丽燕陈容容姜金豆胡葵葵
夏学颖, 何 伟, 孙 赛, 张碧芳, 李丽燕, 陈容容, 姜金豆, 胡葵葵
(1广东省妇幼保健院医学美容科,广州 510010; 2顺德区第一人民医院烧伤整形科)
E16.5 d胚胎小鼠皮肤细胞作为毛囊重建模型种子细胞的可行性研究
夏学颖1, 何 伟2, 孙 赛1, 张碧芳1, 李丽燕1, 陈容容1, 姜金豆1, 胡葵葵1
(1广东省妇幼保健院医学美容科,广州 510010;2顺德区第一人民医院烧伤整形科)
目的 研究胚胎小鼠皮肤及其毛囊的发育规律,探讨胚胎小鼠的皮肤细胞作为毛囊重建模型种子细胞的可行性。 方法 对80只胎龄14.5-18.5 d小鼠及新出生的小鼠皮肤进行连续石蜡切片,连续切片进行HE染色,观察其组织学结构并了解其附件形成情况。免疫荧光染色观察胚胎表皮特异性蛋白细胞角蛋白8(cytokeratin 8,CK8)和18(CK18)在胚胎小鼠皮肤表达。 结果 胎龄14.5 d(embryonic day 14.5,E14.5 d)的胚胎小鼠,表皮层形成表皮细胞仅为 1-2层;E16.5 d的胎鼠背部皮肤较薄,表面凹凸不平并形成褶皱,未见毛囊形成;E18.5 d胎鼠毛囊发育达到旺盛的时期,毛囊数量明显增加;新出生的小鼠皮肤附件基本发育成熟。E16.5 d小鼠皮肤中表皮干细胞标记物CK8和CK18为阳性。 结论 16.5 d胚胎小鼠(E16.5)的皮肤细胞可以作为毛囊重建模型的种子细胞。
种子细胞; 毛囊; 表皮干细胞; 细胞角蛋白; 胚胎小鼠
各种外界因素,如创伤、烧伤和慢性溃疡,所导致的大面积皮肤损伤一直是临床治疗的难点。近年来,随着老龄化人口的增加,慢性创面的发病率有上升趋势[1]。组织工程皮肤作为一种新型组织移植物,有望为复杂难愈创面的治疗提供新的治疗策略[2]。种子细胞是构建组织工程人工皮肤的重要组成部分。表皮干细胞参与了毛囊的发生、修复、改建,并起着十分重要的作用[3,4]。毛囊的形成过程实质上是在胚胎发生期由多种因素诱导表皮干细胞定向分化为皮肤附件细胞的过程[5,6]。目前国内外研究表明,胎鼠真皮细胞或毛囊毛乳头细胞中含有促进皮肤附件形成的信号[7]。本实验通过HE染色观察不同发育阶段的胚胎小鼠皮肤的组织学结构,用两种蛋白标记来观察胚胎小鼠皮肤表皮干细胞情况,探讨胚胎小鼠的皮肤细胞作为毛囊重建模型种子细胞的可行性。
1 材料和方法
1.1 实验动物
C57BL/6J孕鼠,4-6周龄裸鼠(BALB/cAJcl-nu)均为上海市第九人民医院动物中心提供,生产许可证:SCXK(沪)2013-0016。所有动物实验均在动物保护和使用委员会的批准下进行的。交配之前小鼠采取小群饲养。在饲养的过程之中仔细注意观察,选择发情小鼠合笼饲养。合笼后,第2天观察雌鼠是否有阴道栓的形成,观察到阴道栓的当天为妊娠的0 d,取C57BL/6J E14.5 d,E16.5 d,E18.5 d胎鼠,P0天小鼠各20只进行实验。
1.2 标本包埋
颈椎脱臼处死孕鼠,取出胎鼠,分离完整皮肤,在固定液中固定24 h。标本经固定、脱水、透明、浸蜡后包埋。切片脱蜡,然后依次放置于100%、95%、85%、75%的酒精中水化。连续切片进行HE染色。二甲苯Ⅰ、Ⅱ、Ⅲ透明,中性树脂封片,光镜下观察。
1.3 染色
石蜡切片脱蜡后,将组织切片置于盛满EDTA抗原修复缓冲液(pH 9.0)的修复盒中于微波炉内进行抗原修复。切片稍甩干后用组化笔在组织周围画圈(防止抗体流走),在圈内滴加用3%BSA均匀覆盖组织,依次加入一抗和二抗,切片稍甩干后在圈内滴加DAPI染液,避光室温孵育10 min。切片稍甩干后用抗荧光淬灭封片剂封片。切片于尼康倒置荧光显微镜下观察并采集图像。
2 结果
2.1 小鼠皮肤在不同阶段的HE染色
E14.5 d的胚胎小鼠,表皮层形成表皮细胞仅为1-2层。E16.5 d的胎鼠背部皮肤较薄,表面凹凸不平并形成褶皱,未见毛囊形成。随着胎鼠皮肤的发育皮肤褶皱逐渐减少,同时皮肤增厚,表皮层中开始出现局部的聚集并向皮肤的真皮层中凹陷。E18.5 d胎鼠毛囊发育达到旺盛的时期,毛囊数量明显增加,发育中的毛囊逐渐伸长。新出生的小鼠皮肤明显增厚,发育中的毛囊长度和密度均明显增加,皮肤褶皱接近消失趋于平坦(见图1)。
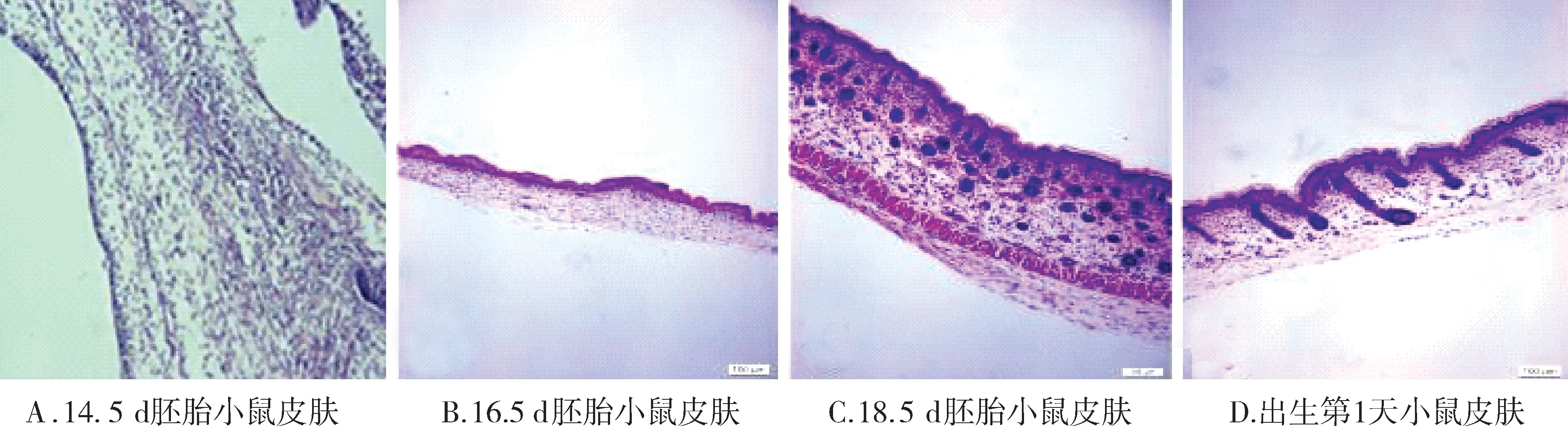
图1 不同时间段胚胎小鼠皮肤及其附件的组织学观察 (×100)Figure 1 Histological observation of fetal mouse skin structure at different development stages (×100)
2.2 E16.5 d小鼠皮肤的免疫荧光染色
对E16.5 d胚胎小鼠皮肤CK8、CK18的间接免疫荧光检测结果显示,早期表皮干细胞标记物CK8、CK18在表皮层阳性表达(见图2),提示在E16.5 d胚胎小鼠皮肤存在大量的表皮干细胞。
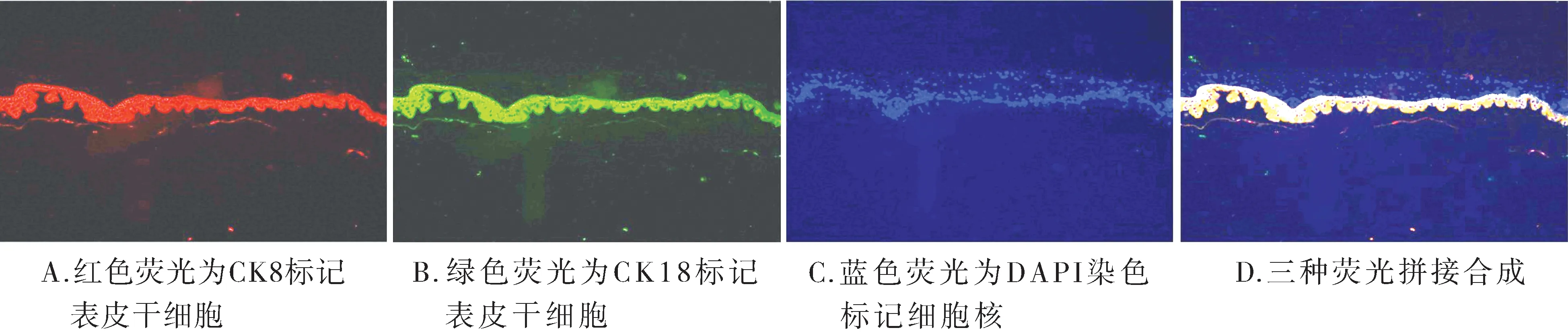
图2 E16.5 d小鼠皮肤CK8/18免疫荧光染色 (×100)Figure 2 Expression of CK8/18 of the mouse embyonic skin at E16.5 d (×100)
3 讨论
理想的组织工程皮肤的形态和功能应尽可能接近正常皮肤。目前临床所用最好的组织工程皮肤并不具备正常皮肤的很多功能和附属器结构[8],缺乏皮肤的附属结构如毛发、皮脂腺和汗腺将会丧失正常皮肤的生理功能(排泄和体温调节等)。因此构建具有皮肤附属结构的组织工程皮肤是亟待解决的重要问题,尤其是寻找合适的种子细胞是其关键。
有实验表明,表皮干细胞在体外可以分化形成平滑肌细胞、神经元细胞、神经胶质细胞和色素细胞[9,10]。所以表皮干细胞非常适合成为体内毛囊重建的种子细胞。胚胎小鼠的表皮细胞和真皮细胞目前常被用于毛囊再生研究的。
了解胚胎小鼠皮肤早期发育,特别是皮肤附件的演变规律,可确定毛囊发育过程中分离和培养及鉴定表皮干细胞的最佳时间,为进一步在毛囊发育过程中寻找干细胞及毛囊发育分子机制的研究提供参考。本实验观察表明,在14.5 d的胚胎小鼠,表皮层形成表皮细胞仅为1-2层。16.5 d的胚胎小鼠是其皮肤附件发育的开始阶段,还未见毛囊形成。随着胎鼠皮肤的发育皮肤褶皱逐渐减少,同时皮肤增厚,表皮层中开始出现局部的聚集并向皮肤的真皮层中凹陷。18.5 d胚胎小鼠的皮肤附件发育是最为旺盛的时期,毛囊数量明显增加,发育中的毛囊逐渐伸长。新出生的小鼠皮肤明显增厚,发育中的毛囊长度和密度均明显增加,皮肤褶皱接近消失趋于平坦。
根据以上实验结果,结合目前国内外相关研究,本实验初步的推断,E16.5 d时是小鼠皮肤附件发育的开始阶段,E18.5 d时小鼠皮肤附件发育最为旺盛的时期,新出生的小鼠的皮肤附件发育基本完成。对于目前表皮干细胞的鉴定尚无严格的统一的标准,比较常用的是CK8/18来进行鉴定。Bilousova等[11]实验表明,CK8/18是外胚层向皮肤发育的早期标记物。因此CK8/18表达阳性的表皮干细胞被认为是多能性的表皮干细胞,在适当的微环境下能够选择分化为各种皮肤组织细胞。本实验16.5 d胚胎小鼠皮肤中表皮干细胞标记物CK8/18为阳性,提示16.5 d的胚胎小鼠皮肤中含有大量的表皮干细胞,同时16.5 d胚胎小鼠的成纤维细胞有很强的诱导附件形成的能力。
综上所述,16.5 d胚胎小鼠未见明显附件形成。此时期小鼠的成纤维细胞有很强的诱导附件形成的能力。其次,16.5 d胚胎小鼠的表皮中,存在大量的表皮干细胞。
[1] 刘传波,黄瑶,叶俊娜,等.糖尿病足溃疡预后相关因素研究[J].中华创伤杂志,2015,30(4):291-297.
[2] Greaves NS,Iqbal SA,Baguneid M,etal.The role of skin substitutes in the management of chronic cutaneous wounds[J].Wound Repair Regen,2013,21(2):194-210.
[3] Abbas O,Mahalingam M.Epidermal stem cells:practical perspectives and potential uses[J].Br J Dermatol,2009,161(2):228-236.
[4] Blanpain C.Stem cells:skin regeneration and repair[J].Nature,2010,464(7289):686-687.
[5] Ma DR,Yang EN,Lee ST.A review:the location,molecular characterisation and multipotency of hair follicle epidermal stem cells[J].Ann Acad Med Singapore,2004,33(6):784-788.
[6] Cotsarelis G.Epithelial stem cells:a folliculocentric view[J].J Invest Dermatol,2006,126(7):1459-1468.
[7] Blanpain C,Horsley V,Fuchs E.Epithelial stem cells:turning over new leaves[J].Cell,2007,128(3):445-458.
[8] 王新刚,吴攀,韩春茂.组织工程皮肤用于慢性创面治疗研究进展[J].中华创伤杂志,2015,31(9):859-862.
[9] Morris RJ,Liu Y,Marles L,etal.Capturing and profiling adult hair follicle stem cells[J].Nat Biotechnol,2004,22(4):411-417.
[10] Amoh Y,Mii S,Aki R,etal.Multipotent nestin-expressing stem cells capable of forming neurons are located in the upper,middle and lower part of the vibrissa hair follicle[J].Cell Cycle,2012,11(18):3513-3517.
[11] Bilousova G,Chen J,Roop DR.Differentiation of mouse induced pluripotent stem cells into a multipotent keratinocyte lineage[J].J Invest Dermatol,2011,131(4):857-864.
Feasibility of follicle reconstitution with embryonic 16.5 d fetal mouse skin cells as seed cells
XIA Xueying1, HE Wei2, SUN Sai1, ZHANG Bifang1, LI Liyan1, CHEN Rongrong1, JIANG Jindou1, HU Kuikui1
(1DepartmentofMedicalCosmetology,GuangdongWomenandChildrenHospital,Guangzhou510010,China;2DepartmentofBurnandPlasticSurgery,FirstPeople’sHospitalofShunde)
ObjectiveTo investigate the periodical changes of hair follicles and explore the feasibility of constructing follicle reconstitution model with embryonic skin cells.MethodsThe skin structures of embryonic 14.5-18.5 d fetal mice and neonatal(P0)mice were observed by HE staining, and the expression of CK8/18 was observed in skin using immunofluorescence.ResultsOnly 1-2 layers of keratinocytes was seen in the E14.5 d fetal mouse. The hair follicles were not found in the E16.5 d fetal mouse. The skin became thicker gradually in the E18.5 d fetal mouse, and the skin appendage development basically completed. Skin appendages were mature in neonatal mice. The expression of CK8/18 was positive in the E16.5 d fetal mouse.ConclusionE16.5 d fetal mouse skin cells can be used as seed cells in follicle reconstitution.
seed cells; hair follicles; epidermal stem cells; CK8/18; fetal mice
广东省自然科学基金资助项目(2014A030313675);广州市科技计划基金资助项目(2014J4100139)
夏学颖,男,1981-03生,硕士,主治医师,E-mail:xiaxueying212@sina.com
2016-11-15
R329.1
A
1007-6611(2017)02-0129-03
10.13753/j.issn.1007-6611.2017.02.008
