板栗过氧化氢酶基因CAT1的克隆及生物信息学分析
2017-07-31苗英杰吴祖芳翁佩芳
葛 颖,苗英杰,吴祖芳,翁佩芳,张 鑫
(宁波大学食品科学与工程系,应用海洋生物技术教育部重点实验室,浙江宁波 315211)
板栗过氧化氢酶基因CAT1的克隆及生物信息学分析
葛 颖,苗英杰,吴祖芳*,翁佩芳,张 鑫
(宁波大学食品科学与工程系,应用海洋生物技术教育部重点实验室,浙江宁波 315211)
为研究板栗过氧化氢酶基因CAT1的功能,旨在为其采后贮藏中品质变化研究提供分子机理基础。以板栗为试材,提取总RNA,通过cDNA末端快速扩增技术(RACE),克隆到板栗CAT1基因cDNA全长,并对其进行生物信息学分析。结果表明,该基因序列全长1485 bp,包含一个1479 bp的开放阅读框,编码492个氨基酸。氨基酸序列分析表明,板栗CAT1与枣(Ziziphusjujuba)、烟草(Nicotianatabacum)、陆地棉(Gossypiumhirsutum)等植物过氧化氢酶CAT1氨基酸序列有较高的相似性。蛋白分析表明,该蛋白分子量为56947.31 Da,理论等电点6.65,属稳定性亲水蛋白;亚细胞定位于过氧化氢酶体,存在30个磷酸化位点,无信号肽。二级结构以α螺旋、无规则卷曲为主。保守结构域预测表明,该基因编码蛋白属于Catalase-like超家族。本研究克隆获得了板栗CAT1基因,为进一步研究该基因的生物学功能奠定了基础。
板栗,CAT1基因,克隆,生物信息学分析
板栗(Castaneamollissimablume)俗称“栗子”,山毛榉科栗属坚果类植物,是我国重要的经济树种,栽培历史悠久,分布广泛[1-2]。板栗果实营养丰富,富含淀粉,蛋白质,脂肪,多种维生素及矿物质等;据测定,每100 g栗实中含碳水化合物42 g、蛋白质4.8 g、脂肪1.5 g、抗坏血酸46 mg、铁15 mg[3-4]。板栗既可生食、炒食和煮食,又可制成糕点、栗酱、罐头、饮料等食品;如糖炒栗子,风味极佳,深受消费者喜爱[5]。然而,板栗果实属顽拗型种子,采后水分含量高、呼吸强度大、酶类活性强、淀粉水解快,贮藏不当极易发生虫蛀、栗实发芽、霉烂等现象[6-7]。目前,国内外学者对板栗采后贮藏保鲜进行了大量的研究,而有关植物体内抗氧化酶活性变化与板栗衰老的分子机制研究报道较少[8-9]。
植物体内的抗氧化系统包括非酶类抗氧化和酶类抗氧化系统。非酶类抗氧化剂包括还原性谷胱甘肽、维生素E、β-胡萝卜及生物碱等;酶类抗氧化剂主要有过氧化氢酶(Catalase,CAT)、超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽还原酶(Glutathione,GR)、抗坏血酸过氧化物酶(Ascorbate,APX)等[10]。过氧化氢酶(CAT)是一类广泛存在于动物、植物和微生物体内的氧化酶,主要分布在植物细胞的过氧化物酶体、乙醛酸循环体和细胞质[11]。它能够清除植物细胞内光呼吸、
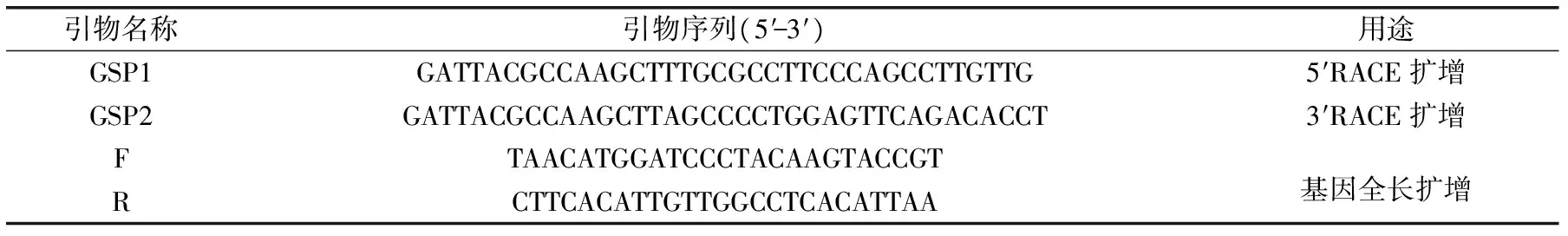
表1 引物序列Table 1 The sequences of primers
线粒体电子传递及脂肪β-氧化等过程中产生的H2O2,从而保护细胞免于过氧化氢酶的毒害[12]。按照催化中心结构差异CAT可分为两类:含铁卟啉结构的CAT,又称铁卟啉酶(FeCAT);含锰离子替代铁的卟啉结构的CAT,又称锰过氧化氢酶(MnCAT)[13]。研究表明,CAT与植物多种抗逆性和氧化衰老等有关[14-15]。近年来,研究者已陆续从多种植物中克隆出相关CAT基因,并对这些基因功能及表达特性进行了研究[16-17]。如王升平等[18]通过RT-PCR技术克隆获得烟草NC89 CAT1基因,并对该基因在烟草NC89的不同组织部位表达特征进行分析。结果发现:CAT1基因在烟草NC89的根、茎、叶等部位均有表达;但在根部表达量较低,在叶中相对表达量最高。温庆放等[19]采用RT-PCR和RACE技术从普通丝瓜果肉克隆到过氧化氢酶CAT1基因。LcCAT1基因全长1755 bp,开放读码框1479 bp,编码492个氨基酸。序列分析发现,LcCAT1氨基酸序列与黄瓜、陆地棉、拟南芥、萝卜等植物相似性较高,均在92%以上。同时定量PCR分析显示,普通丝瓜品种‘福丝3号’叶片中表达量最高,将近为花、果实、根和茎中表达量的5倍,表明LcCAT1基因具有组织表达特异性。程华等[20]利用RACE技术从银杏中克隆获得过氧化氢酶基因GbCAT1的cDNA全长,并定量分析了该基因在其不同组织部位表达特性。结果表明:GbCAT1在银杏的根、茎、叶和果中都有表达,在叶中的相对表达量最高,其次为果、茎和根。而板栗中过氧化氢酶基因CAT1的克隆尚未见报道。本研究以板栗为材料,克隆CAT1基因的cDNA全长,运用生物信息学方法对该基因编码的蛋白质从理化性质、疏水性/亲水性,跨膜结构域,亚细胞定位、磷酸化位点及二级结构等方面进行预测分析,同时构建系统进化树,旨在为后续探索该基因的功能及其在板栗生理活动中的作用奠定基础。
1 材料与方法
1.1 材料与仪器
板栗(Castaneamollissimablume) 选自宁波本地种植魁栗,将栗肉组织切薄片后、以液氮中快速研磨至粉末状,置于-80 ℃超低温冰箱保存,用于总RNA的提取;Trans1-T1 Phage Resistant化学感受态细胞,pEASY-T1克隆载体 全式金生物技术公司(北京);TransTaq® HiFi高保真DNA聚合酶 全式金生物技术公司(北京);FastQuant cDNA第一链合成试剂盒、DNA Marker 天根生化科技有限公司(北京);琼脂糖凝胶回收试剂盒 OMEGA公司(美国),2×Taq PCR Master Mix 鼎国生物技术公司(北京);引物 上海生物工程有限公司合成;其他化学试剂 均为国产分析纯。
5804R高速冷冻离心机 德国Eppendorf公司;IT041-0001梯度PCR仪 上海吉泰依科赛生物仪器公司;DK-S24电热恒温水浴锅 上海精宏实验设备公司;GenoSens1880 凝胶成像采集系统 上海勤翔科学仪器公司;NanoDrop2000超微量核酸蛋白测定仪 美国Thermo Scientific公司。
1.2 实验方法
1.2.1 板栗总RNA的提取及cDNA模板的合成 采用CTAB法提取板栗总RNA[21]。RNA提取质量及纯度以1%琼脂糖凝胶电泳和超微量核酸蛋白仪检测。按照FastQuant cDNA第一链合成试剂盒说明将RNA反转录成cDNA,-20 ℃保存备用。
1.2.2 基因克隆
1.2.2.1 板栗CAT1基因的RACE扩增 使用SMARTer® RACE Kit(Clontech Laboratories,Inc)试剂盒进行板栗CAT1基因RACE扩增。参照试剂盒说明书,以反转录合成cDNA为模板,根据试剂盒说明书关于特异性引物的要求使用Oligo7.0设计5′RACE和3′RACE所需的特异性引物GSP1和GSP2(表1),克隆过程操作依据试剂盒说明书。产物回收、连接转化送测序,将RACE克隆测序片段使用DNASTAR软件拼接。
1.2.2.2 板栗CAT1基因cDNA全长的克隆 根据拼接得到的板栗CAT1基因全长序列,使用Oligo7.0设计全长引物F和R,以板栗反转录cDNA为模板,使用TransTaq®HiFi高保真DNA聚合酶进行PCR扩增;PCR反应体系依据试剂说明书。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s,共30个循环;最后72 ℃延伸5 min[22]。PCR产物经1%琼脂糖凝胶电泳,切下预期大小的目的条带,用琼脂糖凝胶试剂盒(OMEGA公司)回收纯化PCR产物。将回收产物与pEASY-T1 载体(北京全式金)连接,热激法转化Trans1-T1 Phage Resistant化学感受态细胞,取阳性克隆送上海华大基因科技有限公司测序。
1.2.3 生物信息学分析 利用NCBI ORF-finder软件在线分析板栗CAT1基因开放阅读框,并翻译编码其蛋白氨基酸序列。利用Protparam程序(http://web.expasy.org/protparam/)分析编码其蛋白氨基酸组成、分子式、等电点等理化性质。用NCBI的Conserved Domains服务器分析板栗CAT1蛋白氨基酸序列的保守结构域。运用Protscale程序(http://web.expasy.org/protscale/)进行蛋白疏水性/亲水性分析。利用SignaIP4.1server(http://www.cbs.dtu.dk/services/SignalP/)分析预测蛋白N-末端信号肽。通过TMHMM2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测该蛋白的跨膜区域。利用NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)对蛋白磷酸化位点进行分析。用TargetP1.1Server进行蛋白的亚细胞定位。利用Hopfield神经网络HNN(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_hnn.html)进行蛋白二级结构预测,同时用MEGA5.0软件构建蛋白的系统进化树。
2 结果与分析
2.1 总RNA的提取结果与检测
提取板栗总的RNA,经1%琼脂糖凝胶电泳后的结果如图1所示。从图1可以看到3条清晰完整的RNA条带,分别为28S RNA、18S RNA和5S RNA。说明提取总RNA完整性较好。RNA吸光值A260/A280比值均在1.8~2.0之间,纯度较高,可用于后续反转录实验[23]。
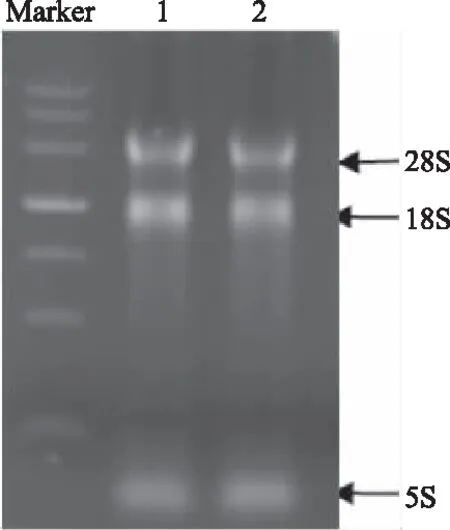
图1 板栗总RNA电泳图Fig.1 Electrophoresis result of total RNA from Castanea mollissima blume注:Marker:DL4500 DNA分子标准量;1和2:总RNA。
2.2CAT1基因全长cDNA的克隆
由设计全长引物F和R,以板栗cDNA为模板,进行全长序列的扩增。扩增产物进行1%琼脂糖凝胶电泳,结果如图2所示。从图2可以看出,PCR结果在1500 bp位置扩增出一条带,与预期结果大小相符。将扩增后PCR产物回收、连接pEASY-T1 Cloning vector,转化大肠杆菌感受态细胞,挑选阳性克隆,经菌落PCR和电泳条带大小鉴定后送华大基因公司(上海)测序,测序序列经DNASTAR软件拼接得到CAT1基因全长1485 bp。运用OFR-finder分析发现,该基因含有一个1479 bp开放读码框,编码492个氨基酸,GeneBank登录号为KY883373。用NCBI在线conserved Domains预测该蛋白的保守结构域,发现板栗CAT1基因编码的蛋白属于Catalase-like超家族(图3)。
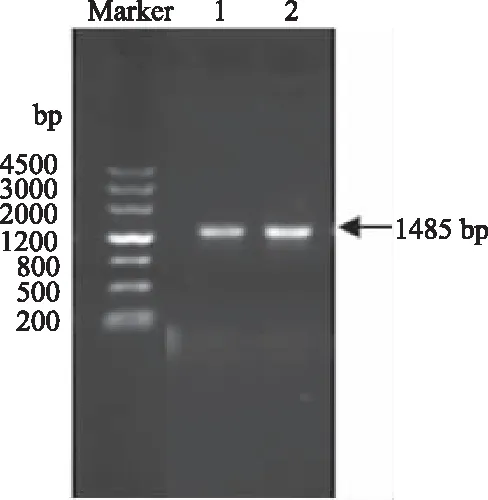
图2 板栗CAT1基因cDNA全长扩增电泳图Fig.2 Full-length cDNA amplification results of Castanea mollissima blume CAT1 gene注:Marker:DNA标准分子量(DL4500); 1和2:CAT1基因cDNA全长扩增产物。
2.3 板栗CAT1蛋白理化性质分析
利用ProtParam软件对板栗CAT1蛋白理化性质进行预测,结果表明,CAT1蛋白分子式为C2578H3873N715O726S14,分子量56947.31 Da,理论等电点(pI)6.65。该蛋白由Ala,Arg等20种氨基酸组成,其中Pro含量最高(7.5%),Cys含量最低(1.2%),负电荷残基(Asp+Glu)61个,正电荷残基(Arg+Lys)57个。不稳定系数(II)为38.87,表明该蛋白为稳定蛋白;消光系数83685(280 nm),脂肪系数(AI)71.52。该蛋白N末端为Met,估计半衰期为30 h(哺乳动物网状细胞,体外),总平均疏水性-0.554,表明该蛋白为亲水性蛋白。
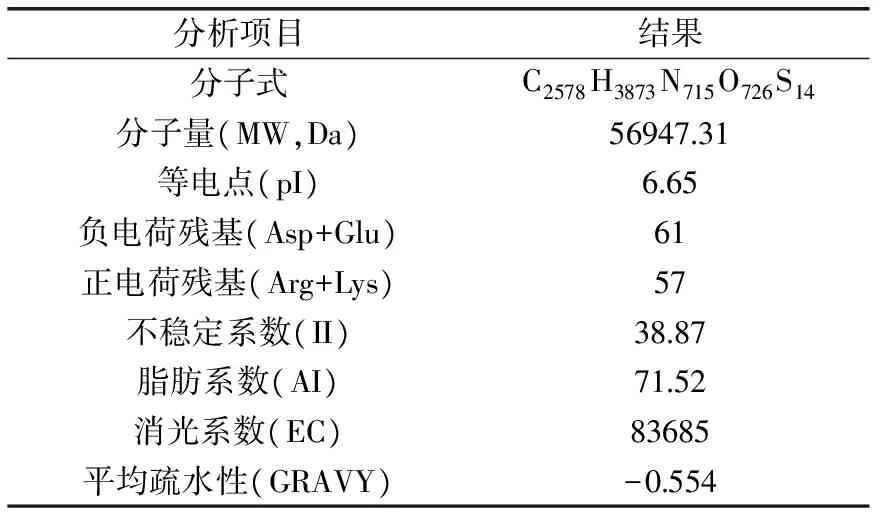
表2 板栗CAT1编码蛋白理化性质Table 2 Physical and chemical properties ofCastanea mollissima blume CAT1 protein
2.4 板栗CAT1蛋白亲水性/疏水性分析
运用ExPASy的ProtScale在线软件对板栗CAT1基因编码蛋白氨基酸序列进行疏水性/亲水性预测。以0为界线,正值为疏水,负值为亲水,且氨基酸分值越低亲水性越强、分值越高疏水性越强。结果表明(图4);该蛋白在第326位分值最高,为2.667,疏水性最强;第427位分值最低,为-2.678,亲水值最强。由图中分布知,该蛋白氨基酸得分大都为负值,结合ProtParam理化性质分析结果,其平均疏水性为-0.554,可推测该蛋白为亲水性蛋白。
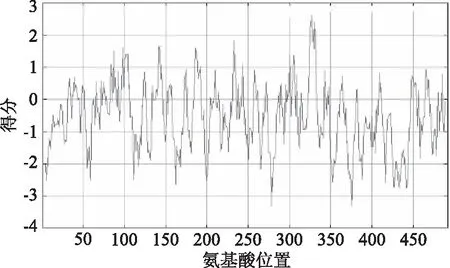
图4 板栗CAT1编码蛋白疏水性/亲水性预测Fig.4 The prediction on hydrophobic/hydrophilic region of Castanea mollissima blume CAT1 protein
2.5 板栗CAT1蛋白亚细胞定位分析
采用TargetP1.1 Server软件对板栗CAT1蛋白进行亚细胞定位,结果如表3所示,该蛋白在线粒体靶向肽(mTP),叶绿体转运肽(cTP),分泌途径信号肽(SP)中分值均较低,分别为0.350、0.148、0.032,而划分为其他不含信号肽的蛋白分值较高为0.614。同时结合PSORT Prediction预测显示,CAT1蛋白在微体(过氧化氢酶体)中概率最高为0.748,线粒体基质空间(mitochondrial matrix space)概率0.100,内质网(腔)中概率0.000,内质网(膜)中概率为0.000。结合以上2种预测,推测CAT1蛋白可能定位于过氧化氢酶体。

表3 板栗CAT1蛋白亚细胞定位Table 3 Subcellular location of Castanea mollissima blume CAT1 protein
注:“-”表示无。2.6 板栗CAT1蛋白跨膜和信号肽分析
用TMHMM2.0工具预测其跨膜结构域,结果显示(图5)该蛋白跨膜螺旋数量为0,氨基酸的螺旋数量为0.00475,第60个氨基酸跨膜螺旋数量为0.00067,表明该蛋白不存在跨膜结构域。属于非跨膜蛋白。同时通过SignalP 4.1分析板栗CAT1蛋白信号肽(图6)所示,其最高原始剪切位点分值(C值),综合剪切位点分值(Y值)和信号肽分值(S值)为分别是第68位甘氨酸和第12位酪氨酸,分值分别为0.113、0.108、0.127;可知信号肽的分值低于0.5,推断该蛋白不存在信号肽,为非分泌蛋白。
图5 板栗CAT1编码蛋白的跨膜结构域分析Fig.5 Transmembrane analysis of Castanea Mollissima blume CAT1 protein
图6 板栗CAT1编码蛋白信号肽预测Fig.6 Signal peptide prediction of Castanea mollissima blume CAT1 protein
2.7 板栗CAT1蛋白磷酸化位点分析
通过NetPhos3.1工具预测板栗CAT1编码蛋白磷酸化位点(图7),结果表明该蛋白含有30个可能的磷酸化位点,其中包括13个丝氨酸(Ser)磷酸化位点,11个苏氨酸(Thr)磷酸化位点和6个酪氨酸(Tyr)磷酸化位点。
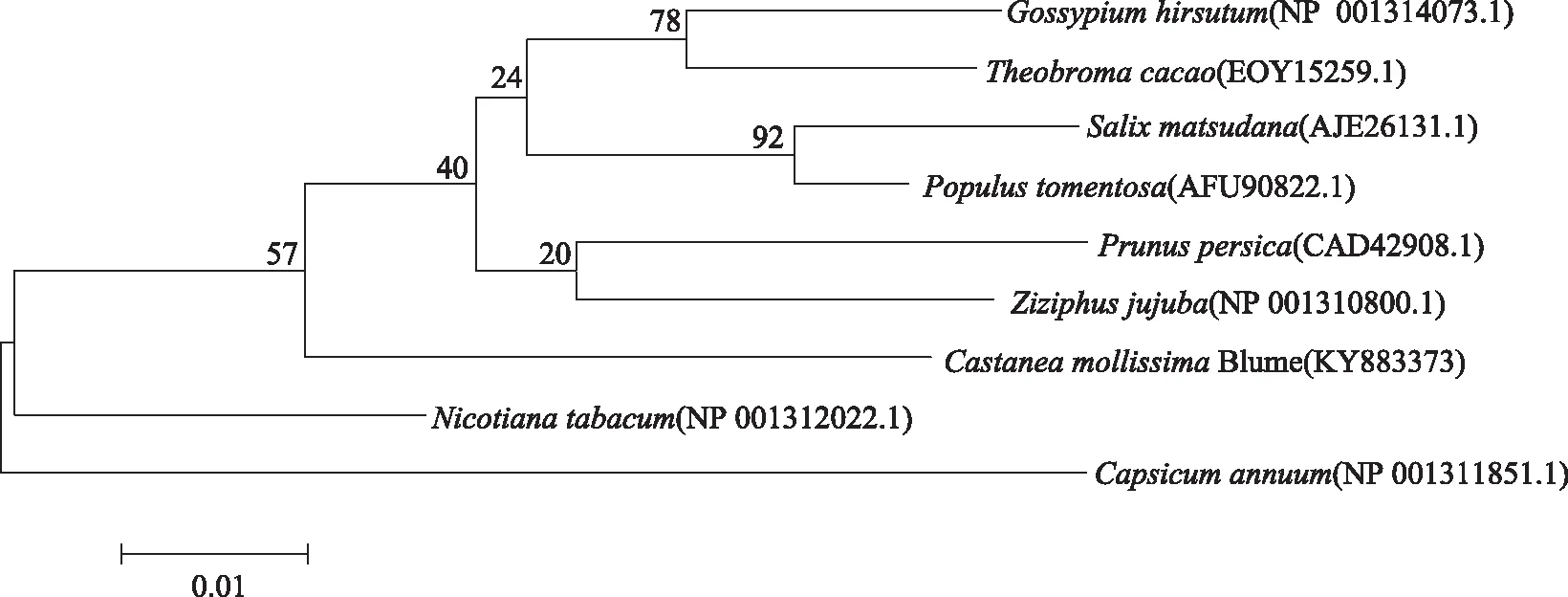
图9 板栗CAT1与其他植物CAT氨基酸序列系统进化树分析Fig.9 Phylogenetic tree analysis of the Castanea mollissima blume CAT1 protein with other plant species
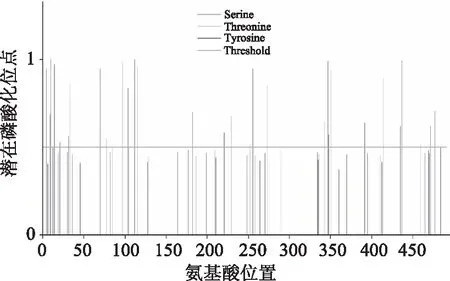
图7 板栗CAT1编码蛋白磷酸化位点Fig.7 Phosphorylation sites of Castanea mollissima blume CAT1 protein
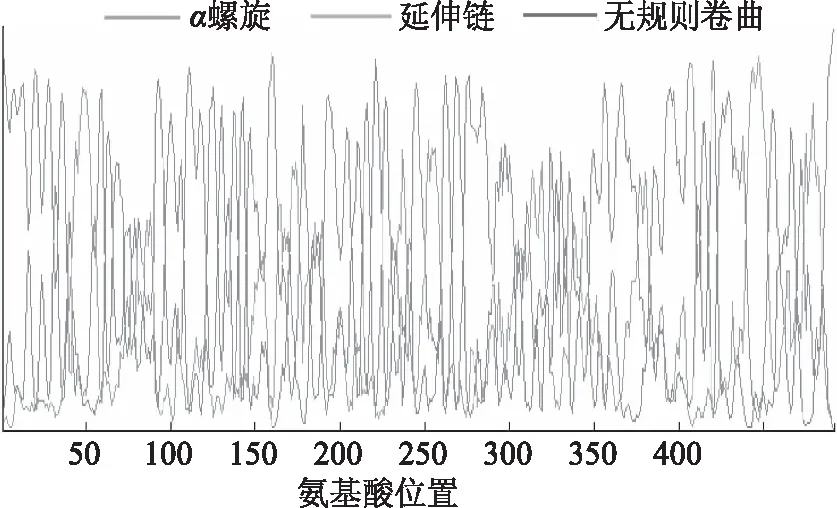
图8 板栗CAT1编码蛋白二级结构预测Fig.8 Secondary structure prediction of Castanea mollissima blume CAT1 protein
2.8 板栗CAT1蛋白二级结构预测
用Hopfield神经网络(HNN)对板栗CAT1蛋白的二级结构果进行预测,结果表明(图8),该蛋白含有α-螺旋(Alpha helix)20.53%、无规则卷曲(Random coil)59.55%、延伸链(Extended strand)19.92%,其中无规则卷曲所占比例最高,其次是α-螺旋和延伸链,不含β折叠的氨基酸。表明该蛋白二级结构主要是以α螺旋、无规则卷曲为主。
2.9 板栗CAT1编码蛋白的氨基酸同源性及进化树分析
将板栗CAT1基因编码蛋白的氨基酸序列在NCBI上进行Blastp检索,结果发现,该氨基酸序列与来自桃(Prunuspersica,CAD42908.1)、烟草(Nicotianatabacum,NP_001312022.1)、陆地棉(Gossypiumhirsutum,NP_001314073.1)、可可(Theobromacacao,EOY15259.1)、毛白杨(Populustomentosa,AFU90822.1)、旱柳(Salixmatsudana,AJE26131.1)、枣(Ziziphusjujuba,NP_001310800.1)、辣椒(Capsicumannuum,NP_001311851.1)等植物CAT氨基酸序列同源性较高,均达到93%以上。将板栗CAT1蛋白氨基酸序列与上述植物CAT氨基酸序列,用MEGA5.0软件通过近临相接法(Neighbor-Joining)构建蛋白序列的进化树(图9),由进化树可知,相同科毛白杨、旱柳聚为一类;棉花与可可、桃与枣分属不同科,在聚类中聚为一类,表明植物CAT编码蛋白在同一科属有较高的同源性,不同科间也有一定程度的同源性;板栗又与以上植物聚为一大类。
3 结论
CAT家族由多基因编码,其表达和活性受温度、盐度、干旱、重金属及臭氧、紫外等多种环境环境因子的影响[24-26]。如玉米中存在CAT1、CAT2和CAT3三种过氧化氢酶的同工酶,它们分别由3个独立的基因编码,且具有各自不同的时空表达模式[27]。小麦中的两种过氧化氢同工酶CAT1和CAT2的表达量与干旱条件相关[28]。本研究运用RACE技术,获得了板栗过氧化氢酶CAT1基因cDNA全长。该基因全长1485 bp,开放阅读框为1479 bp,编码492个氨基酸,最大疏水值2.667。其亚细胞定位在过氧化氢酶体中,这与前人报道的植物细胞CAT主要分布在过氧化物酶体、乙醛酸循环体和细胞质中结论相一致[29]。板栗CAT1与来自桃、烟草、陆地棉、枣等植物过氧化氢酶CAT1氨基酸序列具有较高相似性,达到93%以上。二级结构以α螺旋、无规则卷曲为主。这些分析为进一步探究该基因功能及表达特性等研究提供理论依据。
[1]鄢丰霞,陈俊红. 国内外的栗产业[J]. 河北果树,2013,45(3):23-26.
[2]魏晓霞. 板栗贮藏保鲜技术概述[J]. 中国果菜,2016,36(12):5-7.
[3]朱丽清,高海生,刘绍军. 板栗加工技术研究进展[J]. 食品科学,2011,32(s1):141-143.
[4]高海生,常学东. 我国板栗产品加工技术研究进展[J]. 河北科技师范学院学报,2016,30(2):1-10.
[5]董翠. 板栗饮料的研究进展[J]. 畜牧与饲料科学,2016,37(9):79-81.
[6]翟海瑞,杨劲松. 板栗贮藏保鲜综述[A]. 2011管产学研助推食品安全重庆高峰论坛.
[7]王胜男,王乃红. 影响板栗贮藏保鲜效果的关键因素[J]. 现代农业科技,2016(15):268-269.
[8]Yang B,Jiang G X,Prasad K N,et al. thermal and textural characteristics of star ches isolated from chestnut(CastaneamollissimaBl.)seeds at different degrees of hardness[J]. Food Chemistry,2010,119(3):995-999.
[9]杨娟侠,田守乐,张坤鹏,等. 壳聚对低温“红栗2号”板栗防腐保鲜效果的影响[J]. 安徽农学通报,2013,19(12):108-110.
[10]林宇丰,李魏,戴良英. 抗氧化酶在植物抗旱过程中的功能研究进展[J]. 作物研究,2015,219(3):326-330.
[11]于德玲,王昌留. 过氧化氢酶的研究进展[J]. 中国组织化学与细胞化学杂志,2016,25(2):189-194.
[12]Purew M,Kim Y J,Kim,et al. Isolation of a novel catlase(Cat1)gene from Panax ginseng and analysis of the response of this gene to various stresses[J]. Plant physiology and Biochemistry,2010,48(6):451-460.
[13]Mhamdi A,Queval G,Chaouch S,et al. Catalase function in plant:a focus onArabidopsismutantsas stress-mimic models[J]. Journal of Experimental Botany,2010,61(15):4197-4220.
[14]王凤德,衣艳君,王海庆,等. 豌豆过氧化氢酶在烟草叶绿体中的过量表达提高了植物的抗逆性[J]. 生态学报,2011,31(4):1058-106.
[15]杜建雄,师尚礼,刘金荣,等. 干旱胁迫和复水对草地早熟禾3个品种生理特性的影响[J]. 草地学报,2010,18(1):73-77.
[16]Li J,Liu J,Wang G,et al. A chaperone function of no catalase activity is required to maintain catalase activity and for multiple stress responses inArabidopsis[J]. Plant Cell,2015,27(3):908-925.
[17]Nie Q,Gao G L,Fan Q J,et al. Isolation and characterization of a catalase gene “HuCAT3” from pitaya(Hylocereusundatus)and its expression under abiotic stress[J]. Gene,2015,563(1):63-71.
[18]王升平,杨金广,战徊旭,等. 烟草过氧化氢酶基因CAT1的克隆及表达特征分析[J]. 中国烟草学报,2014,20(5):103-109.
[19]温庆放,刘建汀,朱海生,等. 丝瓜过氧化氢酶基因CAT1的克隆及表达分析[J]. 园艺学报,2016,43(10):2039-2048.
[20]程华,李琳玲,徐峰,等. 银杏过氧化氢酶CAT1的克隆及表达分析[J]. 林业科学研究,2010,23(4):493-499.
[21]张晓丽,代红军. 植物RNA提取方法的研究进展[J]. 北方园艺,2014(8):175-178.
[22]林星谷,孔德仓,庞晓明,等. 冬枣过氧化氢酶基因的克隆及表达分析[J]. 西北植物学报,2012,32(6):1086-1092.
[23]郜祥雄,郑诚乐,钟凤林,等. 锥栗总RNA 提取方法比较及LFY基因克隆研究[J]. 热带作物学报,2014,35(9):1747-1751.
[25]Safari M,Ghanati F,Behmanesh M,et al. Enhancement of antioxidant enzymes activity and expression of CAT and PALgenes in hazel(CorylusavellanaL.)cells in response to low-intensity ultrasound[J]. Acta Physiologiae Plantarum,2013,35(9):2847-2855.
[26]Osipova S V,Permyakov A V,Permyakova M D,et al. Leaf dehydroascorbate reductase and catalase activity is associated with soil drought tolerance in bread wheat[J]. Acta Physiologiae Plantarum,2011,33(6):2169-2177.
[27]刘汉梅,张怀渝,谭振波,等. 玉米catalase-3基因克隆及低温表达研究[J]. 四川农业大学学报,2006,24(3):272-275.
[28]Luna C M,Pastori G M,Driscoll S,et al. Drought controls on H2O2accumulation,catalase(CAT)activity and CAT gene expression in wheat[J]. Journal of Experimental Botany,2005,56:417-423.
[29]徐娟,常雁红,罗晖. 过氧化氢酶的研究和固定化及其应用进展[J]. 安徽农业科学,2014(34):12035-12038.
Cloning and bioinformatics analysis ofcatalase gene(CAT1)fromCastaneamollissimablume
GE Ying,MIAO Ying-jie,WU Zu-fang*,WENG Pei-fang,ZHANG Xin
(Department of Food Science and Engineering,Key Laboratory ofApplied Marine Biotechnology,Ningbo University,Ningbo 315211,China)
The objectives of the present study were to provide a molecular mechanism basis in the studying of quality changes in postharvest and storage fromCastaneamollissimablume,and further exploring the function ofCAT1 gene. Full-lengthCAT1 cDNA was cloned fromCastaneamollissimablume using rapid amplication of cDNA ends(RACE)method,and were analyzed by bioinformatics technology. The results of sequence analysis indicated thatCAT1 had a length of 1485 bp containing a 1479 bp open reading frame which encoded 492 amino acid residues. Amino acid sequence analysis indicated that,CAT1 was high identity with the catalases ofZiziphusjujuba,Nicotianatabacum,Gossypiumhirsutumand many other plants. The predicted molecular weight of the protein was 56947.31 Da with the pI of 6.65. Characteristic analysis of protein results revealed thatCAT1 protein is a stable,non-transmenbrane and hydrophilic protein,located in microbody(peroxisome). It has no signal peptide and contains 30 phosphorylation sites. The conserved domains service analysis indicated thatCAT1 belonged to catalase-like superfamily. The secondary structure prediction showed thatCastaneamollissimablumeCAT1 protein mainly containsα-helix and random coil.CastaneamollissimablumeCAT1 gene were cloned in this study,which laid the foundation for further studying biological of the gene.
Castaneamollissimablume;catalase gene;cloning;bioinformatics
2016-12-27
葛颖(1985-),女,硕士研究生,研究方向:果蔬保鲜方法及作用的分子机制,E-mail:1257718424@qq.com。
*通讯作者:吴祖芳(1963-),男,博士,教授,研究方向:食品生物技术研究,E-mail:wzfwpf@163.com。
TS201.3
A
1002-0306(2017)13-0124-06
10.13386/j.issn1002-0306.2017.13.023
