光学微操纵过程的轴平面显微成像技术∗
2017-07-31安莎1彭彤1周兴1韩国霞1黄张翔1于湘华1蔡亚楠1姚保利1张鹏1
安莎1)2) 彭彤1)2) 周兴1)2) 韩国霞1) 黄张翔1) 于湘华1) 蔡亚楠1)2)姚保利1)† 张鹏1)‡
1)(中国科学院西安光学精密机械研究所,瞬态光学与光子技术国家重点实验室,西安 710119)2)(中国科学院大学,北京 100049)(2016年7月21日收到;2016年9月6日收到修改稿)
光学微操纵过程的轴平面显微成像技术∗
安莎1)2) 彭彤1)2) 周兴1)2) 韩国霞1) 黄张翔1) 于湘华1) 蔡亚楠1)2)姚保利1)† 张鹏1)‡
1)(中国科学院西安光学精密机械研究所,瞬态光学与光子技术国家重点实验室,西安 710119)2)(中国科学院大学,北京 100049)(2016年7月21日收到;2016年9月6日收到修改稿)
光学俘获技术利用光与物质相互作用产生的光势阱效应来实现对微粒的操控,已经成功应用于生物医学、材料科学等交叉领域.在对微粒进行三维俘获时,传统的宽场光学显微技术只能观测到某一平面内微粒的横向运动,对微粒沿轴向运动的观测受到很大限制.本文将轴平面显微成像技术引入光学微粒操控研究中,利用45◦倾斜的反射镜把微粒的轴向运动信息转换到横向平面进行观测,与传统宽场显微成像技术相结合,实现了对二氧化硅小球俘获过程横向和轴向运动的同步观测.该成像方法无需扫描和数据重构,具有实时快速等优点,在新型光束光镊、厚样品三维观测和成像等领域具有潜在的应用价值.
轴平面成像,光学微操纵,光学俘获,光学显微成像
1引 言
光镊利用光与物质间动量传递的力学效应形成的三维梯度光学势阱实现对微粒的操控.自1986年Ashkin等[1]首次提出并实现利用光强梯度力俘获和操纵微粒的光镊概念以来,经历了30年的积累和发展,光学微操纵技术凭借其非接触、无机械损伤、精确操作定位等独特优势,在物理化学、生物医学、材料科学等众多领域得到了广泛应用,并逐渐成为相关学科研究者们不可或缺的研究工具.
近年来,随着光场调控技术的不断进步,基于贝塞尔光束[2,3]、艾里光束[4−6]等具有无衍射、自愈合特性的新型光束[7−10]的相关技术也不断发展,将自加速光束引入光学俘获成为新的研究方向,其独特优势是能够实现沿特定弯曲轨迹对微粒的操控.2013年,Zhang等[11]利用多个艾里光束的叠加产生了光学瓶子光束,并以此实现了对多个微粒的稳定俘获,其轴向信息的获取由一系列垂直于光轴的二维图像重构完成,精度和速度受到限制;2014年,Schley等[12]设计的抗损耗自加速光束可以在吸收介质中传播任意距离,且保持光束主瓣轮廓及强度不变,并首次利用该光束实现了对微粒的非傍轴微操纵,但微粒沿轴向运动的观测需要借助垂直于光轴的显微物镜,这使得该技术在大数值孔径物镜系统中的应用受到限制.传统的宽场光学显微技术可以对物镜焦平面附近垂直于光轴的样品截面成像[13,14],但人们同样对平行于光轴的样品截面信息感兴趣,这就需要发展能够直接获取样品轴向信息的显微成像技术.2008年,Dunsby[15]提出了一种斜平面显微成像技术,该技术能够对样品的离焦面成像,但受光学结构等因素限制,对样品轴向信息的获取能力有限,从而影响了该技术的应用和推广.此外,激光扫描共聚焦显微[16,17]、宽场荧光层析显微[18]等技术均可实现对样品的三维成像,但需要依托扫描系统,限制了成像速度.2014年,Li等[19,20]提出了轴平面光学显微成像技术,该技术利用一个45°倾斜的反射镜把样品的轴向信息转换到横向进行观测.该方法已成功应用到生物组织显微观察中,实现了对小鼠大脑切片的成像.
本文将轴平面光学显微成像技术与光学微操纵技术相结合,以实现对光学俘获过程的三维实时观测.以横向重叠无法分辨的两个微粒作为观察目标,根据45°倾斜反射镜对样品两个正交截面信息的转换原理,以轴向可分辨这两个微粒作为实现轴平面成像的判断标准.理论模拟扩束准直透镜位置对聚焦光斑轴向调控距离的影响,并利用轴平面光学成像技术对此进行实验验证,实验结果表明轴向可调控范围约为20µm,与模拟结果相符.利用宽场显微成像技术对微粒的横向俘获过程进行观测,同时利用轴平面显微成像技术观测俘获微粒的轴向运动过程,实时、快速地实现了对俘获过程中微粒横向和轴向运动的同步观测,并达到了约30µm的轴向动态观测范围.该方法无需扫描和数据重构即可获取物体的轴平面信息.
2实验方法
为实现轴平面成像系统对微粒轴向俘获的观测,我们设计并搭建了如图1(a)所示的光路.半导体激光器(λ=650nm)出射的激光通过透镜L1(f1=50mm)、L2(f2=100mm)组成的扩束准直系统后,经过分束镜BS1后到达物镜Obj1(南京英星公司,100×,NA=1.25,油镜),在其焦平面会聚并俘获微粒.蓝光LED(中心波长λ=480nm)用于系统照明,其发出的光经物镜Obj1收集后由BS1反射,通过透镜L3,L4(f3=f4=200mm)组成的4f系统后到达另一分束镜BS2.经过该分束镜后光被分为两部分,一部分经成像透镜L5(f5=75mm)后,在CCD1上对样品横向(x-y平面)信息成像,另一部分经过与Obj1完全相同的物镜Obj2后在其焦平面成像.物镜Obj2焦平面附近放置一个45°倾斜的反射镜M,该反射镜将样品轴向(x-z平面)信息转换到横向(x-y平面)并通过透镜L6(f6=75mm)成像在CCD2上,从而直接观测到样品的轴向信息.实验中使用的两个CCD(德国Imaging Source公司,DMK23G445)均为1280×960像素,帧速率最高30帧/s.此外,F为截止波长500nm的短波通滤光片,能够保证在照明光通过的前提下滤掉俘获激光,L2的另一作用是通过调节其轴向位置来改变激光经过Obj1后的光场聚焦位置,从而操控微粒沿轴向移动.
图1(b)所示为轴平面成像的原理,Obj1焦平面附近不同轴向深度的三个点1,2,3经过系统后成像于Obj2焦平面附近,该像经45°倾斜的反射镜M反射后转换为横向镜像的1′,2′,3′三个点,再经Obj2及透镜L6组成的成像系统后将轴向信息转换为横向并成像于CCD2的探测面上.

图1 (网刊彩色)光学俘获轴平面显微成像系统装置 (a)实验光路图;(b)轴平面成像原理图;不同颜色的1,2,3点代表不同轴向深度的位置;L1—L6,透镜;BS1,BS2,分束镜;Obj1,Obj2,显微物镜100×/NA1.25;F,短波通滤光片(截止波长500nm);M,反射镜Fig.1.(color online).Optical system for observing particle trapping with the axial plane optical microscopy(APOM).(a)Experimental setup;(b)schematics showing the principle of the APOM.Points 1,2,3in di ff erent colors represent corresponding positions at di ff erent axial depths.L1–L6,lens;BS1,BS2,beam splitter;Obj1,Obj2,objective lens 100×/NA1.25;F,short-pass fi lter(cut-o ffwavelength 500nm);M,mirror.
为实现轴平面成像,需要将反射镜M倾斜45°,这就对显微物镜的数值孔径NA提出了一定要求.如图2所示,红色线条代表入射光线,绿色线条代表反射光线,α为物镜的半孔径角,θ为反射镜M与光轴的夹角.图2(a)中,当α<θ时,所有入射光线经M反射后偏离光轴,无法被Obj收集参与成像;图2(b)中,当α>θ时,部分入射光线经M反射后进入Obj参与成像,此时反射镜M可将样品轴向信息转换为横向进行观测,从而实现轴平面成像.

图2 (网刊彩色)物镜数值孔径和成像关系示意图(a)α < θ;(b)α > θ;Obj,显微物镜;M,反射镜;α,半孔径角;θ,M倾角;红色代表入射光线,绿色代表反射光线Fig.2.(color online).Diagrams showing the e ff ect of Objective NA on the imaging process:(a)α < θ;(b)α > θ.M,mirror;α,half aperture angle;θ,tilted angle of M.The red and green lines represent the incident rays and re fl ected rays,respectively.
根据图2所示,为实现轴平面成像,显微物镜的NA以及反射镜倾角需满足以下关系:

式中n为介质折射率,α为物镜的半孔径角,θ为反射镜M与光轴的夹角.实验中,我们采用油浸物镜,其n=1.52,θ=45°,为满足成像关系,需要NA>1.07.我们采用的显微物镜NA=1.25,大于临界值,满足(1)式关系.理论上物镜数值孔径越大,参与成像的有效光线越多,成像质量越好.但是,一般而言,物镜的NA越大,相应的工作距离越短,所以实验中要根据实际情况权衡物镜NA与工作距离这两个因素.
为实现对微粒轴向运动的观测,我们通过沿光轴移动透镜L2来调控俘获位置,从而达到轴向移动微粒的目的.为了验证该调控方法的可行性,我们采用Zemax光学设计软件进行了模拟,如图3(a)所示.为了获得较大的聚焦点轴向移动距离,我们选L2为f2=50mm的透镜(若选f2=100mm,L2移动10mm,则聚焦点轴向移动距离只有约5µm),即模型采用两个焦距均为50mm的透镜和一个数值孔径NA=1.25的油浸显微物镜组成,其中,d为透镜L2和物镜Obj1入瞳之间的距离,u为物镜Obj1前表面到光束聚焦点(俘获位置)的距离.L1,L2的初始距离为100mm,L2与Obj1的初始距离为50mm,沿光轴方向移动L2,观测俘获位置的变化,模拟结果如图3(b)所示.可以看出,在d=50mm±5mm范围内,透镜L2的移动距离与俘获位置的移动距离之间近似为线性关系,L2移动10mm,相应俘获位置移动约20µm,模拟结果证明可以通过透镜L2调控俘获位置.

图3 俘获位置调控模拟结果 (a)Zemax光学设计软件中的模型,d为透镜L2到显微物镜Obj1入瞳的距离,u为物镜前表面到光束聚焦点的距离;(b)u与d的关系曲线Fig.3.Simulation results of the optical trapping position:(a)Zemax model,d is the distance between L2and the pupil plane of Obj1,and u is the distance between the front surface of Obj1and beam focus;(b)the relationship between u and d.
3结果与讨论
为验证轴平面成像结果,采用如图1(a)所示的实验光路,我们首先沿光轴方向同时俘获两个微粒,然后通过调节系统中45°倾斜的反射镜M,在CCD1和CCD2上同时观测俘获微粒.图4为轴向同时俘获两个SiO2小球时的成像结果.从x-y平面观测时,1,2两个小球相互重叠不可分辨(图4(a)).利用轴平面成像系统,可以直接对其轴向进行成像,结果如图4(b)所示,可以看出在横向两个无法分辨的小球在轴向可清晰分辨,该结果可以作为实现轴平面成像的判断标准.
在实现轴平面显微成像后,我们利用该系统观测了光镊对微粒的俘获过程.图5为光俘获微粒的轴向运动过程.其中,图5(a)—(e)为微粒不同时刻的x-y平面成像结果,图5(f)—(j)为相应的轴平面成像结果(x-z平面).从图中可看出,当微粒沿光轴方向运动时,沿横向(x-y平面)观测,其成像结果表现为微粒在同一位置上清晰程度的变化,而用轴平面成像方法观测微粒轴向(x-z平面)运动时,成像结果表现为微粒的横向运动,且沿这一方向运动的范围约为30µm.将该技术可以应用于光学负向力[21−24]的研究,通过轴平面成像结果中微粒的运动方向就可以判断光对微粒作用力的方向.

图4 轴平面显微成像实验结果 (a)轴向同时俘获两个微粒(1和2)的x-y平面成像结果;(b)利用轴平面系统观测的对应(a)的x-z平面成像结果;微粒为5µm直径的SiO2小球,标尺10µmFig.4.Experimental demonstration of the APOM in optical trapping:(a)The x-y plane image of two overlapping particles(1and 2);(b)the x-z plane image of the two particles.Particles:SiO2beads(5µm in diameter);scale bar:10µm.

图5 光学俘获微粒动态过程的轴平面显微成像实验结果 (a)—(e)x-y平面观测的光俘获单个微粒的运动过程;(f)—(j)x-z平面观测的分别对应(a)—(e)的俘获微粒运动过程;微粒为5µm直径的SiO2小球,标尺 10µmFig.5.Experimental observation of particle trapping dynamics along beam trajectories with the APOM:(a)–(e)The x-y plane images of a single trapped particle at di ff erent time;(f)–(j)the x-z plane images corresponding to Figs.(a)–(e).Particles:SiO2beads(5 µm in diameter);scale bar:10 µm.
为实现轴平面成像技术下对微粒轴向操控的观测,在图1(a)的光路中,将L2换为f2=50mm的透镜,通过轴向调节透镜L2来改变俘获位置.实验结果如图6所示,其中图6(a)—(c)为通过轴向移动透镜L2得到的三个不同位置处微粒x-y平面的成像结果,图6(d)—(f)为分别对应图6(a)—(c)微粒的x-z平面成像结果.从图中可以看出,当微粒沿轴向运动时,在x-y平面直接观测的成像结果表现为微粒由模糊变清晰再变模糊,而利用轴平面成像技术,其x-z平面成像结果表现为微粒的横向移动.实验中,沿不同方向移动透镜L2,相应的轴平面结果显示微粒也随之改变运动方向.
本实验中,我们通过移动透镜L2来调节俘获光场的位置,但这一方法可以调节的范围有限.当L2的位置改变10mm时,俘获焦点的位置变化约为20µm,这与模拟结果以及文献[25]中的理论分析相符.实验中,为了达到稳定俘获效果,需要保证入射光斑充满物镜入瞳,但若想要进一步增大俘获位置的轴向移动,则需在较大范围内改变透镜L2的轴向位置,这又会使物镜入瞳处光斑半径发生变化,影响光场分布,从而导致光镊的俘获能力下降.
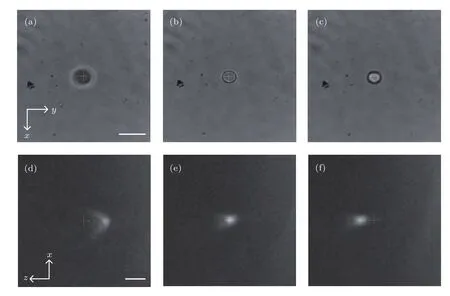
图6 不同俘获位置的轴平面显微成像实验结果 (a)—(c)不同俘获位置的x-y平面成像结果;(d)—(f)对应图(a)—(c)的轴平面(x-z平面)成像结果;微粒为5µm直径的SiO2小球,标尺 10µmFig.6.APOM imaging of particle trapped at di ff erent axial positions:(a)–(c)The x-y plane images of a single particle trapped at di ff erent axial positions;(d)–(f)the x-z plane images corresponding to Figs.(a)–(c);Particles:SiO2beads(5 µm in diameter);scale bar 10µm.
4结 论
本文将光学俘获、宽场显微成像系统和轴平面显微成像技术相结合,实现了对光学微操纵过程的三维实时观测.利用Zemax光学设计软件模拟了俘获光场焦点位置变化对微粒操控的影响.通过轴平面成像技术,成功实现了光学俘获过程中对微粒横向和轴向运动的同步观测.该方法无需扫描和数据重构,具有实时快速等优点,在新型光束光镊、厚样品三维观测和成像等领域具有潜在的应用价值.
[1]Ashkin A,Dziedzic J,Bjorkholm J 1986 Opt.Lett.11 288
[2]Durnin J,Miceli J,Eberly H 1987 Phys.Rev.Lett.58 1499
[3]McQueen C A,Arlt J,Dholakia K 1999 Am.J.Phys.67 912
[4]Siviloglou G A,Christodoulides D N 2007 Opt.Lett.32 979
[5]Siviloglou G A,Broky J,Dogariu A,Christodoulides D N 2007 Phys.Rev.Lett.99 213901
[6]Green fi eld E,Segev M,Walasik W,Raz O 2011 Phys.Rev.Lett.106 213902
[7]Yu X H,Yao B L,Lei M,Yan S H,Yang Y L,Li R Z,Cai Y N 2015 Acta Phys.Sin.64 244203(in Chinese)[于湘华,姚保利,雷铭,严绍辉,杨延龙,李润泽,蔡亚楠2015物理学报64 244203]
[8]Zhang P,Hu Y,Li T C,Cannan D,Yin X B,Morandotti R,Chen Z G,Zhang X 2012 Phys.Rev.Lett.109 193901
[9]Zhao J Y,Zhang P,Deng D M,Liu J J,Gao Y M,Chremmos I D,Efremidis N K,Christodoulides D N,Chen Z G 2013 Opt.Lett.38 498
[10]Yu X H,Li R Z,Yan S H,Yao B L,Gao P,Han G X,Lei M M 2016 Appl.Opt.55 3090
[11]Zhang Z,Zhang P,Mills M,Chen Z G,Christodoulides D N,Liu J J 2013 Chin.Opt.Lett.11 033502
[12]Schley R,Kaminer I,Green fi eld E,Bekenstein R,Lumer Y,Segev M 2014 Nat.Commun.5 5189
[13]Abbe E 1884 J.Royal Microscop.Soc.4 20
[14]Murayam M,Pérez-Garci E,NevianT,Bock T,Senn W,Larkum M E 2009 Nature 457 1137
[15]Dunsby C 2008 Opt.Express 16 20306
[16]Pawley J B 2006 Handbook of Biological Confocal Microscopy(New York:Springer US)pp20–42
[17]Conchello J A,Lichtman J W 2005 Nat.Methods 2 920
[18]Lin H M,Shao Y H,Qu J L,Yin J,Chen S P,Niu H B 2008 Acta Phys.Sin.57 7641(in Chinese)[林浩铭,邵永红,屈军乐,尹君,陈思平,牛憨笨2008物理学报57 7641]
[19]Kim J,Li T C,Wang Y,Zhang X 2014 Opt.Express 22 11140
[20]Li T C,Ota S,Kim J,Wong Z J,Wang Y,Yin X B,Zhang X 2014 Sci.Rep.4 7253
[21]Shvedov V,Davoyan A R,Hnatovsky C,Engheta N,Krolikowski W 2014 Nat.Photon.8 846
[22]Sukhov S,Dogariu A 2011 Phys.Rev.Lett.107 203602
[23]Kajorndejnukul V,Ding W,Sukhov S,Dogariu A 2013 Nat.Photon.7 787
[24]Dogariu A,Sukhov S,Sáenz J 2013 Nat.Photon.7 24
[25]Ren H L 2013 Acta Phys.Sin.62 100701(in Chinese)[任洪亮2013物理学报62 100701]
PACS:07.60.–j,42.65.Jx,87.64.M–,87.80.CcDOI:10.7498/aps.66.010702
*Project supported by the National Natural Science Foundation of China(Grant Nos.11574389,81427802).
†Corresponding author.E-mail:yaobl@opt.ac.cn
‡Corresponding author.E-mail:pengzhang@opt.ac.cn
Observation of particle manipulation with axial plane optical microscopy∗
An Sha1)2)Peng Tong1)2)Zhou Xing1)2)Han Guo-Xia1)Huang Zhang-Xiang1)Yu Xiang-Hua1)Cai Ya-Nan1)2)Yao Bao-Li1)†Zhang Peng1)‡
1)(State Key Laboratory of Transient Optics and Photonics,Xi’an Institute of Optics and Precision Mechanics,Chinese Academy of Sciences,Xi’an 710119,China)2)(University of Chinese Academy of Sciences,Beijing 100049,China)(Received 21 July 2016;revised manuscript received 6 September 2016)
Optical micromanipulation of particles based on the optical trapping e ff ect induced by the interaction between light and particles has been successfully applied to many interdisciplinary fi elds including biomedicine and material sciences.When particles are trapped in three dimensions,the conventional wide- fi eld optical microscopy can only monitor the movement of the trapped particles in a certain transverse plane.The ability to observe the particle movement along light trajectories is limited.Recently,a novel method named axial plane optical microscopy(APOM)has been developed to directly image the axial plane that is parallel to the optical axis of an objective lens.The APOM observes the axial plane by converting the axial information of a sample into that of a transverse plane by using a 45◦-tilted mirror.In this paper,we propose and demonstrate that the APOM serves as an e ff ective tool for observing the axial movement of particles in optical tweezers.By combining with a conventional wide- fi eld optical microscopy,we show that both transverse and axial information can be acquired simultaneously for the optical micromanipulation.As in our fi rst experimental demonstration,we observe two particles which are trapped and aligned along the optical axis.From the transverse image,only one particle is observable,and it is difficult to obtain the information along the axial direction.However,in the axial plane imaging,the longitudinal dipolar structure formed by the two particles is clearly visible.This clearly demonstrates the APOM imaging capability along the axial axis.The numerically simulations on the trapping focal spot against the position of a collimating lens agree well with our experimental APOM results.Furthermore,we directly observe the dynamic capture process of a single trapped particle in transverse plane by conventional wide- fi eld optical microscopy as well in axial plane by the APOM,and can obtain the 3D information rapidly and simultaneously.We point out that the observable axial dynamic range is about 30µm.Taking advantages of no requirement of scanning and data reconstruction,the APOM has potential applications in many fi elds,including optical trapping with novel beams and 3D imaging of thick biological specimens.
axial plane imaging,optical micromanipulation,optical trapping,optical microscopy
10.7498/aps.66.010702
∗国家自然科学基金(批准号:11574389,81427802)资助的课题.
†通信作者.E-mail:yaobl@opt.ac.cn
‡通信作者.E-mail:pengzhang@opt.ac.cn
