差异基因分析揭示多耐药鲍曼不动杆菌生物被膜特性
2017-07-31李海涛齐天杰李帅张鲁涛王伯丽
李海涛 齐天杰 李帅 张鲁涛 王伯丽
·论著·
差异基因分析揭示多耐药鲍曼不动杆菌生物被膜特性
李海涛 齐天杰 李帅 张鲁涛 王伯丽
目的 探索多药耐药鲍曼不动杆菌生物被膜状态独特的基因表达。方法 选取多药耐药鲍曼不动杆菌菌株,在同一菌株两种不同状态下,处于快速生长期的浮游菌体和生物被膜固着生长的菌体,两个样本间进行mRNA的提取和全基因基因表达的分析比对,比较两者间基因表达的差异。研究表达差异的基因在基因功能上的体现。结果 同一菌株两种不同状态下,处于快速生长期的浮游菌体和生物被膜固着生长的菌体,两个样本间进行全基因组基因表达的分析比对,两者间基因表达存在差异。同株细菌的生物被膜状态,是一种独特的存在方式,具有自己独特的生物行为和基因的表达。在两个样本对比中,发现有106个基因表达上调,92个基因表达下调。结论 表达差异基因所编码蛋白,大多参与了生物被膜形成和形态维持。细菌生物被膜形成和形态维持,是通过特殊的信号通路以及信号因子、转录因子所调节的;在浮游细菌的状态,它们不表达或者没有显著表达。
多药耐药鲍曼不动杆菌;基因分析;生物被膜;高通量测序
近期,多药耐药鲍曼不动杆菌已经被列入六大最危险机会致病病原菌之一[1]。目前多重耐药的鲍曼不动杆菌,对目前临床所应用的大多数抗生素均是耐药的,治疗困难,是目前临床亟待解决的难题。多重耐药的鲍曼不动杆菌,其耐药基因在菌落间可以快速获得和稳定遗传,增加了临床治疗难度。鲍曼不动杆菌可以快速对临床应用多种抗生素耐药,是由于β-内酰胺酶的产生,外排泵,孔蛋白,甲基化酶等多种机制,其中还有个更重要的机制,是由于菌体生物被膜的产生[2,3]。鲍曼不动杆菌常常会采用固着的生活方式,不同于浮游细菌状态;分泌多种胞外基质,将菌落包裹其中,形成生物被膜[4]。在传统意义上,人们常常认为细菌的生物被膜就是一团细菌的组合和堆叠,菌落不可逆的黏附在医疗器械或者生物体的表面;然而,近期一些学者通过蛋白质组学分析以及转录组研究发现,生物被膜不单单只是细菌菌体简单混合物。不同于浮游细菌状态,生物被膜下的菌体具有自己独特的生物行为和基因的表达[5]。存在于生物被膜内的细菌,更加耐多种抗生素,耐干燥,耐各种环境压力,甚至是紫外线的照射[2]。这就导致了,在生物被膜状态下,细菌会持续存在于各种医疗器械和导管内表面,难以清除;形成了持续稳定释放菌体的感染源[6]。鲍曼不动杆菌形成生物被膜的能力,已经成为评估其致病力的主要因素之一[7]。细菌生物被膜所引起的相关感染过程包括,细菌的慢性定植、细菌生物被膜稳固的黏附于生物和非生物(中心静脉置管、导尿管、置入支架、人工瓣膜和隐形眼镜等)的表面,引发慢性感染包括心内膜炎、慢性骨髓炎,还会导致细菌长期定植于患者下呼吸道及肺组织[8]。细菌的生物被膜,可以帮助细菌适应不利的外环境和躲避宿主的攻击,使得细菌菌体可以在生物被膜的保护下持久的存在,形成稳定释放细菌的慢性感染源;因此就使得这些致病菌难以治疗和彻底清除[9]。生物被膜实际上是菌体微生物的功能性的聚集体,形成有序的、动态稳定的动态结构。正是由于生物被膜的保护,鲍曼不动杆菌才能持续的存在于宿主的上皮细胞表面或其他无机物表面[10]。形成生物被膜,就像形成了病原菌的慢性感染源,细菌可以迁移感染至下呼吸道及肺组织,导致肺炎反复发生甚至导致慢性阻塞性肺疾病[11]。细菌生长在生物被膜内,得到持久有效的保护,不会被抗菌药物杀灭和清除,导致了细菌耐药能力和致病力的增加,使得多药耐药鲍曼不动杆菌成为致命性病原菌[12]。因此,探索多药耐药鲍曼不动杆菌生物被膜黏附、形成机制,是揭示其独特致病性,揭示其导致慢性感染迁延不愈和反复发生的关键步骤。
1 资料与方法
1.1 细菌菌株的收集 所有多药耐药鲍曼不动杆菌菌株,筛选自河北医科大学第二医院临床检验科细菌室,自2015至2016年,共筛选多重耐药鲍曼不动杆菌菌株608株。菌株入选标准为:(1)鉴定为鲍曼不动杆菌菌属;(2)药敏检测对三类或三类以上抗生素同时耐药。对筛选合格的菌株,采用重复序列聚合酶链反应(REP-PCR)方法,进行DNA同源性分析,分析细菌亚型。分离寻找优势菌株,最后选取数量最多优势菌株多药耐药鲍曼不动杆菌Acinetobacter baumannii BJAB0868作为研究对象。
1.2 样品的制备 选取多药耐药鲍曼不动杆菌Acinetobacter baumannii BJAB0868菌株,培养在MH肉汤培养基中,37℃恒温且持续摇晃的微量振荡器上培养7~8 h。获得快速生长期菌株(检测OD600=0.4)。同一菌株,用无菌肉汤配制浓度为0.7 Mac的菌悬液制备生物被膜。在50 ml微发酵罐中,37℃恒温培养96 h。另有一个空白微发酵罐,作为空白对照。96 h后,用PBS液清洗3次,无菌环境中常温风干,加入1%结晶紫2 ml,染色30 min。再用PBS清洗3次,无菌环境中常温风干,再加入2 ml 95%的乙醇,脱色15 min,用酶标仪测定600 nm吸光度值。均值为空白对照的2倍以上者为生物膜形成阳性。然后电子显微镜镜下观察生物被膜生长情况。
1.3 菌体mRNA的提取和高通量测序 取自同一菌株两种不同状态下的样品,处于快速生长期的浮游菌体和生物被膜固着生长的菌体,2个样本间进行mRNA的全基因组的提取和分析比对,比较两者间基因表达的差异。首先向提取上述两个样本的细菌的总RNA。使用RNAprotect Bacteria Reagent和RNeasy Mini Kit试剂盒。取悬浮菌液,离心,用溶菌酶消化菌体,再加入裂解液,反复收集、提纯,剔除样本中的DNA和蛋白质。得到上述两个样本的细菌总RNA后,再进一步提纯mRNA,进行mRNA的高通量测序分析,应用life-tech Ribominus系列试剂盒提取。首先分离菌体总RNA,对提取的总RNA进行量和质的检测;其纯度应用NanoPhotometer®spectrophotometer检测。提取样本总RNA完整性的检测和评估应用RNA Nano 6000 Assay Kit of the Agilent Bioanalyzer 2100 system。之后,再将上述2个样本进行mRNA的纯化, mRNA的破碎;然后进行反转录、末端修复、PCR扩增。得到样本的基因测序,与公共数据库数据进行比较,通过基因的相似性进行功能注释。
1.4 差异基因GO富集分析 GO(Gene Ontology)是基因功能国际标准分类体系。研究表达差异的基因在基因功能上的体现和表达。GO富集分析方法为GOseq,通过对基因长度的偏好性进行评估,更加准确的计算GOterm中差异基因富集的概率。
1.5 统计学分析 两个基因样本间基因表达的差异性检测,统计学分析fisher精确检验方法,差异表达基因定义为P<0.001,具有统计学意义。检测样本生物学重复、偏倚的筛选方法,采用DEseq进行差异分析,筛选阈值为qvalue<0.001且|Fold Change|>2。
2 结果
2.1 同一菌株不同状态下mRNA表达差异 同一菌株两种不同状态下的样本,处于快速生长期的浮游菌体和生物被膜固着生长的菌体,两个样本间进行mRNA的提取和分析比对,两者间进行全基因组基因表达的两两对比,以P<0.001为差异有统计学意义,我们发现,两个样本间基因表达确实存在差异。结果表明,同株细菌的生物被膜状态,确实是一种独特的存在方式,具有自己独特的生物行为和基因的表达。在2个样本对比中,我们发现有106个基因表达上调,92个基因表达下调。见表1~3。

表1 2组样本间基因表达差异统计结果
2.2 表达差异基因GO富集分析 GO(Gene Ontology)富集分析,是基因功能国际标准分类体系。研究样本中差异基因在功能上的体现。表达差异的基因主要编码参与菌体生物被膜生成和形态维持的蛋白。见表4,图1。
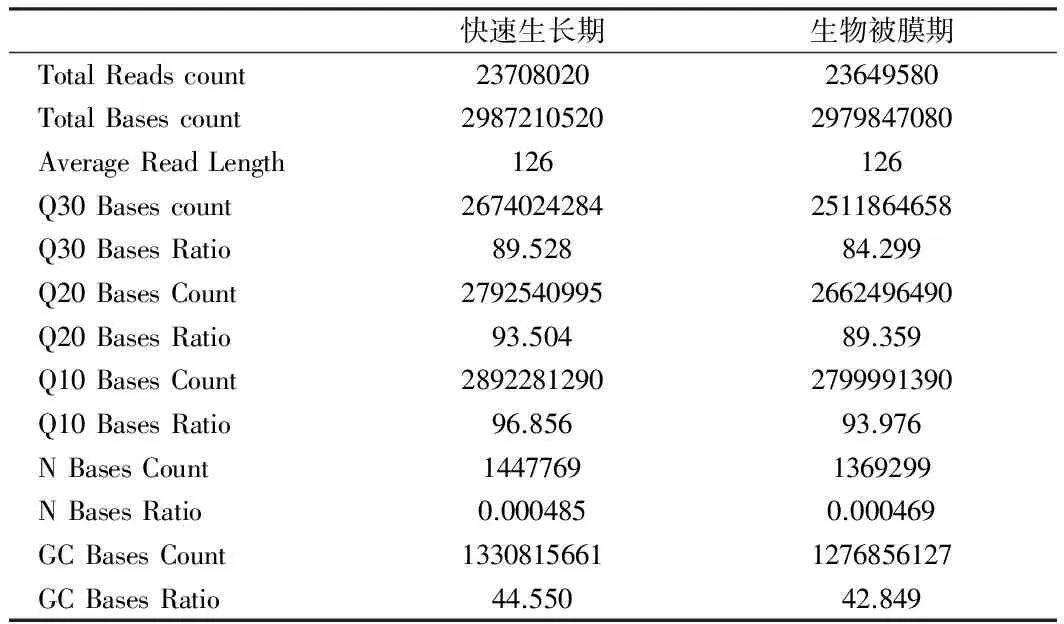
表2 浮游菌状态和生物被膜状态的全基因组信息
3 讨论
细菌生成的生物被膜,在过去被认为是细菌将自身菌落包埋其中,进入自身分泌的多种细胞外基质和复合物中,形成不可逆的黏附的一种动态稳定的结构。近期蛋白质组学分析表明,生物被膜状态细菌有着自身独特的基因表达。在生物被膜状态下的菌株,无论是其形态结构、生理生化特性,还是致病性等,都与浮游状态细菌有着显著的差异;尤其是对抗生素和宿主的免疫系统,具有更强的抵抗力。细菌生物被膜,为菌体提供持续的防护,造成了菌体独特的致病性,以及耐药性的增加和院内慢性感染的反复发生。
表3 表达上调差异基因

细菌从浮游细菌菌状态到生物被膜固着状态,是一系列的复杂过程转变。需要复杂的信号因子调控,包括形成足够密度的菌落,适宜的营养物质和外环境,适宜的阳离子浓度等等,当然还包括复杂的信号转导机制。生物被膜形成从初始黏附表面,到逐渐成熟,需要复杂的信号调控网络,协调各种基因时间顺序表达,包括动态移动、黏附、分泌大量细胞外基质等[13]。生物被膜形成,最重要的步骤中包括初始黏附和信号因子的调控。最初,细菌与生物或非生物表面之间,通过非特异性力相互黏附。之后,细菌与之黏附表面之间,菌落内的菌体之间,黏附力逐渐增加,加之细胞外基质大量分泌合成,使得黏附力逐渐增加,形成不可逆的黏附。此后,菌落间,菌体内会分泌大量细胞外基质,信号因子,维持生物被膜动态稳定[14]。

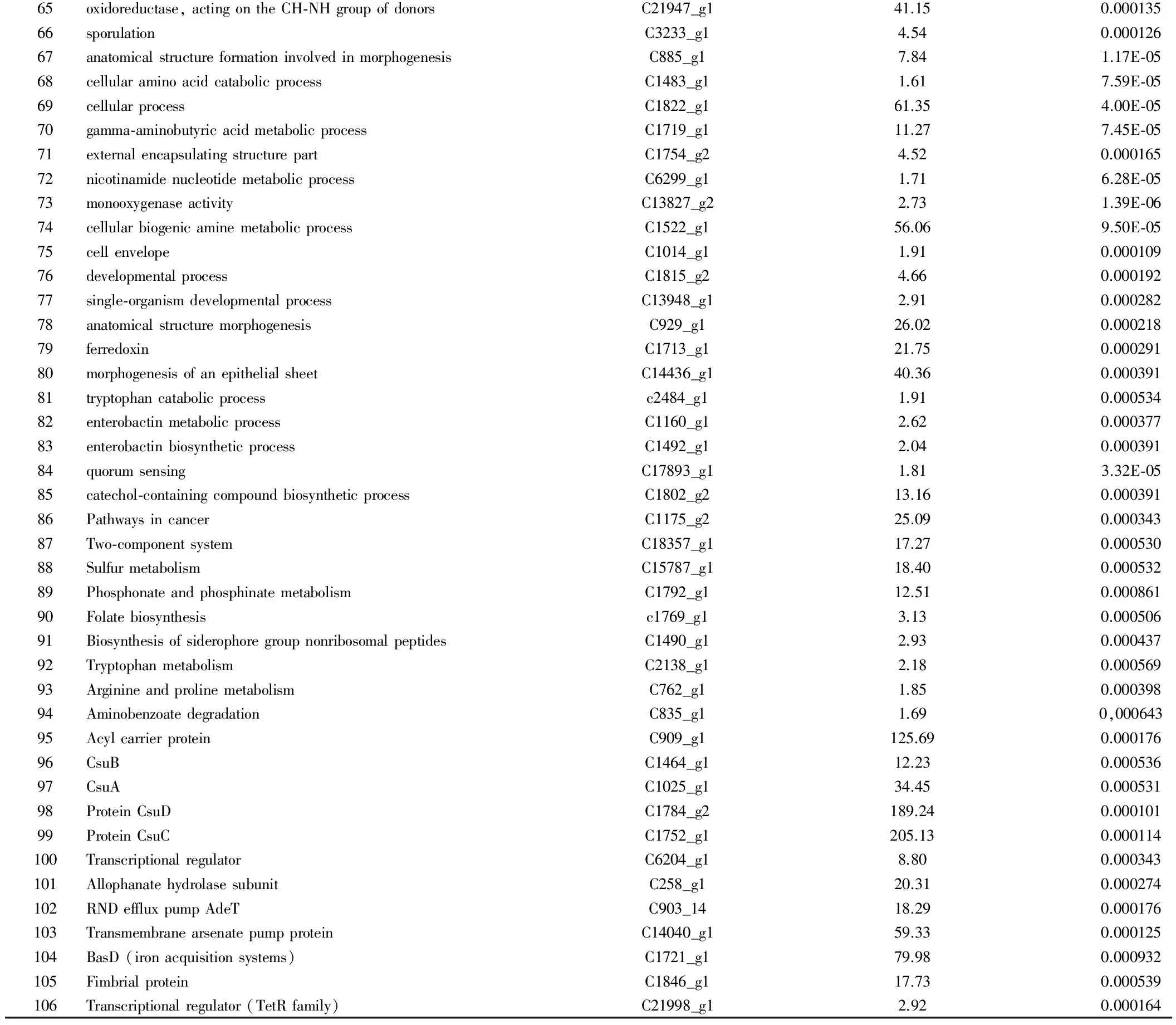
表4 差异基因GO富集分析前30个散点图

图1 差异基因GO富集分析前30个散点图
纵轴表示GO基因名称,横轴表示GO对应的Rich factor,P-value的大小用点的颜色来表示,P-value越小则颜色越接近红色
这些表达差异基因所编码蛋白,都参与了生物被膜形成和形态维持。细菌生物被膜形成和形态维持,是通过特殊的信号通路以及信号因子、转录因子所调节的;在浮游细菌的状态,它们不表达或者没有显著表达。表达差异的基因中,包含多种酶类。在生物被膜生成阶段,多种酶类被激活,氧化还原多种氨基酸及多肽类,激活三羧酸循环,参与了菌体生物被膜的生成和菌体间的信号交互作用,帮助菌体外膜蛋白表达增加,增加生物被膜与表面的黏附。
我们发现,Csu基因簇在生物被膜状态过塑表达,也是生物被膜形成必要条件之一。Csu基因簇介导菌毛过度表达,而菌毛会参与介导生物被膜的初始粘附,还会促使鲍曼不动杆菌粘附运动[15]。
外膜蛋白OmpA也在生物被膜状态下过度表达。生物被膜状态下的菌体,会大量分泌OmpA,参与生物被膜的生成。OmpA可以介导生物被膜的初始粘附,还可以与菌毛特异性结合,介导细菌粘附于宿主上皮细胞。
在表达差异的基因中,还存在多种氨基酸代谢和运输的相关基因。各种氨基酸的代谢和运输,在生物被膜的形成和形态维持中,也发挥着重要的作用。生物被膜的生成依赖于氨基酸代谢的显著升高。例如色氨酸的代谢和转运在生物被膜成熟过程中,发挥重要作用[16]。氨基酸的代谢以及相关调控因子,在生物被膜形成和发展阶段起到了至关重要的作用。
综上所述,生物被膜生物被膜不单单只是细菌菌体简单混合物,它具有自己独特的生物行为和基因的表达;并且为细菌菌体提供持续的保护。GO基因功能研究揭示了生物被膜状态下独特的基因表达和蛋白质表达,我们将会进一步研究,期待能够在此基础上找到抑制生物被膜形成的新方向。
1 Ong CW,Lye DC,Khoo KL,et al.Severe community acquired Acinetobacter baumannii pneumonia:an emerging highly lethal infectious disease in the Asia Pacific.Respirology,2009,14:1200-1205.
2 Higgins PG,Dammhayn C,Hackel M,et al.Global spread of carbapenem resistant acinetobacter baumannii.J antimicrob chemother,2010,65:233-238.
3 Coyne S,Guigon G,Courvalin P,et al.Screening and quantification of the expression of antibiotic resistance genes in acinetobacter baumannii with a microarray,Antimicrob agents chemother,2010,54:333-340.
4 Moreno Paz M,Gomez MJ,Arcas A,et al.Environmental transcriptome analysis reveals physiological differences between biofilm and planktonic modes of life of the iron oxidizing bacteria leptospirillum spp.in their natual microbial community.BMC Genomics,2010,11:409.
5 Marti S,Rodriguez Bano J,Catel Ferreira M,et al.Biofilm formation at the solid liquid and air liquid interfaces by acinetobacter species.BMC Res Notes,2011,4:5-10.
6 Mc Connell MJ,Actis L,Pachon J.Acinetobacter baumannii human infections,factors contributing to pathogenesis and animal models.FEMS Microbiol Rev,2013,37:130-155.
7 Kennedy P,Brammah S,Wills E.Burns,biofilm and a new appraisal of burn wound sepsis.Burns,2010,36:49-56.
8 Hoiby N,Ciofu O,Bjarnsholt T,Pseudomonas aeruginosa biofilm in cystic fibrosis.Future Microbiol,2010,5:1663-1674.
9 Gurung J,Khyriem AB,Banik A,et al.Association of biofilm production with multidrug resistance among clinical isolates of acinetobacter baumannii and pseudomonas aeruginosa from intensive care unit.Indian J Crit Care Med,2013,17:214-218.
10 Hoiby N,Ciofu O,Bjarnsholt T.Pseudomonas aeruginosa biofilm in cystic fibrosis.Future Microbiol,2010,5:1663-1674.
11 Watanabe K,Senba M,Ichinose A,et al.Bactericidal activity in filtrated supernatant of streptococcus sanguinis against multidrug resistant pseudomonas aeruginosa.Tohoku J Exp Med,2009,219:79-84.
12 Gandhi J,Ekhar V,Asplund M,et al.Alcohol enhance acinetobacter buamannii associated pneumonia and systemic dissemination by impairing neutrophil antimicrobial activity in a murine model of infection.Plos One,2014,9:10-17.
13 Southey P,Davies DG,Sauer K.Characterization of temporal protein production in Pseudomonas aeruginosa biofilms.J Bacteriol,2005,187:8114-8126.
14 Marti S,Nait Chabane Y,Alexandre S.Growth of Acinetobacter baumannii in pellicle enhanced the expression of potential virulence factors.Plos One,2011,6:10-10.
15 Wilharm G,Piesker J,Laue M,et al.DNA uptake by the nosocomial pathogen acinetobacter baumannii occurs during movement along wet surfaces.J Bacteriol,2013,195:4146-4153.
16 Hamilton S,Bongaerts R,Mulholland F,et al.The transcriptional programme of Salmonella enterica serovar typhimurium reveals a key role for tryptophan metabolism in biofilms.BMC Genomics,2009,10:599-603.
The unique characteristics of multidrug resistant Acinetobacter baumannii biofilm revealed by difference gene analysis
LIHaitao,QITianjie,LIShuai,etal.
DepartmentofRespiratoryDiseases,TheSecondHospitalofHebeiMedicalUniversity,Hebei,Shijiazhuang050000,China
Objective To investigate the unique gene expression of multidrug resistnat Acinetobacter baumannii biofilm,and to expore its acton mechanism.Methods The multidrug resistant Acinetobacter baumannii strains were selected, and the cells were grown in two different status including floatings thallus at rapid growth phase and thw thallus that growed on biofilm. The two samples were used to extract mRNA and analyze the whole gene expression,and to compare the differences of gene expression.Finally the materialization of expression difference gene in gene function was analyzed.Results In the two different states of the same strain,the two genes which growed at rapid growth phase on biofilm were all extracted and analyzed.The expression of the two genes was different.The biofilm status was indeed a unique way of existence,with its own unique biological behavior and gene expression.In comparison between the two samples,that the expressions of 106 genes were up-regulated,however, the expressions of the other 92 genes were down-regulated.Conclusion The proteins encoded by expression differences genes are involved in biofilm formation and morphous maintenance,which are regulated by specific signaling pathways,signaling factors and transcription factor.In floatings bacteria status,they were not expressed or were not obviously expressed.
multidrug resistance Acinetobacter baumannii; genetic analysis; biofilm; high-flux sequencing
10.3969/j.issn.1002-7386.2017.16.003
项目来源:河北省卫生厅青年科技课题(编号:20130503)
050000 石家庄市,河北医科大学第二医院呼吸一科
齐天杰,050000 石家庄市,河北医科大学第二医院呼吸一科;
E-mail:qitianjie2008@sina.com
R 378
A
1002-7386(2017)16-2414-06
2017-05-16)
