山羊FSHR基因编码蛋白的结构及功能分析
2017-07-31杨佳栋刘月琴张英杰
杨佳栋,刘月琴,张英杰
(河北农业大学动物科技学院,河北保定071000)
山羊FSHR基因编码蛋白的结构及功能分析
杨佳栋,刘月琴,张英杰
(河北农业大学动物科技学院,河北保定071000)
通过ProtParam和ProtScale等在线软件对山羊FSHR基因编码蛋白的理化性质、亚细胞定位及功能进行分析,分别使用Chou-Fasman和同源建模方法对二级、三级结构进行预测,并对采用邻近法构建的不同物种FSHR基因编码蛋白的系统发育树进行分析。结果显示,山羊FSHR基因编码蛋白由695个氨基酸残基组成,包含7个跨膜域和1个G蛋白耦合受体,属于不稳定蛋白,具有较高的亲水性;亚细胞定位结果显示,FSHR基因编码蛋白分布在内质网、液泡和线粒体内;二级结构主要是α螺旋,三级结构富含helix螺旋结构域和长链卷曲。对不同物种FSHR基因编码蛋白进行系统发育分析发现,与其他物种相比,山羊与绵羊、家牛、野猪亲缘关系较近,系统发育分析结果与其动物学分类结果一致。
FSHR基因;系统发育分析;功能预测;蛋白质结构
繁殖性状是评价山羊产业经济效益的重要经济性状[1]。激素作为动物机体分泌的特殊化学物质,对其生长发育、代谢及繁殖等生理活动有重要的调节作用[2]。促卵泡素受体(FSHR)由FSHR基因编码,可通过不同的激素刺激而进行表达[3]。FSHR蛋白作为G蛋白耦合受体超家族成员之一[4],其表达情况决定了卵巢获得促性腺激素(gonadotropic hormone,GTH)反应的能力,FSHR的缺失使卵泡无法正常发育,严重的可导致繁殖力降低甚至不孕[2]。开展山羊FSHR基因研究对提高山羊繁殖性状研究具有重要意义。已有研究表明,FSHR基因表达量对繁殖率有重要影响。在对多浪羊和卡拉库尔羊卵巢的免疫组化研究过程中发现,两者的FSHR基因表达量存在差异,但均与繁殖率相关[5]。与低繁殖力的贵州山羊卵巢组织中的FSHR基因表达量相比,高繁殖力的黔北麻羊、贵州白山羊在同一组织中FSHR基因的表达总量较高[6]。高繁殖力的沂蒙黑山羊卵巢组织中FSHR基因的表达量显著高于低繁殖力的山羊[7]。在超数排卵效果不同的绵羊卵巢中,发现排卵效果与其卵巢上FSHR分布有相关性[8]。人卵泡中的FSHR基因表达不足会引起原发性不育症[9-10]。可见,山羊FSHR基因是影响山羊繁殖性状的重要基因,对FSHR基因进行研究对调控母羊排卵等有重要意义。将生物信息技术和分子育种等知识运用到传统的育种领域,对遗传资源的利用、保护及育种目标的实现有重要价值。为此,利用生物信息学方法对山羊FSHR基因编码蛋白的理化性质、各级结构、亚细胞定位和功能等进行预测,采用邻近法分析不同物种FSHR基因编码蛋白在进化中的亲缘关系,以进一步丰富山羊FSHR基因的遗传信息,以期为FSHR基因编码蛋白的结构和生物学功能研究奠定基础。
1 材料和方法
1.1 材料
本研究中分析的各物种FSHR基因编码蛋白序列均从NCBI数据库中获取,包括东非狒狒(XP_ 003908694.2)、褐家鼠(NP_954707.1)、黑猩猩(XP_ 525753.2)、家马(NP_001157485.1)、家猫(NP_ 001041479.1)、家牛(NP_776486.1)、家犬(XP_ 013972995.1)、绵羊(NP_001009289.1)、人(NP_ 000136.2)、山羊(NP_001272565.1)、小家鼠(NP_ 038551.3)、雪貂(XP_004752903.1)、野猪(NP_ 999551.2)、原鸡(NP_990410.1)。
1.2 方法
应用多种生物信息学在线预测软件对山羊FSHR基因编码蛋白序列进行预测和分析;利用Bioedit软件的ClustalW分别对不同物种FSHR基因编码的蛋白质序列进行比对,并保存为fasta格式文件;再采用MEGA 6.0中的邻近法,选择Pairwise Distance(自举检验法Bootstrap=1 000)对其构建系统发育树并进行亲缘关系分析。
蛋白质一级结构及理化性质预测网址:http:// web.expasy.org/protparam/;疏水性分析网址:http://web.expasy.org/protscale/;蛋白质二级结构预测网址:http://www.biogem.org/tool/chou-fasman/;跨膜结构域分析网址:http://www.cbs.dtu.dk/services/TMHMM/;信号肽分析网址:http://www.cbs.dtu.dk/services/SignalP/;亚细胞定位分析网址:http://www.genscript.com/psort.html;三级结构模型的建立网址:https://swissmodel.expasy.org/;蛋白质功能基序预测网址:http://prosite.expasy.org/;蛋白质功能分类的预测网址:http://www.cbs.dtu.dk/services/ProtFun/。
2 结果与分析
2.1 FSHR基因编码蛋白一级结构及理化性质分析
山羊FSHR基因cDNA全长共2 085 bp,编码695个氨基酸,位于11号染色体,包含10个外显子和9个内含子。由图1可知,FSHR基因编码蛋白中相对含量较高的氨基酸是Leu(12.5%)和Ser (8.3%),等电点为6.4,总的带负电荷残基(Asp+ Glu)为63个,总的带正电荷残基(Arg+Lys)为57个。推测其编码蛋白的分子式为C3545H5547N915O996S40,原子总数为11 043个。
由表1可知,FSHR蛋白不稳定系数为41.86,属于不稳定蛋白,脂肪族氨基酸指数和亲水性总平均值分别为105.80和0.234。第385个氨基酸疏水性值(3.622)最高,第428个氨基酸亲水性值(-2.378)最高(图2),具有较高的亲水性。
图1 山羊FSHR基因编码蛋白的各氨基酸成分
表1 不同物种FSHR基因编码蛋白的理化参数
图2 山羊FSHR基因编码蛋白亲水性/疏水性预测结果
2.2 FSHR基因编码蛋白二级结构分析
Chou-Fasman在线软件预测结果显示,山羊FSHR基因编码蛋白的二级结构主要是α螺旋,所占比例为71.9%,其次是β折叠和β转角,比例分别是51.8%和9.5%,α螺旋主要分布于编码的多肽链主链骨架前、中段,在后端分布也较为均匀。SignalP预测结果表明,第18个氨基酸的最高原始剪切位点得分是0.749,同时该位点被结合的剪切位点最高得分是0.847,第19个氨基酸信号肽的最高得分是0.981,第1~17个氨基酸的信号肽平均得分为0.956,趋向于+1,表明山羊FSHR基因编码蛋白存在信号肽。如图3所示,山羊FSHR基因编码蛋白共有7个跨膜区,分别位于第367—389、402—424、444—466、490—512、532—554、575—597、 607—695个氨基酸,第1—366、425—443、513—531、598—606个氨基酸位于胞外,第390—401、467—489、555—574个氨基酸位于胞内,表明山羊FSHR基因编码蛋白为跨膜蛋白。
图3 山羊FSHR基因编码蛋白信号肽预测结果
2.3 FSHR基因编码蛋白的亚细胞定位分析
亚细胞定位预测结果表明,山羊FSHR基因编码蛋白主要存在于内质网(44.4%),在液泡(22.2%)、线粒体(11.1%)、细胞质(11.1%)及高尔基体(11.1%)中也有少量分布。FSHR基因编码蛋白大部分定位于内质网中,主要发挥受体、运输和结合的作用。
2.4 FSHR基因编码蛋白三级结构分析及其功能位点预测
基于同源建模的方法对山羊FSHR基因编码蛋白建立空间结构,同源建模的模板为4ay9.2.C。如图4所示,FSHR基因编码蛋白含有丰富的helix螺旋结构富集域和长链卷曲。如图5所示,第379—626个氨基酸为GS结构域(29.780),为G蛋白耦合受体(G protein coupled receptor),该结构域对由FSHR受体介导的腺苷酸环化酶-环磷酸腺苷(cAMP)途径有重要作用。
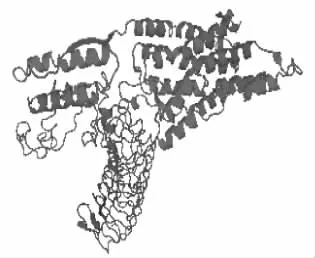
图4 山羊FSHR基因编码蛋白三级结构预测结果
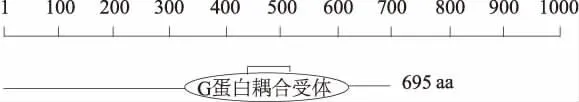
图5 山羊FSHR基因编码蛋白功能位点预测结果
2.5 FSHR基因编码蛋白功能分类的分析
如表2所示,对山羊FSHR基因编码蛋白的功能进行预测,结果表明,该蛋白作为嘌呤和嘧啶在山羊体内发挥生物学作用,并具有运输和结合的功能,这与其主要作为受体和运输载体紧密相关。上述结果提示,山羊FSHR基因编码蛋白的跨膜域与其结合和运输等作用的发挥有重要的相关性。
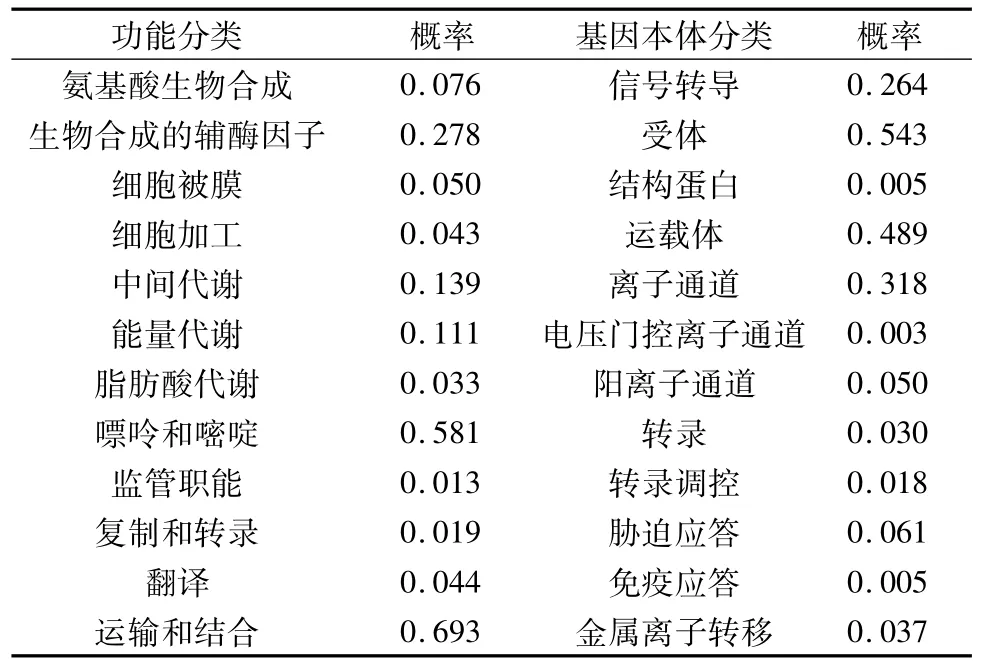
表2 FSHR基因编码蛋白功能分类的预测结果
2.6 不同物种FSHR基因编码蛋白的系统发育分析
如图6所示,对14个不同物种FSHR基因编码蛋白构建的系统发育树进行分析,结果表明,偶蹄目的绵羊、山羊、家牛和野猪聚为一类;食肉目的家猫、家犬和雪貂聚为一类;奇蹄目的家马再与偶蹄目和食肉目相聚类;灵长目的东非狒狒、黑猩猩和人聚为一类;啮齿目的褐家鼠和小家鼠聚为一类。在各聚类中,偶蹄目和食肉目间的亲缘关系较近,两者聚类后再与灵长目和啮齿目聚类,哺乳纲物种与唯一的原鸡(鸟纲)之间亲缘关系最远。
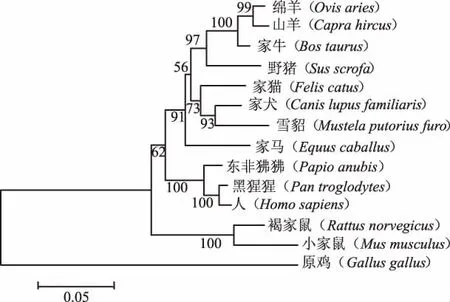
图6 不同物种FSHR基因编码蛋白的系统发育树
3 结论与讨论
促卵泡素(FSH)对雌性和雄性动物的生殖内分泌系统的作用均由其受体FSHR来介导。因此,FSHR受体在靶细胞中的含量及其敏感度对FSH生理功能的实现有重要作用。有研究表明,FSHR含量的高低可能与家畜的繁殖力相关。高产冀中山羊卵巢中FSHR基因mRNA表达量显著高于低产冀中山羊[11]。多态罗曼诺夫绵羊卵泡中FSHR基因mRNA表达量高于法兰西岛绵羊[12]。蛋白质能将生命中的多种形式紧密联系起来,且参与机体内每个细胞的组成[13]。生物信息学的预测和分析,可以使人们从分子的角度更好地了解基因序列所内涵的结构和功能信息[14]。本研究基于生物信息学技术对山羊FSHR基因编码蛋白一级、二级及三级结构、亚细胞定位、功能基序及功能分类进行预测和分析,有利于进一步认识和分析山羊FSHR基因编码蛋白的结构及功能。
本研究通过分析不同物种FSHR基因编码蛋白序列发现,FSHR基因编码蛋白为不稳定的亲水性蛋白。该结果与Sprengel等[15]研究结果一致。人和大多数哺乳动物FSHR基因编码区包含10个外显子和9个内含子,第10个外显子编码跨膜域及胞内域[16-17]。山羊FSHR基因编码695个氨基酸,其中第1—17个氨基酸编码蛋白为信号肽,第367—389、402—424、444—466、490—512、532—554、575—597、607—695个氨基酸为跨膜域。有研究表明,FSHR基因的第2~4个跨膜域部分具有高度的保守性,但其他跨膜域保守性较低。其中第4、第6、第7个跨膜域部分存在同源性,高度保守的Asn-Arg-Tyr三联体基序可能在受体及G蛋白中起核心作用[18]。通过Chou-Fasman在线软件预测[19],α螺旋在山羊FSHR基因编码的整个多肽链主链骨架上所占比例较大,α螺旋与水分子的亲和性较高,能在胁迫状态下阻止内部组织水分子损失[20],推测与其蛋白质的亲水性相关。分子功能的正常发挥依赖于其结构的保守性和稳定性[21-22]。山羊FSHR基因编码蛋白的三级结构富含helix螺旋结构域和长链卷曲。该基因编码蛋白主要存在于内质网中,发挥运输和结合等作用,并在靶细胞中主要扮演受体和运载体的角色。Vannier等[23]在表达FSHR细胞中,通过抗FSHR的单克隆抗体的Western杂交检查到2种不同大小的蛋白质,分别是含有寡糖链的成熟FSHR分子(分子质量87 ku)和富含甘露糖的FSHR前体分子(分子质量81 ku)。山羊FSHR基因编码的第379—626个氨基酸为GS结构域,该结构域是G蛋白耦合受体。该结构域对由FSHR受体介导的cAMP途径有重要作用。Van Loenen等[24]在对支持细胞cAMP的研究中发现,FSH与FSHR的结合需要几个小时,但稳定态的激活仅需几分钟。因此,FSHR功能与FSH的结合和信号转导有密切联系。
本研究对14个不同物种FSHR基因编码蛋白序列构建系统发育树,系统发育分析结果表明,东非狒狒、黑猩猩和人(灵长目)亲缘关系较近,山羊、绵羊、家牛和野猪(偶蹄目)亲缘关系较近,家猫、家犬和雪貂(食肉目)亲缘关系较近,褐家鼠和小家鼠(啮齿目)亲缘关系较近,而原鸡(鸟纲)与上述哺乳动物亲缘关系最远,该结果与动物学分类结果一致。提示FSHR基因在遗传进化过程中具有高度保守性。
[1]陈祥,龙威海,孙振梅,等.贵州地方山羊FSHR基因与繁殖性状的相关性研究[J].农业生物技术学报,2017,25(1):94-101.
[2]黄贺.北极狐ESR和FSHR基因多态性、表达及其与产仔关系的研究[D].哈尔滨:东北林业大学,2013.
[3]王文芳,何玉琴,韩志磊,等.高原甘加型藏羊发情周期不同阶段卵巢FSHR和LHR基因表达差异的研究[J].中国兽医科学,2016,46(1):97-103.
[4]蔡婕,黄荷凤,金帆.卵泡刺激素受体基因突变的研究[J].国外医学(计划生育分册),2005,24(2):69-72.
[5]王惠娥,汪澜,王艳萍,等.多浪羊和卡拉库尔羊卵巢促卵泡素受体的定位研究[J].新疆农业科学,2014,51(5):957-962.
[6]龙威海,丁玫,冯文武,等.卵泡刺激激素受体基因(FSHR)在贵州地方山羊的多态性及表达研究[J].农业生物技术学报,2015,23(6):755-761.
[7]石中强,徐艳,王树迎,等.沂蒙黑山羊子宫中FSHR和LHR基因在发情周期内的表达规律[J].山东农业大学学报(自然科学版),2012,43(1):48-54.
[8]倪和民,张鸿波,刘云海,等.超数排卵效果不同绵羊卵巢卵泡促卵泡素受体的分布[J].中国农业科学,2014,44(6):1232-1238.
[9]Borgbo T,Jeppesen J V,Lindgren I,et al.Effect of the FSH receptor singlenucleotidepolymorphisms(FSHR 307/680)on the follicular fluid hormone profile and the granulosa cell gene expression in human small antral follicles[J].Mol Hum Reprod,2015,21(3):255-261.
[10]周立花,李汶,卢光琇.FSHR、LHR基因突变与多态对女性生殖的影响[J].现代生物医学进展,2010,10 (1):186-189.
[11]唐杰.山羊促性腺激素及其受体mRNA丰度的研究[D].保定:河北农业大学,2007.
[12]Abdennebi L,Monget P,Pisselet C,et al.Comparative expression of luteinizing hormone and follicle-stimulating hormone receptors in ovarian follicles from high and low prolific sheep breeds[J].Biol Reprod,1999,60(4): 845-854.
[13]何建川,邵阳,张波.蛋白质和变性蛋白质二级结构的FTIR分析进展[J].化学研究与应用,2012,24 (8):1176-1180.
[14]李丽莎,李祥龙,毛艳朋,等.山羊TYRP1基因编码蛋白结构及功能的生物信息学分析[J].贵州农业科学,2015,43(10):147-152.
[15]Sprengel R,Braun T,Nikolics K,et al.The testicular receptor for follicle stimulating hormone:Structure and functional expression of cloned cDNA[J].Mol Endocrinol,1990,4(4):525-530.
[16]Marsters P,Kendall N R,Campbell B K.Temporal relationships between FSH receptor,type 1 insulin-like growth factor receptor,and aromatase expression during FSH-induced differentiation of bovine granulosa cells maintained in serum-free culture[J].Mol Cell Endocrinol,2003,203 (1/2):117-127.
[17]Daelemans C,Smits G,de Maertelaer V,et al.Prediction of severity of symptoms in iatrogenic ovarian hyperstimulation syndrome by follicle-stimulating hormone receptor Ser680Asn polymorphism[J].J Clin Endocrinol Metab,2004,89(12):6310-6315.
[18]Gudermann T,Nürnberg B,Schultz G.Receptors and G proteins as primary components of transmembrane signal transduction.Part 1.G-protein-coupled receptors:Structure and function[J].J Mol Med(Berl),1995,73(2): 51-63.
[19]Chou P Y,Fasman G D.Empirical predictions of protein conformation[J].Annual Review of Biochemistry,1978,47:251-276.
[20]Maskin L,Gudesblat G E,Moreno J E,et al.Differential expression of the members of the Asr gene family in tomato(Lycopersicon esculentum)[J].Plant Science,2001,161(4):739-746.
[21]张菊,杜立新,李宏滨,等.绵羊MC4R基因的半定量RT-PCR及生物信息学分析[J].畜牧兽医学报,2010,41(7):804-810.
[22]连云涓.蛋白质二级结构预测的多核学习方法[D].上海:上海交通大学,2013.
[23]Vannier B,Loosfelt H,Meduri G,et al.Anti-human FSH receptor monoclonal antibodies:Immunochemical and immunocytochemical characterization of the receptor[J].Biochemistry,1996,35(5):1358-1366.
[24]Van Loenen H J,Flinterman J F,Rommerts F F G.Follicle-stimulating hormone stimulates rat sertoil cells via relatively low affinity binding sites[J].Endocrine,1994,2(11):1023-1029.
Structure and Function Analysis of Goat FSHR Gene-Coding Protein
YANG Jiadong,LIU Yueqin,ZHANG Yingjie
(College of Animal Science and Technology,Agriculture University of Hebei,Baoding 071000,China)
In this study,the physical and chemical properties,subcellular localization and function of goat FSHR gene were analyzed by ProtParam and ProtScale online software.Chou-Fasman and homology modeling methods were used to predict the secondary structure and tertiary structure,respectively.Phylogenetic trees of different species of FSHR genes were constructed by the neighbor joining method.Goat FSHR gene encoding protein was an unstable protein containing seven transmembrane domains and one G protein coupled receptors,and it had high hydrophilicity.The subcellular localization of FSHR gene was in endoplasmic reticulum,vacuole and mitochondria.Secondary structure was mainly alpha helix,and tertiary structure was rich in helix domain and long chain coil.Compared with other species,goats had closer genetic relationship with sheep,cattle and pig.Different mammalian FSHR genes were highly conserved in evolution,and phylogenetic results were consistent with their animal taxonomy.
FSHR gene;phylogenetic analysis;function prediction;protein structure
S855.3
A
1004-3268(2017)07-0120-05
2017-02-10
国家现代肉羊产业技术体系项目(CARS-39)
杨佳栋(1977-),男,河北保定人,讲师,硕士,主要从事反刍动物营养研究。E-mail:hbnydx96@126.com
