基于Plackett-Burman设计和响应面法优化羊肝抗氧化肽的制备工艺
2017-07-31母应春苏伟文飞李静雯宋玉齐琦杨旭卉
母应春,苏伟,文飞,李静雯,宋玉,齐琦,杨旭卉
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵州大学生命科学学院,贵州贵阳550025)
基于Plackett-Burman设计和响应面法优化羊肝抗氧化肽的制备工艺
母应春1,苏伟1,文飞1,李静雯1,宋玉1,齐琦2,杨旭卉1
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵州大学生命科学学院,贵州贵阳550025)
以羊肝为原料,分别测定5种蛋白酶酶切羊肝所得的酶解液的羟基自由基清除率和肽得率。结果表明,风味蛋白酶羟自由基清除率(84.50%)和肽得率(22.49%)最好。在单因素试验基础上,以羟基自由基清除率为评价指标,采用响应面法优化最佳酶解条件。结果表明,羊肝抗氧化肽制备的最佳酶解条件为料液比1∶3(g∶mL)、加酶量2 400 U/g、酶解温度50℃、pH7.50、酶解时间2.8 h。在此优化条件下,测得实际羟自由基清除率为93.70%,与模型理论值相接近。羊肝酶解产物中总氨基酸含量为57.23 g/100 g,其中疏水性氨基酸和必需氨基酸占总氨基酸含量分别为46.47%和41.63%,表明以风味蛋白酶酶解羊肝产物具有较高的抗氧化活性和营养价值。
羊肝;Plackett-Burman设计;响应面法;氨基酸;抗氧化肽
随着人工合成抗氧化剂的使用,如2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)和丁基羟基茴香醚(butyl hydroxy anisd,BHA),对机体虽能起到一定的抗氧化作用,但研究表明,人工合成抗氧化剂具有毒副作用[1],因此利用酶解技术从动物内脏中制备安全、高效的天然抗氧化剂成为了研究热点。酶解法制备肽因其反应时间短、反应条件温和可控、水解效率高等优点,广泛应用于多肽的制备。
我国每年对羊肉的需求量达数百万吨,随着对羊肉需求量和羊肉加工企业的增多,羊肉加工过程不可避免的产生大量副产物,这些副产物常被加工成饲料或丢弃,不仅产品附加值低,而且污染环境。因此如何对羊肝进行深加工,提高其附加值是亟待解决的问题。羊肝为羊肉加工过程副产物之一。据报道羊肝中除含蛋白质外,还含有铁、磷、钙、尼克酸及维生素A等营养元素[2-3]。目前,对羊肉加工副产物已有相关研究,刘旺旺等[4]利用微生物发酵法研究了羊胎盘多肽的工艺;YANG H等[5]以羊骨胶原蛋白为原料,通过酶解得到了免疫活性肽;韩志慧等[2]以羊肝为原料,研究了羊肝羹的工艺;李黎等[3]以羊肝为原料,研究了明目羊肝口服液的关键工艺。而有关羊肝的酶解及抗氧化肽的制备方面的报道鲜见。
为提高羊肉加工过程中羊肝副产物资源利用率,本研究以羊肝为原料,采用风味蛋白酶酶解,在单因素试验的基础上,以羟自由基清除率为评价指标,进行Plackett-Burman主因素筛选试验,再结合响应面法优化制备羊肝抗氧化肽的酶解工艺,并测定酶解液中氨基酸的组成,以期为羊肝的深加工及提高羊肝资源加工利用率提供理论依据。
1 材料与方法
1.1 材料与试剂
羊肝(蛋白质含量为17.61%):贵州晴隆县海权清真肉羊食品加工有限责任公司提供;牛血清蛋白:上海索宝莱生物有限公司;风味蛋白酶(4万U/g)、中性蛋白酶(40万U/g)、碱性蛋白酶(40万U/g)、木瓜蛋白酶(80万U/g)、胰蛋白酶(4万U/g):广西南宁庞博生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
SpectraMax-190酶标仪:美国Molecular Devices公司;LGJ-10D冷冻干燥机:北京四环科学有限公司;TDL-20M台式高速冷冻离心机:长沙湘仪离心机仪表有限公司;KDN-08系列凯氏定氮仪:浙江托普科学仪器有限公司;PHS-06型酸度计:上海欧宇仪器有限公司;L-8900氨基酸分析仪:日本日立有限公司。
1.3 试验方法
1.3.1 羊肝肽粉的制备

1.3.2 酶解蛋白酶种类筛选
选择风味蛋白酶、中性蛋白酶、碱性蛋白酶、胰蛋白酶和木瓜蛋白酶对羊肝分别进行单酶酶解,并根据表1中的条件进行水解,根据5种酶对羊肝蛋白质水解物的·OH清除率和肽得率的影响确定适用的蛋白酶种类。5种蛋白酶酶解条件见表1。
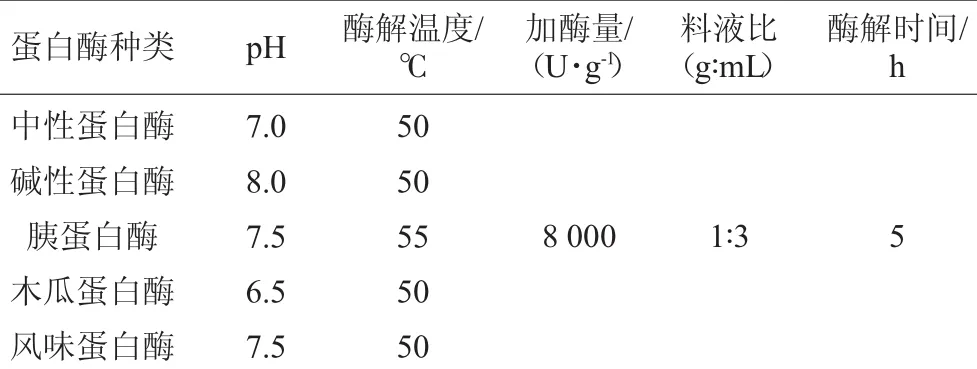
表15 种蛋白酶酶解条件Table 1 Enzymolysis condition of 5 kinds of proteases
1.3.3 单因素试验
研究pH值(6.0、7.0、7.5、8.0、9.0)、酶解温度(40℃、45℃、50℃、55℃、60℃)、加酶量(800 U/g、1 600 U/g、2 400 U/g、3 200 U/g、4 000 U/g、4 800 U/g)、料液比(1∶1、1∶2、1∶3、1∶4、1∶5(g∶mL))、酶解时间(1 h、2 h、3 h、4 h、5 h、6 h)对羊肝抗氧化肽制备工艺的影响。
1.3.4 Plackett-Burman试验设计
Plackett-Burman设计因其能快速有效地从众多因素中筛选出主因素而广泛应用于因素的筛选试验[6]。在单因素试验基础上,以·OH清除率为风味蛋白酶酶解制备羊肝抗氧化肽的响应值,对5个因素进行主效应因子的筛选,每个因素有高(+1)和低(-1)两个水平,共12组试验。试验因素及水平见表2。
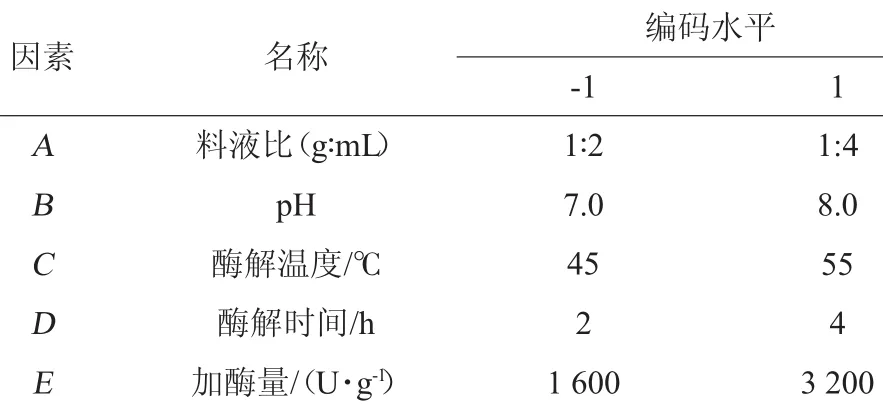
表2 Plackett-Burman试验因素与水平Table 2 Factors and levels of Plackett-Burman experiments
1.3.5 响应面试验设计
选取酶解温度(A)、pH(B)、酶解时间(C)为自变量,以·OH清除率为响应值,结合Box-Behnken中心组合试验设计原理,进行3因素3水平响应面试验。因素与水平编码见表3。

表3 羊肝抗氧化肽制备的最佳酶解条件优化响应面试验因素与水平Table 3 Factors and levels of response surface experiments for hydrolytic conditions optimization of sheep liver antioxidant peptides preparation
1.3.6 测定方法
羊肝酶解产物肽得率测定:参照李亚娴等[7-8]的方法,采用三氯乙酸(trichloroacetic acid,TCA)+双缩脲法测定酶解液中多肽含量。肽得率计算公式如下:
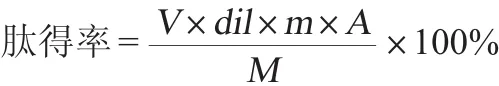
式中:V为羊肝酶解液离心后体积,mL;dil为羊肝酶解液稀释倍数;m为羊肝原料取样质量,g;A为酶解液多肽质量浓度,mg/mL;M为原料中蛋白含量,g。
羟自由基清除率测定:参照李桂峰等[9]的方法进行,羟自由基(·OH)清除率计算公式如下:

羊肝酶解液中氨基酸含量测定:参考文献[10]的方法略微修改,称取羊肝酶解液0.2mL于水解管中,加入6 mol/L HCl溶液5mL,充氮气后,拧紧密封,110℃烘箱中水解24h,待放冷后,用蒸馏水无损转移水解液至容量瓶中1/3处,加4.8 mL的NaOH溶液进行中和,用6 mol/L HCl调节pH值至2~3,再用蒸馏水定容至100 mL容量瓶,取适量浓度的水解液过0.45 μm滤膜至进样瓶约1 mL,采用全自动氨基酸分析仪上样测定。
2 结果与分析
2.1 蛋白酶的筛选
不同的蛋白酶由于作用位点及所结合的底物特性不同,对同一种底物所产生的酶解效果不同。5种蛋白酶对羊肝进行酶解,结果如图1所示。
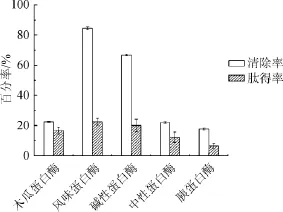
图1 单酶酶解产物对·OH清除率和肽得率的影响Fig.1 Effect of enzymolysis products by single enzyme on·OH scavenging rate and peptide yield
由图1可知,5种蛋白酶清除羟自由基能力和肽得率的大小依次为风味蛋白酶>碱性蛋白酶>木瓜蛋白酶>中性蛋白酶>胰蛋白酶。风味蛋白酶对羟基自由基的清除率为84.50%,肽得率为22.49%。因此,选择风味蛋白酶进行后续试验研究。
2.2 单因素试验
2.2.1 酶解温度对·OH清除率和肽得率的影响

图2 酶解温度对·OH清除率和肽得率的影响Fig.2 Effect of enzymolysis temperature on·OH scavenging rate and peptide yield
由图2可知,随着温度的上升,·OH清除率和肽得率均呈不断升高趋势,当温度为50℃时,两者均达到最大值,为91.85%和21.12%,此后两者均开始下降。这是由于酶解温度超过了该蛋白酶最适酶解温度,致使酶结构发生变性,从而酶活力降低,清除率和肽得率从而开始下降。因此选择酶解温度为50℃。
2.2.2 酶解时间对·OH清除率和肽得率的影响
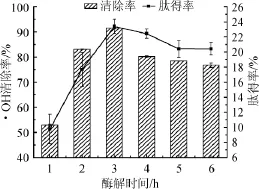
图3 酶解时间对·OH清除率和肽得率的影响Fig.3 Effect of enzymolysis time on·OH scavenging rate and peptide yield
由图3可知,随着酶解时间的延长,羊肝酶解液对·OH清除能力和肽得率不断升高,酶解3 h后,·OH清除率和肽得率开始下降,并逐渐趋于平缓态势。可能是由于在反应前期,酶活力较高,蛋白酶与底物充分接触,此后随着酶解时间的延长,底物质量浓度减少,酶与底物的结合位点随之减少,已被降解成活性的多肽进一步被降解成无活性的氨基酸而使得反应趋于缓慢,并达到一定动态平衡,同时酶的活力也有所降低[11-12]。因此酶解时间选择3 h为宜。
2.2.3 pH值对·OH清除率和肽得率的影响

图4pH值对·OH清除率和肽得率的影响Fig.4 Effect of pH on·OH scavenging rate and peptide yield
由图4可知,在pH值为6.0~7.5时,羊肝酶解液对·OH的清除能力和肽得率随pH的增大不断升高;当pH值为7.5时,两者达到最大值,为90.45%和20.87%,此后两者开始下降,这可能是由于pH增大不适于风味蛋白酶的最佳pH作用条件,影响了酶活性部位有关基团的解离,从而反应速率下降[12]。因此pH值选择7.5为宜。
2.2.4 加酶量对·OH清除率和肽得率的影响

图5 加酶量对·OH清除率和肽得率的影响Fig.5 Effect of enzyme addition on·OH scavenging rate and peptide yield
由图5可知,在加酶量为800~2 400 U/g范围时,羊肝酶解液对·OH的清除率和肽得率随着加酶量的增加不断升高;当加酶量为2 400 U/g时,·OH清除率和肽得率达到最大值,为91.49%和19.01%,此后清除率变化趋于平缓,肽得率逐渐降低。这是由于在底物质量浓度一定条件下,酶添加量的增加有助于酶与底物充分结合,促使反应速率加快,当加酶量过多时,由于底物蛋白结合位点逐渐被占据,中间复合物也达到饱和状态[13-14],清除率趋于平缓,而肽得率降低可能是由于加酶量过多,使得具有活性的多肽进一步水解成无活性的氨基酸所致。因此,选择加酶量为2 400 U/g为宜。
2.2.5 料液比对·OH清除率和肽得率的影响
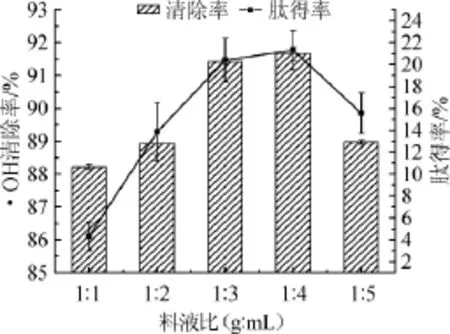
图6 料液比对·OH清除率和肽得率的影响Fig.6 Effect of material-liquid ratio on·OH scavenging rate and peptide yield
由图6可知,料液比在1∶3、1∶4(g∶mL)时,羊肝酶解液对·OH的清除率和肽得率变化相差不大,并且料液比过大,会增加抗氧化肽制备后期的浓缩及水电成本。因此选择料液比为1∶3进行后续试验。
2.3 Plackett-Burman试验关键因素筛选分析
在单因素试验基础上,以·OH清除率为主要评价指标,对料液比、pH、酶解温度、酶解时间和加酶量进行Plackett-Burman因素筛选试验设计及主效应分析,结果见表4、表5。

表4 Plackett-Burman试验设计与结果Table 4 Design and results Plackett-Burman experiments
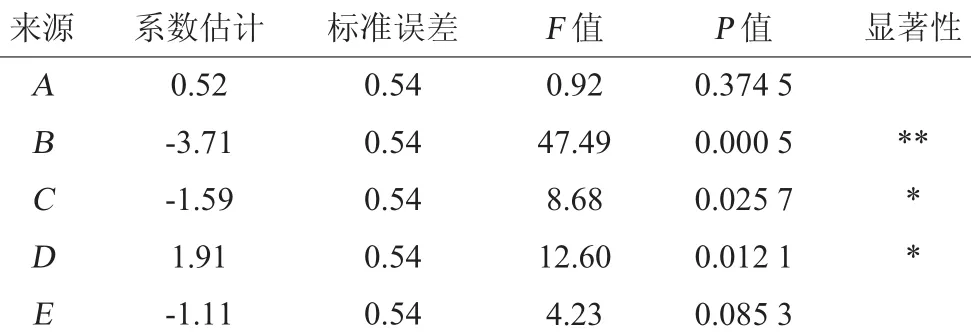
表5 Plackett-Burman试验设计回归分析结果Table 5 Design and results of Plackett-Burman experiments
由表5可知,羊肝酶解产物清除羟自由基能力的因素影响大小依次为B(pH)>D(酶解时间)>C(酶解温度)>E(加酶量)>A(料液比),其中pH对羊肝酶解产物清除羟自由基能力的影响达极显著(P=0.000 5<0.01),而酶解温度和酶解时间对响应值的影响为显著水平(P<0.05),因此选择pH、酶解温度和酶解时间这3个显著因素进行下一步响应面试验设计及结果分析。对于E(加酶量)和A(料液比)等非显著性因素,在后续试验中均选取单因素试验中的最优水平,即加酶量2 400 U/g,料液比为1∶3(g∶mL)。
2.4 风味蛋白酶酶解羊肝的响应面试验及结果
2.4.1 响应面试验设计及结果分析
在单因素结果和Plackett-Burman因素筛选试验基础上,选取酶解温度、pH和酶解时间为自变量,以·OH清除率为主要响应值,进行3因素3水平响应面试验设计,结果见表6,方差显著性分析见表7。
利用Design-Expert V 8.0.6软件对表6数据进行回归分析,得到以羟自由基清除率(Y)为响应值的二次多项式回归方程为:


表6 Box-Behnken试验设计与结果Table 6 Design and results of Box-Behnken experiments
由表7可知,回归模型的P值<0.000 1,说明模型达极显著水平,模型的复相关系数R2=0.988 1,说明试验值与拟合值之间具有高度相关性,调整决定系数R2Adj=0.972 8,说明该模型能解释97.28%羊肝风味蛋白酶酶解产物以羟自由基清除率为响应值的变化。失拟项P值=0.5692>0.05,说明差异不显著,表明模型的方程对数据拟合的较好,能较好的反映各自变量与响应值之间的关系。因此,利用该回归方程能较好的对试验结果进行拟合和预测分析。

表7 回归模型方差分析Table 7 Variance analysis of regression model
模型的一次项C、交互项AC以及二次项A2、B2和C2差异均为极显著(P<0.01),一次项A差异显著(P<0.05)。由表7中各因素的P值可知,3个因素对羟自由基清除率影响大小依次为酶解时间>酶解温度>pH。
2.4.2 各因素之间交互作用的响应面直观图分析
在方差分析结果基础上,利用Design-Expert V 8.0.6软件对酶解温度、pH和酶解时间进行交互作用分析,结果如图7所示。响应面图可以直观地表示出因素交互作用对响应值的影响,而等高线的形状可以反映出交互作用的强弱大小,圆形表示两交互作用不显著,椭圆形表示两者交互作用显著[15-16]。

图7 酶解温度、pH、酶解时间交互作用对羊肝酶解产物·OH清除率的影响的响应面与等高线Fig.7 Response surface plots and contour line of effects of interaction between enzymolysis temperature,pH and time on the·OH scavenging rate of sheep liver enzymolysis products
由图7可知,酶解温度和pH、pH和酶解时间的等高线形状近似圆形,说明酶解温度和pH、pH和酶解时间之间的交互作用不显著。
利用Design-ExpertV8.0.6软件对羊肝酶解制备抗氧化肽工艺进行优化预测,得到最佳制备工艺条件为料液比1∶3(g∶mL)、加酶量2 400 U/g、酶解温度49.8℃、pH7.51、酶解时间2.78 h,在此酶解工艺条件下,羟自由基清除率的预测值为93.76%。
2.4.3 最佳工艺条件的验证
为了进一步验证模型预测的最佳工艺条件的准确性,同时考虑实际操作条件,将酶解工艺条件修正为料液比1∶3(g∶mL)、加酶量2 400 U/g、酶解温度50℃、pH7.50、酶解时间2.8 h。在上述最佳工艺条件下,进行3次验证试验,得到羟自由基清除率为93.86%、93.91%、93.32%,平均清除率为93.70%,与模型理论值相接近。说明利用该模型能较好的预测羊肝抗氧化肽制备的工艺过程。
2.5 氨基酸组成分析
氨基酸的组成在一定程度上影响酶解物的生物活性。由表8可知,羊肝风味蛋白酶酶解液中含有甘氨酸、丙氨酸、缬氨酸、亮氨酸、脯氨酸、蛋氨酸、苯丙氨酸、酪氨酸和异亮氨酸等疏水性氨基酸[17]和必需氨基酸,占总氨基酸含量分别为46.47%和41.63%。研究表明,疏水性氨基酸在脂相中具有良好的溶解性,从而保证了酶解物具有较强的抗氧化活性[17]。此外,酶解液中还含有对某些二价过渡金属离子(Fe2+、Cu2+)具有较强螯合金属能力的组氨酸(His)和酸性氨基酸(Asp、Glu),能有效抑制羟自由基的生成,从而达到抗氧化的功效[1,18],其占总氨基酸含量的29.89%。羊肝酶解液中疏水性氨基酸和较强金属螯合能力氨基酸的存在,为其具有较强抗氧化活性提供了可能。
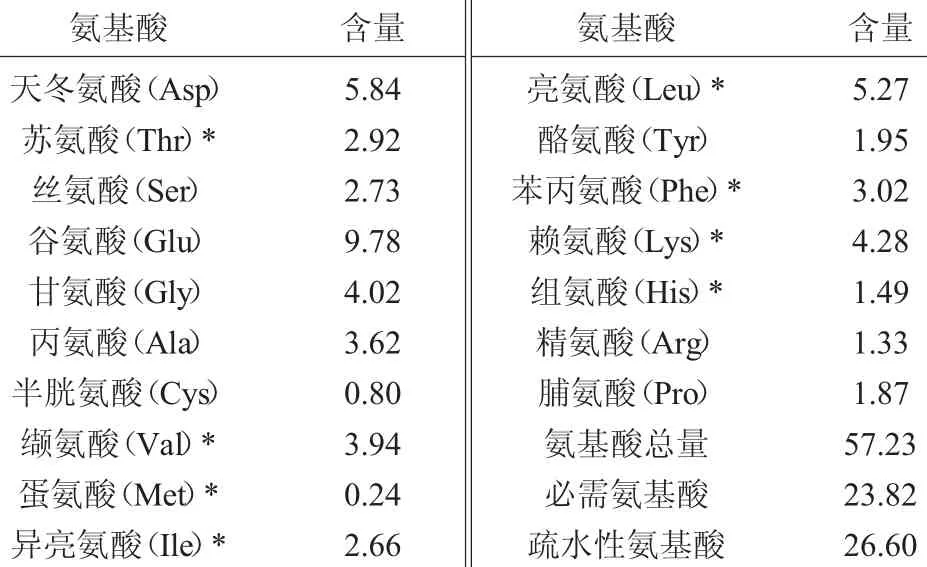
表8 羊肝酶解液氨基酸结果分析Table 8 Result analysis of amino acid of sheep liver enzymatic hydrolysis solution g/100 g
3 结论
在羟自由基清除率和肽得率为评价指标的蛋白酶筛选试验下,得到酶解羊肝的最佳蛋白酶为风味蛋白酶。在单因素基础上,对酶解温度、酶解时间、pH、加酶量和料液比5个因素进行Plackett-Burman因素筛选试验分析,得到对羟自由基清除率影响显著的三个主效应因素:酶解温度、pH、酶解时间。通过分析,得到羊肝抗氧化肽的最佳酶解条件为料液比1∶3(g∶mL)、加酶量2 400 U/g、酶解温度50℃、pH 7.50、酶解时间2.8 h。在此最佳条件下,得到羊肝酶解产物清除羟自由基的清除率为93.70%。氨基酸结果表明,羊肝酶解液含有疏水性氨基酸和较强螯合金属离子能力的组氨酸(His)和酸性氨基酸(Asp,Glu),占总氨基酸含量分别为46.47%和29.89%。试验研究表明,该抗氧化肽制备工艺条件可行,以风味蛋白酶酶解羊肝产物具有较强的抗氧化活性,对羊肝的资源利用及开发提供了新的思路,也为羊肝的深加工提供了理论依据。
[1]李致瑜,庄玮婧,张宁宁,等.Alcalase蛋白酶酶解大黄鱼内脏制备抗氧化肽[J].中国食品学报,2016,16(8):109-117.
[2]韩志慧,隋姣,马俪珍.明目羊肝羹的工艺技术研究[J].山西农业科学,2013,41(3):254-258.
[3]李黎,马俪珍,唐燕.明目羊肝口服液关键工艺优化参数研究[J].食品科技,2012,37(5):92-95.
[4]刘旺旺,侯银臣,程永霞,等.羊胎盘多肽的制备及其清除自由基能力的研究[J].中国酿造,2014,33(9):89-93.
[5]YANG H,LIU Y,MA L,et al.Hydrolyzing condition and immunocompetenceof sheep bone protein enzymatic lysates[J].Agr Sci China,2009, 8(11):1332-1338.
[6]孟雅红,李辉.Plackett-Burman设计和响应面法优化超声协同酶法提取鸡油菌多糖工艺[J].食品工业科技,2015,36(21):242-248.
[7]李亚娴,谷越,汪秋宽,等.澳洲秃参酶解制备多肽的工艺优化[J].食品工业科技,2016,37(16):215-219.
[8]刘廷强,严泽民,周华峰,等.蚯蚓小分子多肽提取物的制备及抗氧化活性[J].江苏农业科学,2016,44(7):463-466.
[9]李桂峰,王向东,赵国建,等.酶解双孢菇蛋白制备抗氧化肽的研究[J].中国食品学报,2011,11(5):37-43.
[10]王雪芹,邢荣娥,刘松,等.鲐鱼蛋白酶解工艺优化及酶解物的抗氧化活性测定[J].现代食品科技,2013,29(5):1023-1028.
[11]韦海胜,常虹,段振华,等.牡蛎肉酶解液的抗氧化工艺研究[J].食品科技,2012,37(6):150-153.
[12]范三红,胡雅喃,何亚.响应面法优化菊芋渣酶解制备抗氧化肽工艺[J].食品科学,2015,36(8):49-53.
[13]黄群,杨万根,余佶,等.杜仲籽粕蛋白酶解制备抗氧化肽工艺优化[J].食品科学,2013,34(17):205-209.
[14]丛艳君,于晓凤,陈澍.响应面法优化草鱼内脏蛋白质酶解工艺[J].食品科学,2015,36(10):43-48.
[15]唐素婷,母应春,赵泽伟,等.鸭心蛋白酶解条件优化及其抗氧化活性研究[J].食品科技,2015,40(12):100-106.
[16]陈燕,王文平,邱树毅,等.响应面法优化超声波强化提取薏苡仁酯[J].食品科学,2010,31(8):46-50.
[17]张艳萍,戴志远,张虹.贻贝蛋白的酶解及其酶解物的抗氧化活性研究[J].中国食品学报,2012,12(1):10-18.
[18]KIM G,JANG H,KIM C.Antioxidant capacity of caseinophosphopeptides prepared from sodium caseinate using alcalase[J].Food Chem, 2007,104(4):1359-1365.
Optimization of preparation technology of antioxidant peptides from sheep liver by Plackett-Burman design and response surface methodology
MU Yingchun1,SU Wei1,WEN Fei1,LI Jingwen1,SONG Yu1,QI Qi2,YANG Xuhui1
(1.School of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China; 2.College of Life Sciences,Guizhou University,Guiyang 550025,China)
Using the sheep liver as raw material,the hydroxyl free radical scavenging rate and peptide yield of enzymatic hydrolysis solution was obtained from sheep liver,the activity of five protease were determined.The enzyme screening results showed that hydroxyl free radical scavenging rate(84.50%)and peptide yield(22.49%)ofenzymatic hydrolysissolution byflavor protease were the optimal.On the basisofsingle factor experiments, with hydroxyl free radical scavenging rate as evaluation index,the optimum enzymolysis conditions were optimized by response surface method.The results showed that the optimum hydrolytic conditions of sheep liver antioxidant peptides preparation were material-liquid ratio 1∶3(g∶ml),enzyme addition 2 400 U/g,enzymolysis temperature 50℃,pH 7.50 and enzymolysis time 2.8 h.Under the conditions,the actual hydroxyl free radical scavenging rate was 93.70%,which was close to the model theoretical value.The total amino acid content in the sheep liver enzymolysis products was 57.23 g/100 g,in which the contents of hydrophobic amino acid and essential amino acid were 46.47%and 41.63%,respectively.It indicated that sheep liver enzymolysis products by flavor protease had high antioxidant activity and nutritional value.
sheep liver;Plackett-Burman design;response surface methodology;amino acid;antioxidant peptides
TS251.95
0254-5071(2017)07-0161-06
10.11882/j.issn.0254-5071.2017.07.035
2017-03-30
黔西南州科技计划重点项目(2016-1-117);贵州大学研究生创新基金项目(研理工2016057)
母应春(1974-),女,副教授,硕士,研究方向为食品生物技术。
