snoRNA来源的pi—sno81对乳腺癌中FOXO3a表达的影响
2017-07-29陈欣欣胡小戊夏婷
陈欣欣+胡小戊+夏婷

[摘要] 目的 探讨snoRNA来源的piRNA在乳腺癌中对FOXO3a基因的影响。 方法 将5个化学合成的pi-snoRNAs(pi-sno44/74/75/78/81)分别转入MDA-MB-231乳腺癌细胞后收样提取总RNA,检测每个piRNA对FOXO3a mRNA水平的影响,找出对FOXO3a作用最明显的piRNA,验证其对FOXO3a蛋白水平的影响;收集2016年3月~2016年10月在我科行乳腺根治手术的乳腺癌患者术后新鲜肿瘤及瘤旁标本28对,检测其中pi-sno81、sno81及FOXO3a的表达情况;应用典型相关分析对pi-sno81、sno81及FOXO3a在乳腺癌及癌旁乳腺组织中的表达情况进行相关性分析,了解pi-sno81与FOXO3a的相关性。结果 qRT-PCR检测发现,FOXO3a基因表达被pi-sno44/74/75/81上调;其中pi-sno81上调FOXO3a最明显,且pi-sno81明显上调了FOXO3a蛋白水平;FOXO3a在乳腺癌中呈低表达;相关性分析发现,pi-sno81在乳腺癌及癌旁乳腺组织中的表达与FOXO3a在乳腺癌及癌旁乳腺组织中的表达成正相关(P<0.001,Corr=0.835)。结论 snoRNA来源的pi-sno81能上调乳腺癌细胞中FOXO3a基因的表达,并可能通过影响FOXO3a的表达影响乳腺癌细胞的生长。
[关键词]snoRNA;pi-sno81;FOXO3a;乳腺癌
[中图分类号] R737.9 [文献标识码] A [文章编号] 1674-4721(2017)06(c)-0008-05
[Abstract]Objective To investigate the influence of snoRNA-derived piRNA on FOXO3a gene in breast cancer.Methods Five chemically synthesized pi-snoRNAs including pi-sno44,pi-sno74,pi-sno75,pi-sno78,and pi-sno81 were transfected into MDA-MB-231 breast cancer cells and the total RNA was extracted.EachpiRNA was detected in order to find its influence on FOXO3a mRNA levels as well as the most effective piRNA on FOXO3a,and then testified its influence on FOXO3a level.The fresh tumor and peritumoral specimen in 28 pairs in breast cancer patients undergone the radical surgery of the mammary gland in our department from March to October in 2016 were collected.Among them,expressions of pi-sno81,sno81,and FOXO3a were detected.Expressions of pi-sno81,sno81,and FOXO3a in breast cancer and adjacent mammary gland tissue were in correlation analysis aiming at understanding the correlation of pi-sno81and FOXO3a by canonical correlation analysis.Results qRT-PCR detected the expression of FOXO3a was up-regulated by pi-sno44,pi-sno74,pi-sno75,and pi-sno81,of which pi-sno81 was in most remarkable on up-regulating FOXO3a.Besides,pi-sno81 greatly up-regulated the protein level of FOXO3a,a low expression in breast cancer.Correlation analysis detected that expression of pi-sno81 in breast cancer and adjacent mammary gland tissue was in positive correlation with FOXO3a in expression of breast cancer and adjacent mammary gland tissue (P<0.001,Corr=0.835).Conclusion The snoRNA-derived pi-sno81 can up-regulate the expression of FOXO3a gene in breast cancer cells,and may affect the growth of breast cancer cells by influencing FOXO3a expression.
[Key words]SnoRNA;Pi-sno81;FOXO3a;Breast cancer
piRNA(Piwi-interacting RNA)是一類长度在26~31 nt的内源性小分子RNA,既往对piRNA的研究主要集中在生殖细胞内[1],但最近逐渐开始了对体细胞内piRNA的研究,目前已经有研究证实了海兔的神经细胞内有大量piRNA表达[2],也有研究证实了肿瘤细胞中也存在piRNA,笔者在既往的研究证实了乳腺癌的临床样本中存在GAS5编码的核仁小分子RNA(small nucleolar RNA,snoRNA)来源的5个piRNAs[3],且这些piRNAs在乳腺癌细胞低表达,也因其来源于snoRNA,将其命名为pi-snoRNA,这些pi-snoRNA对乳腺癌的生长具有抑制作用。
FOX蛋白家族是2000年才被正式统一命名的新的转录因子家族,因其每个成员都含有一个高度保守的DNA结构域(即FOX结构域)而得名。目前已知哺乳动物中FOXO家族有4个成员,包括FOXO1、FOXO3a、FOXO4和FOXO6,其中FOXO3a研究最多,与细胞转化、肿瘤的发生、发展及其血管生成等有重要关系[4-5]。
既往研究发现pi-snoRNAs在乳腺癌中呈低表达,可能参与了抑制肿瘤生长的过程[3],将化学合成pi-sno44/74/75/78/81转入乳腺癌MCF-7细胞中,48 h后收样,提取总RNA,送mRNA芯片检测,发现FOXO家族的FOXO4被上调了,那么做为同属FOXO家族的FOXO3a,一个肿瘤抑制因子,是否也受到这些piRNAs的调控而参与了piRNA抑制肿瘤的过程?本文开展了以下方面的研究。
1材料与方法
1.1临床样本收集
收集广州医科大学附属第二医院乳腺外科2016年3月~2016年10月接受乳腺癌根治(包括改良根治及保乳根治)乳腺癌患者术后标本28例,同一个体同时取乳腺癌组织及癌旁组织样本,年龄为25~72 岁,平均(41.8±1.57)岁。纳入标准:①女性患者;②接受乳腺癌改良根治术或者保乳手术;③无伴发其他肿瘤;④术前未接受过放化疗。排除标准:①穿刺的乳腺癌组织;②乳腺癌组织或癌旁组织量太少不能进行重复试验者。在采集样本时已征得患者同意和签署知情同意书,本项目已经通过广州医科大学伦理委员会批准。
具体操作方法:将手术切除的乳腺癌组织,在肉眼观察典型切取1 cm×0.5 cm大小的组织块,并将组织块切成2 mm厚度后分装于事先做好标记的冻存管中并放入液氮中保存,留1管行病理检查证实为癌组织。在肿瘤旁开2~3 cm处切取1 cm×0.5 cm大小的组织块,并将组织块切成4 mm厚度后分装于事先做好标记的冻存管中,留出组织做冰冻病理切片證实组织内没有癌细胞浸润,其余放入液氮中保存。
1.2 试剂和引物来源
试剂 RT-PCR及Real-Time PCR引物由Life公司合成,转染、RT-PCR、Western Blot及Real-Time PCR试剂盒从TAKARA公司购买,FOXO3a抗体从proteintech公司购买,piRNA由上海吉玛公司合成。
1.3实验方法
1.3.1 FOXO4的mRNA和FOXO3a蛋白水平检测 将MDA-MB-231细胞铺12孔板待转染,转染小分子RNA的转染试剂为RNAimax,将piRNAs于RNAimax试剂分别与opti-MEM混合,然后将两者混匀,室温放置15 min,加到细胞中,48 h后收样提取总RNA行qRT-PCR检测FOXO4的mRNA水平变化,同时收集细胞裂解后提取蛋白行Western blot检测FOXO3a蛋白水平变化,所有操作步骤按试剂盒说明书进行。
1.3.2 临床样本的处理 将约100 g组织片在液氮中研碎后融入1 ml的Trizol中裂解后按照常规操作流程提取总RNA行qRT-PCR检测pi-sno81、FOXO3a、sno81、GAS5以及肿瘤坏死因子相关的诱导凋亡配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)在临床样本中的mRNA水平。
1.4 统计学方法
采用SPSS 19.0软件进行统计,先对两组样本表达量的差值进行正态性检验(P=0.00),不符合正态分布,采用配对资料的秩和检验;piRNA与基因在临床样本表达之间的相关性分析采用R统计软件进行处理,同时对FOXO3a及piRNA在乳腺癌及正常乳腺组织中的表达共4组数据进行统计,请统计专业人员用R 软件编写程序进行计算,统计学方法为典型相关分析(canonical correlation analysis,CCA),以P<0.05为差异有统计学意义。
2结果
2.1 检测pi-sno44/74/75/78/81对FOXO3a表达的影响
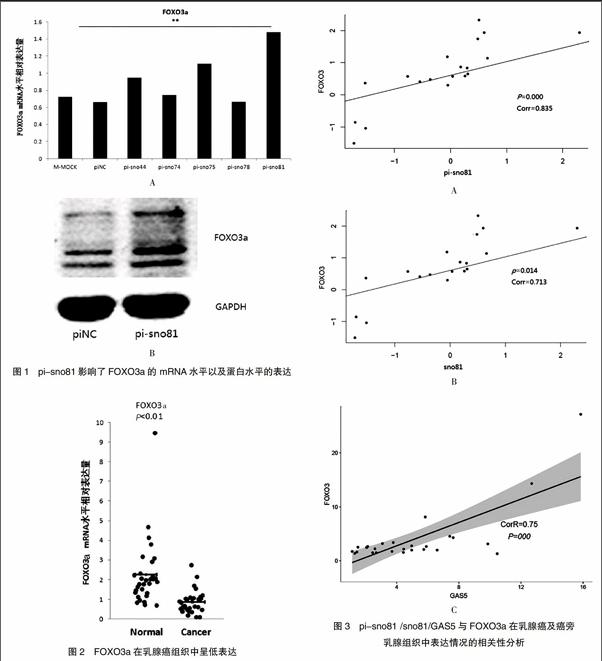
将人工合成的pi-sno44/74/75/78/81分别转入MBA-MD-231细胞中,用qRT-PCR检测FOXO3a的表达变化,发现pi-sno81上调FOXO3a的作用最明显(图1A);用Western blot检测FOXO3a蛋白水平的表达,同样发现pi-sno81明显上调FOXO3a蛋白水平表达(图1B)。
2.2 FOXO3a在乳腺癌组织中低表达
收集28对接受乳腺癌改良根治或者保乳根治术患者的乳腺癌及癌旁组织,用qRT-PCR检测FOXO3a在乳腺癌及癌旁组织的表达情况,发现FOXO3a在乳腺癌组织中的相对表达明显低于癌旁组织(图2)。FOXO3a在正常组织中的相对表达量的中位数为1.93(1.68~2.96),乳腺癌组织中的相对表达量的中位数为0.67(0.63~1.00),两组样本的表达差异有统计学意义(P<0.01)。
2.3 pi-sno81、sno81、GAS5与FOXO3a在乳腺癌及正常乳腺组织中表达的相关性分析
收集28例患者乳腺癌及癌旁乳腺组织,提取总RNA,qRT-PCR检测pi-sno81、sno81、FOXO3a及GAS5的表达情况,利用R统计软件编写程序,将pi-sno81在乳腺癌及正常组织中相对表达值(两组值)与FOXO3a的相应表达值用(两组)进行相关性分析,统计学方法为典型相关分析统计学方法,得出pi-sno81表达与FOXO3a的表达成正相关(P<0.05),并且有较强的相关性(Corr=0.835,0.713)。除此之外,产生pi-sno81的sno81、GAS5在组织中的表达与FOXO3a也成正相关(Corr=0.713,0.75,P<0.05),图3A~C为统计软件分析得出上述的相关为线性相关。
2.4 FOXO3a与TRAIL在乳腺癌及正常乳腺组织中的表达成正相关
研究表明并且FOXO3a是促凋亡基因TRAIL的转录激活因子,本研究对FOXO3a与TRAIL在乳腺癌及癌旁乳腺组织中的表达进行相關性分析,用R软件编写程序,用正则相关方法分析,得出两者在临床样本中的差异表达成正相关(Corr=0.703,P<0.01)(图4)。
3 讨论
snoRNA是一类广泛分布于真核生物细胞核仁的小分子非编码RNA,研究表明snoRNA在肿瘤的发生发展中起到了十分重要的作用[6-7]。Chang等[8]发现,h5sn2在正常脑组织的表达明显高于脑膜瘤组织中,提示缺失这种snoRNA有可能导致脑肿瘤的发生。Dong等[9]发现,U50在前列腺癌细胞中的表达水平非常低,而提高它的表达水平可以抑制前列腺癌细胞的克隆形成;进一步研究发现,带有U50基因中2个碱基(TT)缺失纯合子的个体容易患前列腺癌;该缺失突变的杂合子还与乳腺癌的发生密切相关。与U50同样来源的SNORD44不仅低表达于乳腺癌和头颈鳞状细胞癌组织中,而且其表达水平还与患者预后成负相关[10]。SNORD42在非小细胞性肺癌表达水平与患者预后明显负相关;提高癌细胞内SNORA42水平将明显增强细胞的增殖能力和克隆形成;下调NSCLC细胞株中SNORA42的表达将诱导细胞凋亡、降低克隆形成能力和减少动物体内移植瘤的形成[11]。SNORD114-1、SNORD123、U70C(SNORA70C也被发现影响着肿瘤的发生[12-13]。我们在既往的研究中证明了pi-sno81是由含boxC/D的sno81切割而成的,本研究发现了sno81来源的pi-sno81可能通过上调肿瘤抑制因子FOXO3a抑制乳腺癌的生长,预示snoRNA除了能直接参与肿瘤的调节过程,还可能通过其来源的piRNA来发挥抑制肿瘤的功能,为研究snoRNA在肿瘤发生发展过程中的分子机制提供了新思路。由于sno81是由GAS5编码的,而sno81切割产生了pi-sno81,我们对临床样本的分析发现,pi-sno81、sno81、GAS5与FOXO3a在临床样本中的表达成正相关,都在乳腺癌低表达,进一步说明pi-sno81与sno81在抑制乳腺癌方面发挥相同的作用,与之前的结果相互印证。
piRNA的发现是生命科学领域的一个革命性的进展。piRNA在生殖细胞中沉默转座子元件和基因组自私性遗传元件以确保基因组的稳定性和完整性;piR-651在胃癌、肺癌、乳腺癌等样本中高表达,可能影响了这些肿瘤的发展[14];piR30840可以明显下调IL-4表达,进而抑制Th2T淋巴细胞的成熟[15];pi-sno75可以通过激活促凋亡因子TRAIL的表达从而抑制乳腺癌的生长[3]。本研究发现了pi-sno75同源的pi-sno81可以明显上调FOXO3a的表达,而FOXO3a已经被证实能够促进细胞凋亡,说明pi-sno81可能通过激活FOXO3a的表达起到抑制乳腺癌生长的作用,同时进一步说明了piRNA在体细胞中尤其是肿瘤细胞中发挥了重要的作用。
大量的研究发现FOXO3a因子表达及活性改变与肿瘤的形成和进展密切相关[5]。目前已有的研究表明FOXO3a失活与乳腺癌、卵巢癌、前列腺癌、肾癌、膀胱癌有关,且FOXO3a的低表达与上述这些肿瘤的预后相关。在乳腺癌中,敲除FOXO3a基因促进了肿瘤细胞的生长[16]。Sunters等[17]研究发现,在紫杉醇敏感的乳腺癌MCF7细胞株,当紫杉醇处理后,FOXO3a及其靶基因Bim和p27Kip1水平显著升高,诱导凋亡,通过小干扰RNA(small interference RNA,siRNA)抑制FOXO3a后,FOXO3a、Bim和p27Kip1降低,从而降低了药物诱导的凋亡。Zou等[18]发现在乳腺癌细胞株MCF7中,FOXO3a通过降低一些ER调节基因的表达,从而抑制乳腺癌细胞的增殖。动物实验发现FOXO3a的高表达能抑制E2诱导性乳腺癌的发生,然而相反,敲除FOXO3a基因却促进肿瘤的生长。另外,HER2与通过与表皮生长因子受体家族其他成员聚合,可活化PI3K/Akt信号途径,使FOXO3a磷酸化而抑制其转录活性。本研究发现在ER阴性的乳腺癌细胞中,FOXO3a受到了snoRNA来源的piRNA(pi-sno81)的调控,且FOXO3a在乳腺癌临床样本中低表达,这一表达与pi-sno81在乳腺癌组织中的表达相关,说明pi-sno81可能通过增强FOXO3a的作用来抑制乳腺癌的生长。
FOXO3a是上调TRAIL的转录激活因子[19],这与本研究中FOXO3a与TRAIL在临床样本中的表达成正相关一致,既往的研究证明pi-sno75能上调TRAIL的表达,本研究中发现同样是snoRNA切割而成的pi-sno81能够上调FOXO3a,两个piRNAs的作用可能存在一定的协同性。
综上所述,pi-sno81能够上调乳腺癌细胞中FOXO3a的表达,这与既往的研究结果一致,为piRNA在体细胞中作用的分子机制提供了新思路,也可能成为FOXO3a诱导的凋亡通路的新的调节靶点。
[参考文献]
[1]Malone CD,Brennecke J,Dus M,et al.Specialized piRNA pathways act in germline and somatic tissues of the Drosophila ovary[J].Cell,2009,137(3):522-535.
[2]Rajasethupathy P,Antonov I,Sheridan R,et al.A role for neuronal piRNAs in the epigenetic control of memory-related synaptic plasticity[J].Cell ,2012,149(3):693-707.
[3]He X,Chen X,Zhang X,et al.An Lnc RNA (GAS5)/SnoRNA-derived piRNA induces activation of TRAIL gene by sitespecifically recruiting MLL/COMPASS-like complexes[J].Nucleic Acids Res,2015,43(7):3712-3725.
[4]Potente M,Urbich C,Sasaki K,et al.Involvement of Foxo transcription factors in angiogenesis and postnatal neovascularization[J].J Clin Invest,2005,115(9):2382-2392.
[5]钟振,刘益飞,刘俊华. FOXO3a基因在癌症中的研究进展[J].中国肿瘤外科杂志,2013,5(3):184-186.
[6]Williams GT,Farzaneh F.Are snoRNAs and snoRNA host genes new players in cancer?[J].Nat Rev Cancer,2012,12:84-88.
[7]屈良鹄,张周惠. snoRNA的结构与功能[J].生命科学,2008, 20(2):171-177.
[8]Chang LS,Lin SY,Lieu AS,et al.Differential expression of human 5S snoRNA genes[J].Biochem Biophys Res Commun,2002, 299(2):196-200.
[9]Dong XY,Rodriguez C,Guo P,et al.SnoRNA U50 is a candidate tumor-suppressor gene at 6q14.3 with a mutation associated with clinically significant prostate cancer[J].Hum Mol Genet,2008,17(7):1031-1042.
[10]Appaiah HN,Goswami CP,Mina LA,et al.Persistent upregulation of U6:SNORD44 small RNA ratio in the serum of breast cancer patients[J].Breast Cancer Res,2011,13(5):86-96.
[11]Liao J,Yu L,Mei Y,et al.Small nucleolar RNA signatures as biomarkers for non-small-cell lung cancer[J].Mol Cancer,2010,9(1):198-238.
[12]Valleron W,Laprevotte E,Gautier EF,et al.Specific small nucleolar RNA expression profiles in acute leukemia[J].Leukemia,2012,26(9):2052-2060.
[13]Ferreira HJ,Heyn H,Moutinho C,et al.CpG island hypermethylation-associated silencing of small nucleolar RNAs in human cancer[J].RNA Biol,2012,9(6):881-890.
[14]Cheng J,Guo JM,Xiao BX,et al.piRNA,the new non-coding RNA,is aberrantly expressed in human cancer cells[J].Clin Chim Acta,2011,412(17):1621-1625.
[15]Zhong F,Zhou N,Wu K,et al.A SnoRNA-derived piRNA interacts with human interleukin-4 pre-mRNA and induces its decay in nuclear exosomes[J].Nucleic Acids Res,2015,43(21):10474-10491.
[16]Malamou-Mitsi V,Gogas H,Dafni U,et al.Evaluation of the prognostic and predictive value of p53 and Bcl-2 in breast cancer patients participating in a randomized study with dose-dense sequential adjuvant chemotherapy[J].Ann Oncol,2006,17(10):1504-1511.
[17]Sunters A,Madureira PA,Pomeranz KM,et al.Paclitaxel-induced nuclear translocation of FOXO3a in breast cancer cells is mediated by c-Jun NH2-terminal kinase and Akt[J].Cancer Res,2006,66(1):212-220.
[18]Zou Y,Tsai WB,Cheng CJ,et al.Forkhead box transcription factor FOXO3a suppresses estrogen-dependent breast cancer cell proliferation and tumorigenesis[J].Breast Cancer Res,2008,10(1):21-68.
[19]Coomans de Brachene A,Demoulin JB.FOXO transcription factors in cancer development and therapy[J].Cell Mol Life Sci,2016,73(6):1159-1172.
(收稿日期:2017-01-06 本文編辑:许俊琴)
