花生AhDGAT1基因启动子的克隆与功能验证
2017-07-29张会郑玲万书波李新国郭峰单雷
张会+郑玲+万书波+李新国+郭峰+单雷+高文伟+彭振英

摘要:二酰基甘油酰基转移酶(DGAT)是三酰基甘油(TAG)生物合成过程的限速酶。在本研究中,通过染色体步移法从栽培花生品种鲁花14基因组中克隆了AhDGAT1的启动子(pAhDGAT1)序列,并通过生物信息学分析发现该启动子含有多个 TATA-box、CAAT-box、光调控元件、胁迫防御相关元件和激素响应元件。利用农杆菌介导法将pAhDGAT1∶GUS植物表达载体转化烟草叶片。通过GUS染色发现在转基因烟草营养器官和生殖器官中均检测到GUS表达,在花丝和花柱中表达较低,而在柱头、花药和种子中表达较高,表明pAhDGAT1表达没有组织特异性,具有组成型启动子的特征。
关键词:花生;AhDGAT1基因;启动子;GUS染色;功能验证
中图分类号:S565.2:Q781 文献标识号:A 文章编号:1001-4942(2017)07-0001-07
Abstract Diacylglycerol acyltransferase (DGAT) is a rate-limiting enzyme in the biosynthesis pathway of triacylglycerol (TAG). In this study, with peanut cultivar Luhua 14 as material, we cloned the promoter sequence of AhDGAT1 gene (pAhDGAT1) by genome walking method. By bioinformatics analysis, we found that the pAhDGAT1 had many TATA-box, CAAT-box, light regulation, stress and defense response and hormone response elements. The constructed pAhDGAT1∶GUS plant expression vector was transformed into tobacco leaves by Agrobacterium tumefaciens-mediated method. By GUS staining,we found the GUS enzyme activity were detected in all organs of the positive transgenic tobacco lines, while in stigma, anther and young seed, the expression levels were higher than those in filament and style. It indicated that pAhDGAT1 was not tissue-specific promoter and had constitutive promoter feature.
Keywords Peanut; AhDGAT1 gene; Promoter; GUS staining; Function identification
我國花生不仅总产量在世界占据首位而且有近500万公顷的种植面积,是主要的油料和经济作物之一[1]。食用油脂主要来源于动植物油脂[2],其中75%的脂类消耗是植物油脂,但其不饱和脂肪酸含量高,不宜长时间储存。油料作物中单位脂肪含量最高的是芝麻[3],花生以50%的脂肪含量排在第二位。花生油含不饱和脂肪酸80%以上,其中油酸含量40%左右,亚油酸含量38%左右(油亚比随品种不同而变化),能有效降低有害胆固醇,不降低或相对提高有益胆固醇,阻止动脉粥样硬化[4]。
三酰甘油(triacylgycerol,TAG)主要以3-磷酸甘油和脂酰辅酶A为前体在内质网中合成,是动植物脂类的主要储存形式。二酰基甘油酰基转移酶(DGAT)是三酰甘油(TAG)合成途径的限速酶,它控制TAG的合成速度与量的积累[5]。到目前为止,共有四种类型的DGAT:DGAT1、DGAT2、WS/DGAT和胞质内DGAT,主要是根据它们的蛋白结构、细胞和亚细胞定位的不同而划分的。DGAT1属于包括酰基辅酶A、胆固醇酰基转移酶ACAT1和ACAT2在内的蛋白家族[6]。DGAT2是一种与DGAT1蛋白家族相似性较低的单酰甘油酰基转移酶家族,普遍存在于动物[7]、植物[8]和酵母[9]中。近年,又发现了WS/DGAT和胞质DGAT,但对它们的研究还比较少。Saha等从花生未成熟种子中克隆获得一类没有跨膜结构和信号肽序列的新型DGAT[10],即胞质DGAT,其氨基酸序列与WS/DGAT具有13%的相似性,与DGAT1和DGAT2基因的核苷酸序列相似性不到10%。DGAT1和DGAT2蛋白大多定位于内质网上[7,8],较小部分存在于叶绿体、微粒体中,而胞质DGAT定位于细胞质中[10],含有345个氨基酸。
油脂合成主要是由DGAT1和DGAT2参与完成的[11,12],二者在动物、植物细胞中普遍存在。目前DGAT1基因在旱金莲[13]、烟草[14]、蓖麻[15]、玉米[8]、油菜[16]等植物中被鉴定出,DGAT2基因也在拟南芥[17]、油桐[18]、蓖麻[19]中被克隆出。DGAT1基因在野生型拟南芥中过量表达可使DGAT1的转录水平提高10%~70%[20],其种子含油量也显著增加。在大豆等转基因油料作物中过量表达DGAT2基因能使种子含油量得到显著提高[21,22]。
随着人们对DGAT基因越来越多的关注,近几年花生DGAT基因的研究也取得一定成效[22-25],但是对于其启动子的调控机理还不是很清楚。本课题组从花生中克隆了AhDGAT2基因并进行了功能验证,结果表明在大肠杆菌中过量表达该基因可以提高菌体的脂肪酸含量[24]。随后又克隆了花生AhDGAT2a的启动子序列,并用GUS染色的方法证明其在各个组织器官均有表达[26]。本研究拟克隆花生AhDGAT1基因的启动子序列(pAhDGAT1),构建pAhDGAT1∶GUS植物表达载体并转化烟草验证其功能,为研究DGAT基因的表达调控提供一定的理论基础。
1 材料与方法
1.1 试验材料
供试植物材料:栽培花生品种鲁花14、烟草品种SR1。细菌材料:大肠杆菌(Escherichia coil)DH5α,购于天根生化科技有限公司;根癌农杆菌(Agrobacterium tumefaciens)菌株LBA4404、植物表达载体pCAMBIA2301 均为本实验室自存。
1.2 花生基因组DNA的提取
以鲁花14的幼嫩叶片为材料,采用CTAB法提取叶片基因组DNA[23]。
1.3 AhDGAT1启动子克隆
根据GenBank数据库登录的AhDGAT1基因序列(登录号:XM_016346854.2)设计启动子 genome walking引物D1W1: 5′-TCTGTTTGAAAATGTTGCC-3′,D1W2: 5′-TCCGCCTTCTCCAACGGCGTA-3′,引物由上海生工生物工程有限公司合成。按照 genome walking 试剂盒(TaKaRa)进行两轮扩增。反应体系含基因组 DNA 1 μg、2.5 mmol/L dNTPs混合物8 μL、10×LA PCR buffer Ⅱ 5 μL、TaKaRa LA Taq 0.5 μL、100 μmol/L AP1 Primer (5′-GTAATACGACTCACTATAGGGC-3′)和10 μmol/L D1W1引物各1 μL,ddH2O 33.5 μL。反应条件为94℃ 1 min,98℃ 1 min;5个循环的94℃ 30 s,65℃ 1 min,72℃ 2 min;然后94℃ 30 s,25℃ 3 min,72℃ 2 min;15个循环的94℃ 30 s,65℃ 1 min,72℃ 2 min;94℃ 30 s,65℃ 1 min,72℃ 2 min;94℃ 30 s,44℃ 1 min,72℃ 2 min;最后72℃延伸10 min。取1 μL PCR产物稀释100倍作为第二轮反应的模板,以AP1 Primer 为上游引物,D1W2 为下游引物,其余同第一轮扩增体系。反应条件为15个循环的94℃ 30 s,65℃ 1 min,72℃ 2 min;94℃ 30 s,65℃ 1 min,72℃ 2 min;94℃ 30 s,44℃ 1 min,72℃ 2 min;最后72℃延伸10 min。将第二轮得到的PCR产物进行凝胶电泳,回收纯化目的条带,连接到克隆载体pMD18-T,转入大肠杆菌中,提取质粒进行PCR检测。将有正确条带的质粒送往上海生工生物工程有限公司进行测序分析。
1.4 pAhDGAT1∶GUS植物表达载体构建
利用得到的pAhDGAT1序列设计特异性扩增引物(PD1aF:5′-CGCTCTAGACGGTATAAACTTCCAAAGCAT-3′,PD1aR:5′-CCATGGCGAAGAATAAAGAATGAAAAAG-3′),两端分别引入XbaⅠ和NcoⅠ酶切位点,然后以花生基因组DNA为模板对pAhDGAT1序列进行扩增。将扩增后的pAhDGAT1序列进行双酶切,并利用T4连接酶连接到同样经XbaⅠ和NcoⅠ双酶切的pCAMBIA2301载体上,将载体中的CaMV35S 启动子替换掉,然后转化大肠杆菌DH5α感受态,经酶切和测序证实pAhDGAT1∶GUS表达载体构建完全正确。
1.5 根癌农杆菌介导的烟草叶片遗传转化
将构建好的pAhDGAT1∶GUS载体转化农杆菌LBA4404感受态细胞,挑取单菌落进行PCR验证并保存阳性菌液。将烟草种子放在75%乙醇中消毒1 min,无菌水冲洗3~5次,再用0.1%次氯酸钠消毒10 min,无菌水洗净后均匀鋪洒于1/2 MS0基本培养基上生长4~5周,利用叶盘法转化烟草叶片。将携带pAhDGAT1∶GUS表达载体的农杆菌接种于含有50 μg/mL那霉素、50 μg/mL利福平的YEP液体培养基中,28℃、200 r/min振荡培养至对数生长期。将烟草叶片剪成小块(0.5 cm × 0.5 cm)置于MS0重悬的菌液中1.5 min,无菌滤纸吸干水分后,在28℃ MS分化培养基上暗培养两天。将叶片松散排列在MS选择培养基上,待其长出丛生芽时切下放入伸长培养基。当丛生芽长至3~5 cm 时,转移到生根培养基进行生根培养。将生根的幼苗进行炼苗然后移栽入花盆,温室常规管理。
1.6 阳性植株的分子检测和GUS染色
将筛选出的抗性转基因烟草株系提取基因组DNA,用引物 PD1aF/PD1aR 进行PCR分子检测。将阳性烟草的幼苗和各组织器官浸泡在GUS染色液中,置于37℃恒温箱中染色16 h,用70%乙醇将材料洗成白色,在体视镜下拍照观察。
2 结果与分析
2.1 启动子克隆与序列分析
运用genome walking方法,经过两轮扩增得到长度为1 258 bp的pAhDGAT1核苷酸序列片段,通过测序确定所得片段为AhDGAT1的启动子序列。通过在线分析软件PlantCARE对启动子序列区域调控元件进行分析,发现该区域含有许多高等植物重要的顺式调控元件和组织器官表达及诱导表达专化元件(图1)。其中包括64个TATA-box和19个CAAT-box元件,表明该启动子具有较高的启动子活性。光是影响植物生长的重要因子,光调节基因主要是通过一些光响应元件进行表达调控,该启动子含有14个光响应元件,表明它对光信号的敏感性。另外,该启动子序列还包含一个赤霉素应答元件、一个参与脱落酸应答反应的元件、一个干旱应答元件和五个参与水杨酸应答的元件,表明该基因的表达可能与激素和胁迫诱导有关。
2.2 pAhDGAT1∶GUS植物表达载体构建及烟草转化
以花生基因组DNA为模板,利用携带XbaⅠ和NcoⅠ酶切位点的引物PD1aF/PD1aR对pAhDGAT1序列进行PCR扩增。将得到的序列进行双酶切,利用T4连接酶连接到pCAMBIA2301载体,替换载体上的CaMV35S 启动子,然后转化大肠杆菌DH5α感受态。挑取单菌落进行PCR验证,得到阳性克隆并提取质粒,用XbaⅠ和NcoⅠ双酶切质粒,产生1 200 bp左右的条带,说明pAhDGAT1已成功克隆到pCAMBIA2301载体中。
将构建好的pAhDGAT1∶GUS载体转化农杆菌LBA4404感受态细胞,利用叶盘法转化烟草。
2.3 转基因烟草的分子检测
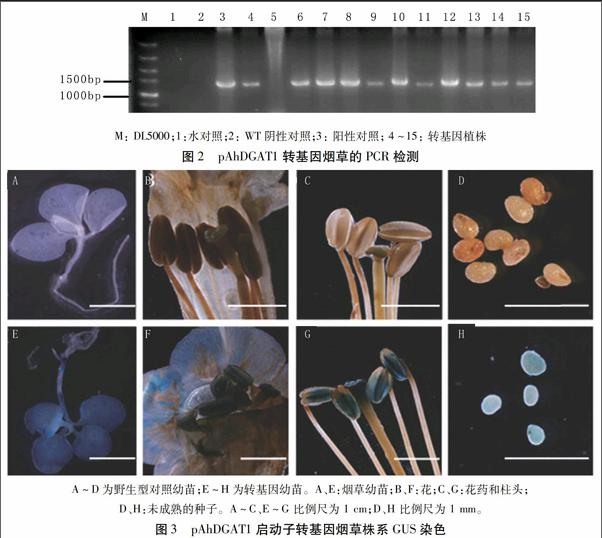
利用卡那霉素对转基因烟草进行筛选,将白化苗去掉,得到12个抗性株系。提取12个株系烟草叶片DNA作为模板进行PCR分子检测,结果表明,有11个株系在1 200 bp左右出现了特异性条带(图2),即为阳性转基因烟草株系。
2.4 转基因烟草的GUS 活性检测
利用GUS染色方法检验pAhDGAT1启动子的活性。从图3可以看出该启动子具有较强的启动GUS基因表达的能力,在营养器官和生殖器官中均能检测到GUS表达(图3E-H),但是花丝和花柱中GUS表达很低(图3G),柱头、花药和种子中表达较高(图3G、H)。表明pAhDGAT1的表达没有组织器官特异性,具有组成型启动子的特性。
3 讨论与结论
DGAT催化酰基辅酶A酰化sn-1,2二酰基甘油形成TAG,也是该途径的限速酶和关键酶[5],这就是肯尼迪(Kennedy)途径。DGAT在植物和动物的油脂合成中具有非常重要的作用。油茶中油脂的合成主要受DGAT1基因表达的影响,但是DGAT1对其脂肪酸成分变化的影响较小[27],甚至不影响脂肪酸组成。我们前期从花生中克隆得到了DGAT1和DGAT2基因,将其转化烟草进行功能验证,发现转基因烟草种子的总脂肪酸含量显著增加[23,24]。
基因启动子位于基因上游的非编码区,能够活化RNA聚合酶并准确结合模板DNA,进而获得转录起始的特异性[28]。启动子主要由核心启动区、上游元件和应答元件三部分组成。上游元件包括TATA-box、CAAT-box和GC-box等,其中TATA-box是植物启动子最典型的特征。本研究克隆获得的pAhDGAT1序列含有64个TATA-box和19个CAAT-box元件,说明pAhDGAT1具有典型启动子特性。另外还发现,pAhDGAT1含有一些光应答、激素诱导和胁迫诱导等调控元件,推测AhDGAT1的表達可能会受这些因素的影响。前期研究发现在冷、紫外损伤以及机械损伤前提下,AhDGAT1基因表达明显降低,说明冷、紫外损伤和机械损伤对其影响较大[23],该结果与本研究相符。
DGAT的表达差异对植物中油脂的合成具有重要作用[29]。DGAT1基因在大多数高等植物的各组织器官中都有表达,但是表达模式却存在很大的差异。例如在拟南芥发育中的种子、花瓣、花芽中DGAT1表达量相比叶和茎中表达量高[20],而且在拟南芥衰老叶片中DGAT1转录水平明显增加,导致蛋白含量和TAG含量的提高[30]。对其他双子叶植物DGAT的研究表明,它们的表达模式与在拟南芥中相似[9,11,31],但旱金莲DGAT1只在发育的种子中表达[13],在其他组织中没有表达。前期我们对AhDGAT1表达模式研究发现该基因在花生的各个组织中都有表达,但在花中表达量最高,未成熟种子和萌发种子中的表达量高于根、茎、叶中的表达量[23]。随后又在花生中克隆了AhDGAT2a的启动子序列并对其进行了功能验证,结果表明AhDGAT2a的启动子在各个组织器官均有表达[26]。本研究发现pAhDGAT1在花丝和花柱中表达量较低,而在柱头、花药和种子中表达较高。这些研究与前人研究结果类似,说明DGAT1不仅对植物种子脂肪酸合成起重要作用,还对其他组织器官的脂肪酸合成起重要作用。
参 考 文 献:
[1]万书波. 花生品质学[M]. 北京:中国农业科学技术出版社, 2007.
[2]Broun P, Gettner S, Somerville C. Genetic engineering of plant lipids [J]. Annual Review of Nutrition, 1999, 19(1): 197-216.
[3]廖伯寿. 中国花生油脂产业竞争力浅析[J].花生学报, 2003(S1): 11-15.
[4]Jung S, Swift D, Sengoku E, et al. The high oleate trait in the cultivated peanut [Arachis hypogaea L.]. I. Isolation and characterization of two genes encoding microsomal oleoyl-PC desaturases [J]. Molecular Genetics and Genomics, 2000, 263(5): 796.
[5]Settlage S B, Kwanyuen P, Wilson R F. Relation between diacylglycerol acyltransferase activity and oil concentration in soybean [J]. Journal of the American Oil Chemists Society, 1998, 75(7): 775-781.
[6]Hofmann K. A superfamily of membrane-bound O -acyltransferases with implications for Wnt signaling [J]. Trends in Biochemical Sciences, 2000, 25(3): 111.
[7]Cases S, Smith S J, Zheng Y W, et al. Identification of a gene encoding an acyl CoA:diacylglycerol acyltransferase, a key enzyme in triacylglycerol synthesis [J]. Proceedings of the National Academy of Sciences, 1998, 95(22): 13018-13023.
[8]Bouviernavé P, Benveniste P, Oelkers P, et al. Expression in yeast and tobacco of plant cDNAs encoding acyl CoA:diacylglycerol acyltransferase [J]. European Journal of Biochemistry, 2000, 267(1): 85-96.
[9]Sandager L,Gustavsson M H,Sthl U, et al. Storage lipid synthesis is non-essential in yeast [J]. Journal of Biological Chemistry, 2002, 277(8): 6478-6482.
[10]Saha S, Enugutti B, Rajakumari S, et al. Cytosolic triacylglycerol biosynthetic pathway in oilseeds. Molecular cloning and expression of peanut cytosolic diacylglycerol acyltransferase [J]. Plant Physiology, 2006, 141(4): 1533-1543.
[11]Hobbs D H, Lu C, Hills M J. Cloning of a cDNA encoding diacylglycerol acyltransferase from Arabidopsis thaliana and its functional expression [J]. Febs. Letters, 1999, 452(3):145-149.
[12]Lu C L, Shen B D N, Hobbs D H, et al. Expression pattern of diacylglycerol acyltransferase-1, an enzyme involved in triacylglycerol biosynthesis, in Arabidopsis thaliana[J]. Plant Molecular Biology, 2003, 52(1): 31-41.
[13]Xu J, Francis T, Mietkiewska E, et al. Cloning and characterization of an acyl-CoA-dependent diacylglycerol acyltransferase 1 (DGAT1)gene from Tropaeolum majus, and a study of the functional motifs of the DGAT protein using site-directed mutagenesis to modify enzyme activity and oil content [J]. Plant Biotechnology Journal, 2008, 6(8): 799-818.
[14]He X, Chen G Q, Lin J T, et al. Regulation of diacylglycerol acyltransferase in developing seeds of castor [J]. Lipids, 2004, 39(9): 865.
[15]Zheng P, Allen W B, Roesler K, et al. A phenylalanine in DGAT is a key determinant of oil content and composition in maize [J]. Nature Genetics, 2008, 40(3): 367-372.
[16]Nykiforuk C L, Laroche A, Weselake R J. Isolation and characterization of a cDNA encoding a second putative diacylglycerol acyltransferase from a microspore-derived cell suspension culture of Brassica napus L. cv. Jet Neuf (Accession No. AF164434). (PGR99-158) [J]. Plant Physiology, 1999, 121(3):1053.
[17]Tabata S, Kaneko T, Nakamura Y, et al. Sequence and analysis of chromosome 5 of the plant Arabidopsis thaliana[J]. Nature, 2000, 402(6763): 761-768.
[18]Shockey J, Gidda S, Chapital D, et al. Tung tree DGAT1 and DGAT2 have nonredundant functions in triacylglycerol biosynthesis and are localized to different subdomains of the endoplasmic reticulum [J]. The Plant Cell, 2006, 18(9): 2294-2313.
[19]Kroon J T, Wei W, Simon W J, et al. Identification and functional expression of a type 2 acyl-CoA:diacylglycerol acyltransferase (DGAT2) in developing castor bean seeds which has high homology to the major triglyceride biosynthetic enzyme of fungi and animals [J]. Phytochemistry, 2006, 67(23): 2541-2549.
[20]Jako C, Taylor D C. Seed-specific over-expression of an Arabidopsis cDNA encoding a diacylglycerol acyltransferase enhances seed oil content and seed weight [J]. Plant Physiology, 2001, 126(2): 861.
[21]Lardizabal K, Effertz R, Levering C, et al. Expression of Umbelopsis ramanniana DGAT2A in seed increases oil in soybean [J]. Plant Physiology, 2008, 148(1): 89-96.
[22]Burgal J, Shockey J, Lu C, et al. Metabolic engineering of hydroxy fatty acid production in plants: RcDGAT2 drives dramatic increases in ricinoleate levels in seed oil [J]. Plant Biotechnology Journal, 2008, 6(8): 819-831.
[23]王龍龙. 花生二酰甘油酰基转移酶(DGAT)基因的克隆与分析 [D]. 济南:山东师范大学, 2010.
[24]Peng Z Y, Li L, Yang L Q, et al. Overexpression of peanut diacylglycerol acyltransferase 2 in Escherichia coli [J]. PLoS ONE, 2013, 8(4): e61363.
[25]Chi X, Hu R, Zhang X, et al. Cloning and functional analysis of three diacylglycerol acyltransferase genes from peanut (Arachis hypogaea L.) [J]. PLoS ONE, 2014, 9(9): e105834.
[26]郑玲, 史灵敏, 田海莹, 等. 花生AhDGAT2a基因启动子的克隆和功能验证[J]. 作物学报, 2016, 42(7): 1094-1099.
[27]刘敏. 油茶DGAT1基因的表达和功能研究[D]. 株洲:中南林业科技大学, 2014.
[28]李峰, 纵瑞收, 韩永华, 等. 我国超高油酸花生品种研究进展与利用探究[C]//2014年中国作物学会学术年会. 2014.
[29]周丹. 大豆二酰甘油酰基转移酶(DGAT)基因克隆及其功能的初步研究[D]. 南京:南京农业大学, 2012.
[30]Kaup K P. Regionalism versus ethnicnationalism in the Peoples Republic of China [J]. China Quarterly, 2002, 172:863-884.
[31]Wang H W, Zhang J S, Gai J Y, et al. Cloning and comparative analysis of the gene encoding diacylglycerol acyltransferase from wild type and cultivated soybean [J]. Theoretical and Applied Genetics, 2006, 112(6): 1086-1097.
