品味化学电源发展史 螺旋式认识原电池原理
2017-07-25吴文中
吴文中
摘要:以“化学电源”发展史为课堂教学素材,遵循课堂教学的科学发展观,从能量与物質变化两个层面品味、解读各时期经典化学电源,分析、比较各时期化学电源的工作原理和特征,螺旋式认识原电池工作原理,提出突破原电池工作原理的教学难点、重点的策略和建议。
关键词:化学电源;发展史;原电池原理;螺旋式
文章编号:1005–6629(2016)12–0085–05 中图分类号:G633.8 文献标识码:B
许多学者[1、2、3]从不同视角对原电池工作原理以及课堂教学设计作了细致的研究,对教师准确把握有关原电池的教学起到很大作用。本文试以“化学电源”的发展史为素材,遵循和挖掘化学史中所体现的科学发展规律,采用《物理化学》[4]中有关热力学电极电位等相关理论,对原电池原理做出全面解读(有关物理化学理论和计算,都出自该文献),理解“螺旋式上升”教材的编写理念及有关教学策略、设计的初衷[5],以馈读者。
1 伏打电堆与Daniell电池
教学建议:让学生依据伏打电堆工作实景画出等效电路图,如图1(c)。
教学意义:许多学生开始对原电池的认识只停留在电流表指针会偏转这一“奇特”的现象上,教学中,教师引导学生通过画出等效电路图,可让学生深刻体会:原电池实际上就是一种电源装置。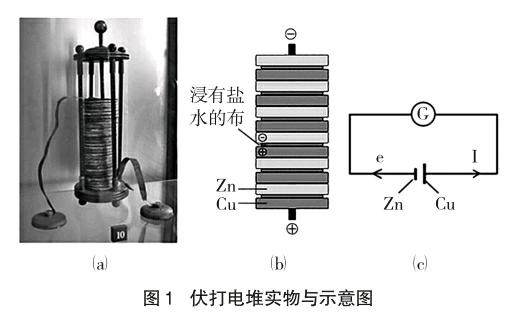
比较伏打电堆与Zn|H2SO4|Cu所组成的单液电池发现:前者装置中并不存在一个显而易见的自发的氧化还原反应,而后者很容易得出装置中发生氧化还原反应是发生原电池反应前提的结论。
教学建议:与其先引入Zn|H2SO4|Cu所组成的单液电池有关实验,不如先展示伏打电堆这一最早的原电池,以避免学生产生电极必须参与反应的错误认知。
1.2 Daniell(丹尼尔)电池
科学家Daniell在1836年采用盐桥将两种电解质溶液连通起来的装置,解决了H+与金属Zn接触而发生反应的问题。盐桥中的阴、阳离子的迁移速率几乎相同,如K+和Cl-的迁移率非常接近,当盐桥插入到浓度不大的两电解质溶液之间的界面时,K+和Cl-向外扩散是接界面上离子扩散的主流,从而消除液接电位。
教学困惑:电解质溶液中的离子会进入盐桥吗——由于盐桥中的离子浓度很高,电化学反应中电解质溶液不会进入盐桥;若电解质是AgNO3溶液时,则不能使用KCl盐桥,而应使用NH4NO3盐桥,其道理一样——NH4+和NO3-的迁移速率也非常接近。
随着Daniell电池反应的进行,溶液中的c(Zn2+)升高,c(Cu2+)降低,在非标态下的E(Zn2+/Zn)变正,E(Cu2+/Cu)变负,最终E(Zn2+/Zn)=E(Cu2+/Cu),电流表指针归零。
此时,若在电池的ZnSO4溶液中继续加适量的固体ZnSO4溶解,在CuSO4溶液中加水稀释,则c(Zn2+)升高,c(Cu2+)降低,则将发生Cu|Cu2+电极失去电子,而Zn|Zn2+电极得到电子,发生的电极反应与Daniell电池反应刚好相反,其总反应为:Cu(s)+Zn2+(aq)=Zn(s)+Cu2+(aq)——是一个非自发的氧化还原反应。
对于Zn(s)+Cu2+(aq)=Zn2+(aq)+Cu(s)而言,该反应是放热反应,化学能转化为电能易于理解,但对于相反的过程,其电能又是如何产生的?
邢瑞斌等[7]在“能设计成原电池的反应一定是放热反应吗”一文中很好地回答了这一问题,认为放热反应不是发生原电池反应的必要条件,原电池反应是吸热反应时,完全可以理解成电池反应过程中吸收环境中提供的热量(开放体系的化学电池),认为原电池反应必须是放热反应是建立在孤立体系的前提下的,实际上,反应体系往往与外界有能量和物质的交换,相关案例不再赘述。
教学建议:对学生的学习过程,何尝不是如此?螺旋式上升的学习过程,对知识渐进感悟的过程是客观事实,一步到位的教学思想不可取。
2 采用《物理化学》中相关理论准确认识原电池工作原理
2.1 金属在盐溶液中的“溶解-沉积”平衡和双电层理论
金属在水溶液中存在着金属的“溶解-沉积”过程,金属与其一定浓度的盐溶液会形成一种动态平衡,金属越活泼(如金属Zn),越容易失去电子,Zn2+进入溶液的倾向越大,进入溶液的Zn2+受晶体负电荷的吸引,聚集到金属表面附近,形成一个正电荷层,与晶体上的负电荷层形成双电层,如图2(a)、(c),在正负电层之间产生了一定的电位差,金属铜也一样,只是产生的电位方向相反,如图2(b)。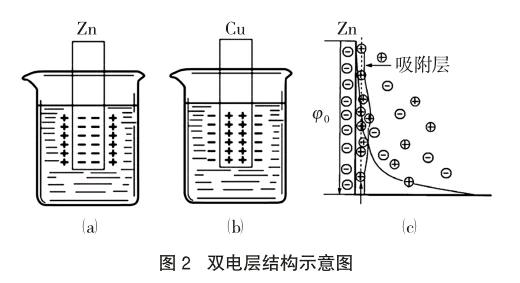
教学建议:教师设问——Zn分别与Zn、Fe、石墨能否构成原电池,指针是否偏转?若把稀硫酸改成食盐水,电流表指针会偏转吗?
这样的设问可避免带来一个问题:学生原以为形成原电池需要两个电极材料不同的电极,给后续的教学带来不必要的负担——如苏教版《化学2》中在第42页就介绍了使用相同的电极(石墨)所组成的氢氧燃料电池。因此在教学中,不过分强调电极不同是发生原电池的必要条件是明智的。
教学意义:不同电极在不同的电解质溶液的电极电位不一样,因此“电源”的电动势也不一样;两个完全相同的金属电极在相同的电解质溶液中,不能形成电势差;若两电极的金属材料一样,而电解质溶液不相同,则还能形成电势差。那种形成原电池必须是两个不同材料的电极的观点是不恰当的。
疑难问题:许多教材中的Zn(s)|H2SO4(aq)|Cu(s)所组成的单液电池,在实验过程中,总能发现在Zn片表面有大量气泡产生,大多教师的解释:金属Zn是不可能绝对纯净的,其本身已然形成原电池,因此在Zn表面一定有H2产生。
了解了上述金属在盐溶液中存在的双电层现象,可以看到:在Zn表面本就聚集了“大量”的电子,溶液中的H+完全也可与Zn2+一样在双电层附近的金属表面得到电子(只要不是处处都有双电层结构存在即可),即锌的纯度若不是100%,锌表面就会有气泡产生。
教学建议:若先把锌片用砂纸打磨后,用蒸馏水冲洗掉其表面杂质,再用0.1 mol·L-1 HCl溶液清洗,将2/3长度的锌片浸入0.1 mol·L-1 HgCl2溶液中约20分钟,取出后用盐酸洗净表面不溶物,发现锌片表面附有一层光亮的锌汞齐。锌片经过上述处理后,然后进行Zn(s)|H2SO4(aq)|Cu(s)原电池反应,则在锌表面就不会有氢气产生,这是因为H+在汞表面的超电位很大,使得H2难以在Zn表面产生。
2.2 浓差电池的解读
总反应为非氧化还原反应是否能设计成原电池?现以解读浓差电池为例,说明该问题的可行性。
对于上述总反应为中和反应的原电池而言,高中阶段可这样解释:物质的氧化性或还原性不但与其浓度有关,H2的还原性还与溶液的pH有关,pH越大,H2越容易失去电子转化为H+或H2O,随着电池反应的进行,NaOH溶液的pH变小,H2SO4溶液的pH变大,最后两电极的H2被氧化和H+被还原的趋势一样时,电池停止工作。
教学应用:氧浓差电池——以Fe的锈蚀为例(如图3)。
教学冲突:这一化学现象和大多数学生的认知产生了较大的反差——有氧气的地方有铁锈,但铁却没有被腐蚀,没有氧气的或氧气浓度低的地方,铁却腐蚀了。2014年福建理综24题,如图3(c)实际上就是一种浓差电池,这在《金属腐蚀手册》第70页上有很详细的解读,在离海面近的区域氧含量高,得电子能力强,而离海面远的区域,氧含量比较低,得电子能力弱,造成的结果是铁闸的B点为原电池的正极,C点铁为负极,C点产生的Fe2+会迁移到正极的B点附近,然后Fe2+再与富氧区的O2作用,最终形成铁锈。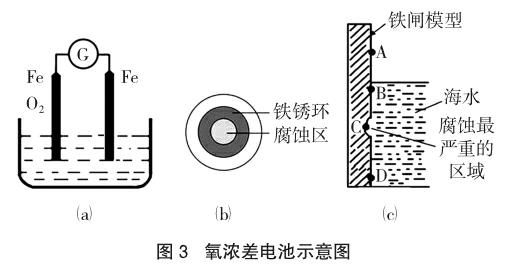
教学中,这样去理解是不错的选择:O2浓度越高,氧化性越强,首先发生反应,即在富氧区的氧气先得到电子,贫氧区为负极,贫氧区Fe反而发生腐蚀,如图3(a)中,左边的金属铁反而不容易腐蚀,但却锈迹斑斑,而右边的铁棒变细发生腐蚀。
教学总结:原电池的正负极的判据是电极过程到底是发生氧化还是还原反应,那种活泼金属为负极、不活泼金属为正极的结论是不恰当的。
教学建议:区别金属的腐蚀和生锈有其现实意义,可分析以下两个问题加以体会:(1)钉入木材的铁钉,长时间后,露在空气中的铁钉附着的铁锈多,而钻入木材的铁钉腐蚀严重,铁钉变细;(2)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(2011年浙江高考),如图3(b)。
2.3 设计原电池
所以说,形成原电池,并不一定需要在体系中发生自发的氧化还原反应,但必定存在电子得失,形成电势差是必要条件。
教学建议:把上述问题设计成强化性习题,让学生通过对各种信息的处理,充分感悟发生原电池反应的本质特征,使电化学有关知识的深度学习成为可能。
3 利用原电池原理设计的化学电源
3.1 干电池
20世纪50年代,为提高锌锰碱性干电池放电效率,其解决方案如下:(1)改变电解质酸碱性,使用KOH为电解质,提高电解质的pH——降低金属Zn与H+反应的可能性;(2)二氧化锰作去极化剂或正极材料——提高电池放电效率;(3)避免在正极产生H2——消除析氢过电位。
不管是碱性干电池还是酸性干电池,一般都加入汞或汞的化合物,这是因为:一是为了防止金属锌的自身腐蚀——干电池锌片表面有金属汞时,可以防止干电池中的H+放电得到氢气,防止金属锌与干电池中的氢离子反应而发生自放电现象(原因是金属汞是一种高超电位金属材料,超电势约为-1.0V,有金属汞在锌表面就难以释放出氢气,从而防止金属锌的溶解);二是为了防止H+在碳棒表面产生氢气,从而提高电池的放电效率(同时使用去极化剂MnO2来吸收可能产生的H2)。
3.2 燃料电池
燃料电池的工作原理最早于1839年由英国科学家葛洛夫(Grove)證实,并在1948年创造了第一个燃料电池——氢氧燃料电池。进入20世纪以后,燃料电池由于其特有的零污染优势而得以迅速发展。
燃料电池其原理是一种电化学装置,其组成与一般电池基本相同,其单体电池是由正、负两个电极以及电解质组成,不同的是一般干电池的活性物质贮存在电池内部,因此限制了电池容量,而燃料电池的正、负极本身不包含活性物质,只是个催化转换元件,因此燃料电池是名副其实地把化学能转化为电能的能量转换机器。
教学意义:燃料电池中的燃料和氧气,实际上就是不断补充正极和负极材料,使得电池能长时间工作,增强环保意识。
3.3 锂离子、钠离子和铝离子电池
随着人们环保意识的日益增强,铅、汞等有毒金属的使用日益受到限制,在1970年发明了传统铅酸电池的替代者——锂离子电池。
锂离子电池充电时,Li+强行进入石墨层,如图4(a),利用电能,把“电”存在石墨中(发生还原反应),把“电”贮存的过程,就是电能转化为化学能的过程。
锂离子电池放电时,被嵌入的Li+自发释放而脱出,石墨层释放出电子,发生氧化反应,而正极材料得到Li+发生还原反应,电解质中的有机阴离子因“行动极其缓慢”一般不参与导电,对电流无贡献,如图4(b)。
铝离子电池和锂离子电池的最大不同是石墨层充电情景不同,铝离子电池充电时,石墨层是释放电子,AlCl4-离子(阴离子)嵌入。
教学素材:为什么是锂离子电池而不是其他离子电池?锂离子的特点:锂离子半径小,容易在正极和负极材料之间脱出和嵌入,因此找到和锂离子半径相近的,便宜的阳离子电池——钠离子电池的开发也进入了崭新的时代。
化学能归根到底来自于太阳能,若能直接把太阳能转化为人类所需要的电能,不但实现低碳的现实目标,且太阳能可谓取之不尽,利用太阳能直接转化为电能才是长远之计。
4 利用太阳能设计电池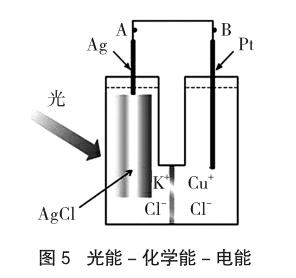
4.1 光化学电池
如图5是一种光电池,其中一个半电池内装有1 mol·L-1的氯化钾及一支银棒,另一半电池内则装有氯化亚铜及一支白金丝。当此电池受光照射时,氯化银会立即转变成银原子与氯原子,而氯原子会暂时吸附在氯化银上[简记为Cl(AgCl)]。
光照时:AgCl(s)=Ag+Cl,Cl吸附在AgCl(s)表面,称为吸附氯,有很强的氧化性,其Eθ=3.80V,Cu+(aq)-e-→Cu2+(aq),Eθ=0.15V。电池组成:(-)Ag(s),AgCl(s),Cl|KCl(aq)‖CuCl2(aq)|CuCl(s),Pt(s)(+)。
4.2 光伏发电
1839年法国科学家贝克勒尔(Becqurel)发现的“光伏效应”为太阳能电池的问世奠定了理论基础,1854年美国贝尔研究所首先研制了第一块实用型的单晶太阳能电池,图6为光伏电池与氮化镓光电池示意图。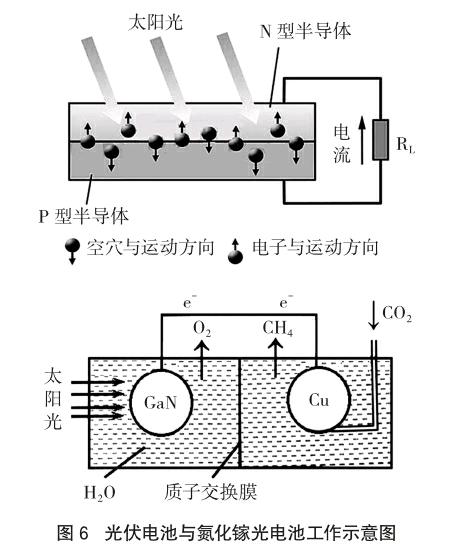
向晶体硅中参杂了磷、砷等元素后便形成了N型硅(能释放电子,成为电子型半导体),参杂了硼、镓等元素后便形成了P型半导体(能俘获电子,成为空穴型半导体)。当太阳能电池受到照射后,P型硅俘获的电子接受光能向N型区移动,使N型区带负电;同时空穴向P型区移动,使P区带正电,这样在P-N两端便产生了电动势。
教学设问:氮化镓光电池是原电池反应还是电解?由于整个回路中,无外加电源存在,因此不可能是电解,只能是原电池,但该原电池反应显然需要借助开放体系中的能量(太阳能)。最令人迷惑的是——氮化镓光电池的产物是甲烷和氧气,把甲烷和氧气组成燃料电池又可转化为电能,至此,假如去纠结这类装置到底是原电池还是电解池就无意义了。
教学意义:让学生细细品味化学电源工作原理,深度学习原电池有关知识,体验电化学本质特征。
5 结束语
从伏打电池、丹尼尔电池发现了“电”,到干电池的商业化和铅蓄电池的化学“存电”,发展到低污染的燃料电池以及锂离子电池利用石墨来“贮电”,最后到光电池以及光伏发电等利用太阳能直接“发电”,化学能与电能的相关研究经历了300多年。在科学的道路上,是艰辛、不平坦的,但正是人们的不懈追求,才使得人类的物质文明如此灿烂。
电极材料相同,但只要电极所处的环境不一样,电极电位就会不一样;总反应是非氧化还原反应,但只要电极过程有电子得失;总反应是吸热反应,但只要不是孤立体系,外界提供能量,就都能发生原电池反应;但是形成由电解质溶液组成的闭合回路和电池反应过程中有电子得失的前提是必不可少的。
纵观化学电源的发展史,从能量角度上,化学电源都是存在这样的过程:太阳能(或热能或电能等)→化学能→电能,其中电能转化为化学能,就是电解。值得注意的是:最初的原电池的确只是发生化学能→电能的过程,但随着实用电池的发展,各种能量转化过程完全可以在同一装置(电池)中发生。
参考文献:
[1]王灿.化学史中的科学发展观:以“化学电源”教学设计为例[J].化学教学,2014,(8):31~34.
[2]周庆华,王仲如.对原電池工作原理的探讨[J].化学教育,2016,(1):38~39.
[3]江敏.发现人类思维的脉络:“原电池”教学实践与思考[J].中学化学教学参考,2014,(12):1,5~9.
[4]傅献彩,陈瑞秋主编.物理化学[M].北京:高等教育出版社,1980.
[5]杭伟华.基于教材“螺旋式上升”编写理念的教学设计研究——以“原电池”教学为例[J].化学教学,2015,(12):29~33.
[6]但世辉,陈莉莉.电池300余年的发展史[J].化学教育,2011,(7):74~76.
[7]邢瑞斌,张凤香.能设计成原电池的反应一定是放热反应吗[J].中学化学教学参考,2014,(9):46~47.
