HPLC法同时测定祛瘀止痛合剂中6种成分的含量Δ
2017-07-25李洁环王洛临郭鸣徐文杰陈雪婷李智勇广州中医药大学附属广东第二中医院广州510405广东省中医药工程技术研究院广东省中医药研究开发重点实验室广州510095
李洁环,王洛临,郭鸣,徐文杰,陈雪婷,李智勇(1.广州中医药大学附属广东第二中医院,广州510405;.广东省中医药工程技术研究院/广东省中医药研究开发重点实验室,广州510095)
HPLC法同时测定祛瘀止痛合剂中6种成分的含量Δ
李洁环1,2*,王洛临2#,郭鸣1,2,徐文杰2,陈雪婷2,李智勇2(1.广州中医药大学附属广东第二中医院,广州510405;2.广东省中医药工程技术研究院/广东省中医药研究开发重点实验室,广州510095)
目的:建立同时测定祛瘀止痛合剂中芍药苷、柚皮苷、新橙皮苷、三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1含量的方法。方法:采用高效液相色谱法。色谱柱为Waters Xbridge C18,流动相为0.1%磷酸-乙腈(梯度洗脱),流速为1.0m L/m in,检测波长为203 nm,柱温为20℃,进样量为5µL。结果:芍药苷、柚皮苷、新橙皮苷、三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1检测进样量线性范围分别为0.273 4~2.734µg(r=0.999 9)、0.119 1~1.191µg(r=0.999 9)、0.081 5~0.815µg(r=0.999 9)、0.622 8~6.228µg(r=0.999 9)、0.807 2~8.072µg(r=0.999 9)、1.036 4~10.364µg(r=0.999 9);定量限分别为0.082 0、0.029 8、0.028 5、0.436 0、0.403 6、0.310 9µg,检测限分别为0.027 9、0.009 5、0.010 2、0.124 6、0.121 1、0.093 3µg;精密度、稳定性、重复性试验的RSD<2.0%;加样回收率分别为97.85%~100.34%(RSD=0.81%,n=6)、98.14%~101.22%(RSD=1.09%,n=6)、98.42%~102.15%(RSD=1.29%,n=6)、97.77%~100.25%(RSD=0.96%,n=6)、97.32%~99.53%(RSD=0.81%,n=6)、98.28%~101.51%(RSD=1.11%,n=6)。结论:该方法简便快速、稳定可行、重复性好,可用于祛瘀止痛合剂中6种成分含量的同时测定。
高效液相色谱法;祛瘀止痛合剂;芍药苷;柚皮苷;新橙皮苷;三七皂苷R1;人参皂苷Rg1;人参皂苷Rb1
祛瘀止痛合剂是广州中医药大学附属广东第二中医院的临床经验方,由三七、枳壳、白芍、川芎等药材组成,具有活血止痛、行气活络、祛瘀消肿之功效,临床上用于治疗骨折早期由于气血阻滞而导致的瘀血肿胀。研究表明,三七中皂苷类成分能降低血液黏度、抑制血小板聚集、改善微循环,是活血的主要成分[1-2]。白芍中芍药苷具有镇痛解痉、改善血流变、抑制血小板凝集等作用[3-4]。枳壳中柚皮苷具有镇痛抗炎作用,还能促进成骨细胞的生成,增强骨更新[5];新橙皮苷能抑制毛细血管脆性,恢复损伤所致的紫斑[6-8]。中药复方制剂组成复杂、成分众多,但目前对该制剂的研究多采用单一成分的含量测定来进行质量监测,不能全面反映其质量。因此,本课题组采用高效液相色谱法(HPLC)建立了同时测定祛瘀止痛合剂中芍药苷、柚皮苷、新橙皮苷、三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1含量的方法,以期为完善该制剂的质量标准提供参考。
1 材料
1.1 仪器
1200型HPLC仪,包括G1322A紫外检测器、G1322A标准真空脱气机、G1312A二元泵、G1329A标准自动进样器、G1316A标准柱温箱、Agilent Chemstation B 03.01色谱工作站(美国Agilent公司);JJ500型电子分析天平(常熟市双杰测试仪器厂);FE20型pH计、ME204型电子分析天平均购自瑞士M ettler-Toledo公司;KQ-300DE型数控超声波清洗器(昆山市超声仪器有限公司,功率:300W,频率:40 kHz);M illi-Q Advantage A10型超纯水系统(美国M illipore公司);T-50型溶剂过滤器(天津市津腾实验设备有限公司)。
1.2 药品与试剂
祛瘀止痛合剂(广州中医药大学附属广东第二中医院自制,批号:160301、160302、160303,规格:150m L/瓶);芍药苷对照品(批号:110736-201640,纯度:95.2%)、柚皮苷对照品(批号:110722-201312,纯度:94.7%)、新橙皮苷对照品(批号:111857-201102,纯度:99.6%)、三七皂苷R1对照品(批号:110745-201318,纯度:94.0%)、人参皂苷Rg1对照品(批号:110703-201128,纯度:93.4%)、人参皂苷Rb1对照品(批号:110704-201223,纯度:95.9%)均购自中国食品药品检定研究院;乙腈为色谱纯,其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:Waters Xbridge C18(250 mm×4.6 mm,5 µm);流动相:0.1%磷酸(A)-乙腈(B),梯度洗脱(0~12 min,15%B;12~60 m in,15%→36%B);流速:1.0 m L/m in;检测波长:203 nm;柱温:20℃;进样量:5µL。
2.2 溶液的制备
2.2.1 混合对照品溶液取芍药苷、柚皮苷、新橙皮苷、三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1对照品各适量,精密称定,置于同一10m L量瓶中,加甲醇溶解,制成上述各待测成分质量浓度分别为0.546 8、0.238 2、0.163 0、1.245 6、1.614 4、2.072 8mg/m L的混合对照品贮备液。精密量取上述混合对照品贮备液适量,置于2m L量瓶中,加甲醇稀释,制成上述各待测成分质量浓度分别为0.273 4、0.119 1、0.081 5、0.622 8、0.807 2、1.036 4mg/m L的混合对照品溶液。
2.2.2 供试品溶液精密量取样品0.3m L,置于10m L量瓶中,加甲醇适量,超声处理25m in,放冷至室温,加甲醇定容,摇匀,经0.45µm微孔滤膜滤过,取续滤液,即得。
2.2.3 阴性对照溶液按祛瘀止痛合剂的处方比例和制备工艺制备缺白芍、枳壳和三七的单一阴性样品,再按“2.2.2”项下方法制备缺白芍、枳壳和三七的单一阴性对照溶液。
2.3 系统适用性试验
精密量取“2.2”项下混合对照品溶液、供试品溶液和阴性对照溶液各适量,按“2.1”项下色谱条件进样测定,记录色谱,详见图1。由图1可知,在该色谱条件下,理论板数以芍药苷峰计为11 878,保留时间为11.801m in;各成分均能达到基线分离,分离度>1.5。结果表明,其他成分对测定无干扰。

图1 高效液相色谱图Fig 1 HPLC chromatogram s
2.4 线性关系考察
精密量取“2.2.1”项下混合对照品贮备液0.1、0.2、0.4、0.6、0.8、1.0m L,分别置于1m L量瓶中,加甲醇稀释至刻度,摇匀,即得系列混合对照品溶液。精密量取上述系列混合对照品溶液各5µL,按“2.1”项下色谱条件进样测定,记录峰面积。以各待测成分进样量为横坐标(x,µg)、峰面积为纵坐标(y)进行线性回归,得回归方程与线性范围,详见表1。
2.5 定量限与检测限考察
取“2.2.1”项下混合对照品溶液适量,倍比稀释,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。当信噪比为10∶1时,得定量限(LOQ);当信噪比为3∶1时,得检测限(LOD)。结果,芍药苷、柚皮苷、新橙皮苷、三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1的LOQ分别为0.082 0、0.029 8、0.028 5、0.436 0、0.403 6、0.310 9μg,LOD分别为0.027 9、0.009 5、0.010 2、0.124 6、0.121 1、0.093 3μg。

表1 回归方程与线性范围Tab 1 Regression equationsand linear ranges
2.6 精密度试验
精密量取“2.2.1”项下混合对照品溶液5µL,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,芍药苷、柚皮苷、新橙皮苷、三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1峰面积的RSD分别为0.83%、0.79%、0.92%、1.02%、0.98%、1.13%(n=6),表明仪器精密度良好。
2.7 稳定性试验
精密吸取“2.2.2”项下供试品溶液(批号:160301)5 µL,分别于室温下放置0、2、4、8、12、24 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,芍药苷、柚皮苷、新橙皮苷、三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1峰面积的RSD分别为0.91%、1.03%、1.15%、0.98%、1.34%、1.22%(n=6),表明供试品溶液在室温下放置24 h内稳定性良好。
2.8 重复性试验
取同一批样品(批号:160301)适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算各待测成分的含量。结果,芍药苷、柚皮苷、新橙皮苷、三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1含量的平均值分别为1.903 2、0.966 8、0.602 5、5.132 2、13.343 1、9.644 7mg/m L,RSD分别为1.21%、0.89%、0.97%、1.05%、1.18%、1.42%(n=6),表明本方法重复性良好。
2.9 加样回收率试验
取样品(批号:160301)0.15m L,共6份,分别加入一定质量的芍药苷、柚皮苷、新橙皮苷、三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1对照品,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表2。
2.10 样品含量测定
取3批样品各适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算样品含量,结果见表3。
3 讨论
3.1 色谱柱的选择
本课题组考察了Agilent Eclipse Plus C18、AgilentExtend C18和Waters Xbridge C18色谱柱的分离、洗脱效果,结果,Agilent Eclipse Plus C18和Agilent Extend C18的分离效果均较差,在25~50min内(即柚皮苷、新橙皮苷、三七皂苷R1、人参皂苷Rg1的出峰时间段)色谱基线漂移严重,而改用Waters Xbridge C18时,各成分分离效果较好,且色谱基线相对平稳。因此,选择Waters Xbridge C18为本试验的色谱柱。

表2 加样回收率试验结果(n=6)Tab 2 Resultsof recovery tests(n=6)
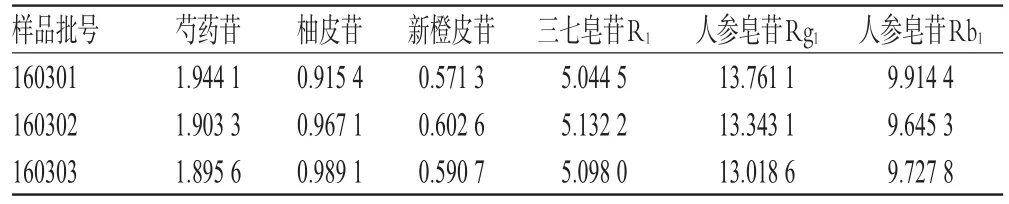
表3 样品含量测定结果(n=3,mg/m L)Tab 3 Resu lts of contents determ ination of sam p les(n=3,mg/m L)
3.2 检测波长的选择
本课题组在预试验阶段采用分段变换波长的方法进行测定,结果,色谱基线漂移严重,故考虑选用单波长进行测定。笔者考察了203 nm和283 nm两个波长,结果选择283 nm为本试验的检测波长时,芍药苷、柚皮苷、新橙皮苷的色谱峰较高,而三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1色谱峰则较低,与前3个成分相差悬殊;改用203 nm波长进行测定时,三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1的色谱峰较高,而且其他3个成分的色谱峰也适中,故本试验确定检测波长为203 nm。
3.3 柱温的选择
笔者曾考察了20、25、30℃3个柱温对色谱分离效果的影响。结果,柱温为20℃时,与25℃和30℃相比,新橙皮苷、人参皂苷Rg1的分离度有明显改善,故确定本试验的柱温为20℃。
3.4 流动相的选择
笔者参考相关报道[9-12],考察了不同流动相系统及流动相比例对各成分的洗脱效果。结果,用甲醇-水系统进行梯度洗脱时,部分成分未能洗脱出,不适合作为本试验的流动相;用乙腈-水系统进行梯度洗脱时,各成分虽均被洗脱,但峰形差、有拖尾,改用0.1%磷酸-乙腈作为流动相进行梯度洗脱,并经过多次调整流动相比例,各成分峰形得到改善,且分离度较好,最终本试验选择0.1%磷酸-乙腈作为流动相。
综上所述,本方法简便快速、稳定可行、重复性好,可用于祛瘀止痛合剂中6种成分含量的同时测定。
[1]刘东平,杨军,丁丹.三七及其有效成分对血液系统的药理活性研究概况[J].中医药信息,2012,29(4):172-174.
[2]王海燕,容蓉,田景振.三七活性成分药理作用及临床应用概述[J].山东中医药大学学报,2014,38(2):178-180.
[3]李岩.白芍及其化学成分的药理研究进展[J].职业与健康,2015,31(15):2153-2156.
[4]张建军,李伟,王丽丽,等.赤芍和白芍品种、功效及临床应用述评[J].中国中药杂志,2013,38(20):3595-3601.
[5]舒尊鹏,胡书法,翟亚东,等.中药枳壳化学成分及药理作用研究[J].科技创新,2012,7(1):8-9.
[6]陈振鹤,吴国泰,任远.枳壳的化学成分、药理作用及临床应用[J].安徽农业科学,2016,44(26):95-97.
[7]高颖,高文远,董玄.HPLC-ELSD法测定血府逐瘀胶囊中苦杏仁苷、芍药苷和柚皮苷[J].中草药,2009,40(11):1756-1758.
[8]刘翔,黄京.HPLC法同时测定麻仁丸中芍药苷、柚皮苷及橙皮苷的含量[J].中国药品标准,2010,11(6):442-446.
[9]陈亮,钱一帆.HPLC测定田七痛经胶囊中人参皂苷Rg1、Rb1及三七皂苷R1含量[J].中国中医药信息杂志,2015,22(10):77-80.
[10]耿燕娜,张文鑫.一测多评法同时测定复方丹参片中人参皂苷Rg1,Re,Rb1和三七皂苷R1含量[J].中国实验方剂学杂志,2015,21(1):69-72.
[11]方德宇,田原,樊晖,等.HPLC法测定温阳活血颗粒中芍药苷及人参皂苷Rg1、Re、Rb1含量[J].中华中医药学刊,2016,34(5):1228-1230.
[12]杨佳静,薛佳,周华方,等.HPLC法同时测定胃苏颗粒中柚皮苷、橙皮苷和新橙皮苷的含量[J].中国药房,2014,25(4):372-374.
(编辑:刘柳)
SimultaneousDeterm ination of 6 Components in Quyu Zhitong M ixture by HPLC
LIJiehuan1,2,WANG Luolin2,GUO M ing1,2,XUWenjie2,CHEN Xueting2,LIZhiyong2(1.Guangdong Second Chinese Medical Hospital A ffiliated to Guangzhou University of TCM,Guangzhou 510405,China;2.Guangdong Research Institute of TCM Engineering and Technology/Guangdong Provincial Key Laboratory of TCM Research and Development,Guangzhou 510095,China)
OBJECTIVE:To establish a method for simultaneous determ ination of paeoniflorin,naringin,neohesperidin,notoginsenoside R1,ginsenoside Rg1and ginsenoside Rb1in Quyu zhitong mixture.METHODS:HPLC method was adopted.The determ ination was performed on Waters Xbridge C18column w ith mobile phase consisted of 0.1%phosphoric acid-acetonitrile(gradient elution)at the flow rate of 1.0 m L/min.The detection wavelength was set at 203 nm,and column temperature was 20℃.The sample size was 5µL.RESULTS:The linear ranges of paeoniflorin,naringin,neohesperidin,notoginsenoside R1,ginsenoside Rg1and ginsenoside Rb1were 0.273 4-2.734µg(r=0.999 9),0.119 1-1.191µg(r=0.999 9),0.081 5-0.815µg(r=0.999 9),0.622 8-6.228 µg(r=0.999 9),0.807 2-8.072µg(r=0.999 9),1.036 4-10.364µg(r=0.999 9).The limits of quantitation were 0.082 0,0.029 8,0.028 5,0.436 0,0.403 6,0.310 9µg.The lim its of detection were 0.027 9,0.009 5,0.010 2,0.124 6,0.121 1,0.093 3µg.RSDs of precision,stability and reproducibility testswere lower than 2.0%.Recoverieswere 97.85%-100.34%(RSD=0.81%,n=6),98.14%-101.22%(RSD=1.09%,n=6),98.42%-102.15%(RSD=1.29%,n=6),97.77%-100.25%(RSD=0.96%,n=6),97.32%-99.53%(RSD=0.81%,n=6)and 98.28%-101.51%(RSD=1.11%,n=6).CONCLUSIONS:The method is simple,rapid,stable,feasible and reproducible,and can be used for the simultaneous determination 6 components in Quyu zhitongmixture.
HPLC;Quyu zhitong m ixture;Paeoniflorin;Naringin;Neohesperidin;Notoginsenoside R1;Ginsenoside Rg1;Ginsenoside Rb1
R 917
A
1001-0408(2017)18-2557-04
2017-01-13
2017-03-17)
DOI10.6039/j.issn.1001-0408.2017.18.31
