RCP与G蛋白偶联在静压力促血管平滑肌细胞增殖中的作用
2017-07-25张晓一刘玉环秦旭平
张晓一,王 珍,郭 峰,刘玉环,杨 丽,阳 芳,秦旭平
(1.长治医学院药学系,山西 长治 046000;2.南华大学药物药理研究所,湖南 衡阳 421001)
RCP与G蛋白偶联在静压力促血管平滑肌细胞增殖中的作用
张晓一1,王 珍2,郭 峰2,刘玉环2,杨 丽2,阳 芳2,秦旭平2
(1.长治医学院药学系,山西 长治 046000;2.南华大学药物药理研究所,湖南 衡阳 421001)
目的 探讨受体组分蛋白(RCP)在静压力促血管平滑肌细胞(VSMC)增殖信号跨膜转导中的作用。方法 以鼠源性A10血管平滑肌细胞(A10VSMC)作为研究对象,用静压力处理细胞,噻唑蓝比色法(MTT)检测细胞的活性;Western blot 检测增殖细胞核抗原(PCNA)、RCP和G蛋白的表达;RT-PCR检测RCP mRNA表达水平;免疫共沉淀检测G蛋白和RCP间相互作用。结果 静压力呈压力和时间依赖性地增加A10VSMC活性、PCNA蛋白表达和RCP表达,并在120 mmHg静压力和6 h达到最大。静压力在增加细胞 p-Akt表达水平(P<0.05)的同时,减少RCP与Gαs的相互作用,增加RCP与Gβ的作用,但对Gγ不明确。结论 静压力可使VSMC增殖和RCP表达增加,其作用可能涉及到细胞G蛋白信号转导机制。
受体组分蛋白;静压力;血管平滑肌细胞;增殖;G蛋白;信号转导
血管平滑肌细胞(vascular smooth muscle cell, VSMC)增殖在高血压血管重构、冠状动脉粥样硬化、冠状动脉搭桥术、经皮冠状动脉介入治疗术后血管再狭窄的发生和发展过程中起着重要的作用。引起平滑肌细胞增殖的因素很多,包括机械力、生长因子、细胞因子、多肽和核酸代谢产物等[1-2]。其中,血压升高所产生的异常机械力作用于血管壁,引起VSMC肥大、增生和细胞外基质的产生,是导致VSMC增殖并诱发血管重构的重要原因之一[3]。在血管内,血压和血流对血管壁产生的机械力按不同方向分为剪应力、静压力、牵张力。剪应力是血液流动所产生的摩擦力,静压力是血液在血管内由于重力所造成的压力,而牵张力是心脏周期性搏动所产生的具有一定频率的张力[4]。由于VSMC不直接与剪应力接触,所以,VSMC的功能主要受静压力和牵张力的调控。静压力对VSMC功能调控作用研究甚少,且具体信号通路不完全清楚[5]。
降钙素基因相关肽(calcitonin gene-related peptide,CGRP),可由感觉神经末梢和组织旁分泌,是目前发现的体内最强的舒血管活性物质。研究发现,高压大鼠和原发性高血压患者体内CGRP合成和分泌减少是导致血压持续增高的重要原因[6]。由于CGRP通过其受体发挥作用,故阐明CGRP受体在血压调节中的信号转导实属必要。目前认为,CGRP受体主要有3种成分构成,包括降钙素受体样受体(calcitonin receptor-like receptor, CLR)、受体活性修饰蛋白-1(receptor activity modifying protein 1, RAMP1)和降钙素基因相关肽受体组分蛋白(calcitonin gene-related peptide receptor component protein, RCP)[7]。CLR是7次跨膜的G蛋白偶联受体蛋白,CGRP携带的信息是通过磷酸化CLR而传递进入胞内,进而进行下游的生物应答,RAMP1是CLR的一个分子伴侣蛋白,与CLR的膜分布有关,而RCP在膜内侧,起作用可能与信号转导有关,也有认为RCP可能不仅仅只转导CGRP的信息,还可能与G蛋白偶联在转导其他细胞外信号中发挥作用[8]。故本文探索RCP在静压力诱导VSMC增殖信号跨膜转导中的作用。
1 材料与方法
1.1 试剂与药物 RCP山羊多克隆抗体、β-actin鼠单克隆抗体、3种G蛋白亚型兔多克隆抗体,均购自美国Santa Cruz公司;增殖细胞核抗原(proliferating cell nuclear antigen,PCNA) 鼠单克隆抗体(英国Abcam公司);CGRP(美国Sigma公司);胎牛血清(美国纽约Gibco公司产品)。
1.2 仪器 Forma 3111 CO2培养箱(美国 Thermo公司);压力培养箱(南华大学自主研制);PE2400 PCR仪(美国Perking 公司);Western blot装置(北京六一仪器厂);酶联免疫检测仪Elx-800型(Bio-Tek公司)。
1.3 方法
1.3.1 大鼠血管平滑肌细胞培养 鼠源性A10血管平滑肌细胞株(A10VSMC)购自上海众华生物公司(来源于美国ATCC细胞库)。细胞用含10%胎牛血清的高糖DMEM细胞培养液吹散制成细胞悬液,接种于培养瓶中,置于5% CO2培养箱中培养(温度37 ℃,湿度95%)。每隔2~3 d换培养液1次,待细胞80%融合时,用0.25%胰蛋白酶消化并传代。取对数生长期细胞,并待细胞长满至整个细胞瓶70%左右时,换成含1%胎牛血清的DMEM高糖培养基继续培养24 h,使细胞同步化,然后分别加入不同的处理因素进行实验。整个实验根据处理因素,以静止期细胞零压力或零时间为对照组,其他处理因素为处理组,其中CGRP处理组为阳性药物对照组,在各实验过程中具体说明。
1.3.2 MTT法检测VSMC的活性 A10细胞以密度为5×103个种植在96孔板,贴壁24 h,然后换为无血清培养基24 h同步化,以不同压力、不同时间处理A10VSMC。然后,每孔加入20 μL浓度为50 g·L-1MTT溶液,置于CO2培养箱37 ℃孵育4 h后,轻轻吸掉液体,每孔加入150 μL DMSO,室温摇床上摇动10 min,使用酶标仪测量波长为570 nm的吸光度。根据公式计算细胞存活率,存活率/%=A增殖组/A对照组×100%。
1.3.3 Western blot法检测蛋白表达 于冰上用5 mL 4℃预冷的PBS洗涤培养瓶中的细胞,弃去洗涤液,重复3次。加入60 μL含PMSF的裂解液裂解10 min,用BCA蛋白定量分析试剂盒进行总蛋白定量。取含50 μg蛋白至1.5 mL的EP管中,加入5×SDS上样缓冲液,于沸水中煮10 min使蛋白变性后,上样。用12%分离胶5%浓缩胶进行SDS-PAGE电泳。电泳结束后,转移至PDVF膜上,用适量5%脱脂牛奶封闭1 h。TBST洗掉牛奶后,加入适当浓度的一抗,4℃孵育过夜,次日,用TBST在室温下脱色摇床上洗膜3次,每次10 min。再加入适当浓度的二抗室温孵育1~2 h后,再用TBST清洗3次,每次10 min,然后进行化学发光法显色。根据荧光强度确定压片时间,取出胶片,分别向显影盒和定影盒中倒入适量显影液和定影液,将胶片放入显影液中,缓慢摇动,5~10 s后取出,放入定影液中约10 min后,晾干并保存。将胶片进行扫描或拍照,用凝胶图像处理系统分析目的条带和净光密度值。
1.3.4 RT-PCR法检测RCP mRNA的表达 按TRIzol试剂操作说明提取A10VSMC的总RNA, 按照逆转录试剂盒说明书在PCR仪上逆转录后,所得的cDNA可直接进行PCR反应或-20℃保存。由上海生工DNA合成大鼠RCP和GAPDH的引物并作适当修饰,以避免引物自身形成发夹结构及引物二聚体合成,并经ULTRAPAGE方式纯化。RCP上游:5′-CGGGATCCCGAGGCAACATGGAAGTGAAGG-3′,下游:5′-GCTCTAGAGCTGTCTATGCAGGCTCCTCCT-3′; GAPDH:上游:5′-GAACTTGAACGCCATCACCTA-3′, 下游:5′-GTGTGCAGGAGAGCTTCAA TC-3′ 。反应体系:Taq Master Mix(2×) 12.5 μL, PCR 上、下游引物各1 μL,无核酸酶水9.5 μL,cDNA 1 μL。反应条件:预变性94 ℃ 5 min,变性94 ℃ 30 s,退火30 s(RCP:64 ℃,GAPDH:55 ℃),延伸72 ℃ 30 s,进行30个循环,最后72 ℃延伸10 min。然后,于2%琼脂糖凝胶电泳检测,显影并用灰度扫描目标条带的积分吸光度值(IA)与内标IA比值的半定量法,分析目的基因的表达变化。
1.3.5 免疫共沉淀法检测蛋白质之间的相互作用 将对数生长期的A10VSMC消化接种于 6孔板中,每孔加入2 mL含有 1×105个细胞的细胞悬液。然后,按照免疫共沉淀试剂盒步骤操作。简化步骤包括通过抗体固化、免疫共沉淀、免疫复合物的洗脱,向Pierce Spin Column 中加入30 μL Elution Buffer,室温孵育30 min,离心收集洗脱物,用RCP和G蛋白抗体做Western blot检测。
2 结果
2.1 静压力诱导VSMC的增殖 不同静压力处理A10VSMC不同时间,Western blot检测PCNA蛋白表达水平和MTT法检测细胞活性。结果显示,在同一6 h时间点,与对照组相比,VSMC的活性随着静压力的增加而逐渐增加,在120 mmHg的静压力下达到最高(P<0.01,Fig 1A);Western blot法也显示,PCNA蛋白表达水平随着静压力的增加而逐渐增加,在120 mmHg的压力下达到最大(P<0.01,Fig 1B)。在同一120 mmHg静压力下,与对照组相比,VSMC的活性随着时间的延长逐渐增加,在6 h达到了最高并处于平台期(P<0.01,Fig 1C);Western blot结果显示,PCNA蛋白表达在6 h达到最大并处于平台期(P<0.01,Fig 1D)。我们选择静压力为120 mmHg处理A10VSMC 6 h用于后续实验。

Fig 1 Effect of static pressure on A10VSMC viability and PCNA expression (±s, n=3)
Dose-effect relationship of static pressure on cell viability(A) and PCNA (B).*P<0.05,**P<0.01vs0 mmHg. Time-effect relationship of static pressure on cell viability (C) and PCNA (D).*P<0.05,**P<0.01vs0 h. On the y-axis, 1 represents the OD value in control group (0 mmHg or 0 h).
2.2 静压力上调VSMC中RCP蛋白和mRNA 为了检测静压力对RCP的表达是否有影响,我们用不同静压力处理A10VSMC不同时间,检测RCP mRNA和蛋白表达。结果显示,在6 h时间点,与0 mmHg压力组相比,RCP蛋白表达和mRNA随着静压力的增加而增加,并在120 mmHg的压力下达到最大(P<0.01,Fig 2A、2B)。在120 mmHg静压力下,与0 h组相比,RCP蛋白表达和mRNA水平随着时间的延长逐渐上调,在6 h达到了最高并处于平台期(P<0.01,Fig 2C、2D)。这些结果表明,RCP的表达与静压力成剂量和时间依赖关系,与细胞增殖呈正相关,提示RCP参与了静压力诱导的A10VSMC增殖。
2.3 CGRP抑制静压力诱导的VSMC增殖 为了进一步确认RCP的表达是否对静压力诱导平滑肌细胞增殖有影响。采用终浓度为10 nmol·L-1的CGRP孵育细胞12 h,然后用120 mmHg的压力处理6 h。结果显示,与no-CGRP组比较,在静压力作用下,细胞活性明显降低(P<0.05,Fig 3A);PCNA蛋白表达也明显减少(P<0.05,Fig 3B)。这说明CGRP诱导的RCP表达减弱了静压力诱导的VSMC增殖作用,RCP的表达限制了静压力诱导VSMC的过分增殖。
2.4 静压力对PI3K/Akt信号通路及RCP与G蛋白的相互作用的影响 为了解静压力导致的A10VSMC增殖是否与G蛋白和PI3K/Akt信号通路有关,以静止期细胞(Control)组和CGRP组(CGRP受体激动剂,药物对照)为对照,用120 mmHg静压力分别处理细胞5、30 min和1、3、6 h。如Fig 4所示,与Control组相比,p-Akt的表达在施压后30 min降低,但随后表达增强(Fig 4A);同时,在5 min时间点,Gαs与RCP的偶合明显减少(Fig 4B),RCP与Gβ的偶合增加(Fig 4C),但RCP与Gγ亚型的偶合作用不明显(Fig 4D)。另外也发现,Akt的表达在施压后1 h增加,提示静压力解离了Gαs与RCP的偶合,可能与激活PI3K/Akt信号通路有关;与对照组的静止期细胞相比,给予10 nmol·L-1的CGRP孵育细胞30 min,Gαs、Gβγ与RCP偶合作用均减少(Fig 4B~4D)。

Fig 2 Effect of static pressure on expression of RCP (±s, n=3)
Dose-effect relationship of static pressure on the expression of RCP protein(A) and mRNA (B).*P<0.05,**P<0.01vs0 mmHg. Time-effect relationship of static pressure on the expression of RCP protein (C) and mRNA (D).*P<0.05,**P<0.01vs0 h.
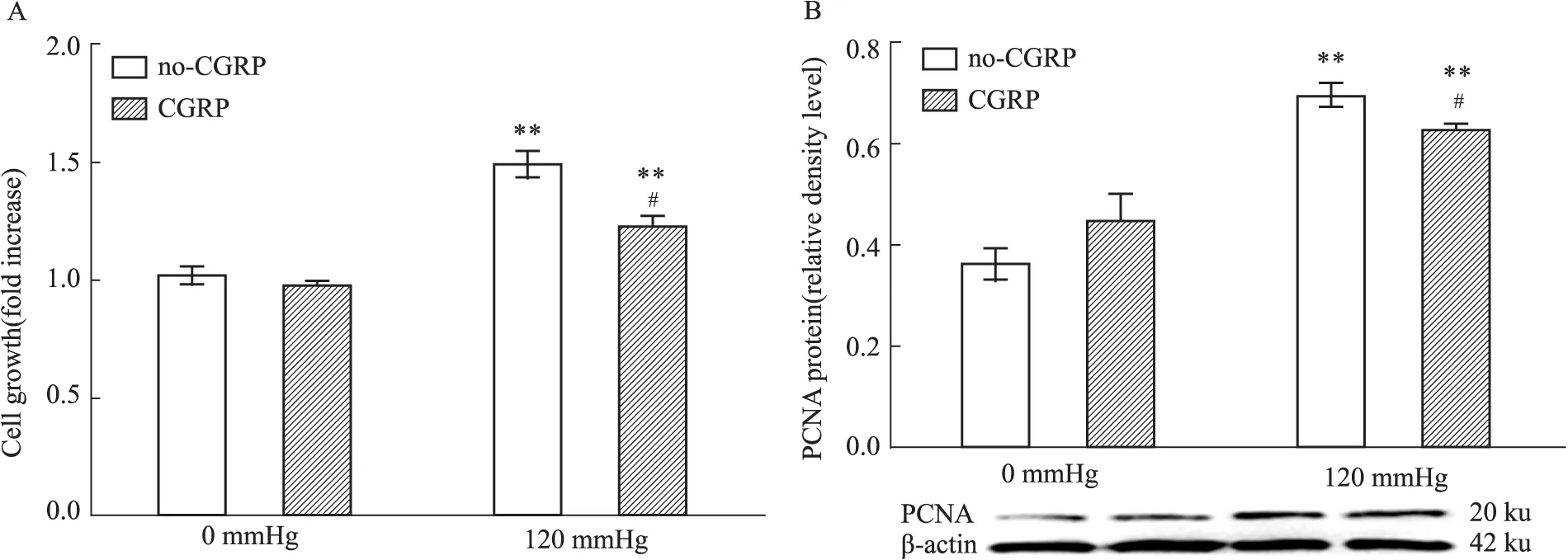
Fig 3 Effect of CGRP on A10VSMC proliferation induced by static pressure (±s, n=3 )
Cell viability (A) and PCNA (B).**P<0.01vs0 mmHg (control);#P<0.05vsno-CGRP group.

Fig 4 Expression of Akt and interaction of RCP and G proteins induced by static pressure
3 讨论
本研究发现,静压力能够促进VSMC的增殖,也可诱导RCP的表达增加, RCP与Gαs蛋白的相互作用可能在介导静压力激活PI3K/Akt信号使VSMC增殖通路中起重要作用。同时,RCP的增加,也可能增加VSMC对CGRP的敏感性,通过代偿性地抑制了静压力诱导的VSMC过度增殖;静压力促VSMC增殖的同时,减弱了RCP与Gαs蛋白的结合,但增加了与Gβ结合,说明在静止期的VSMC中,RCP起到了束缚Gαs蛋白的作用。文献报道,管腔内血压和血流产生的机械力在调节血管平滑肌形态和生长方面有着重要的作用,其压力的信号转导机制一直是人们关心的问题[9]。本实验结果显示,静压力能够使静止期VSMC活性和蛋白增殖抗原表达增加,说明除过量血管活性物质(如血管紧张素II等)外,血压引起的压力增高也是导致血管重构的一个因素[10]。体内CGRP分泌增加在抑制血压升高方面起重要作用,这与本实验结果CGRP能抑制静压力增高导致的细胞增殖完全一致,说明CGRP抑制高血压血管重构作用与抑制VSMC增殖有关。令人感兴趣的是在本实验中,静压力能诱导RCP的表达增加,这是否提示RCP也参与了静压力诱导VSMC增殖的信号转导值得探索。
众所周知,G蛋白偶联受体是以G蛋白亚单位Gαs和Gβγ结合与分离介导信号转导为特征,大多数药物的治疗作用都与G蛋白偶联受体有关[11-12]。机械力的信号转导是否也与G蛋白有关,而且机械力能否调节RCP,目前仍不清楚。本实验发现,与对照组(静止期细胞)比较,持续施加静压力,RCP与Gαs和Gγ的结合明显减弱,而相应地与Gβ结合增加,这提示静压力减弱了RCP与Gαs或(和)Gγ的偶合作用,促进了Gαs和Gγ游离;同时也发现,Akt信号在施加静压力5、30 min时,表达降低,但1 h后,明显增强,这进一步证明PI3K/Akt信号是导致VSMC增殖中的一个重要通路,持续机械力作用下,磷酸化的Akt在1 h后明显增大[13],这可能与蛋白表达的滞后效应有关,但为什么Akt在30 min时表达降低,仍需要进一步探讨。本实验结果说明PI3K/Akt信号介导了静压力诱导的VSMC增殖。由于前期实验我们证实,CGRP对血管紧张素II诱导的VSMC增殖有抑制作用[14],故在本实验中,我们以CGRP为对照药,与对照组(静止期细胞)比较,CGRP组Gαs、Gβγ与RCP偶合作用均减少,说明CGRP对静止期细胞有促增长作用,但这种机制可能与静压力激活PI3K/Akt信号促VSMC增殖机制不完全相同。需要说明的是,由于本实验设计局限性,本实验只能说明静压力能够促进VSMC的增殖作用,同时也可诱导RCP的表达增加,要确切证明RCP与Gαs蛋白的相互作用介导了静压力激活PI3K/Akt信号通路使VSMC增殖,还必须在沉默RCP和(或)Gαs基因基础上,进一步观察PI3K/Akt信号的表达活性与细胞增殖的关系。
[1] 秦旭平, 廖端芳, 李元建. 血管平滑肌细胞增殖及其调控[J]. 中国动脉硬化杂志, 2001, 9(5):450-5.
[1] Qin X P,Liao D F,Li Y J. Vascular smooth muscl cell proliferation and regulation[J].ChinJArterioscler, 2001, 9(5):450-5.
[2] 杨晓玲,郭凤英,马胜超,等. miRNA-143在同型半胱氨酸致血管平滑肌细胞增殖中作用的研究[J].中国药理学通报,2016,32(8):1097-101.
[2] Yang X L,Guo F Y,Ma S C,et al.Effect of miRNA-143 on homocysteine induced vascular smooth muscle cell proliferation[J].ChinPharmacolBull, 2016,32(8): 1097-101.
[3] Chaterji S, Kim P, Choe S H,et al.Synergistic effects of matrix nanotopography and stiffness on vascular smooth muscle cell function[J].TissueEngPartA, 2014,20(15-16):2115-26.
[4] Tsuda Y, Okazaki M, Uezono Y, et al. Activation of extracellular signal-regulated kinases is essential for pressure-induced proliferation of vascular smooth muscle cells[J].EurJPharmacol, 2002, 446(1-3):15-24.
[5] Shyu K G. Cellular and molecular effects of mechanical stretch on vascular cells and cardiac myocytes[J].ClinSci(Lond), 2009, 116(5):377-89.
[6] 邓盘月,李元建. 降钙素基因相关肽与高血压[J]. 中国药理学通报, 2004, 20(8): 853-6.
[6] Deng P Y, Li Y J. The role of calcitonin gene-related peptide in hypertension[J].ChinPharmacolBull, 2004, 20(8):853-6.
[7] 唐江琼, 秦旭平. 降钙素基因相关肽受体组分蛋白[J]. 生命的化学, 2011, 31(2): 277- 80.
[7] Tang J Q, Qin X P. Researches of calcitonin gene-related peptide receptor component protein [J].ChemLife, 2011, 31(2): 277-80.
[8] Evans B N, Rosenblatt M I, Mnayer L O, et al. A novel protein required for signal transduction at calcitonin gene-related peptide and adrenomedullin receptors[J].JBiolChem, 2000, 275(40):31438-43.
[9] Li C, Xu Q. Mechanical stress-initiated signal transductions in vascular smooth muscle cells[J].CellSignal, 2000,12(7):435-45.
[10]Forrester S J, Elliott K J, Kawai T, et al. Caveolin-1 deletion prevents hypertensive vascular remodeling induced by angiotensin II [J].Hypertension, 2017,69(1):79-86.
[11]Monk K R, Hamann J, Langenhan T, et al. Adhesion G protein-coupled receptors: frominvitropharmacology toinvivomechanisms [J].MolPharmacol, 2015, 88(3): 617-23.
[12]Vaidehi N, Grisshammer R, Tate C G. How can mutations thermostabilize G-protein-coupled receptors [J].TrendsPharmacolSci, 2016,37(1):37-46.
[13]Boyd N L, Park H, Yi H, et al. Chronic shear induces caveolae formation and alters ERK and Akt responses in endothelial cells[J].AmJPhysiolHeartCircPhysiol, 2003, 285(3):H1113-22.
[14]Qin X P, Ye F, Hu C P, et al. Effect of calcitonin gene-related peptide on angiotensin II-induced proliferation of rat vascular smooth muscle cells[J].EurJPharmacol, 2004,488(1-3): 45-9.
Interacting of receptor component protein and G protein in static pressure-induced proliferation of VSMC
ZHANG Xiao-yi1,WANG Zhen2, GUO Feng2, LIU Yu-huan2, YANG Li2, YANG Fang2,QIN Xu-ping2
(1.DeptofPharmacy,ChangzhiMedicalCollege,ChangzhiShanxi046000,China;2.InstituteofPharmacyandPharmacology,UniversityofSouthChina,HengyangHunan421001,China)
Aim To explore the effect of receptor component protein (RCP) in the signal transduction of vascular smooth muscle cell (VSMC) proliferation induced by static pressure. Methods The mouse-derived vascular smooth muscle cell line (A10VSMC) was employed in the experiment. Cells were exposed to static pressure, and MTT assay was used to detect the cell viability. Western blot was used to determine the expressions of PCNA, RCP and p-Akt, RCP mRNA was tested by RT-PCR, and co-immunoprecipitation was used to test the interaction between RCP and G proteins. Results The cell viability, expressions of PCNA and RCP increased with the elevation of static pressure and reached their peaks at 120 mmHg, and after 6 hours they got a plateau. The static pressure significantly increased the level of p-Akt, meanwhile, the binding of RCP and Gαs significantly decreased. However, the binding of RCP and Gβ increased in response to static pressure after stimuli of static pressure, but Gγ was obscure. Conclusion Static pressure can induce VSMC proliferation and expression of RCP, which may involve G protein signal transduction model.
RCP; static pressure; vascular smooth muscle cells; proliferation; G protein; signal transduction
2017-05-07,
2017-06-06
国家自然科学基金资助项目(No 30572192, 81173060);南华大学研究生科研创新项目(No 2011XCX13, 0223-0002-00031)
张晓一(1967- ),女,讲师,研究方向:心血管药理学,Tel: 0355-3151442,E-mail:zhangxiaoyi1225@aliyun.com; 秦旭平(1963- ),男,博士,教授,硕士生导师,研究方向:血管重构机制及药物防治,通讯作者,Tel: 0734-8160781,E-mail: qinxp333@hotmail.com
时间:2017-7-7 11:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170707.1104.050.html
10.3969/j.issn.1001-1978.2017.08.025
A
1001-1978(2017)08-1170-06
R-332;R322.74;R329.24;R392.11;R977.6