马鞭草总黄酮靶向拓扑异构酶Ⅱ诱导肝癌HepG-2细胞凋亡
2017-07-25李先佳任丽平金少举
李先佳, 任丽平, 金少举
(漯河医学高等专科学校1. 生化教研室、2. 药理学教研室,河南 漯河 462002)
马鞭草总黄酮靶向拓扑异构酶Ⅱ诱导肝癌HepG-2细胞凋亡
李先佳1, 任丽平2, 金少举2
(漯河医学高等专科学校1. 生化教研室、2. 药理学教研室,河南 漯河 462002)
目的 探讨马鞭草总黄酮靶向拓扑异构酶诱导肝癌HepG-2细胞凋亡及机制。方法 采用质量浓度为50、100、200 mg·L-1的马鞭草总黄酮处理HepG-2细胞,TUNEL-DAPI双染色法检测HepG-2细胞凋亡;超螺旋pBR322 DNA松弛实验分析TopⅡ活性; Real time PCR法分析TOP Ⅱα、TOP Ⅱβ mRNA表达水平;Western blot法分析Bcl-2、Bax、TOP Ⅱα、TOP Ⅱβ和caspase-3蛋白表达水平。结果 质量浓度为50、100、200 mg·L-1的马鞭草总黄酮能促进HepG-2细胞凋亡(P<0.05),抑制TopⅡ的活性,降低TOP Ⅱα、TOP Ⅱβ mRNA表达水平(P<0.05);马鞭草总黄酮可通过抑制 Bcl-2、TOP Ⅱα、TOP Ⅱβ蛋白,增加Bax和caspase-3蛋白水平,诱导细胞凋亡(P<0.05)。结论 马鞭草总黄酮抑制TopoⅡ活性是诱导HepG-2细胞凋亡的直接因素,并通过Bcl-2/Bax/caspase-3信号通路启动级联反应,是其体外抗肿瘤作用的重要分子机制。
马鞭草总黄酮;HepG-2;细胞凋亡;TopⅡ;Bcl-2/Bax/caspase-3信号通路
研究显示,拓扑异构酶Ⅱ(topoisomerase Ⅱ, Top Ⅱ)涉及多种恶性肿瘤,与癌细胞中DNA复制、转录和染色质重塑相关,是一个重要的化疗靶点,而且Top Ⅱ抑制剂在化疗中非常有效,已作为多种恶性肿瘤的预后标记物[1]。因此,DNA Top Ⅱ是一个筛选抗癌剂重要靶点。目前,Top Ⅱ抑制剂已被用于人类恶性肿瘤临床治疗,但大多数Top Ⅱ抑制剂易产生心脏毒性、多药物抵抗等严重的副作用[2]。因此,寻求一种毒性和副作用较少的Top Ⅱ靶向药物迫在眉睫。本课题组前期研究表明,马鞭草总黄酮(total flavonoids ofVerbenaofficinalisL, TFV )能抑制肝癌HepG-2细胞的增殖,诱导细胞凋亡[3-4],本研究重点考察不同剂量的TFV对肝癌HepG-2细胞凋亡、Top Ⅱ表达的影响。
1 材料与方法
1.1 细胞株 人肝癌HepG-2细胞购自武汉博士德有限公司。
1.2 药物与试剂 芦丁对照品 (南京泽朗医药科技有限公司),纯度: >98% ;TFV (漯河医专天然药物化学教研室),以芦丁为标准品,高效液相色谱法在检测波长510 nm测得总黄酮含量约为81%,溶于适量二甲基亚砜(dimethyl sulfoxide, DMSO) 中,培养基稀释成不同浓度,过滤除菌 4 ℃ 保存;DMEM高糖培养基(美国Hyclone公司);胎牛血清(杭州四季青生物技术公司);胰酶(美国Gibco公司);DNA TopoⅡ(美国USB公司);质粒pBR 322DNA(Fermentas公司);Dead end TM TUNEL荧光法检测系统(美国普洛麦格公司);TOPO Ⅱα、TOPO Ⅱβ兔抗人抗体(美国Abcam公司);caspase-3、Bcl-2、Bax兔抗人抗体、HRP标记的羊抗兔IgG二抗及β-actin抗体(美国Sigma公司)。
1.3 仪器 ST-360酶联免疫检测仪(上海科华实验系统有限公司);Geldoc 2000凝胶成像分析系统(美国Bio-Rad公司);light cycleR96实时荧光定量PCR仪(德国Roche Diagnostics 公司)。
1.4 方法
1.4.1 细胞培养 HepG-2细胞株由漯河市医学生物工程重点实验室传代保种,用含10%胎牛血清的DMEM培养基在37 ℃、5% CO2条件下培养,0.25%的胰蛋白酶消化。
1.4.2 TUNEL-DAPI双染色法检测细胞凋亡 取对数期HepG-2细胞,以1×108·L-1的密度接种于6孔培养板内,各孔事先加入已清洗干净的盖玻片,细胞贴壁后,参照前期研究设置[3-4]质量浓度为50、100、200 mg·L-1的TFV组,对照组给予等量培养液,每组设置3个平行孔,培养48 h后,弃去上清,PBS漂洗2次。参照TUNEL试剂盒说明书,采用4%多聚甲醛固定、0.2% Triton X-100通透,加入TUNEL 反应混合液(TdT和荧光素标记的dUTP),37 ℃孵育60 min,PBS漂洗2次,每次5 min,加DAPI 4 min,PBS漂洗2次,每次5 min,封片。荧光显微镜下观察,每个玻片随机选择10个视野,计数凋亡细胞,计算凋亡率。凋亡率/%=(阳性细胞数/细胞总数)×100%。
1.4.3 超螺旋pBR322 DNA松弛实验 DNA拓扑异构酶Ⅱ活性采用超螺旋pBR322 DNA松弛实验测定,将0.2 μg pBR322 DNA与1U TopⅡ和不同浓度的TFV在20 μL反应缓冲液[10 mmol·L-1Tris(pH 7.9)、50 mmol·L-1KCl、50 mmol·L-1NaCl、5 mmol·L-1MgCl2、0.1 mmol·L-1EDTA、15 mg·L-1BSA、1 mmol·L-1ATP]37℃反应30 min。 然后,加入2 μL终止液(10% SDS和100 mmol·L-1EDTA)终止反应。 样品在0.8%琼脂糖凝胶1×TAE缓冲液120 V电泳60 min,0.5 mg·L-1溴化乙锭染色15 min,凝胶成像系统观察并拍照。
1.4.4 Real time PCR 将药物处理48 h的细胞(TFV 50、100、200 mg·L-1组和对照组),TRIzol提取总RNA,测定纯度。按照逆转录试剂盒说明书逆转录生成 cDNA。引物序列由上海英骏公司提供。TOP Ⅱα上游序列:5′-GCGGGCTAAAGGAAGGTTCA-3′,下游序列:5′-TGACACTTCCATGGTGACGG-3′,产物大小151 bp;TOP Ⅱβ上游序列:5′-CGTCCGCTCCGGATCTTCG-3′,下游序列:5′-CACCCACATGAACTGCGTCA-3′,产物大小408 bp;内参 GAPDH上游引物:5′-CTCCTGTTCGACAGTCAGCC-3′,下游引物:5′-TTCCCGTTCTCAGCCTTGAC-3′,长度262 bp。PCR采用20 μL的反应体系,其中2×SYBRRPremix Ex-Taq Ⅱ 10 μL,上游(10 μmol)和下游(10 μmol)各0.5 μL,cDNA 1 μL,PCR级高纯水8 μL。采用light cycleR96实时荧光定量PCR仪同时对目的基因和内参基因(GAPDH)进行基因扩增。采用Ct值计算基因的相对表达量,相对表达量=2-△△Ct×100%,△Ct=Ct(待测基因)-Ct(GAPDH)。1.4.5 Western blot方法检测凋亡相关蛋白的表达 收集TFV处理48 h后的细胞,常规提蛋白,考马斯亮蓝染色法测总蛋白的量,10% SDS-PAGE分离,PVDF膜转膜,5%山羊血清(PBS 稀释)封闭;加入1 ∶3 000、1 ∶2 000、1 ∶2 000、1 ∶2 000、1 ∶2 000稀释(体积分数为1% BSA-PBS 稀释)的Bcl-2、Bax、TOP Ⅱα、TOP Ⅱβ和caspase-3一抗,1 ∶1 000稀释的 β-actin,4℃孵育过夜,加入辣根过氧化物酶标记的二抗(羊抗兔),室温孵育1 h。行ECL反应,显色。Bio-Rad凝胶成像系统拍照,GIS凝胶成像分析软件分析。
2 结果
2.1 马鞭草总黄酮对肝癌HepG-2细胞凋亡的影响 质量浓度分别为50、100、200 mg·L-1马鞭草总黄酮作用于肝癌HepG-2细胞48 h时,细胞凋亡率较对照组明显增加(Fig 1、2),差异均有统计学意义(P<0.05)。
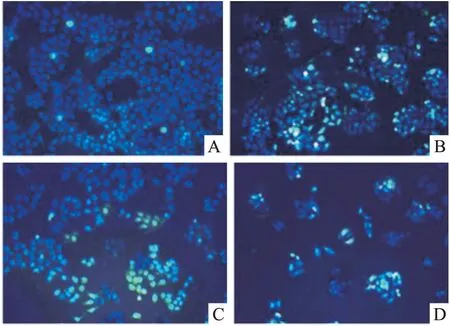
Fig 1 TUNEL staining of HepG-2 cells following 48 h treatment with TFV(×200)
A: 0 mg·L-1TFV treated group; B: 50 mg·L-1TFV treated group;C:100 mg·L-1TFV treated group; D: 200 mg·L-1TFV treated group
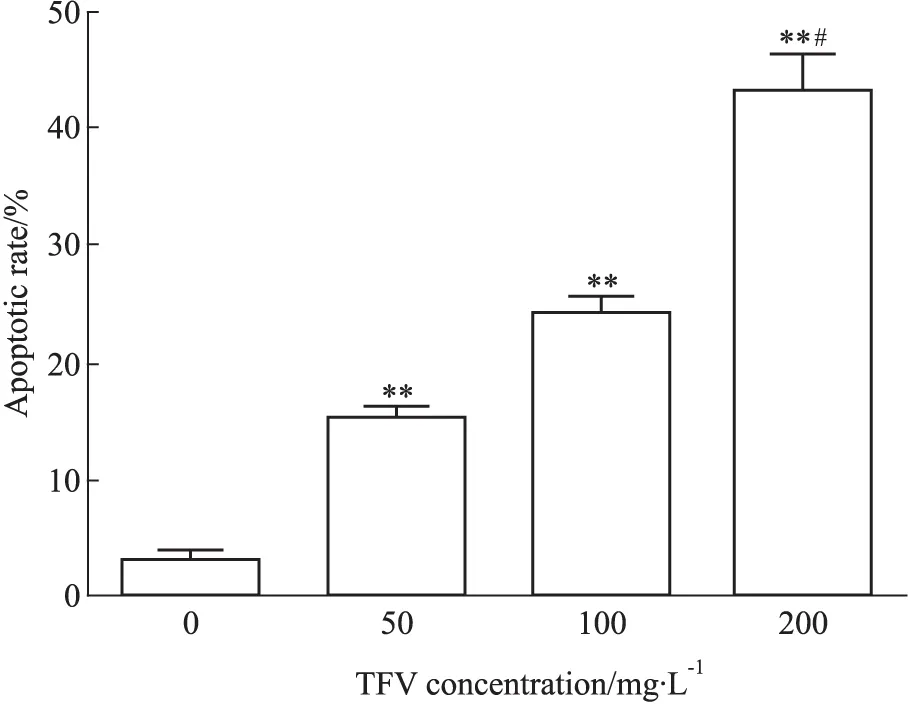
Fig 2 Apoptotic rate of HepG-2 cells
**P<0.01vscontrol;#P<0.05vs50 mg·L-1TFV treated group
2.2 马鞭草总黄酮对DNA TOP Ⅱ活性的影响 Fig 3结果显示,泳道5为负超螺旋pBR322 DNA;泳道1为加TOP Ⅱ反应后,负超螺旋全部转化为松弛型DNA;加入50、100、200 mg·L-1的马鞭草总黄酮后,解旋的DNA明显减少,DNA保持超螺旋状态,并呈现剂量效应。
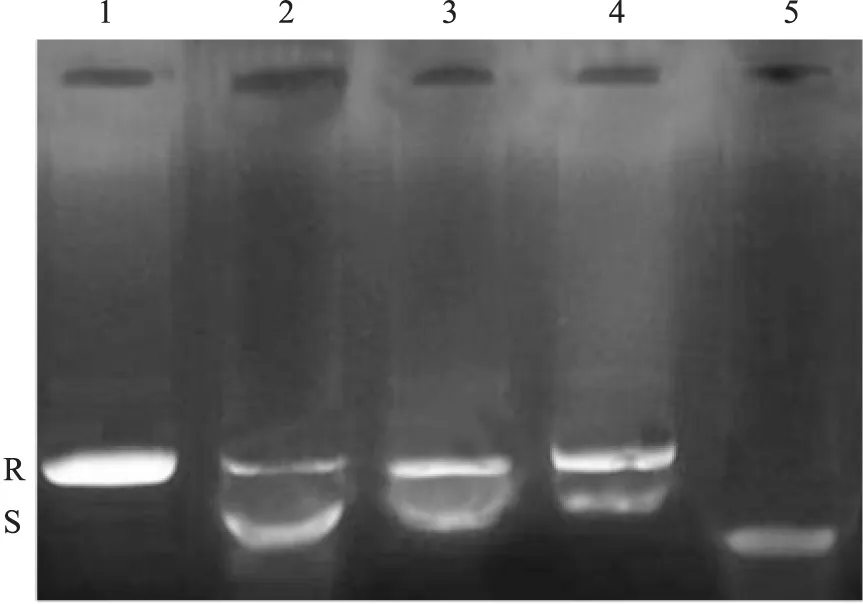
Fig 3 Effect of TFV on DNA TOP Ⅱ activity in HepG-2 cells
1: 0.2 μg pBR322 DNA; 2~4:0.2 μg pBR322 DNA and TFV at 200, 100, 50 mg·L-1+1 U TOP Ⅱ; 5: 0.2 μg pBR322 DNA+1 U TOP Ⅱ; R:Relaxed DNA; S: Supercolid DNA
2.3 马鞭草总黄酮对肝癌HepG-2细胞拓扑异构酶Ⅱ mRNA表达的影响 马鞭草总黄酮处理肝癌HepG-2细胞48 h后,TOP Ⅱα mRNA表达量较对照组明显下降,差异均有统计学意义(P<0.05),同样TOP Ⅱβ mRNA表达量较对照组明显下降(Fig 4),差异均有统计学意义(P<0.05)。
2.4 马鞭草总黄酮对肝癌HepG-2细胞凋亡相关蛋白表达的影响 质量浓度分别为50、100、200 mg·L-1的马鞭草总黄酮处理HepG-2细胞48 h后,Bcl-2、TOP Ⅱα、TOP Ⅱβ蛋白表达量均较对照组明显下降,Bax、caspase-3蛋白水平明显升高,差异均有统计学意义(P<0.05);质量浓度200 mg·L-1的马鞭草总黄酮作用于HepG-2细胞48 h后,Bcl-2、TOP Ⅱα、TOP Ⅱβ、Bax、caspase-3蛋白变化幅度较对照组更加明显(Fig 5、6),差异均有统计学意义(P<0.05)。
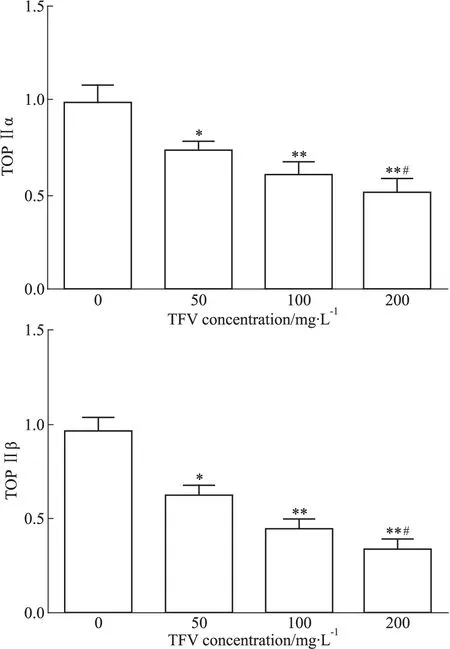
Fig 4 Effect of TFV on expression of DNA TOP Ⅱ mRNA in HepG-2 cells(±s,n=3)
*P<0.05,**P<0.01vscontrol;#P<0.05vs50 mg·L-1TFV treated group
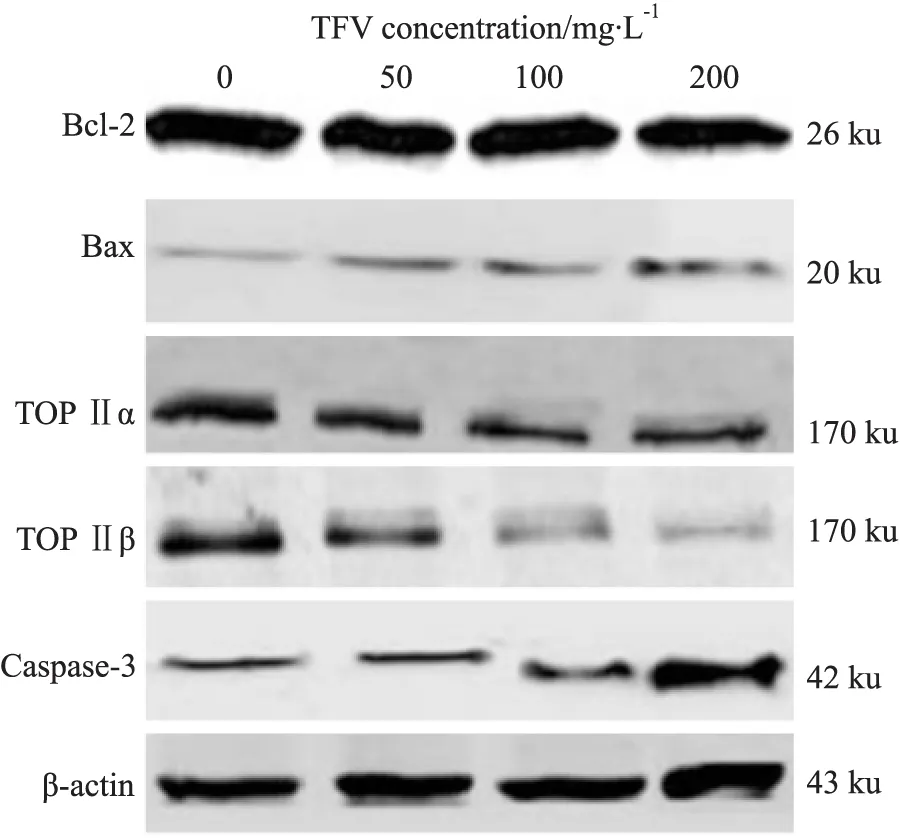
Fig 5 Expression of apoptotic protein detected by Western blot
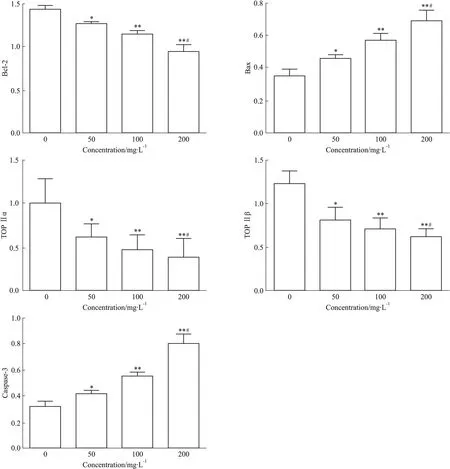
*P<0.05,**P<0.01vscontrol;#P<0.05vs50 mg·L-1TFV treated group
3 讨论
TopⅡ为存在于细胞核中的一种重要的酶,由TOP Ⅱα、TOP Ⅱβ两种亚基组成,通过识别特殊的 DNA 序列选择性切断DNA双链,协调超螺旋和解螺旋相互转变,调节DNA 拓扑异构化。研究显示,部分肿瘤细胞中TopoⅡ水平活性明显高于正常组织细胞,因此,通过干扰TopoⅡ调节DNA的断裂和连接,诱导肿瘤细胞凋亡是目前抗肿瘤重要机制,其中临床抗肿瘤药物依托泊苷和替尼泊苷就是以TopoⅡ作为作用靶点进行药物治疗[5]。Priyadarshani 等[6]研究发现,黄酮和异黄酮能以拓扑异构酶Ⅱα为靶点,对各种癌细胞产生细胞毒性,对正常细胞低毒性、无凋亡作用。而Sudan 等[7]发现,来源于苹果皮的黄酮能停滞HepG-2细胞细胞周期,并通过抑制DNA拓扑异构酶Ⅱ活性诱导凋亡。本研究结果表明,马鞭草总黄酮能抑制TOP Ⅱα和TOP Ⅱβ mRNA表达量,提示马鞭草总黄酮可能通过和 TopⅡ直接结合,抑制 TopⅡ的活性,并影响HepG-2细胞DNA 复制转录过程,最终影响TOP Ⅱα、TOP Ⅱβ mRNA 的转录水平,而且通过琼脂糖凝胶电泳也说明马鞭草总黄酮能抑制TopoⅡ的活性,并呈现明显的剂量效应。与此相对应的是,马鞭草总黄酮也能降低HepG-2细胞内 TopoⅡα、TopoⅡβ 蛋白表达水平,提示马鞭草总黄酮均可与RNA 和 DNA 结合,并对TopoⅡα、TopoⅡβ 蛋白表达水平产生影响,并进一步抑制HepG-2细胞内 DNA 的解旋,诱导细胞凋亡。
在细胞凋亡环节中,Bcl-2家族在caspase激活通路,尤其是线粒体途径中发挥了极为重要的调控作用。Bcl-2是一种存在于线粒体内膜蛋白,能通过增强线粒体膜电位,抑制钙离子释放,阻止核酸内切酶活化,并发挥抗凋亡作用[8]。此外,Bcl-2为活化的caspase-3 作用底物之一,激活的caspase-3可以降解Bcl-2 表达,因此,Bcl-2 表达水平也能间接反映caspase-3活性。 Bax属于Bcl-2家族成员,与Bcl-2作用相反,可直接激活死亡效应因子caspase-3或改变细胞膜通透性,引起细胞色素C释放,激活caspase-3活性,启动caspase级联反应[9]。Feng 等[10]研究发现,狭基线纹香茶菜总黄酮能通过线粒体途径下调Bcl-2 表达水平,启动细胞凋亡。Wang 等[11]研究显示,来自金莲花总黄酮能下调Bcl-2水平,上调caspase-3表达水平,启动线粒体凋亡。本研究结果显示,马鞭草总黄酮能下调HepG-2细胞中Bcl-2蛋白水平,上调caspase-3以及Bax活性,并呈现明显的剂量效应,提示马鞭草总黄酮能通过调控Bcl-2家族蛋白,并对caspase-3产生激活作用,从而通过有效的调控酶联反应,启动线粒体凋亡,质量浓度越高,调节作用越明显。
总之,马鞭草总黄酮抑制TopoⅡ活性是诱导HepG-2细胞凋亡的直接因素,并通过Bcl-2/Bax/caspase-3信号通路启动级联反应,是其体外抗肿瘤作用的重要分子机制,而且马鞭草总黄酮主要来源于中成药马鞭草,为天然的抗炎、抗肿瘤药物,具有高效低毒的特点,且马鞭草资源丰富,临床应用无毒副作用[12],可以为马鞭草总黄酮的开发提供参考。
(致谢:本实验在河南省漯河市医学生物工程重点实验室完成,感谢实验室所有成员对本实验的支持和帮助!)
[1] Ma Y C, Wang Z X, Jin S J,et al. Dual inhibition of topoisomerase Ⅱ and tyrosine kinases by the novel bis-fluoroquinolone chalcone-like derivative HMNE3 in human pancreatic cancer cells[J].PLoSOne,2016,11(10): e0162821.
[2] Turner J G,Dawson J L,Grant S,et al. Treatment of acquired drug resistance in multiple myeloma by combination therapy with XPO1 and topoisomerase Ⅱ inhibitors[J].JHematolOncol,2016,9(1):73.
[3] 任丽平,李先佳,梁树才,等.马鞭草总黄酮对肝癌HepG-2细胞凋亡的影响[J].中国老年学杂志,2016,36(19):4721-3.
[3] Ren L P, Li X J, Liang S C, et al. Effect of total flavonoids ofVerbenaofficinalisLon apoptotic of human hepatocellular carcinoma HepG-2 cells[J].ChinJGerontol,2016,36(19):4721-3.
[4] 任丽平,李先佳,朱宝安,等.马鞭草总黄酮对HepG-2细胞增殖及侵袭力影响[J].中国公共卫生,2016,32(7):935-7.
[4] Ren L P, Li X J, Zhu B A, et al. Impact of total flavonoids ofVerbenaofficinalisLon proliferation and invasiveness of human hepatocellular carcinoma HepG-2 cells[J].ChinJPublicHealth, 2016,32(7):935-7.
[5] Wu W,Ma B,Ye H,et al. Millepachine, a potential topoisomerase Ⅱ inhibitor induces apoptosis via activation of NF-κB pathway in ovarian cancer[J].Oncotarget,2016, 7(32):52281-93.
[6] Priyadarshani G,Amrutkar S,Nayak A,et al. Scaffold-hopping of bioactive flavonoids: discovery of aryl-pyridopyrimidinones as potent anticancer agents that inhibit catalytic role of topoisomerase Ⅱα[J].EurJMedChem,2016,122(10):43-54.
[7] Sudan S, Rupasinghe H P. Flavonoid-enriched apple fraction AF4 induces cell cycle arrest, DNA topoisomerase Ⅱ inhibition, and apoptosis in human liver cancer HepG2 cells[J].NutrCancer, 2014,66(7):1237-46
[8] 刘金娟,曹成亮,丁 盼,等.野苋菜提取物抗肿瘤作用及诱导人肝癌HepG2 细胞凋亡的分子机制[J].中国药理学通报,2015,31(11):1558-62.
[8] Liu J J,Chao C L,Ding P,et al.Anticancer activity and mechanism of apoptosis induced by Amaranthus spinosus L.extract in Hep G2 cells[J].ChinPharmacolBull,2015,31(11):1558-62.
[9] Zhou H, Ma Y, Zhou Y, et al. Effects of magnesium sulfate on neuron apoptosis and expression of caspase-3,Bax and Bcl-2 after cerebral ischemia-reperfusion injury[J].ChinMedJ(Engl),2003,116(10):1532-4.
[10]Feng C P, Tang H M, Huang S, et al. Evaluation of the effects of the water-soluble total flavonoids from Isodon lophanthoides var.gerardianus (Benth.) H. Hara on apoptosis in HepG2 cell: investigation of the most relevant mechanisms[J].JEthnopharmacol, 2016 ,188(7):70-9.
[11]Wang S,Tian Q,An F. Growth inhibition and apoptotic effects of total flavonoids from Trollius chinensis on human breast cancer MCF-7 cells[J].OncolLett,2016,12(3):1705-10.
[12]杨海光,方莲花,杜冠华. 马鞭草药理作用及临床应用研究进展[J].中国中药杂志,2013,48(12):948-52.
[12]Yang H G, Fang L H, Du G H. Advances in pharmacological effects and clinical application of verbena[J].ChinPharmJ, 2013,48(12):948-52.
Apoptosis of human hepatocellular carcinoma HepG-2 cells induced by total flavonoids ofVerbenaofficinalisLthrough targeting topoisomerase Ⅱ
LI Xian-jia1,REN Li-ping2,JIN Shao-ju2
(1.DeptofBiochemistry, 2.DeptofPharmacology,LuoheMedicalCollege,LuoheHenan462002,China)
Aim To explore whether total flavonoids ofVerbenaofficinalisL(TFV) can induce apoptosis of HepG-2 cells through targeting topoisomerase Ⅱ.Methods HepG-2 cells were cultured with TFV at 200, 100, 50 mg·L-1. Cell apoptosis was evaluated by TUNEL-DAPI double staining. TopⅡ activity was detected by supercoiled pBR322 DNA relaxation assay. The levels of the mRNA of TOP Ⅱα, TOP Ⅱβ were analyzed by real time PCR. Expression of Bcl-2, Bax,TOP Ⅱα, TOP Ⅱβ and caspase-3 was analyzed by Western blot. Results TFV at 200, 100, 50 mg·L-1could promote the apoptosis of HepG-2 cells(P<0.05). TFV could inhibit TopⅡ activity and decrease the expression of TOP Ⅱα, TOP Ⅱβ mRNA(P<0.05). Moreover, TFV could inhibit the expression of Bcl-2, TOP Ⅱα, TOP Ⅱβ protein and increase the expression of Bax and caspase-3 protein(P<0.05).Conclusion The inhibition of Topo Ⅱ activity by TFV is a direct factor in the induction of apoptosis in HepG-2 cells and initiates the cascade reaction by Bcl-2/Bax/caspase-3 signaling pathway, which has a significant anti-tumor effectinvitro.
total flavonoids ofVerbenaofficinalisL; HepG-2; cell apoptosis; TopⅡ; Bcl-2/Bax/caspase-3 signaling pathway
2017-04-19,
2017-05-20
河南省科技攻关计划(社会发展领域)(No 162102310596);河南省高等学校青年骨干教师资助计划项目(No 2015GGJS-288);漯河医学高等专科学校基础科学研究项目(No 2015-S-LMC03)
李先佳(1977-),男,硕士,副教授,研究方向:肿瘤药理学,E-mail:nzr110@163.com; 金少举(1977-),男,博士,副教授,硕士生导师,研究方向:肿瘤药理学,通讯作者,E-mail:37050573@qq.com
时间:2017-7-7 11:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170707.1104.042.html
10.3969/j.issn.1001-1978.2017.08.021
A
1001-1978(2017)08-1147-06
R284.1;R329.25;R735.7;R977.3