番茄红素对糖尿病小鼠骨髓内皮祖细胞功能影响及机制
2017-07-24曾瑶池黄淑芬穆桂萍周熙临彭立生深圳市中医院营养科广东深圳580深圳市中医院健康教育科广东深圳580深圳市中医院病理科广东深圳580深圳市中医院中心实验室广东深圳580深圳市中医院科教科广东深圳580
曾瑶池,黄淑芬,徐 华,穆桂萍,周熙临,彭立生*(.深圳市中医院营养科,广东 深圳 580;.深圳市中医院健康教育科,广东 深圳 580;.深圳市中医院病理科,广东 深圳 580;.深圳市中医院中心实验室,广东 深圳 580;5.深圳市中医院科教科,广东 深圳 580)
番茄红素对糖尿病小鼠骨髓内皮祖细胞功能影响及机制
曾瑶池1,黄淑芬2,徐 华3,穆桂萍4,周熙临1,彭立生5,*
(1.深圳市中医院营养科,广东 深圳 518033;2.深圳市中医院健康教育科,广东 深圳 518033;3.深圳市中医院病理科,广东 深圳 518033;4.深圳市中医院中心实验室,广东 深圳 518033;5.深圳市中医院科教科,广东 深圳 518033)
以链脲霉素(streptozotocin,STZ)诱导C57BL/6小鼠作为糖尿病动物模型,探究番茄红素(lycopene,Lyc)对STZ诱导的糖尿病小鼠骨髓内皮祖细胞(endothelial progenitor cells,EPCs)的保护作用,探讨Lyc防治糖尿病血管并发症的潜力。结果表明:糖尿病小鼠外周血EPCs数量减少,骨髓EPCs氧化应激水平增高,血管内皮生长因子(vascular endothelial growth factor,VEGF)表达降低,EPCs衰老严重并伴功能受损。Lyc灌胃处理糖尿病小鼠后,其外周血EPCs数量增加,骨髓EPCs氧化应激得到抑制,VEGF表达增加,EPCs衰老和功能受损程度明显减轻。由此可知,Lyc作为一种食物来源的植物化合物,具有防治糖尿病血管并发症的潜力。关键词:番茄红素;内皮祖细胞;链脲霉素;糖尿病;氧化损伤
内皮祖细胞(endothelial progenitor cells,EPCs)是一种来源于骨髓并可动员入外周循环、能分化为内皮细胞的干细胞,血管受损时,骨髓内的EPCs可进入外周血并聚集至损伤部位,黏附并分化为成熟的EPCs,参与血管内皮化。研究发现,无论1型还是2型糖尿病患者均存在EPCs数量减少,增殖、黏附和血管形成能力下降的现象,EPCs功能及数量的改变在糖尿病并发症的发生发展过程中起着重要作用[1-2]。因此,增加糖尿病患者EPCs数量和改善其功能对于糖尿病血管并发症的预防和治疗具有重要意义。
课题组前期研究表明番茄红素(lycopene,Lyc)可以通过抑制高糖环境下EPCs中p38 MAPK的激活、线粒体氧化损伤等途径发挥对EPCs的保护作用[3-4],但是Lyc能否通过减轻糖尿病小鼠骨髓EPCs氧化应激和衰老而改善EPCs功能还鲜见报道。因此,本实验通过Lyc对糖尿病小鼠EPCs功能的影响,试图从改善骨髓EPCs氧化应激角度初步阐明其机制,为深化研究Lyc的内皮保护及血管并发症防治作用机制提供新的实验参考。
1 材料与方法
1.1 动物、材料与试剂
C57BL/6小鼠,体质量(24.8±1.1) g,雄性,8 周龄,由广州中医药大学实验动物中心提供。
Lyc(纯度96%) 南京泽朗生物科技有限公司;牛血清白蛋白、链脲霉素(streptozotocin,STZ)、基质胶(matrigel)、玻璃黏连蛋白(vitronectin)、Hoechst 33258、Dil标记乙酰化低密度脂蛋白(Dil-ac-LDL)、FITC标记的荆豆凝集素-1(FITC-UEA-1) 美国Sigma公司;EGM-2 培养基 美国Lonza公司;M199培养基 美国HyClone公司;BCA蛋白含量测定试剂盒美国Pierce公司;兔抗小鼠血管内皮生长因子(vascular endothelial growth factor,VEGF)一抗 英国Abcom公司;β-半乳糖苷酶活性检测试剂盒、活性氧簇(reactive oxygen species,ROS)检测试剂盒 上海碧云天生物技术有限公司。
1.2 仪器与设备
CO2水套式培养箱 美国Thermo公司;改良Boyden小室 江苏海门麒麟医用仪器厂;One Touch Ultra血糖仪美国Johnson公司;垂直电泳仪 美国Bio-Rad公司;E300倒置式生物显微镜 日本Nikon公司;Odyssey近红外双色激光成像系统 美国LI-COR公司。
1.3 方法
1.3.1 动物实验设计
C57BL/6雄性小鼠45 只,随机分为糖尿病组(n=30)、正常对照组(n=15),糖尿病组小鼠腹腔注射60 mg/(kg·d)(以体质量计)STZ,连续5 d。STZ注射液用柠檬酸钠缓冲液(0.1 mol/L,pH 4.15)配制,现用现配。正常对照组小鼠腹腔注射同等剂量柠檬酸钠缓冲液。1 周后取尾部静脉血,用强生血糖分析仪检测空腹血糖(fasting blood sugar,FBS)含量不小于11.1 mmol/L时,确认Ⅰ型糖尿病小鼠造模成功。之后,每周检测FBS含量,取成模2 周的糖尿病小鼠以备Lyc干预实验用。
成模2 周后(实验第4周),糖尿病组小鼠分成模型组、Lyc组,正常对照组,每组15 只。正常对照组和模型组小鼠每天灌胃1 mL 0.5 g/100 mL羧甲基纤维素钠溶液;Lyc组小鼠每天灌胃Lyc 30 mg/kg(以体质量计),Lyc溶于0.5 g/100 mL羧甲基纤维素钠溶液中,现配现用,灌胃容量1 mL。连续灌胃4 周,至实验第8周后检测FBS含量,对小鼠腹腔注射0.2 mL速眠新,麻醉后,无菌条件下分离其股骨、胫骨、髋骨及肱骨,并置于4 mL冰冷EGM-2培养基中。在培养皿中去除肌肉组织,并切除两端骨骺,用注射器吸取EGM-2培养基将骨髓完全冲出,并收集至离心管中,于4 ℃、4 000×g离心20 min收集骨髓细胞,弃上清液。用1 mL红细胞裂解液裂解红细胞1 min,再分别用磷酸盐缓冲液(phosphate buffered saline,PBS)和EGM-2培养液洗涤细胞一次。最后将细胞按照106个/cm3的密度接种在已包被玻璃体结合蛋白的6 孔板中,置于37 ℃、5% CO2培养箱中培养。培养4 d后换液1 次,去除未黏附的细胞,黏附的细胞继续培养3 d备用。1.3.2 外周血EPCs的鉴定和计数
不同灌胃时间(0、4、8 周) 采血,用密度梯度离心法获取外周血单个核细胞,并悬浮于5 mL M199培养液(含体积分数20%胎牛血清、VEGF 10 μg/L、碱性成纤维细胞生长因子(bFGF)2 μg/L、表皮生长因子(EGF)5 μg/L、青霉素1×105μg/L、链霉素100 mg/L)中,将其铺在纤维连接蛋白包被20 min的培养瓶内,37 ℃、饱和湿度、5% CO2温箱中培养4 d。然后以M199培养液轻轻洗去未贴壁细胞,继续培养至第7天。将Dil-ac-LDL(2.4 mg/L)加入EPCs 培养体系中,37 ℃孵育1 h。PBS 洗涤3 次后,加入FITC-UEA-1,37 ℃继续孵育1 h,4 g/100 mL多聚甲醛固定10 min后于荧光显微镜下观察。FITC-UEA-1和Dil-ac-LDL双染色阳性细胞为正在分化的EPCs。激光共聚焦显微镜鉴定EPCs,倒置荧光显微镜对EPCs进行计数。
1.3.3 骨髓EPCs的分离和鉴定
骨髓细胞培养7 d后,PBS洗涤1 次,于含有2 mg/L Dil-ac-LDL的M199培养液中37 ℃避光孵育4 h,然后PBS洗涤3 次,每次5 min。4 g/100 mL多聚甲醛室温固定10 min后,将细胞于含10 mg/L FITC-UEA-1的M199培养液中37 ℃孵育1 h,再用PBS洗涤3 次,每次5 min。最后将细胞与新鲜配制的Hoechst 33258(0.5 µmol/L)室温避光孵育10 min,再用PBS洗涤3 次,每次5 min。使用Prolong封片剂封片。观察方法同1.3.2节。
1.3.4 骨髓EPCs中β-半乳糖苷酶染色
β-半乳糖苷酶染料依据试剂盒说明进行配制。骨髓EPCs培养7 d后弃去上清液,PBS洗涤3 次,每次5 min,4 g/100 mL多聚甲醛室温固定15 min,PBS洗涤3 次,每次5 min,β-半乳糖苷酶染液于37 ℃染色细胞4 h,显微镜下观察蓝色的为β-半乳糖苷酶染色阳性细胞。随机挑选5 个高倍视野(×200),计数1 000 个细胞中阳性细胞的个数,计算阳性细胞数量百分比,取平均值。
1.3.5 骨髓EPCs迁移能力的检测
分别将2×104个EPCs悬浮在不含VEGF、bFGF的200 μL M199培养液中,注入Boyden上室。将含VEGF、bFGF的200 μL M199培养液,注入下室。培养24 h,刮去滤膜上面的未移动细胞,甲醇固定5 min,Giemsa染色,随机选择5 个高倍镜视野(×200)计数迁移到下层的细胞数量,取平均数。
1.3.6 骨髓EPCs小管新生能力的检测
采用基质胶(matrigel)成血管网实验评价EPCs在体外的小管形成能力。4 ℃条件下于24 孔板底加入0.3 mL 基质胶,铺平于37 ℃培养箱固定10 h,将培养板获得的EPCs与ECM-2培养液混合(10 000 个/孔)。混匀后加入24 孔板,每孔0.25 mL。于37 ℃、5% CO2培养箱中培养24 h 后,用100 倍倒置显微镜观察管样结构形成情况,细胞拉长变形,长度为宽度的4 倍以上即可被认为形成小管。随机选取5 个视野,计数完整微管网状结构。
1.3.7 骨髓EPCs内ROS水平的检测
取对数生长期的EPCs,消化后以7×104个/mL细胞悬液接种于96 孔板中,每组设6 个复孔。培养24 h 后弃上清液,PBS洗涤2 次后,每孔加入100 μL PBS,于-80 ℃冷冻5 min后,室温融化,反复冻融3 次,收集50 μL上清液备用。按照ROS测定试剂盒说明书严格操作,测定胞内ROS水平。
1.3.8 VEGF蛋白表达量的检测
收集培养7 d的EPCs,提取总蛋白,BCA法进行蛋白定量,Western blot法进行蛋白电泳、转膜、孵抗体。β-肌动蛋白为内参蛋白,近红外荧光标记二抗,洗涤成像,Odyssey红外双色激光成像系统700通道检测,自带软件分析蛋白表达量。
1.4 数据统计分析
有一天,罗爹爹回来说,阿里在湖边放哀乐的时候,一个人坐在那里呜呜地哭了起来。罗爹爹忙去问他出了什么事。阿里只是说:“姆妈还没有醒。”头一两天,罗爹爹以为只是偶然,但一连几天,阿里都是如此,看来阿里有点不对劲。罗四强也觉得阿里精神也差了许多。晚上阿东一回来,他便告诉阿东说,阿里现在话少了,笑声也少了。叫阿东注意,小心阿里得病。
2 结果与分析
2.1 小鼠生理情况
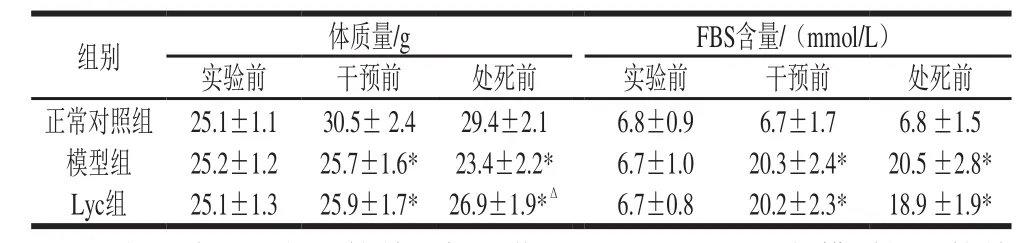
表1 实验小鼠生理情况比较Table 1 Physiological data of mice in all groups
由表1可知,实验前3 组小鼠体质量、FBS含量无显著差异(P>0.05)。体质量方面,Lyc干预前模型组和Lyc组较正常对照组极显著降低(P<0.01),处死前Lyc组和模型组较正常对照组极显著降低(P<0.01),Lyc组较模型组极显著升高(P<0.01)。FBS含量方面,Lyc干预前Lyc组和模型组较正常对照组极显著升高(P<0.01),处死前Lyc组和模型组较正常对照组极显著升高(P<0.01),Lyc组较模型组下降,但差异无统计学意义(P>0.05)。
2.2 外周血EPCs的鉴定、计数结果
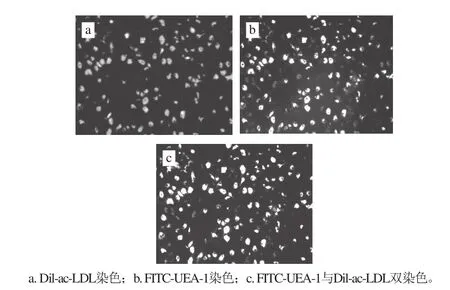
图1 外周血EPCs染色结果(×200)Fig. 1 Characterization of EPCs under confocal laser scanning microscope (× 200)
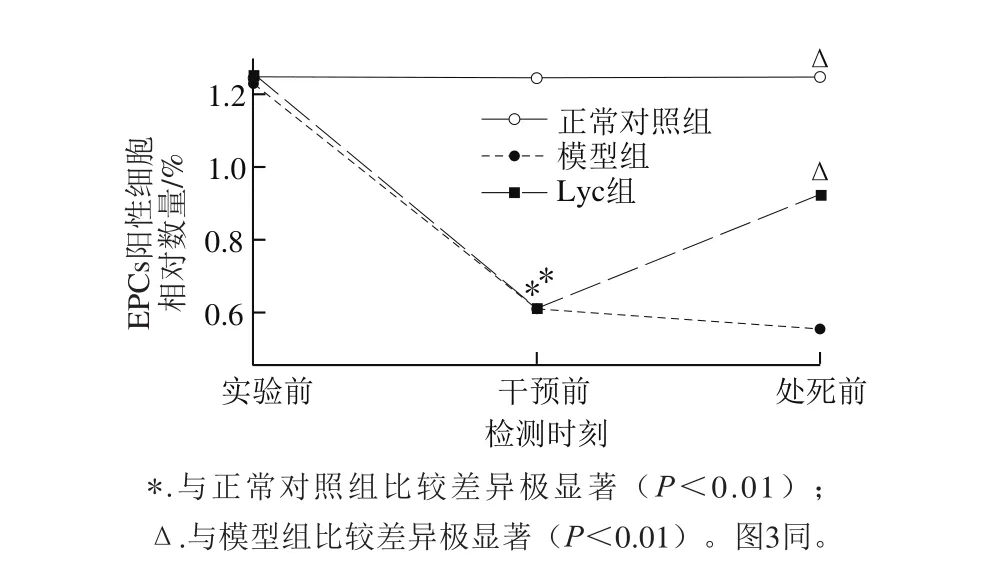
图2 各组不同时间外周血EPCs数量变化情况Fig. 2 Effect of lycopene on the number of peripheral blood derived EPCs in STZ-induced diabetic mice
将FITC-UEA-1和Dil-ac-LDL双染色阳性细胞鉴定为(激光共聚焦显微镜下呈黄色)正在分化的EPCs[5]。如图1所示,5~7 d细胞处于对数生长期,生长迅速,形态呈多边形及不规则形。由图2可知,实验前各组小鼠外周血EPCs数量差异无统计学意义。造模成功时(干预前),模型组和Lyc组外周血EPCs数量迅速减少,极显著低于正常对照组(P<0.01)。Lyc干预4周后(处死前),EPCs数量逐渐上升,Lyc组和正常对照组EPCs数量极显著高于模型组(P<0.01)。
2.3 Lyc对骨髓EPCs衰老的影响
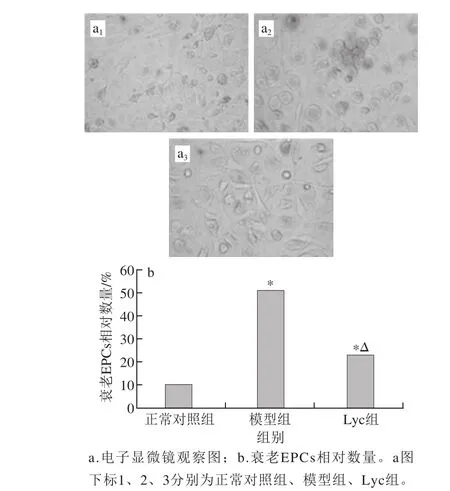
图3 Lyc对糖尿病小鼠骨髓来源EPCs衰老的影响Fig. 3 Effect of lycopene on EPCs senescence
由图3可知,模型组EPCs衰老情况较正常对照组严重(P<0.01),而Lyc干预能极显著抑制糖尿病小鼠骨髓EPCs衰老(P<0.01)。
2.4 Lyc对骨髓EPCs迁移能力的影响

图4 Lyc干预对小鼠骨髓来源EPCs迁移能力的影响(×40)Fig. 4 Effect of lycopene EPCs migration ability (× 40)
采用改良的Boyden小室分析法测定细胞迁移能力。由图4可知,与正常对照组相比,模型组小鼠EPCs的迁移能力高度显著降低(正常对照组(99.54±3.47) 个、模型组(57.12±5.32) 个,P<0.001;Lyc干预后(98.25±6.72) 个,P<0.001),高度显著改善了模型组小鼠骨髓EPCs迁移能力。
2.5 Lyc对骨髓EPCs小管新生能力的影响
模型组小鼠EPCs小管新生能力极显著低于正常对照组C57BL/6小鼠EPCs(正常对照组1.07±0.14,模型组0.57±0.11,P<0.01)。经Lyc干预4 周后,小鼠骨髓EPCs小管新生能力明显增强,为正常对照组的(0.99±0.21) 倍,与模型组比较差异显著(P<0.05)(图5)。
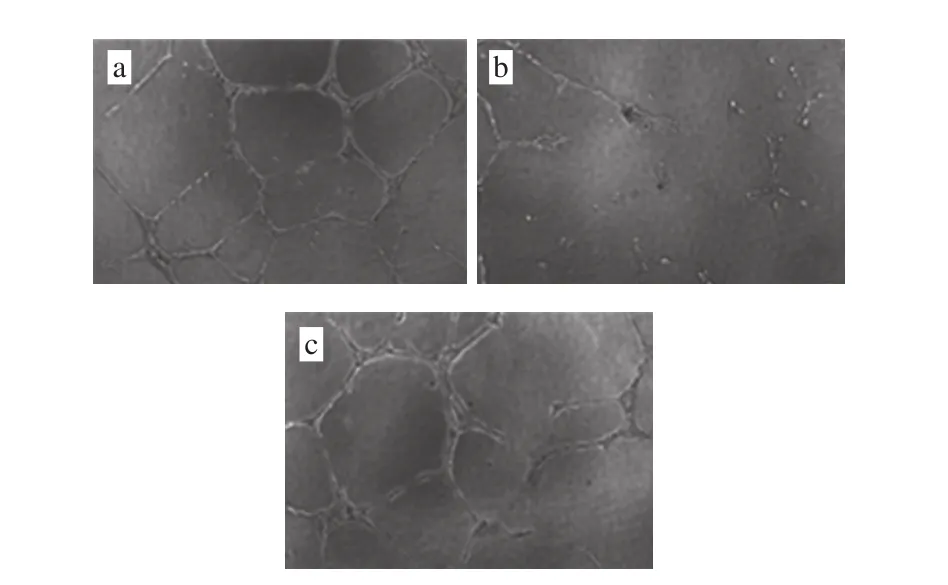
图5 Lyc对糖尿病小鼠骨髓来源EPCs小管新生能力的影响(×200)Fig. 5 Effect of lycopene on tube formation ability of bone marrow derived EPCs (× 200)
2.6 Lyc对骨髓EPCs中ROS水平的影响
模型组小鼠EPCs中ROS水平极显著高于正常对照组(正常对照组39.20±2.47、模型组58.40±4.31,P<0.01)。经Lyc干预4 周后,小鼠骨髓EPCs中ROS水平明显降低(47.10±2.78),与模型组比较差异显著(P<0.05)。
2.7 Lyc对VEGF蛋白表达量的影响

图6 Lyc对糖尿病小鼠EPCs中VEGF蛋白表达的影响Fig. 6 Effect of lycopene on VEGF expression level of EPCs
由图6可知,模型组小鼠骨髓EPCs中VEGF蛋白表达量显著低于正常对照组小鼠EPCs(P<0.05)。经Lyc干预后,骨髓EPCs体外培养后VEGF蛋白表达量高于模型组。
3 讨 论
糖尿病血管并发症发生与EPCs功能减退密切相关,正常情况下局部血管损伤或组织缺血后会释放生长因子,生长因子能促使骨髓EPCs增殖并形成细胞集落,当骨髓EPCs动员至外周循环损伤处时可黏附于成熟的内皮表面,促进再内皮化及新生血管生成[6-7]。糖尿病代谢异常导致过量葡萄糖和脂肪酸进入细胞内氧化,使线粒体跨膜电位(Δψm)升高,而线粒体O2-·的生成量与Δψm密切相关:Δψm越高,生成的O2-·越多。经呼吸链产生的O2-·及ROS水平升高,导致氧化应激[8-9]。
糖尿病机体内环境复杂,对EPCs的影响是多方面的,但ROS产生过多和氧化应激损伤被视为糖尿病心血管并发症发生、发展的主要原因[10-12]。ROS是细胞凋亡的第二信使,ROS过度升高,EPCs凋亡和损伤加重,EPCs数量和功能下降,严重影响血管内皮修复作用,容易引发再内皮化不全或延迟,增加不良心血管事件发生概率[13-14]。di Stefano等[15]的研究显示高糖环境使ROS产生增多,p66ShcA的表达上调,使EPCs凋亡增加、功能紊乱。另外,糖尿病病人由于长期处于高血糖状态,导致体内糖化反应及晚期糖基化终末产物(advanced glycation endoproducts,AGEs)生成加速,AGEs促进EPCs内ROS生成,减少抗氧化酶的合成、增强氧化应激、破坏细胞内环境稳定性,使EPCs功能受损[16-18]。Dernbach等[19]研究发现EPCs中ROS水平比内皮细胞更低,EPCs修复损伤血管的能力与其较低的ROS水平有关,ROS水平升高,EPCs修复损伤血管的活性降低。多项研究证实,糖尿病机体EPCs中的ROS含量显著高于正常EPCs[20-21],在本研究中以STZ构建糖尿病动物模型,检测EPCs内ROS水平,发现STZ刺激后可显著增加小鼠骨髓EPCs内ROS水平,说明STZ可以刺激EPCs内ROS生成。本研究证实糖尿病小鼠内环境使外周血EPCs数量减少,可能与体内氧化应激状态有关。Lyc干预可明显提高糖尿病小鼠EPCs在外周血的生存能力,这说明Lyc能改善糖尿病的EPCs数量异常。VEGF是维护内皮祖细胞生存必需的活性因子[22-23]。糖尿病患者骨髓EPCs动员功能严重受损,与血管内皮细胞中VEGF释放受阻密切相关[24-25]。本研究显示,模型组小鼠骨髓EPCs的VEGF表达量低于正常对照组,此时检测到的外周血EPCs的数量也随之减少,而Lyc干预可以升高骨髓EPCs中VEGF表达量水平,增加外周血EPCs数量。说明Lyc能够通过提高糖尿病小鼠骨髓VEGF水平,动员EPCs进入外周血。Lyc增加外周血EPCs数量的机制与抑制EPCs的凋亡[26],增加EPCs自身分泌VEGF有关。氧化损伤是也细胞衰老的主流学说,ROS水平对细胞造成氧化损伤,进而诱导细胞衰老。本实验结果表明,给糖尿病小鼠灌胃Lyc,骨髓EPCs内ROS水平显著降低,细胞衰老得到延缓。
有研究报道EPCs衰老与EPCs数量减少和功能受损有关[27]。EPCs功能受损主要表现为增殖、黏附、迁移和小管新生能力下降。本研究显示糖尿病小鼠骨髓来源EPCs迁移能力和小管新生能力均受损,Lyc干预后显著改善了糖尿病小鼠骨髓EPCs迁移能力和小管新生能力。
综上所述,STZ造模的糖尿病小鼠EPCs氧化应激产物增多,超出了自身清除能力,抑制了EPCs迁移及小管新生能力。Lyc可以降低糖尿病小鼠EPCs氧化应激反应、减轻EPCs的损伤、改善EPCs迁移及小管新生能力,这一效应可能是在抑制了氧化应激反应后,通过抑制细胞衰老并上调 EPCs的VEGF蛋白水平,促进了EPCs的成管能力。
尽管EPCs能加速受损血管重新内皮化,直接修复受损血管内皮,但是体外培养EPCs不仅数量有限,而且EPCs易发生衰老而影响其功能[28-29]。糖尿病患者自体EPCs注射治疗改善下肢血管病变的研究亦有报道,但EPCs功能受限,不能很好地发挥血管生成作用来改善血管病变[30]。因此,通过Lyc等食物来源的植物化学物动员内源性EPCs并增强其功能可能是防治糖尿病血管并发症的理想措施。
[1] OIKONOMOU D, KOPF S, von BAUER R, et al. Influence of insulin and glargine on outgrowth and number of circulating endothelial progenitor cells in type 2 diabetes patients: a partially double-blind, randomized, three-arm unicenter study[J]. Cardiovascular Diabetology, 2014, 13: 137. DOI:10.1186/s12933-014-0137-4.
[2] PALOMBO C, KOZAKOVA M, MORIZZO C, et al. Circulating endothelial progenitor cells and large artery structure and function in young subjects with uncomplicated type 1 diabetes[J]. Cardiovascular Diabetology, 2011, 10: 88. DOI:10.1186/1475-2840-10-88.
[3] ZENG Y C, MU G P, HUANG S F, et al. Effect of lycopene on number and function of human peripheral blood endothelial progenitor cells cultivated in high concentration of glucose and preliminary study on the mechanism[J]. Nutrition Research and Practice, 2014, 8(4): 368-376. DOI:10.4162/nrp.2014.8.4.368.
[4] 曾瑶池, 黄淑芬, 彭冬华, 等. 番茄红素对高糖所致内皮祖细胞线粒体氧化损伤和功能的影响[J]. 营养学报, 2015, 37(6): 591-595.
[5] HILL J M, ZALOS G, HALCOX J P, et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk[J]. New England Journal of Medicine, 2003, 348(7): 593-600. DOI:10.1056/ NEJMoa022287.
[6] KIM K A, SHIN Y J, KIM J H, et al. Dysfunction of endothelial progenitor cells under diabetic conditions and its underlying mechanisms[J]. Archives of Pharmacal Research, 2012, 35(2): 223-234. DOI:10.1007/s12272-012-0203-y.
[7] KIM J Y, SONG S H, KIM K L, et al. Human cord blood-derived endothelial progenitor cells and their conditioned media exhibit therapeutic equivalence for diabetic wound healing[J]. Cell Transplantation, 2010, 19(12): 1635-1644. DOI:10.3727/096368910X516637.
[8] MAHMOODNIA L, AGHADAVOD E, BEIGREZAEI S, et al. An update on diabetic kidney disease, oxidative stress and antioxidant agents[J]. Journal of Renal Injury Prevention, 2017, 6(2): 153-157. DOI:10.15171/jrip.2017.30.
[9] PITOCCO D, TESAURO M, ALESSANDRO R, et al. Oxidative stress in diabetes: implications for vascular and other complications[J]. International Journal of Molecular Sciences, 2013, 14(11): 21525-21550. DOI:10.3390/ijms141121525.
[10] RORBERTSON R P. Chronic oxidative stress as a central mechanism for glucose toxicity in pancreatic islet beta cells in diabetes[J]. Journal of Biological Chemistry, 2004, 279(41): 42351-42354. DOI:10.1074/ jbc.R400019200.
[11] TABATABAEI-MALAZY O, FAKHRZADEH H, SHARIFI F, et al. Effect of metabolic control on oxidative stress, subclinical atherosclerosis and peripheral artery disease in diabetic patients[J]. Journal of Diabetes & Metabolic Disorders, 2015, 14(84): 1-7. DOI:10.1186/s40200-015-0215-5.
[12] KIM H J, HAN S J, KIM D J, et al. Effects of valsartan and amlodipine on oxidative stress in type 2 diabetic patients with hypertension: a randomized, multicenter study[J]. Korean Journal of Internal Medicine, 2017, 32(3): 497-504. DOI:10.3904/kjim.2015.404.
[13] DONG L Y, JIN J, LU G, et al. Astaxanthin attenuates the apoptosis of retinal ganglion cells in db/db mice by inhibition of oxidative stress[J]. Marine Drugs, 2013, 11(3): 960-974. DOI:10.3390/md11030960.
[14] EBRAHIMIAN T G, HEYMES C, YOU D, et al. NADPH oxidasederived overproduction of reactive oxygen species impairs postischemic neovascularization in mice with type 1 diabetes[J]. The American Journal of Pathology, 2006, 169(2): 719-728. DOI:10.2353/ ajpath.2006.060042.
[15] di STEFANO V, CENCIONI C, ZACCAGNINI G, et al. p66ShcA modulates oxidative stress and survival of endothelial progenitor cells in response to high glucose[J]. Cardiovascular Research, 2009, 82(3): 421-429. DOI:10.1093/cvr/cvp082.
[16] CHEN J, SONG M, YU S, et al. Advanced glycation endproducts alter functions and promote apoptosis in endothelial progenitor cells through receptor for advanced glycation endproducts mediate overpression of cell oxidant stress[J]. Molecular and Cellular Biochemistry, 2010, 335(1): 137-146. DOI:10.1007/s11010-009-0250-y.
[17] LIN N, ZHANG H, SU Q. Advanced glycation end-products induce injury to pancreatic beta cells through oxidative stress[J]. Diabetes & Metabolism, 2012, 38(3): 250-257. DOI:10.1016/j.diabet.2012.01.003. [18] CHEN J, JING J, YU S, et al. Advanced glycation endproducts induce apoptosis of endothelial progenitor cells by activating receptor RAGE and NADPH oxidase/JNK signaling axis[J]. American Journal of Translational Research, 2016, 8(5): 2169-2178.
[19] DERNBACH E, URBICH C, BRANDES R P, et al. Antioxidative stress-associated genes in circulating progenitor cells: evidence for enhanced resistance against oxidative stress[J]. Blood, 2004, 104(12): 3591-3597. DOI:10.1182/blood-2003-12-4103.
[20] CUBBON R M, KAHN M B, WHEATCROFT S B. Effects of insulin resistance on endothelial progenitor cells and vascular repair[J]. Clinical Science, 2009, 117(5): 173-190. DOI:10.1042/CS20080263.
[21] MARROTTE E J, CBEN D D, HAKIM J S, et al. Manganese superoxide dismutase expression in endothelial progenitor cells accelerates wound healing in diabetic mice[J]. European Journal of Clinical Investigation, 2010, 120(12): 4207-4219. DOI:10.1172/JCI36858.
[22] YE J, NI P, KANG L, et al. Apelin and vascular endothelial growth factor are associated with mobilization of endothelial progenitor cells after acute myocardial infarction[J]. Journal of Biomedical Research, 2012, 26(6): 400-409. DOI:10.7555/JBR.26.20120052.
[23] LIANG J L, HUANG W, YU X Y, et al. Suicide gene reveals the myocardial neovascularization role of mesenchymal stem cells over expressing CXCR4 (MSCCXCR4)[J]. PLoS ONE, 2012, 7(9): e46158. DOI:10.1371/journal.pone.0046158.
[24] LIU Z J, VELAZQUEZ O C. Hyperoxia, endothelial progenitor cell mobilization, and diabetic wound healing[J]. Antioxidants & Redox Signaling, 2008, 10(11): 1869-1882. DOI:10.1089/ars.2008.2121.
[25] BOTUSAN I R, SUNKARI V G, SAVU O, et al. Stabilization of HIF-1 alpha is critical to improve wound healing in diabetic mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(49): 19426-19431. DOI:10.1073/ pnas.0805230105.
[26] 曾瑶池, 穆桂萍, 黄淑芬, 等. 番茄红素对高糖环境下人外周血内皮祖细胞增殖、凋亡的影响[J]. 卫生研究, 2012, 41(4): 623-626; 631.
[27] IMANISHI T, TSUJIOKA H, AKASAKA T. Endothelial progenitor cells dysfunction and senescence: contribution to oxidative stress[J]. Current Cardiology Reviews, 2008, 4(4): 275-286. DOI:10.2174/157340308786349435.
[28] FOTEINOS G, HU Y, XIAO Q, et al. Rapid endothelial turnover in atherosclerosis-prone areas coincides with stem cell repair in apolipoprotein E-deficient mice[J]. Circulation, 2008, 117(14): 1856-1863. DOI:10.1161/CIRCULATIONAHA.107.746008.
[29] FROEHLICH H, GULATI R, BOILSON B, et al. Carotid repair using autologous adipose-derived endothelial cells[J]. Stroke, 2009, 40(5): 1886-1891. DOI:10.1161/STROKEAHA.108.539932.
[30] SCHAUMBERG D A, GLYNN R J, JENKINS A J, et al. Effect of intensive glycemic control on levels of markers of inflammation in type 1 diabetes mellitus in the diabetes control and complications trial[J]. Circulation, 2005, 111(19): 2446-2453. DOI:10.1161/01. CIR.0000165064.31505.3B.
Effect and Mechanism of Lycopene on Functions of Endothelial Progenitor Cells in STZ-Induced Diabetic Mice
C57BL/6 mice challenged with streptozotocin (STZ) were used as an animal model of diabetes mellitus (DM) to study the protective effect of lycopene (Lyc) on functions of endothelial progenitor cells (EPCs) to evaluate its potential in the prevention and treatment of DM vascular complications. The results showed that a significant difference in the number of EPCs derived from peripheral blood was observed between diabetic and normal mice. The migration ability, tube formation ability and vascular endothelial growth factor (VEGF) protein expression level of bone marrow-derived EPCs in diabetic mice were obviously lower than those in normal mice. STZ accelerated oxidative stress and the onset of EPCs senescence. Based on our results, long-term administration with 30 mg/kg Lyc significantly relieved oxidative stress and the senescence of EPCs, and increased the VEGF protein expression level, migration ability and tube formation ability of EPCs when compared with the model group. Lycopene, as a food phytochemical, has the potential to be used in the prevention and treatment of DM vascular complications.
lycopene; endothelial progenitor cells; streptozotocin; diabetes mellitus; oxidative damage
10.7506/spkx1002-6630-201713033
R587.1
A
1002-6630(2017)13-0201-06
曾瑶池, 黄淑芬, 徐华, 等. 番茄红素对糖尿病小鼠骨髓内皮祖细胞功能影响及机制[J]. 食品科学, 2017, 38(13): 201-206. DOI:10.7506/spkx1002-6630-201713033. http://www.spkx.net.cn
ZENG Yaochi, HUANG Shufen, XU Hua, et al. Effect and mechanism of lycopene on functions of endothelial progenitor cells in STZ-induced diabetic mice[J]. Food Science, 2017, 38(13): 201-206. (in Chinese with English abstract)
10.7506/spkx1002-6630-201713033. http://www.spkx.net.cn
2016-07-11
广东省科技计划项目(2014A020212525)
曾瑶池(1975—),女,副主任医师,硕士,研究方向为营养与慢性病。E-mail:0731zyc@163.com
*通信作者:彭立生(1963—),男,主任医师,硕士,研究方向为肝病的中医药治疗。E-mail:szpengls@163.com
ZENG Yaochi1, HUANG Shufen2, XU Hua3, MU Guiping4, ZHOU Xilin1, PENG Lisheng5,*
(1. Department of Clinical Nutrition, Shenzhen Traditional Chinese Medicine Hospital, Shenzhen 518033, China; 2. Department of Health Education, Shenzhen Traditional Chinese Medicine Hospital, Shenzhen 518033, China; 3. Department of Pathology, Shenzhen Traditional Chinese Medicine Hospital, Shenzhen 518033, China; 4. Department of Central Laboratory, Shenzhen Traditional Chinese Medicine Hospital, Shenzhen 518033, China; 5. Department of Science and Education, Shenzhen Traditional Chinese Medicine Hospital, Shenzhen 518033, China)
