文蛤寡肽对小鼠急性肝损伤的保护作用
2017-07-24王佳佳赵莎莎杨最素余方苗丁国芳浙江海洋大学食品与医药学院浙江省海洋生物医用制品工程技术研究中心浙江舟山316022
王佳佳,赵莎莎,杨最素*,余方苗,丁国芳(浙江海洋大学食品与医药学院,浙江省海洋生物医用制品工程技术研究中心,浙江 舟山 316022)
文蛤寡肽对小鼠急性肝损伤的保护作用
王佳佳,赵莎莎,杨最素*,余方苗,丁国芳
(浙江海洋大学食品与医药学院,浙江省海洋生物医用制品工程技术研究中心,浙江 舟山 316022)
对文蛤寡肽(Meretrix meretrix oligopeptides,MMO)在小鼠急性肝损伤中的保护作用进行研究。首先通过酶解、超滤、Sephadex G-25柱分离技术从文蛤中分离纯化出具有肝修复作用的文蛤寡肽,经检测该目标肽的氨基酸序列为Gln-Leu-Asn-Trp-Asp。然后建立四氯化碳(CCl4)致小鼠急性肝损伤模型,测定小鼠肝脏指数;检测小鼠血清谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、γ-谷氨酰转移酶(γ-glutamyltransferase,γ-GT)、超氧化物歧化酶(superoxide dismutase,SOD)活力及甘油三酯(triglyceride,TG)、丙二醛(malondialdehyde,MDA)水平;苏木精-伊红染色观察肝脏病理学改变;免疫组化法测定肝组织TNF-α、NF-κB蛋白表达量。结果表明:MMO组与模型组比较,小鼠肝指数显著降低(P<0.05);血清中ALT、AST、γ-GT活力显著降低(P<0.05),γ-GT活力最高降幅达到47.16%;SOD活力显著升高(P<0.05);TG、MDA水平显著降低(P<0.05),最高降幅分别达到31.88%和28.83%。;苏木精-伊红染色观察肝组织结构明显好转;TNF-α、NF-κB蛋白表达量显著降低。因此,MMO对CCl4小鼠急性肝损伤有较为明显的保护作用。
文蛤寡肽;四氯化碳;急性肝损伤
文蛤(Meretrix meretrix)俗称蛤蜊,属于软体动物门、双壳纲、真瓣鳃目、帘蛤科文蛤属,是我国重要的海洋贝类之一,主要产区在辽宁、河北、山东、江苏沿海[1]。文蛤肉鲜,营养丰富,含有人体必需的各种氨基酸、矿物质、维生素和其他重要物质[2]。近年来研究表明文蛤有重要的药用价值,在抗肿瘤[3]、抗氧化[4-5]和提高免疫力[6]等方面表现出显著的功效,是一种极具开发潜力的海洋药物来源。如文蛤多肽Mere15具有较好的广谱抗癌活性,但对正常细胞却没有明显的抑制作用,对人肺癌移植瘤具有显著的抑制作用[1]。本实验室前期研究表明,文蛤内脏经酶解获得的分子质量为674.6 D,氨基酸序列为Gln-Leu-Asn-Trp-Asp的文蛤寡肽(Meretrix meretrix oligopeptides,MMO),作用于经软脂酸诱导正常肝Chang liver细胞建立的非酒精性脂肪性肝(nonalcoholic fatty liver disease,NAFLD)细胞模型后,能使NAFLD细胞模型中的丙二醛(malondialdehyde,MDA)含量、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)和γ-谷氨酰转移酶(γ-glutamyltransferase,γ-GT)活力下降,超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽-S转移酶的活力上升,对NAFLD细胞模型具有明显的修复作用。而MMO是否能修复经四氯化碳(CCl4)诱导的小鼠急性肝损伤,改善肝的病理结构变化和肝功能相关检测指标,目前鲜见报道。因此本实验通过建立小鼠急性肝损伤模型,经灌胃给药途径,探讨MMO对小鼠急性肝损伤模型的保护作用。
1 材料与方法
1.1 材料、实验动物与试剂
文蛤,购于浙江省舟山市定海南珍菜场。
动物用清洁级雄性ICR小鼠30只,体质量(20±2)g,购于浙江省实验动物中心(动物生产许可证号:SCXK(浙)2015-0001,饲养于浙江海洋大学动物房。
文蛤寡肽,本实验室自制;CCl4、二甲苯、乙醇国药集团化学试剂有限公司;植物油 西王集团;联苯双酯滴丸 浙江万邦药业公司;多聚赖氨酸、伊红 美国Sigma公司;ALT、AST、甘油三酯(triglyceride,TG)、γ-GT、MDA、SOD试剂盒及苏木精染液 南京建成生物工程公司;TNF-α、NF-κB抗体、山羊抗兔IgG/HRP聚合物(二抗)、DAB显色试剂盒北京中杉金桥生物技术有限公司。
1.2 仪器与设备
CF16RXⅡ型高速低温离心机 日本日立公司;Cogent mScale超滤系统 默克密理博公司;752FC紫外分光光度计 上海光谱仪器有限公司;RM2135切片机、HI1210摊片机、H1220烤片机 Leica(莱卡)公司;光学显微镜、CCD-NC6051显微摄像 日本Olympus公司。
1.3 方法
1.3.1 文蛤寡肽的提取
新鲜文蛤经洗净、去壳、取内脏,并用0.1 mol/L的NaOH溶液浸泡去脂,于蒸馏水中轻轻搅拌去杂质,调制中性,匀浆。选用碱性蛋白酶,以料液比1∶2于40 ℃,pH值为9.5的条件下酶解8 h。然后将得到的文蛤酶解液进行超滤,取分子质量小于5 kD的分子段产物。将小于5 kD酶解液过Sephadex G-25柱进行层析分离,收集各管洗脱液于280 nm波长处测定吸光度,收集峰Ⅰ,冷冻干燥。经检测该目标肽序列为Gln-Leu-Asn-Trp-Asp,命名为MMO。冷冻干燥后于4 ℃冰箱保存备用。
1.3.2 CCl4诱导肝损伤小鼠分组
将30 只成年雄性小鼠随机分组,每组6 只,分为正常组、模型组、联苯双酯滴丸阳性药物组(200 mg/kg)、MMO低剂量组(50 mg/kg)、MMO高剂量组(100 mg/kg),均以体质量计。在造模前对小鼠进行预防灌胃给药,连续7 d[7](正常组与模型组给予等量蒸馏水),第7天末次灌胃2 h后,除正常组小鼠外其他小鼠按照0.1 mL/10 g的剂量腹腔注射含有0.5% CCl4的花生油,造成小鼠急性肝损伤。造模结束后小鼠禁食不禁水,16 h后对各组小鼠称质量,摘眼球取血,4 ℃条件下4 000 r/min离心10 min,取血清,用于生化测定,采血后颈椎脱臼处死小鼠后取肝脏,用4 ℃预冷生理盐水冲净表面浮血,滤纸拭干,称质量,观察小鼠肝脏的形态后-80 ℃保存。
1.3.3 小鼠肝脏指数的计算及血清中各项生化指标的测定

血液离心后取上清液,按试剂盒说明书操作步骤进行ALT、AST、γ-GT、SOD活力、TG、MDA含量各项生化指标的测定。
1.3.4 组织病理学HE染色观察
取小鼠肝脏1 cm3左右,立即放入4%多聚甲醛溶液,固定24 h后,常规石蜡包埋后,制备5 µm厚切片,按照苏木精-伊红(hematoxylin-eosin,HE)染色顺序,中性树胶封片且光镜下观察肝组织病理变化。
1.3.5 免疫组化法检测TNF-α、NF-κB蛋白的表达
将小鼠肝脏切片常规脱蜡至水;内源性过氧化物酶阻断剂室温作用10 min;微波炉抗原修复,冷却后磷酸盐溶液洗涤2×5 min/次;滴加封闭用正常山羊血清工作液,室温作用20 min,甩去多余液体;分别滴加适量稀释的一抗(1∶300),4 ℃孵育过夜,磷酸盐溶液洗3×5 min/次;滴加二抗,室温孵育20 min;滴加适量HRP标记的链霉亲和素, 室温孵育20 min;DAB显色,镜下控制时间,自来水冲洗;苏木素复染5 min,乙醇梯度脱水,二甲苯透明后中性树胶封片。显微镜下观察并拍照。
1.4 数据处理
实验数据使用SPSS 18.0统计软件分析处理,实验结果以±s表示,且以P<0.05表示差异显著。
2 结果与分析
2.1 小鼠肝脏形态观察
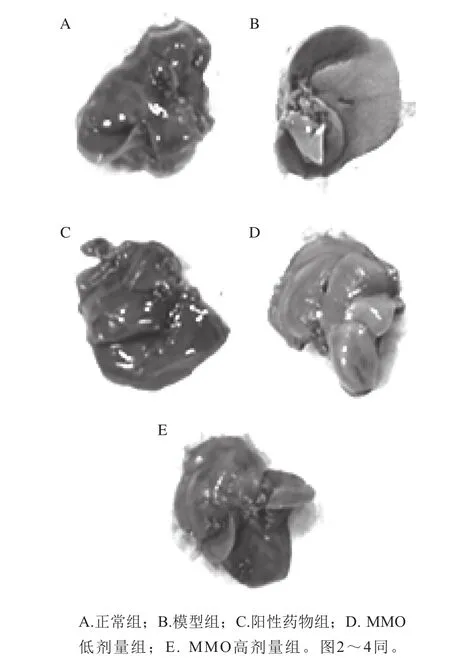
图1 小鼠肝脏Fig. 1 Liver tissues of mice
由图1可以看出,正常组小鼠肝脏体积较小呈暗红色,肝脏色泽鲜亮(图中均未显示颜色),纹理致密,质地中等有弹性;模型组肝脏颜色呈现不正常的乳白色,体积增大,且肝脏表面可见乳白色的颗粒状物体,肝脏质地较硬弹性差;阳性药物组小鼠肝脏形态正常组差别不大;MMO药物处理组肝脏颜色比模型组深,色泽比较鲜亮,且高剂量组更加明显。说明MMO对急性肝损伤具有一定的修复作用。
2.2 MMO对小鼠肝脏指数的影响
由表1可得出,MMO低、高剂量组与阳性药物组均可使小鼠体质量增加,其中高剂量组体质量高于阳性药物组,达到(33.46±1.31)g,与模型组差异显著(P<0.05)。CCl4模型组比正常组的肝脏指数显著增加,说明CCl4造成小鼠肝脏肿大。与模型组比较,阳性药物组与MMO高剂量组小鼠肝指数均显著降低(P<0.05)。
表1 MMO对小鼠肝脏指数的影响(±s,n=6)Table 1 Effect of MMO on liver index in mice with liver injury induced by CCl4(s,n= 6)

表1 MMO对小鼠肝脏指数的影响(±s,n=6)Table 1 Effect of MMO on liver index in mice with liver injury induced by CCl4(s,n= 6)
注:*.与模型组比较,差异显著(P<0.05)。下同。
?
2.3 MMO对小鼠血清ALT、AST活力的影响
表2 MMO对小鼠血清ALT、AST活力的影响(s,n=6)Table 2 Effect of MMO on serum ALT and AST activities in mice with liver injury induced by CCl (s,n= 6) 4

表2 MMO对小鼠血清ALT、AST活力的影响(s,n=6)Table 2 Effect of MMO on serum ALT and AST activities in mice with liver injury induced by CCl (s,n= 6) 4
注:#.与正常组比较,差异显著(P<0.05)。下同。
?
由表2可得出,与正常组比较,模型组小鼠ALT、AST活力均显著升高,分别达到394.89 U/L和1 410.66 U/L。MMO各剂量组和阳性药物组均可降低ALT、AST活力,且以AST高剂量组最为显著,抑制率达到33.04%(P<0.05)。MMO低剂量组ALT、AST活力低于模型组,但高于MMO高剂量组。说明随着MMO水平的增加,小鼠血清中ALT、AST活力逐渐降低,呈现明显的剂量相关性。
2.4 MMO对小鼠血清γ-GT、SOD活力及MDA、TG含量的影响
表3 MMO对小鼠血清γ-GT、SOD活力及MDA、TG含量的影响(,n=6)Table 3 Effect of MMO on serum γ-GT and SOD activities and MDA and TG contents in mice with liver injury induced by CCls,n= 6) 4
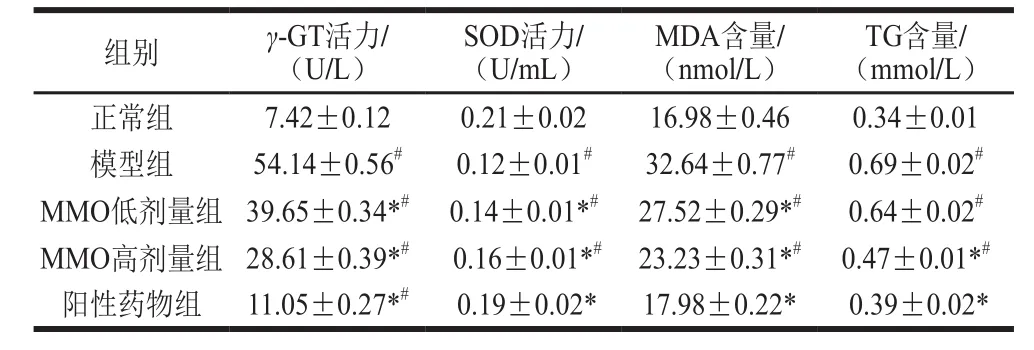
表3 MMO对小鼠血清γ-GT、SOD活力及MDA、TG含量的影响(,n=6)Table 3 Effect of MMO on serum γ-GT and SOD activities and MDA and TG contents in mice with liver injury induced by CCls,n= 6) 4
?
由表3可得出,模型组与正常组比较,γ-GT水平达到正常组7 倍。MMO低、高剂量、阳性药物组与模型组比较γ-GT活力显著降低(P<0.05),MMO高剂量组降幅达到47.16%。与正常组比较,模型组SOD活力显著降低,降幅达到42.86%。MMO低、高剂量组与模型组比较,SOD活力显著升高,但MMO高剂量组与阳性药物组效果更为显著(P<0.05)。模型组MDA、TG含量升高到正常组的2 倍,MMO低、高剂量组与阳性药物组均使MDA含量显著降低(P<0.05),其中MMO高剂量组与阳性药物组呈现更加显著性的差异(P<0.05),相对低剂量组,MMO高剂量组MDA、TG含量降幅更加明显,分别达到了28.83%和31.88%。
2.5 MMO对小鼠肝组织的病理学影响
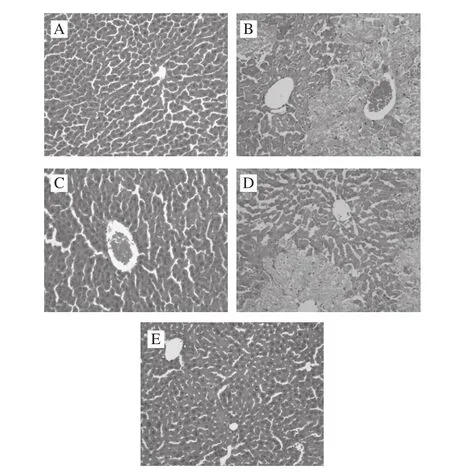
图2 小鼠肝组织HE染色(×200)Fig. 2 Observation of liver slices from mice by HE staining (× 200)
由图2可看出,HE染色后光镜下观察,正常组小鼠肝小叶结构清晰,肝索排列整齐,呈放射状,肝细胞形态规则,细胞质嗜酸性,核结构清晰。模型组肝小叶紊乱,肝索断裂,细胞形态大小不一,肝细胞嗜酸性减弱,出现大量空泡,细胞核聚缩边缘化,呈现中央型坏死并且肝血窦狭窄。阳性药物组肝小叶结构完整,无变性坏死,几乎没有空泡细胞,细胞整体趋于正常。MMO低剂量组肝索比模型组较完整,细胞质内空泡减少,细胞核聚缩边缘化有所减少,但组织受损仍较为严重。MMO高剂量组肝组织修复效果比较明显,肝索放射状排列清楚,空泡数量减少,细胞核形态正常。
2.6 免疫组化法检测TNF-α、NF-κB蛋白的表达
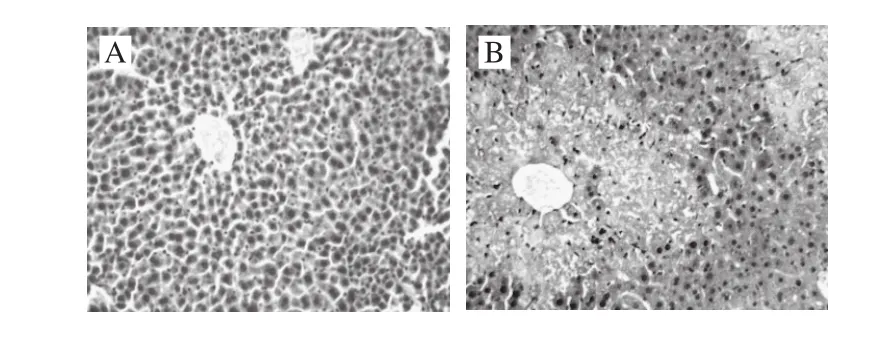
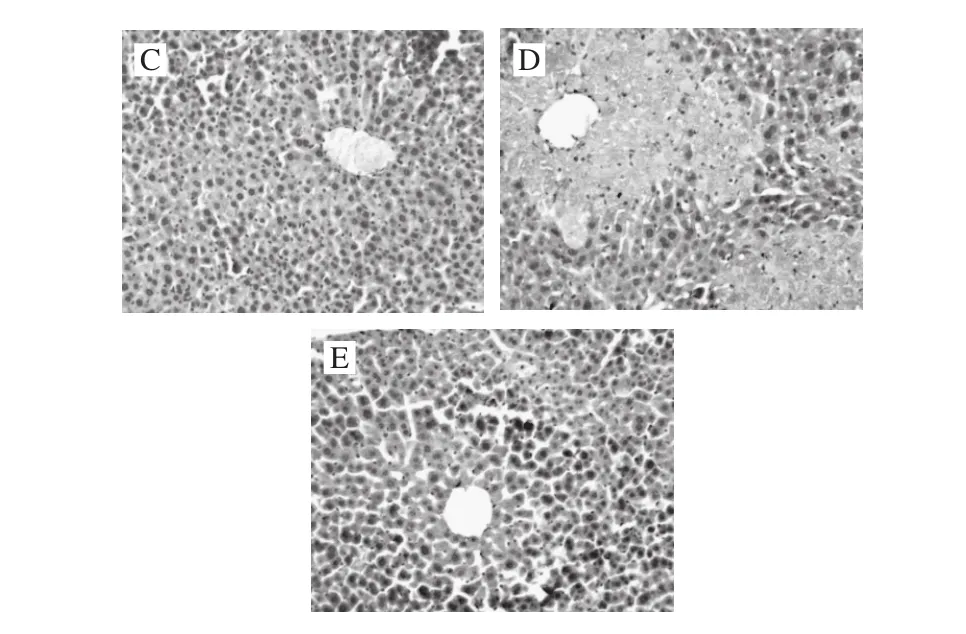
图3 小鼠肝组织TNF-α表达情况(×200)Fig. 3 Microscopic observation of the expression of TNF-α in liver tissue (× 200)
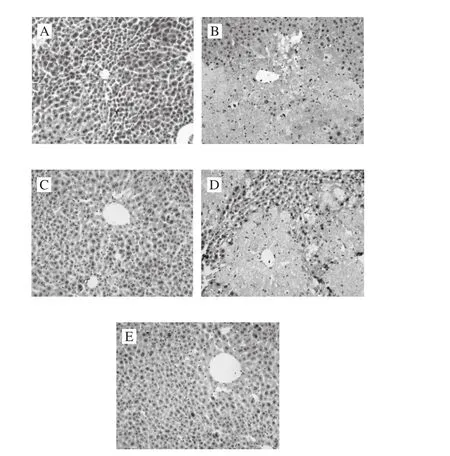
图4 小鼠肝组织NF-κB表达情况(×200)Fig. 4 Microscopic observation of the expression of NF-κB in liver tissue (× 200)
免疫组化法在肝细胞质内显示棕黄色颗粒(淡灰色部分)为TNF-α、NF-κB蛋白表达阳性部位。正常组小鼠肝组织中几乎没有TNF-α、NF-κB阳性表达(图3A、图4A);而模型组中TNF-α、NF-κB阳性表达明显,呈较深的棕黄色,呈现局灶性的弥漫性分布,主要分布在中央静脉的周围(图3B、图4B);阳性药物组中两种蛋白的阳性表达部位较少,只存在于中央静脉周围的少量肝细胞中,并且颜色较浅(图3C、图4C);MMO低剂量组阳性表达部位在中央静脉周围的肝细胞中,也呈现局灶性的弥漫性分布,但颜色比模型组浅(图3D、图4D);高剂量组的阳性表达明显减少,与阳性药物组的表达部位无明显差异(图3E、图4E)。说明MMO可降低TNF-α、NF-κB蛋白表达量,且呈剂量相关性。
3 讨 论
随着人们生活水平的提高以及膳食结构的改变,肝脏疾病成为影响人类健康严重问题之一,世界上每年约有100万患者死于肝病,其中亚太地区肝病患者约占全球总数的一半,我国更是肝病高发地区[8]。从海洋生物中提取护肝保肝活性物质是开发药源的重要途径,其中海洋肽类药物具有分子质量小、结构简单、副作用小、无免疫原性、活性高等优点而成为学者们研究的热点。CCl4是一种广泛用于评估保肝作用的药物和植物提取物的肝毒性剂,它能够使小鼠肝脏肿大,肝指数升高[9-10]。当肝细胞损伤时,细胞膜通透性增加,存在于肝细胞质内的AST和ALT会渗入血液,因此血清中这两种酶活性增高反映出肝细胞损害的程度[11-12]。本实验模型组AST、ALT活力显著高于正常组,AST水平高于ALT,说明肝细胞损伤、坏死的程度比较严重[13],而MMO各剂量组AST、ALT活力下降,表明MMO对肝损伤有较好的修复作用。
活性氧自由基是生物体氧化还原反应的代谢产物,体内氧自由基的产生和清除在正常生理情况下一般保持平衡状态,否则会给机体造成损害。SOD是体内重要的自由基清除剂,在肝细胞受到自由基攻击时,作为机体的保护性机制,肝脏内SOD会因其耗竭而减少[14-16]。MDA是脂质过氧化的产物,可与生物大分子结合形成加醛复合物,进一步破坏细胞膜的结构和功能,其含量反映了组织过氧化的损伤程度[17-19]。有研究表明,肝细胞脂肪变性后肝功能酶活性、肝脂水平和血脂水平会呈现正相关性。人体内的TG主要在肝脏中合成,肝脏受到损伤,机体对游离脂肪酸的利用则会减少,导致血清中TG水平升高。所以血清中TG含量的高低间接反映了肝脏受损情况[20-21]。γ-GT在人体细胞的微粒体中合成,主要存在于肝内胆管上皮和肝细胞质中,从胆道排泄。肝病时,肝细胞受损同时胆道受压,γ-GT排泄受阻,随胆汁返流入血,可致血中γ-GT升高[22]。故本实验采用SOD活力、MDA含量、TG含量、γ-GT活力指标来反映肝损伤的程度。实验结果表明模型组肝损伤严重,抗氧化活性降低,脂质过氧化产物增加。MMO各剂量组均有明显改善,尤其高剂量组对肝损伤修复作用显著。
肝组织的损伤与修复不仅仅体现在肝功能生化指标的改变,同时会引起肝组织结构的变化。通过肝组织的HE染色,发现模型组肝组织损伤比较严重,而经过MMO各剂量和联苯双酯滴丸处理后,小鼠肝组织损伤程度减轻,肝小叶结构逐渐恢复,其中MMO高剂量组的效果与阳性药物组效果相近,效果好于MMO低剂量组。
为了进一步探索MMO对小鼠急性肝损伤的修复,通过免疫组化法检测TNF-α、NF-κB蛋白的表达。在CCl4诱导的肝损伤机制中,自由基的介导发挥着重要的作用,自由基具有双重效应,一方面使机体发生脂质过氧化;另一方面促使肿瘤坏死因子(TNF-α)的生成[23]。TNF-α是一种多效的细胞因子,是由激活的巨噬细胞或单核细胞产生,在炎症反应、细胞免疫和肿瘤免疫等方面发挥着关键作用[24-26]。并且,TNF-α可通过活化NF-κB信号通路,诱导cyclinD1表达,加快细胞周期进程[27-28]。而NF-κB转录因子在调节肝脏炎症、细胞凋亡、自噬和氧化状态方面则发挥着重要作用[29]。NF-κB活化后,可增强TNF-α的基因转录,相应的炎症信号迅速放大,可释放大量的氧自由基、细胞因子和炎症介质[30]。在本实验中,模型组TNF-α、NF-κB蛋白表达水平升高,表明小鼠肝细胞损伤严重,炎症反应明显。而MMO高剂量组TNF-α、NF-κB蛋白表达水平显著降低,减少了炎症因子释放从而降低了炎症反应,其与联苯双酯滴丸组效果相近。
综上所述,MMO一方面能够有效抑制血清AST、ALT、γ-GT活力的升高,阻止自由基清除剂SOD活力的降低,抑制脂质过氧化产物MDA的产生,降低血清TG含量;另一方面可降低TNF-α、NF-κB蛋白的表达量。因此MMO可能通过减轻脂质过氧化反应,减少活性氧及其自由基的产生,从而减轻线粒体氧化负荷,促使氧化-抗氧化机制恢复平衡,并且减少了炎症因子的释放,减轻炎症反应从而达到保护肝脏的目的。
4 结 论
本实验利用CCl4建立小鼠急性肝损伤模型,对文蛤寡肽的肝损伤保护作用进行了体内实验的研究。实验结果表明,无论从血清生化指标、病理学和组织学观察,还是对炎症因子TNF-α、NF-κB的检测,都表明MMO对CCl4引起的肝损伤具有明显的保护作用。
[1] 王翠翠. 文蛤多肽的分离纯化及抗肿瘤机制研究[D]. 北京: 中国科学院, 2011: 13-14.
[2] SUPATRA K, SOOTTAWAT B, HIDEKI K,et al. Chemical compositions and nutritional value of Asian hard clam (Meretrix lusoria) from the coast of Andaman Sea[J]. Food Chemistry, 2013, 141(4): 4138-4145. DOI:10.1016/j.foodchem.2013.07.001.
[3] 张玉艳. 文蛤抗肿瘤多肽的分离纯化及其作用机理的研究[D]. 北京: 中国科学院, 2010: 77-87.
[4] 李和生, 刘智勇, 王鸿飞. 文蛤多肽组分的分离及其抗氧化活性研究[J]. 中国食品学报, 2012, 12(6): 30-35. DOI:10.3969/ j.issn.1009-7848.2012.06.005.
[5] 邱春江, 陈慧. 木瓜蛋白酶水解文蛤蛋白制备小分子肽及其抗氧化研究[J]. 食品科技, 2008, 33(3): 180-182. DOI:10.3969/ j.issn.1005-9989.2008.03.052.
[6] 袁强, 袁弘. 文蛤多糖对实验性糖尿病大鼠免疫功能的影响[J].浙江中医药大学学报, 2006, 30(6): 612-613. DOI:10.3969/ j.issn.1005-5509.2006.06.015.
[7] SHUAI Z, BINAN L, XU H, et al. Protection of the flavonoid fraction from rosa laevigata michx fruit against carbon tetrachloride-induced acute liver injury in mice[J]. Food and Chemical Toxicology, 2014, 55: 60-69. DOI:10.1016/j.fct.2012.12.041.
[8] ISSA R, ZHOU X, CONSTANDINOU C M, et al. Spontaneous recovery from micronodular cirrhosis: evidence for incomplete resolution associated with matrix cross-linking[J]. Gastroenterology, 2004, 126(7): 1795-1808. DOI:10.1053/j.gastro.2004.03.009.
[9] BHATHAL P S, ROSE N R, MACKAY I R, et al. Strain differences in mice in carbon tetrachloride-induced liver injury[J]. British Journal of Experimental Pathology, 1983, 64(5): 524-533.
[10] YUN C T, JUNG C L, CHUAN S C, et al. Esculetin ameliorates carbon tetrachloride-mediated hepatic apoptosis in rats[J]. International Journal of Molecular Science, 2011, 12: 4053-4067. DOI:10.3390/ ijms12064053.
[11] 李晓斐, 李志珂, 武双婵, 等. 红花红色素对小鼠急性CCl4性肝损伤的作用[J]. 现代食品科技, 2013, 29(7): 1569-1573.
[12] 夏娜, 陈义磊, 陶海燕, 等. 药桑多糖对四氯化碳所致大鼠肝损伤的保护作用[J]. 食品科学, 2015, 36(13): 247-251. DOI:10.7506/ spkx1002-6630-201513046.
[13] PENG C Y, HSIEH T C, HSIEH T Y, et al. HBV-DNA level at 6 months of entecavir treatment predicts HBeAg loss in HBe Ag-positive chronic hepatitis B patients[J]. Journal of the Formosan Medical Association, 2015, 114(4): 308-313. DOI:10.1016/j.jfma.2013.10.023. [14] SINHA K, DAS J, PAL P B, et al. Oxidative stress: the mitochondriadependent and mitochondria-independent pathways of apoptosis[J]. Archives of Toxicology, 2013, 87: 1157-1180. DOI:10.1007/s00204-013-1034-4.
[15] YOUNGREN S R, MULIK R, JUN B, et al. Freeze-dried targeted mannosylated selenium-loaded nanoliposomes: development and evaluation[J]. AAPS Pharmaceutical Science and Technology, 2013, 14(3): 1012-1024. DOI:10.1208/s12249-013-9988-3.
[16] 姚秀芬, 程栋, 王承明. 花生粗多糖对四氯化碳及酒精所致小鼠急性肝损伤的保护作用[J]. 食品科学, 2011, 32(9): 261-265.
[17] 陆艳艳, 邱细敏, 刘湘军, 等. 人工虫草多糖对小鼠CCl4肝损伤的保护作用[J]. 食品科学, 2011, 32(7): 319-322.
[18] WU Yu, LI Lin, WEN Tao, et a1. Protective effects of echinacoside on carbon tetrachloride-induced hepatotoxicity in rats[J]. Toxicology, 2007, 232(1/2): 50-56. DOI:10.1016/j.tox.2006.12.013.
[19] ZHANG S, LU B, HAN X, et al. Protection of the flavonoid fraction from Rosa laevigata Michx fruit against carbon tetrachloride-induced acute liver injury in mice[J]. Food Chemical Toxicology, 2013, 55: 60-69. DOI:10.1016/j.fct.2012.12.041.
[20] 樊希承, 黄颖, 黄亦琦, 等. 脂肪肝肝脂与血脂的相关性研究[J].实用医技杂志, 2006, 13(20): 3531-3533. DOI:10.3969/ j.issn.1671-5098.2006.20.002.
[21] CHEN Yaling, PENG Hsiangchi, TAN Shanwen, et al. Amelioration of ethanol-induced liver injury in rats by nanogold flakes[J]. Alcohol, 2013, 47(6): 467-472. DOI:10.1016/j.alcohol.2013.05.006.
[22] TACKE F, LUEDDE T, TRAUTWEIN C. Inflammatory pathways in liver homeostasis and liver injury[J]. Clinical Reviews in Allergy Immunolory, 2009, 36: 4-12. DOI:10.1007/s12016-008-8091-0.
[23] 刘晨晨, 赵玉勤, 杨最素, 等. 鳕鱼皮胶原蛋白肽对小鼠急性肝损伤的保护作用研究[J]. 现代食品科技, 2015, 31(7): 18-24. DOI:10.13982/j.mfst.1673-9078.2015.7.004.
[24] CENGIZ M, MEHTAP K H, BURUKOGLU D, et al. A comparative study on the therapeutic effects of Silymarin and Silymarin-Loaded solid lipid nanoparticles on D-GaIN/TNF-α-induced liver damage in BALB/c mice[J]. Food and Chemical Toxicology, 2015, 77: 93-100. DOI:10.1016/j.fct.2014.12.011.
[25] DU Shilin, XUE Yuan, SUN Zhan, et al. Trametinib, a novel MEK kinase inhibitor, suppresses lipopolysaccharide-induced tumor necrosis factor (TNF)-α production and endotoxin shock[J]. Biochemical and Biophysical Research Communications, 2015, 458(3): 667-673. DOI:10.1016/j.bbrc.2015.01.160.
[26] KODAI S, TAKEMURA S, MINAMIYAMA Y, et al. Sallyl cysteine prevents CCl4-induced acute liver injury in rats[J]. Free Radicol Research, 2007, 41: 489-497. DOI:10.1080/10715760601118361.
[27] 杨季云, 张思仲, 郭红, 等. 肿瘤坏死因子α通过激活NF-κB信号通路加快肝细胞周期进程[J]. 生物化学与生物物理展, 2007, 34(6): 604-610. DOI:10.3321/j.issn:1000-3282.2007.06.008.
[28] 周韵. 氧化应激损伤中NF-κB1多态性对 NF-κB信号通路及细胞凋亡的分子机制研究[D]. 乌鲁木齐: 新疆医科大学, 2016: 39-40.
[29] 丁辉. 小檗碱对动脉粥样硬化性肾损伤的保护作用及与IKK/NFκB信号途径关系的研究[D]. 南京: 南京医科大学, 2011: 34-37.
[30] 龚建苗, 陈庆森, 阎亚丽, 等. 生物活性肽调节NF-κB信号通路的研究进展[J]. 食品科学, 2013, 34(21): 379-388. DOI:10.7506/spkx1002-6630-201321075.
Protective Effect of Meretrix meretrix Oligopeptides on Acute Liver Injury in Mice
WANG Jiajia, ZHAO Shasha, YANG Zuisu*, YU Fangmiao, DING Guofang
(Zhejiang Provincial Engineering Technology Research Center of Marine Biomedical Products, School of Food Science and Medical, Zhejiang Ocean University, Zhoushan 316022, China)
The protective effect of Meretrix meretrix oligopeptide (MMO) on CCl4-induced acute liver injury in mice was examined. MMO, with the potential to repair damaged liver, was enzymatically extracted and purified by ultrafiltration and Sephadex G-25 column chromatography, and its amino acid sequence was determined to be Gln-Leu-Asn-Trp-Asp. Then, an acute liver injury model was established by intraperitoneal injection of CCl4into mice. The liver index of mice was measured, the activities of serum alanine aminotransferase (ALT), aspartate aminotransferase (AST), γ-glutamyltransferase (γ-GT) and superoxide dismutase (SOD) were determined, and serum triglyceride (TG) and malondialdehyde (MDA) levels were measured. Liver tissue samples from mice were stained with hematoxylin-eosin (HE) to observe the effect of MMO on liver histopathology. Immunohistochemical staining was used to detect the protein expression of TNF-α and NF-κB in hepatic tissue. The results showed that the MMO group exhibited a decrease in liver index, a reduction in serum ALT, AST and γ-GT activities (by up to 47.16%), an elevation in serum SOD activity, and a decline in serum TG and MDA levels (by up to 31.88% and 28.83%) compared with the model group, all these changes being statistically significant. Mouse liver tissue stained with HE revealed a notable improvement in liver histology. The protein expression of TNF-α and NF-κB in hepatic tissue was significantly decreased by administration of MMO. Therefore, MMO can effectively protect against acute liver injury induced by CCl4in mice.
Meretrix meretrix oligopeptides; carbon tetrachloride; acute liver injury
10.7506/spkx1002-6630-201713031
TS201.6
A
1002-6630(2017)13-0190-06引文格式:
王佳佳, 赵莎莎, 杨最素, 等. 文蛤寡肽对小鼠急性肝损伤的保护作用[J]. 食品科学, 2017, 38(13): 190-195.
10.7506/ spkx1002-6630-201713031. http://www.spkx.net.cn
WANG Jiajia, ZHAO Shasha, YANG Zuisu, et al. Protective effect of Meretrix meretrix oligopeptides on acute liver injury in mice[J]. Food Science, 2017, 38(13): 190-195. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201713031.
2016-06-11
浙江省自然科学基金项目(LY15C200016;LQ16H300001);舟山市级公益类科技计划项目(2015C31012)
王佳佳(1991—),女,硕士研究生,研究方向为海洋药物、海洋功能食品。E-mail:1354193287@qq.com
*通信作者:杨最素(1967—),女,教授,博士,研究方向为海洋药物、海洋功能食品。E-mail:yangzs87@163.com
