尿石素A对巨噬细胞极化及巨噬-泡沫细胞形成的作用
2017-07-24韩淇安刘红燕闫春红夏效东西北农林科技大学食品科学与工程学院陕西杨凌7200中国农业大学食品科学与营养工程学院北京食品营养与人类健康高精尖创新中心北京0008定兴县医院河北定兴072650西安交通大学生命科学与技术学院陕西西安7009
韩淇安,刘红燕,闫春红,石 超,夏效东,*(.西北农林科技大学食品科学与工程学院,陕西 杨凌 7200;2.中国农业大学食品科学与营养工程学院,北京食品营养与人类健康高精尖创新中心,北京 0008;.定兴县医院,河北 定兴 072650;.西安交通大学生命科学与技术学院,陕西 西安 7009)
尿石素A对巨噬细胞极化及巨噬-泡沫细胞形成的作用
韩淇安1,2,刘红燕3,闫春红4,石 超1,夏效东1,*
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.中国农业大学食品科学与营养工程学院,北京食品营养与人类健康高精尖创新中心,北京 100083;3.定兴县医院,河北 定兴 072650;4.西安交通大学生命科学与技术学院,陕西 西安 710049)
旨在探究尿石素A对巨噬细胞极化及对巨噬-泡沫细胞形成的影响及相关的分子机制。结果发现,尿石素A通过调控不同标志基因的表达,不仅能够抑制RAW264.7小鼠巨噬细胞向促炎的M1型巨噬细胞极化,还能促进自然状态巨噬细胞向M2型巨噬细胞极化;油红O染色发现尿石素A能够显著抑制巨噬-泡沫细胞形成,实时荧光定量聚合酶链式反应检测说明尿石素A能够抑制胆固醇合成基因羟甲基戊二酸单酰辅酶A还原酶和脂肪酸合成酶基因的转录;此外,尿石素A显著上调三磷酸腺苷结合盒转运蛋白A1和G1基因的表达,该两个基因表达与促进了胆固醇的排出相关。本研究证明了尿石素A对巨噬细胞极化具有调控作用,同时尿石素A能够抑制巨噬-泡沫细胞形成和胆固醇合成。这些结果揭示了尿石素A具有潜在的抗动脉粥样硬化的作用,为之后深入研究提供了理论参考。
尿石素A;巨噬细胞极化;泡沫细胞;胆固醇;动脉粥样硬化
动脉粥样硬化被认为是一种慢性炎症导致的疾病,巨噬细胞极化则是动脉粥样硬化发生发展中的关键环节。在促炎或抗炎的微环境下,巨噬细胞分别极化成两种不同类型的分型,即经典活化型M1和替代活化型M2,这两种分型分别决定了巨噬细胞在动脉粥样硬化中的不同功能[1]。其中,M1型巨噬细胞由脂多糖(lipopolysaccharide,LPS)、Toll样受体(Toll-like receptor,TLR)、T helper 1(Th1)等促炎介质诱发形成,可以显著上调白介素(interleukin,IL)-1β、IL-6、IL-12、肿瘤坏死因子(tumor necrosis factor,TNF)-α和诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)等细胞因子的基因表达,是免疫反应的效应细胞,具有促进炎症及动脉粥样硬化发展的作用;相反,抗炎因子诱导巨噬细胞极化为M2型,能够抑制M1型巨噬细胞引起的炎症反应,这类细胞主要分泌IL-10、转化生长因子-β(transforming growth factor-β,TGF-β)等抗炎因子[2-4]。M1型和M2型巨噬细胞可以在体内相互转化,促进M1型巨噬细胞向M2型极化能够减缓早期动脉粥样硬化的发展[5]。
此外,巨噬细胞结合并摄入大量氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)或胆固醇后转化为泡沫细胞是动脉粥样硬化发展过程中的标志性步骤[6]。泡沫细胞内胆固醇也可来源于自身合成,这个过程的限速酶是羟甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMG-CoAR),其能够催化甲基戊酸的合成[7]。脂肪酸合成酶(fatty acid synthase,FAS)与胆固醇平衡密切相关,从而也与动脉硬化斑块的形成相关[8]。而三磷酸腺苷结合盒转运蛋白A1(ATP-binding cassette transporter A1,ABCA-1)和三磷酸腺苷结合盒转运蛋白G1(ATP-binding cassette transporter G1,ABCG-1)可以促进胆固醇从外周细胞转运至肝脏,维持细胞内胆固醇平衡,从而抑制或消除泡沫细胞形成[9]。
多项研究证明,尿石素A(urolithin A,Uro-A)是人体摄入富含鞣花单宁的食物或者鞣花酸后主要的功效物质[10-11]。除具有抗氧化、抗肿瘤等活性外,尿石素A还具有显著的抗炎作用[12]。在THP-1源性巨噬细胞及RAW264.7小鼠巨噬细胞中,尿石素A可以抑制相关促炎因子(TNF-α、IL-6、IL-12α)的表达,体现出强于尿石素B和C的抗炎活性[13-14]。体内研究也已证实尿石素A能够有效抑制角叉莱胶诱导的小鼠足肿胀急性炎症[15]。然而,关于尿石素A对巨噬细胞极化的调控作用尚鲜有研究报道。此外,尿石素A能够显著减少人肝细胞和脂肪细胞中甘油三酯的累积并有效抑制THP-1源性巨噬细胞中胆固醇的募集[16-17],然而尿石素A对巨噬细胞胆固醇摄入和合成的作用至今鲜有报道。因此,本实验旨在研究尿石素A对巨噬细胞极化过程的作用,并深入探究其对泡沫细胞形成及胆固醇代谢的影响及相关的机制,从而进一步证明尿石素A在动脉硬化进程中的调控作用。
1 材料与方法
1.1 材料与试剂
RAW264.7小鼠巨噬细胞系购自中国科学院上海生命科学研究院细胞资源中心。
尿石素A(纯度95%) 杭州麦俊化工科技有限公司;氧化低密度脂蛋白 广州奕源生物科技有限公司;脂多糖 美国Sigma-Aldrich公司;油红O 北京索莱宝科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、4-羟乙基哌嗪乙磺酸(2-[4-(2-hydroxyethyl)-1-piperazinyl] ethanesulfonic acid,HEPES) 美国Life Science公司;其他试剂均为国产分析纯。
细胞细菌总RNA提取试剂盒 天根生化科技(北京)有限公司;PrimeScriptTMRT reagent kit、SYBR®Premix Ex TaqTMII(perfect real time) 宝生物工程(大连)有限公司;总胆固醇(total-cholesterol)试剂盒(COD-PAP法) 南京建成生物工程研究所;BCA蛋白定量试剂盒 北京康为世纪生物科技有限公司。
1.2 仪器与设备
Model 680多孔酶标仪、IQ5实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;Nano-200超微量核酸分析仪 杭州奥盛仪器有限公司;9600基因扩增仪 珠海黑马医学仪器有限公司;5804R低温高速离心机 德国Eppendorf公司。
1.3 方法
1.3.1 尿石素A对RAW264.7细胞毒性的影响
采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide,MTT)法,将200 μL 1×105个/mL RAW264.7细胞悬液均匀接种于96 孔细胞培养板中,孵育24 h。弃去培养液,加入等体积不同浓度的尿石素A溶液(0.5、5.0、25.0、50.0、100.0 μmol/L)设置为实验组,含有0.1% DMSO无血清培养液设置为空白组,不含细胞的培养液(含有0.1% DMSO)为调零组,每组设置5 个复孔。置于细胞培养箱(37 ℃、5% CO2)中分别培养3、6 h和12 h。使用酶标仪测定各组上清液在570 nm波长处光密度值,根据下式计算细胞存活率。

1.3.2 尿石素A对巨噬细胞不同分型标志基因表达的影响
采用实时荧光定量PCR法,将1.5 mL 1×105个/mL RAW264.7细胞悬液均匀接种于6 孔细胞培养板中,孵育24 h。弃去培养液,对照组加入含有0.1% DMSO无血清培养液,实验组分别加入不同浓度的尿石素A(5、10、20 μmol/L)。置于细胞培养箱(37 ℃、5% CO2)中培养3 h后,按照RNA提取试剂盒说明书提取细胞总RNA。采用超微量核酸分析仪检测RNA浓度和纯度,当A260nm/ A280nm在1.8~2.1之间时,样品可用做实时荧光定量PCR模板。将RNA浓度调成一致后,按照反转录试剂盒说明书将总RNA反转录为cDNA,并采用实时荧光定量PCR仪检测基因(IL-1β、IL-6、iNOS、TNF-α、IL-10、TGF-β)的表达量。实时荧光定量PCR条件如下:95.0 ℃预变性30 s;95.0 ℃变性5 s,55.0 ℃退火30 s,72.0 ℃延伸32 s,40 个循环,扩增产物进行溶解曲线分析。样品设置3 个平行实验,并以GAPDH作为内参,采用2-ΔΔCt法分析基因的相对表达量。

表1 目标基因引物序列Table 1 Primers for the target genes
将1.5 mL 1×105个/mL RAW264.7细胞悬液均匀接种于6 孔细胞培养板中,培养24 h后,给予终浓度为1 μg/mL的LPS继续刺激24 h,构建经典活化型M1型巨噬细胞。实验组分别加入不同浓度的尿石素A(5、10、20 μmol/L),提取各组RNA并采用实时荧光定量PCR仪检测基因IL-1β、IL-6、iNOS、TNF-α、趋化因子10(interferoninducible protein-10,IP-10)和巨噬细胞炎症蛋白1(macrophage inflammatory protein-1,MIP-1)的表达量。
采用江泽波[18]、Yang Fan[19]等设计的引物对目标基因进行扩增,引物序列见表1,由南京金斯瑞生物科技有限公司合成。
1.3.3 巨噬细胞源性泡沫细胞模型的建立
将无菌载玻片放入6 孔细胞培养板中,每孔接种1.5 mL 1×105个/mL RAW264.7细胞,待细胞聚合程度达70%~80%后,每孔均加入50 μg/mL ox-LDL刺激细胞摄入脂质形成泡沫细胞。培养24 h后,弃去培养液,对照组加入含有0.1% DMSO的无血清培养液,实验组分别加入5、10 μmol/L和20 μmol/L尿石素A,继续孵育3 h。采用油红O染色,观察细胞内脂质摄入情况。具体操作如下:弃去上清液,每孔用预冷的PBS清洗3 遍,加入1 mL预冷的4%多聚甲醛,4 ℃固定30 min;弃去固定液,再次用PBS清洗3 次,每次5 min;每孔加入1.5 mL新鲜配制的油红O工作液(质量浓度为0.3 g/L),置于37 ℃水浴摇床振摇1 h;PBS洗3 遍,60%异丙醇迅速洗涤一次,将细胞置于PBS中,采用倒置显微镜观察拍照。
1.3.4 巨噬细胞源性泡沫细胞脂肪酸合成基因表达的测定
采用实时荧光定量PCR法,将1.5 mL 1×105个/mL RAW264.7细胞均匀接种于6 孔细胞培养板中,待细胞聚合程度达70%~80%,加入50 μg/mL ox-LDL刺激巨噬细胞形成泡沫细胞。培养24 h后,弃去培养液,对照组加入含有0.1% DMSO的无血清培养液,实验组分别加入5、10、20 μmol/L尿石素A,孵育3 h。根据1.3.2节实验步骤进行实时荧光定量PCR检测。
通过查找文献获得目标基因的引物(表2),由南京金斯瑞生物科技有限公司合成。

表2 目标基因引物序列Table 2 Primers for the target genes
1.3.5 巨噬细胞源性泡沫细胞胆固醇含量的测定
采用总胆固醇试剂盒收集培养液,在1 000 r/min离心10 min,取上清液进行测定;细胞用PBS清洗2 遍后,每孔加入100 μL 1% TritonX-100裂解液,4 ℃裂解30 min,直接用于胆固醇含量测定。另取50 µL细胞裂解液,按照BCA蛋白定量试剂盒说明测定其蛋白质量浓度。
1.4 数据处理与分析
每组实验重复3 次。采用软件GraphPad Prism 5.0和SPSS 17.0处理数据,结果以±s表示;用单因素方差分析(one-way ANOVA)进行多组间差异性分析。
2 结果与分析
2.1 RAW264.7细胞活性实验结果

图1 尿石素A对RAW264.7细胞活性的影响Fig. 1 Effect of Uro-A on RAW264.7 viability
MTT法检测结果如图1所示,当尿石素A和细胞共同培养3 h时,尿石素A浓度对细胞的活性没有显著性影响,巨噬细胞的存活率均在80%以上;当培养时间延长到6 h和12 h时,随着尿石素A浓度的增加,细胞存活率呈明显的下降趋势,与对照组相比,0~25 μmol/L尿石素A对细胞存活率没有显著性影响,而50、100 μmol/L尿石素A可以显著抑制巨噬细胞的增殖(P<0.05),100 μmol/L时的抑制率接近50%。因此,确定最佳培养时间为3 h,选取尿石素A作用浓度为5、10、20 μmol/L。
2.2 尿石素A对RAW264.7巨噬细胞M1型向M2型极化的作用
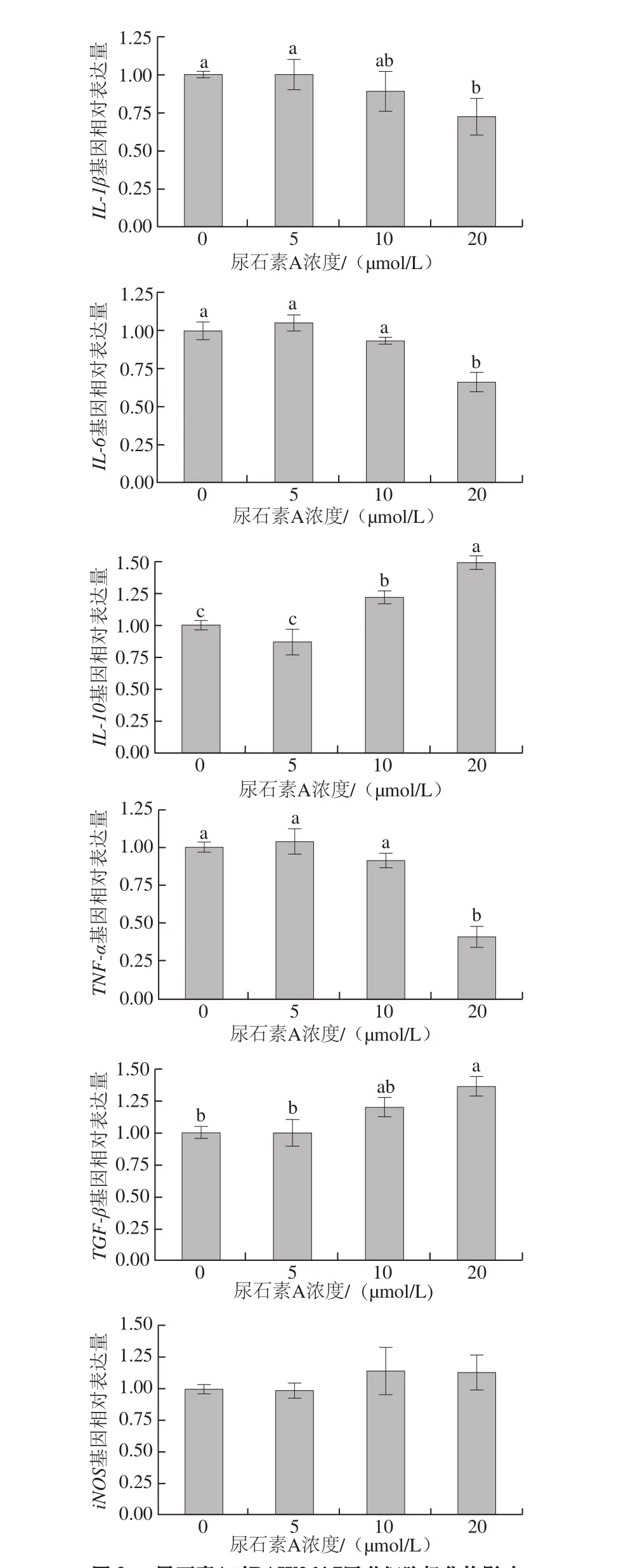
图2 尿石素A对RAW264.7巨噬细胞极化的影响Fig. 2 Effect of Uro-A on RAW264.7 macrophage polarization
如图2所示,尿石素A能够促进M2型巨噬细胞标志基因(IL-10和TGF-β)的表达,并具有剂量-效应关系,尤其当尿石素A浓度为20 μmol/L时,这两种基因的表达与对照组相比分别上调1.5 倍和1.4 倍。此外,尿石素A可以显著抑制M1型巨噬细胞标志基因(IL-1β、IL-6和TNF-α)表达(P<0.05),且抑制作用呈浓度依赖性;但对iNOS基因表达没有显著性影响。以上结果说明尿石素A能够改变巨噬细胞极化的分型,促进自然状态巨噬细胞向M2型极化。
2.3 尿石素A对LPS诱导的M1型巨噬细胞形成的影响

图3 尿石素A对LPS诱导的M1型巨噬细胞标志基因的影响Fig. 3 Effect of Uro-A on target gene expression in M1 macrophage induced by LPS
由图3可知,与对照组相比,LPS能够显著上调RAW264.7巨噬细胞M1型标志基因的表达(IL-1β、IL-6和TNF-α分别上调至4.5、1.5、1.3倍),诱导M1型巨噬细胞形成;而不同浓度的尿石素A能够通过降低3 种M1型标志基因的表达,干预LPS诱导的巨噬细胞极化。但是LPS仅略微提高iNOS表达,各实验组间没有显著性差异。
2.4 尿石素A对LPS诱导的基因IP-10和MIP-1表达的影响
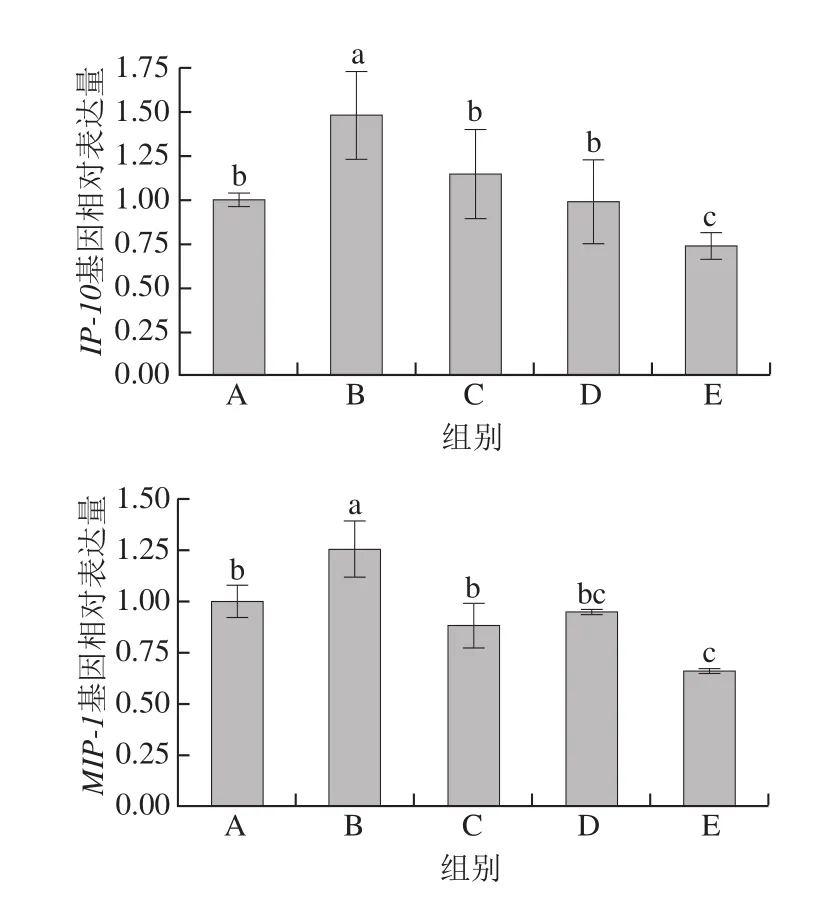
图4 尿石素A对LPS诱导的基因IP-10和MIP-1表达的影响Fig. 4 Effect of Uro-A on the expression of IP-10 and MIP-1 induced by LPS
IP-10和MIP-1在巨噬细胞炎症反应中具有重要的推动作用,因此下调基因IP-10和MIP-1的表达对巨噬细胞向M1型极化和形成泡沫细胞具有抑制作用。由图4可知,LPS诱导的基因IP-10和MIP-1表达显著上调,与对照组相比,两者表达量分别上升到1.5 倍和1.25 倍。加入尿石素A后,两种基因的表达量均受到明显抑制,且与尿石素A浓度呈正相关,说明尿石素A能够调控LPS诱导的巨噬细胞炎症反应。
2.5 尿石素A对ox-LDL诱导的巨噬细胞源性泡沫细胞形成的影响
根据油红O可将脂质染色的原理,在倒置显微镜下观巨噬细胞摄入ox-LDL形成泡沫细胞的情况。从图5A可以看出,对照组几乎没有泡沫细胞形成,单独加入50 μg/mL ox-LDL的巨噬细胞有近一半的比例摄入大量脂质,体积显著增大,转化为泡沫细胞(图5B),而加入不同浓度的尿石素A可以明显降低摄入脂质的巨噬细胞数量(图5C、D、E),以上结果说明ox-LDL与RAW264.7共同孵育能够刺激巨噬细胞转化为泡沫细胞,尿石素A表现出抑制泡沫细胞形成的作用。
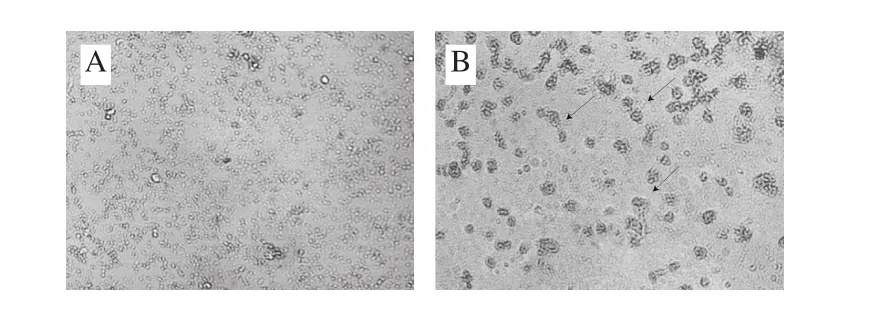
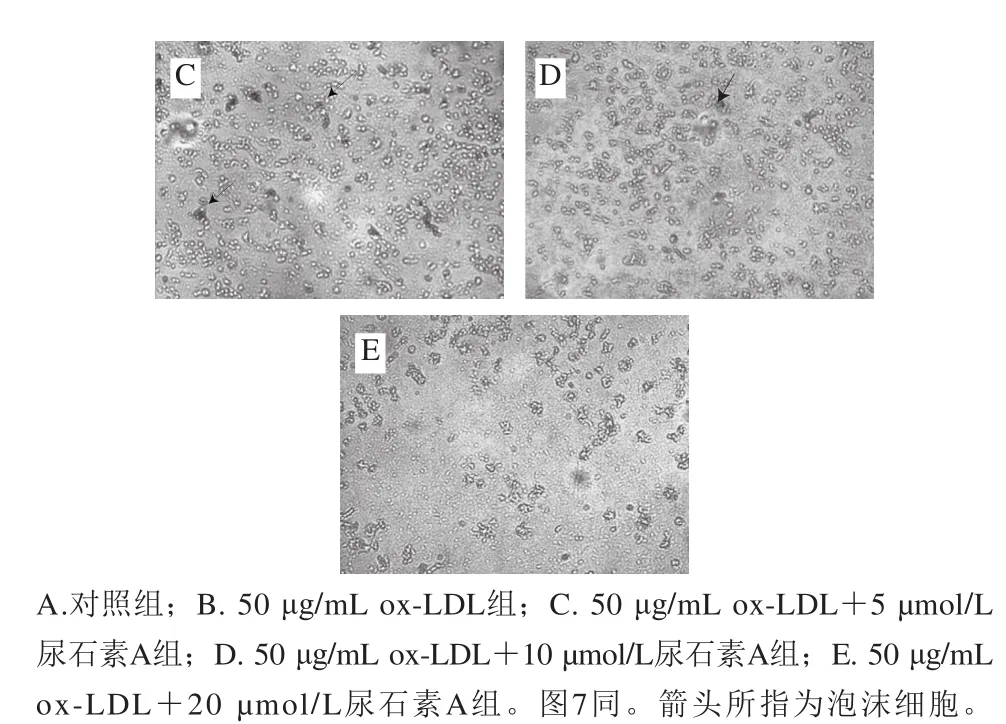
图5 油红O染色法检测尿石素A对巨噬-泡沫细胞形成的影响(×100)Fig. 5 Effect of Uro-A on macrophage-derived foam cell formation (× 100)
2.6 尿石素A对巨噬细胞源性泡沫细胞胆固醇代谢相关基因表达的影响

图6 尿石素A对巨噬细胞源性泡沫细胞胆固醇合成基因表达的影响Fig. 6 Effect of Uro-A on the gene expression related to cholesterol formation in macrophage-derived foam cells
利用实时荧光定量PCR检测巨噬-泡沫细胞中与胆固醇合成相关的基因表达结果,由图6可知,ox-LDL组胆固醇合成相关基因的表达和对照组(不添加药物,作为空白对照)具有显著差异(P<0.05),促进胆固醇合成的基因HMG-CoAR和FAS表达明显上调(与对照组相比,分别上调1.6 倍和1.3 倍),但随着尿石素A浓度增加,其表达量呈梯度降低趋势。此外,促进胞内胆固醇转化为高密度脂蛋白(high-density lipoprotein,HDL)的基因ABCA-1和ABCG-1在ox-LDL作用下转录水平显著降低(与对照组相比,分别下调0.5 倍和0.3 倍),其表达量与尿石素A浓度呈正相关。尤其当尿石素A浓度为20 µmol/L时,ABCA-1基因表达量可达对照组的2 倍。
2.7 尿石素A对巨噬细胞源性泡沫细胞胆固醇含量的影响
根据试剂盒检测步骤分别测定培养液和泡沫细胞中胆固醇的含量,通过胞内和胞外胆固醇含量的变化确定尿石素A在胆固醇合成过程中的作用。如图7所示,ox-LDL处理组泡沫细胞中胆固醇含量最高,与对照组巨噬细胞相比具有显著性差异(P<0.05);加入不同浓度的尿石素A后,胞内胆固醇含量有明显的下降趋势。不同浓度的尿石素A显著提高胞外胆固醇水平,20 µmol/L尿石素A使胆固醇流出量达到对照组的2.3 倍,与ox-LDL组相比显著增加(P<0.05)。以上结果说明尿石素A参与泡沫细胞胆固醇代谢的调控,具有促进胆固醇外排的作用。
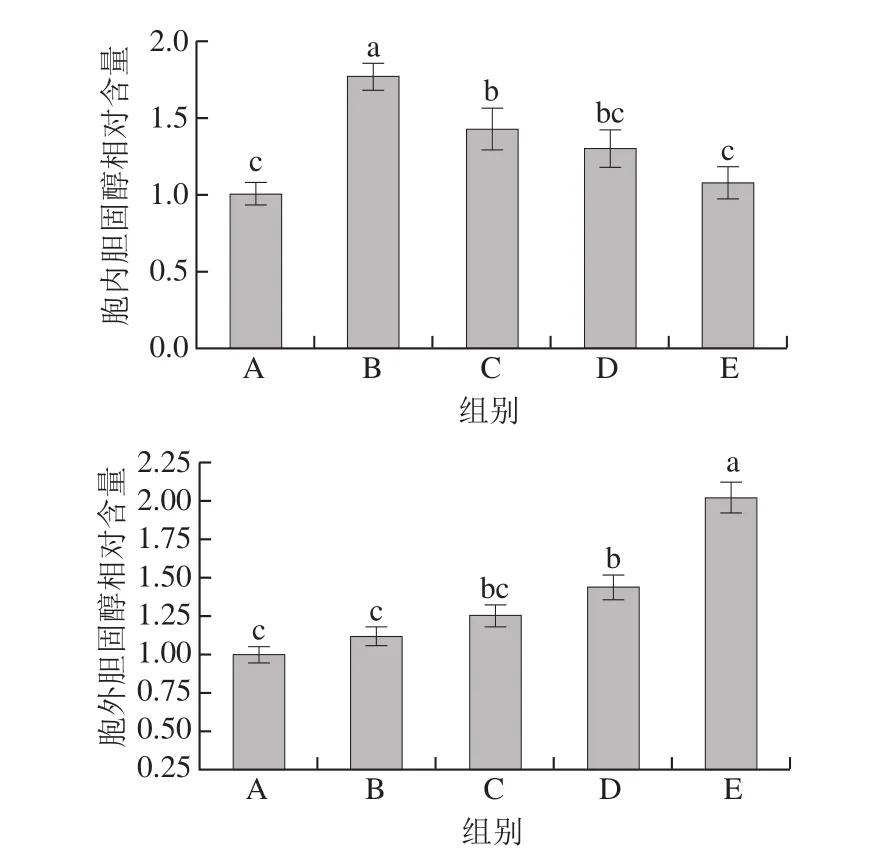
图7 尿石素A对巨噬细胞源性泡沫细胞胆固醇含量的影响Fig. 7 Effect of Uro-A on cholesterol concentration inside or outside macrophage-derived foam cells
3 讨 论
由于巨噬细胞不同分型(经典活化M1型和替代活化M2型)在动脉粥样硬化炎症反应及动脉硬化斑块稳定性方面具有不同作用,因此维持不同分型巨噬细胞平衡具有重要的意义。M1型巨噬细胞在推动动脉粥样硬化病理进程中发挥主要的作用,巨噬细胞M2/M1比值与ApoE基因缺乏小鼠斑块大小和稳定性成反比;不稳定斑块组织中主要以M1型巨噬细胞为主,而稳定斑块组织中M2型巨噬细胞比例增加[22]。Ml与M2型巨噬细胞的极化处于动态平衡中。IFN-γ和LPS可以诱导正常巨噬细胞向M1极化,而IL-4刺激巨噬细胞向M2型极化[23-24]。通过一定方式使巨噬细胞向M2型极化,在一定程度上可以体现出抗动脉硬化的作用。
近年来,已有大量干预巨噬细胞极化的药物被开发出来。血管紧张素受体阻断剂(angiotensin receptor blockers,ARB)与血管紧张素产生系统拮抗作用,显著抑制了小鼠肾脏巨噬细胞M1型形成,提高M2型巨噬细胞极化并下调M1型巨噬细胞分泌的促炎因子表达[25]。Shiho等[26]主要研究了替米沙坦,一种血管紧张素Ⅱ1型受体阻断剂和PPAR-γ激动剂,对高脂饲养的小鼠脂肪组织中巨噬细胞极化的作用。结果发现,替米沙坦可以减少脂肪细胞的大小,从而降低M1型巨噬细胞的数量;下调M1型巨噬细胞特征因子如TNF-α的表达,并显著上调CD163、CD209等M2型巨噬细胞特征因子的表达,使M1型巨噬细胞向M2型转化[27]。另一种PPAR-γ激动剂吡格列酮也可以通过减少M1型巨噬细胞数量提高M2/M1细胞数量的比值;此外,吡格列酮能够提高M2型标志基因IL-10的表达[28]。
应用天然产物和中药调控巨噬细胞的极化分型的研究也越加广泛。如参莲提取物可以抑制炎症发展以及动脉粥样硬化的进一步恶化,下调IFN-γ基因表达并降低LPS诱导的M1型RAW264.7巨噬细胞分泌的炎症因子IL-6、TNF-α和iNOS的转录水平[29]。陈方圆等[30]采用姜黄素干预LPS和IFN-γ诱导的M1型巨噬细胞,结果发现姜黄素不仅可以抑制M1型巨噬细胞分泌IL-1β和IL-6炎性因子,还能通过活化PPAR-γ上调巨噬细胞M2型标志基因KLF4、FIZZ1和MGL1的基因和蛋白表达,从而诱导M1型巨噬细胞向M2型极化。此外,姜黄素还能通过抑制细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2)激活以降低酪氨酸磷酸化,从而减弱了iNOS活性和NO产量,进一步揭示姜黄素抑制巨噬细胞炎症反应的作用[31]。本研究中,尿石素A显示出良好的抗炎活性。当尿石素A浓度为20 μmol/L时,可以显著抑制M1型巨噬细胞标志基因IL-1β、IL-6和TNF-α的表达;尿石素A浓度为10 µmol/L和20 µmol/L时,可以提高M2型巨噬细胞标志基因IL-10和TGF-β的转录水平,说明尿石素A能够促进巨噬细胞向M2型极化。同时,不同浓度的尿石素A梯度降低了LPS诱导的M1型巨噬细胞标志基因(IL-1β、IL-6和TNF-α)的表达,说明尿石素A还能够抑制促炎M1型巨噬细胞的形成。此外,尿石素A对炎症因子IP-10和MIP-1的基因表达也有显著抑制作用。
巨噬细胞吞噬大量脂质形成泡沫细胞被认为是动脉粥样硬化发生和发展过程中重要的始动环节,因此,抑制巨噬-泡沫细胞的形成对防治动脉粥样硬化具有重要的意义。研究表明他汀类药物以及普罗布考、罗格列酮等降血脂药物可以显著降低巨噬-泡沫细胞以及兔动脉粥样硬化模型中胆固醇和甘油三酯的含量,减轻细胞泡沫化程度[32-37]。考虑到此类药物具有一定的副作用,开发新型替代药物已成为目前研究的热点。芍药醇是中药牡丹皮抗炎的功效成分,研究表明芍药醇通过调控LXRα/ABCA1信号转导途径降低巨噬-泡沫细胞中总胆固醇含量,还能加强ApoE基因敲除小鼠血清中ABCA-1蛋白表达和胆固醇外流,并明显减小动脉硬化斑块面积[38]。王帅等[39]发现表松脂醇能够减少ox-LDL诱导的RAW264.7巨噬细胞中胆固醇累积,并能显著增强基因ABCA-1、ABCG-1、PPAR-γ和LXRα的表达,且上调ABCA-1和ABCG-1的作用明显强于罗格列酮(P<0.01)。本研究发现不同浓度的尿石素A能够显著降低泡沫细胞的数量,减少巨噬细胞泡沫化程度,并且能够梯度降低胆固醇合成基因HMG-CoAR和FAS的转录水平,从而抑制ox-LDL诱导的泡沫细胞形成;显著上调基因ABCA-1和ABCG-1表达,而这两种基因的转录水平与胆固醇排出呈正相关。
综上所述,尿石素A不仅能够有效地调控巨噬细胞极化分型,还具有抑制巨噬-泡沫细胞形成的作用。以上结果间接地揭示了尿石素A具有潜在的抗动脉硬化的作用,为之后深入研究提供了理论参考。
[1] 周冰冰, 李玉洁, 李琦, 等. 巨噬细胞极化及其在动脉粥样硬化发生发展中的作用[J]. 世界科学技术: 中医药现代化, 2014(5): 1168-1173. DOI:10.11842/wst.2014.05.039.
[2] DAI M, WU L, HE Z, et al. Epoxyeicosatrienoic acids regulate macrophage polarization and prevent LPS-induced cardiac dysfunction[J]. Journal of Cellular Physiology, 2015, 230(9): 2108-2119. DOI:10.1002/jcp.24939.
[3] GIULIA C, BART S. Macrophage polarization in metabolic disorders: functions and regulation[J]. Current Opinion in Lipidology, 2011, 22(5): 365-372. DOI:10.1097/MOL.0b013e32834a77b4.
[4] SICA A, MANTOVANI A. Macrophage plasticity and polarization: in vivo veritas[J]. Journal of Clinical Investigation, 2012, 122(3): 787-795. DOI:10.1172/JCI59643.
[5] KHAL-LOULASCHET J, VARTHAMAN A, FORNASA G, et al. Macrophage plasticity in experimental atherosclerosis[J]. PLoS ONE, 2010, 5(1): 8852-8861. DOI:10.1371/journal.pone.0008852.
[6] BOULLIER A, BIRD D, CHANG M, et al. Scavenger receptors, oxidized LDL, and atherosclerosis[J]. Annals of the New York Academy of Sciences, 2001, 947: 214-223. DOI:10.1111/j.1749-6632.2001.tb03943.x.
[7] BLOCH K. Sterol molecule: structure, biosynthesis, and function[J]. Steroids, 1992, 57(8): 378-383. DOI:10.1016/0039-128X(92)90081-J.
[8] 靳飞鹏, 马双陶, 杨永健. 游离脂肪酸与动脉粥样硬化[J]. 西南军医, 2013(2): 225-228. DOI:10.3969/j.issn.1672-7193.2013.02.040.
[9] 汪玮琳, 谢云. 泡沫细胞形成与动脉粥样硬化发生机制的研究进展[J]. 继续医学教育, 2015(4): 68-72. DOI:10.3969/ j.issn.1004-6763.2015.04.044.
[10] SALA R, MENA P, SAVI M, et al. Urolithins at physiological concentrations affect the levels of pro-inflammatory cytokines and growth factor in cultured cardiac cells in hyperglucidic conditions[J]. Journal of Functional Foods, 2015, 15: 97-105. DOI:10.1016/ j.jff.2015.03.019.
[11] PIWOWARSKI J, KISS A, GRANICA S, et al. Urolithins, gut microbiota-derived metabolites of ellagitannins, inhibit LPS-induced inflammation in RAW 2647 murine macrophages[J]. Molecular Nutrition & Food Research, 2015, 59(11): 2168-2177. DOI:10.1002/ mnfr.201500264.
[12] 尹培培, 闫林林, 曹若愚, 等. 鞣花酸代谢产物: 尿石素的研究进展[J].食品科学, 2015, 36(7): 256-260. DOI:10.7506/spkx1002-6630-201507047.
[13] PIWOWARSKI J, SEBASTIAN G, KISS A. Influence of gut microbiota-derived ellagitannins’ metabolites urolithins on proinflammatory activities of human neutrophils[J]. Planta Medica, 2014, 80(11): 887-895. DOI:10.1055/s-0034-1368615.
[14] GIMENEZ-BASTIDA J, GONZALEZ-SARRIAS A, LARROSA M, et al. Ellagitannin metabolites, urolithin A glucuronide and its aglycone urolithin A, ameliorate TNF-alpha-induced inflammation and associated molecular markers in human aortic endothelial cells[J]. Molecular Nutrition & Food Research, 2012, 56(5): 784-796. DOI:10.1002/mnfr.201100677.
[15] ISHIMOTO H, SHIBATA M, MYOJIN Y, et al. In vivo antiinflammatory and antioxidant properties of ellagitannin metabolite urolithin A[J]. Bioorganic & Medicinal Chemistry Letters, 2011, 21(19): 5901-5904. DOI:10.1016/j.bmcl.2011.07.086.
[16] KANG I, KIM Y, TOMáS-BARBERÁN F, et al. Urolithin A, C and D, but not iso-urolithin A and urolithin B, attenuate triglyceride accumulation in human cultures of adipocytes and hepatocytes[J]. Molecular Nutrition & Food Research, 2016, 60(5): 1129-1138. DOI:10.1002/mnfr.201500796.
[17] MELE L, MENA P, PIEMONTESE A, et al. Antiatherogenic effects of ellagic acid and urolithins in vitro[J]. Archives of Biochemistry and Biophysics, 2016, 559: 42-50. DOI:10.1016/j.abb.2016.02.017.
[18] 江泽波, 黄闰月, 张娴, 等. 猪苓多糖对M1型巨噬细胞细胞因子表达的调节作用[J]. 细胞与分子免疫学杂志, 2014, 30(10): 1030-1033. DOI:10.13423/j.cnki.cjcmi.007114.
[19] YANF Fan, BAI Yujing, JIANG Yanrong. Effects of Apelin on RAW264.7 cells under both normal and hypoxic conditions[J]. Peptides, 2015, 69: 133-143. DOI:10.1016/j.peptides.2015.04.025.
[20] ZHANG Q, MA A, SONG Z, et al. Nifedipine enhances cholesterol efflux in RAW2647 macrophages[J]. Cardiovascular Drugs and Therapy, 2013, 27(5): 425-431. DOI:10.1007/s10557-013-6472-y.
[21] 张晾, 张燕燕, 叶玲敏, 等. 多不饱和脂肪酸饮食对载脂蛋白E缺失小鼠含载脂蛋白B100脂蛋白代谢的影响[J]. 生物化学与生物物理进展, 2015, 42(9): 843-849. DOI:10.16476/j.pibb.2015.0118.
[22] MATTHIJSEN R, WINTHER M, DIAN K, et al. Macrophage-specific expression of mannose-binding lectin controls atherosclerosis in lowdensity lipoprotein receptor-deficient mice[J]. Circulation, 2009, 119(16): 2188-2195. DOI:10.1161/CIRCULATIONAHA.108.830661. [23] MANTOVANI A, SICA A, SOZZANI S, et al. The chemokine system in diverse forms of macrophage activation and polarization[J]. Trends in Immunology, 2004, 25(12): 677-686. DOI:10.1016/j.it.2004.09.015. [24] MODOLELL M, CORRALIZA I, SOLER G, et al. Reciprocal regulation of the nitric oxide synthasearginase balance in mouse bone marrow-derived macrophages by TH1 and TH2 cytokines[J]. European Journal of Immunology, 1995, 25(4): 1101-1104. DOI:10.1002/ eji.1830250436.
[25] AKI K, SHIMIZU A, MASUDA Y, et al. ANG II receptor blockade enhances anti-inflammatory macrophages in anti-glomerular basement membrane glomerulonephritis[J]. American Journal of Physiology Renal Physiology, 2010, 298(4): 870-882. DOI:10.1152/ ajprenal.00374.2009.
[26] SHIHO F, ISAO U, YUKIKO K, et al. Telmisartan improves insulin resistance and modulates adipose tissue macrophage polarization in high-fat-fed mice[J]. Engineering Mechanics, 2011, 152(5): 1789-1799. DOI:10.1210/en.2010-1312.
[27] 周宪宾, 姚成芳. 巨噬细胞M1/M2极化分型的研究进展[J]. 中国免疫学杂志, 2012, 28(10): 957-960. DOI:l0.3969/j.issn.l000-484X.20l2. l0.022.
[28] FUJISAKA S, USUI I, BUKHARI A, et al. Regulatory mechanisms for adipose tissue M1 and M2 macrophages in diet-induced obese mice[J]. Diabetes, 2009, 58(11): 2574-2582. DOI:10.2337/db08-1475.
[29] 周冰冰, 李玉洁, 李琦, 等. 参莲提取物对巨噬细胞的影响[J]. 中国中药杂志, 2014, 39(11): 2086-2090. DOI:10.4268/cjcmm20141128.
[30] 陈方圆, 袁祖贻, 周娟, 等. 姜黄素促进 RAW264.7源性M1巨噬细胞向替代激活M2表型极化[J]. 西安交通大学学报(医学版), 2015(2): 257-262. DOI:10.7652/jdyxb201502022.
[31] BEN P, LIU J, LU C, et al. Curcumin promotes degradation of inducible nitric oxide synthase and suppresses its enzyme activity in RAW 2647 cells[J]. International Immunopharmacology, 2011, 11(2): 179-186. DOI:10.1016/j.intimp.2010.11.013.
[32] 成小凤, 刘小燕, 宋凌鲲, 等. 阿托伐他汀钙调节PPARγ和NF-κB活性参与巨噬细胞泡沫化的形成[J]. 南方医科大学学报, 2014(6): 896-900. DOI:10.3969/j.issn.1673-4254.2014.06.28.
[33] 李晨光, 罗俊生, 冯旭, 等. 辛伐他汀对THP-1巨噬细胞源性泡沫细胞胆固醇代谢和SR-A表达的影响[J]. 山东医药, 2011, 51(17): 22-24. DOI:10.3969/j.issn.1002-266X.2011.17.011.
[34] 范永臻, 郭志刚, 王振坤, 等. 罗格列酮对动脉粥样硬化兔高密度脂蛋白的影响[J]. 实用医学杂志, 2010, 26(9): 1508-1512. DOI:10.3969/j.issn.1006-5725.2010.09.015.
[35] 李雪霞, 于晓玲. 阿托伐他汀对动脉粥样硬化模型兔Wnt/β-连环蛋白信号通路的影响研究[J]. 中国药房, 2012(5): 405-407. DOI:10.6039/j.issn.1001-0408.2012.05.08.
[36] 王丽霞, 黄彦生, 罗萍, 等. 普罗布考对小鼠体内巨噬细胞胆固醇逆转运的影响及其作用机制[J]. 中华老年心脑血管病杂志, 2013, 15(1): 74-76. DOI:10.3969/j.issn.1009-0126.2013.01.023.
[37] 蒙颖, 徐芳, 王志禄, 等. 罗格列酮对泡沫细胞中胆固醇贮存与运输相关蛋白ACAT-1、ABCA-1表达的影响[J]. 第三军医大学学报, 2012, 34(22): 2288-2291. DOI:10.16016/j.1000-5404.2012.22.034.
[38] ZHAO J, LEU S, SHYUE S, et al. Novel effect of paeonol on the formation of foam cells: promotion of LXRα-ABCA1-dependent cholesterol efflux in macrophages[J]. American Journal of Chinese Medicine, 2013, 41(5): 1079-1096. DOI:10.1142/ S0192415X13500730.
[39] 王帅, 刘明玥, 张雪, 等. 表松脂醇抑制巨噬细胞泡沫化的作用及潜在机制研究[J]. 中草药, 2015, 46(18): 2737-2742. DOI:10.7501/ j.issn.0253-2670.2015.18.012.
Effect of Urolithin A on Macrophage Polarization and the Formation of Macrophage-Derived Foam Cells
This research was designed to investigate the potential anti-atherogenic effect of urolithin A on macrophage polarization and the formation of macrophage derived-foam cells as well as the underlying molecular mechanisms. It was found that urolithin A could mediate the mRNA expression of different marker genes in M1-type and natural macrophages, indicating its ability to inhibit the polarization of macrophage cell line (RAW264.7) into pro-inflammatory M1-type macrophage and to promote the polarization of macrophage cells into M2 type. The results of oil red O staining revealed that urolithin A inhibited the formation of foam cells derived from macrophages. Real time PCR showed that urolithin A also markedly decreased the expression of 3-hydroxy-3-methylglutaryl coenzyme A reductase and fatty acid synthase at the transcriptional level. Besides, urolithin A was capable of up-regulating the mRNA expression of the ATP-binding cassette transporters A1 and G1, which was positively associated with macrophage cholesterol efflux. In summary, the findings confirmed the essential role urolithin A plays in macrophage polarization, and further demonstrated the potential molecular mechanisms of urolithin A in preventing foam cell formation and cholesterol synthesis, which are of great significance in investigating and understanding the anti-atherogenic effect of urolithin A in the future.
urolithin A (Uro-A); macrophage polarization; foam cells; cholesterol; atherosclerosis
10.7506/spkx1002-6630-201713030
TS201.4
A
1002-6630(2017)13-0182-08
2016-05-30
教育部“新世纪优秀人才支持计划”项目(NCET-13-0488);“十二五”国家科技支撑计划项目(2015BAD16B08);北京市食品营养与人类健康高精尖创新中心项目(201502910110942);中央高校基本科研业务费专项资金项目(2452017146)
韩淇安(1989—),女,博士,研究方向为天然活性物质与人类健康。E-mail:hqa0530@163.com
*通信作者:夏效东(1981—),男,教授,博士,研究方向为天然活性物质的营养及抗菌功能。E-mail:foodscixiaodong@yahoo.com
韩淇安, 刘红燕, 闫春红, 等. 尿石素A对巨噬细胞极化及巨噬-泡沫细胞形成的作用[J]. 食品科学, 2017, 38(13): 182-189. DOI:10.7506/spkx1002-6630-201713030. http://www.spkx.net.cn
HAN Qi’an, LIU Hongyan, YAN Chunhong, et al. Effect of urolithin A on macrophage polarization and the formation of macrophage-derived foam cells[J]. Food Science, 2017, 38(13): 182-189. (in Chinese with English abstract)
10.7506/ spkx1002-6630-201713030. http://www.spkx.net.cn
HAN Qi’an1,2, LIU Hongyan3, YAN Chunhong4, SHI Chao1, XIA Xiaodong1,*
(1. College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China; 2. Beijing Advanced Innovation Center for Food Nutrition and Human Health, College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China; 3. Dingxing Hospital, Dingxing 072650, China; 4. School of Life Science and Technology, Xi’an Jiaotong University, Xi’an 710049, China)
