沙米麸皮和外胚乳分离蛋白的理化及功能性质
2017-07-24章梦琦邢梦珂陈国雄南京农业大学食品科技学院江苏南京0095中国科学院寒区旱区环境与工程研究所甘肃兰州730000
彭 菁,章梦琦,邢梦珂,陈国雄,刘 檀,屠 康,*(.南京农业大学食品科技学院,江苏 南京 0095;.中国科学院寒区旱区环境与工程研究所,甘肃 兰州 730000)
沙米麸皮和外胚乳分离蛋白的理化及功能性质
彭 菁1,章梦琦1,邢梦珂1,陈国雄2,刘 檀1,屠 康1,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.中国科学院寒区旱区环境与工程研究所,甘肃 兰州 730000)
利用碱提-等电点沉淀技术分别从沙米麸皮和去皮沙米中提取出沙米麸皮分离蛋白(B-pro)和外胚乳分离蛋白(S-pro),研究这两种蛋白的理化及功能性质。结果表明,沙米麸皮中蛋白以球蛋白为主,而去皮沙米中以清蛋白为主。B-pro和S-pro纯度分别为94.33%、91.80%(md),S-pro颜色更白。两种蛋白均含有丰富的必需氨基酸,且S-pro中Lys含量较高。B-pro和S-pro的功能性质随pH值的变化均符合植物蛋白的一般规律,总体而言,不同pH值条件下S-pro的功能性均优于B-pro。与大豆分离蛋白和鸡蛋蛋白相比,B-pro和S-pro的持油能力及发泡性较好,而溶解性、持水力及乳化性较弱。
沙米;麸皮蛋白;外胚乳蛋白;理化性质;功能特性Abstract: Protein isolates from bran (B-pro) and perisperm (S-pro) of sand rice seeds (Agriophyllum squarrosum) were obtained by alkali extraction/isoelectric precipitation, and their physicochemical and functional properties were evaluated in this study. The results indicated that albumin was higer in the bran, and globulin was higer in the perisperm. The protein contents of B-pro and S-pro were 94.33% (md) and 91.80% (md), respectively and the color of S-pro was more brighter and whiter. Both B-pro and S-pro were rich in essential amino acids and the content of lysine in S-pro was higher than that in B-pro. The functional properties of the two protein isolates were greatly pH dependent like other plant proteins. In general, most of the functional properties of S-pro were superior to those of B-pro at different pH values. Compared to soybean protein isolate (SPI) and egg protein (EP), B-pro and S-pro showed better oil-holding capacity and foaming capacity at pH 7.0, but poorer solubility, water-holding capacity and emulsification capacity.
彭菁, 章梦琦, 邢梦珂, 等. 沙米麸皮和外胚乳分离蛋白的理化及功能性质[J]. 食品科学, 2017, 38(13): 71-76. DOI:10.7506/spkx1002-6630-201713012. http://www.spkx.net.cn
PENG Jing, ZHANG Mengqi, XING Mengke, et al. Physiochemical and functional properties of protein isolates prepared from bran and perisperm of sand rice seeds (Agriophyllum squarrosum)[J]. Food Science, 2017, 38(13): 71-76. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201713012. http://www.spkx.net.cn
沙米(Agriophyllum squarrosum(L.)Moq.)是藜科一年生的沙生植物,在我国西北、华北、东北的流动和半流动沙漠地区大量分布[1-2]。沙米种子近圆形,两面扁平或背部稍凸,胚环形,双子叶,环绕着富含淀粉的外胚乳[3]。沙米在我国民间有1 300多年的采食历史,蒙医认为沙米具有祛疫、清热、解毒、利尿、降糖等功效[4-5]。近年来,有学者提出沙米是应对全球气候变暖粮食减产背景下的潜在粮食作物[6-7]。沙米种子中蛋白含量丰富,平均在21%左右,蛋白功效比值、真消化率、生物价和净利用率分别为0.938、9.21%、87.33%和71.31%,氨基酸组成较全面,富含必需氨基酸,尤其是Lys[8],因此,沙米蛋白是一种良好的植物蛋白来源。植物蛋白能够被提取、加工制成分离蛋白,加入产品中不仅能够影响食品的营养价值,其溶解性、乳化发泡性等功能特性也会影响最终产品的颜色、质构等感官品质[9-10]。目前,关于沙米种子蛋白组成及功能特性的研究鲜见报道。由于种子麸皮蛋白与脱皮种子的蛋白组成及功能性往往存在差异[11],且沙米在食用时又经常需要脱皮处理,因此分别从沙米麸皮(主要由种皮、胚乳和胚组成)和去皮沙米(主要是沙米的外胚乳)中提取其麸皮分离蛋白(B-pro)和外胚乳分离蛋白(S-pro),分别研究这两种分离蛋白的理化及功能性质,旨在为更好地了解蛋白在沙米中的分布、组成及功能性差异情况提供有效信息以及为沙米的综合开发利用提供理论参考。
1 材料与方法
1.1 材料与试剂
沙米种子由中国科学院寒区旱区环境与工程研究所2015年12月提供,4 ℃条件下储藏备用。清理干净后脱皮,获得麸皮与去皮沙米,粉碎。用正己烷(1∶3,m/V)脱脂3 次,每次8 h,除去溶剂后在通风橱中放置24 h,挥干溶剂,备用。
所用试剂均为分析化学纯。
1.2 仪器与设备
Avanti J-30I高速冷冻离心机 美国贝克曼公司;CR-13色差计 日本柯尼卡美能达公司;全自动凯氏定氮仪 丹麦FOSS公司;STAR System差示扫描量热仪(differential scanning calorimeter,DSC) 瑞士梅特勒-托利多公司;L-8900全自动氨基酸分析仪、F-7000荧光分光光度计 日本日立公司;T25数显匀浆机 德国IKA公司;UV1800紫外-可见分光光度计 日本岛津公司。
1.3 方法
1.3.1 蛋白提取
参考Föste等[12]的方法并作少量修改。分别取适量的脱脂麸皮(1∶20,m/V)、脱脂外胚乳(1∶10,m/V)于去离子水中,用1 mol/L NaOH溶液调节pH值至9,25 ℃条件下搅拌提取1 h,4 ℃、8 000×g离心20 min,取上清液;将残渣重新溶解,重复提取一次,合并上清液。然后用1 mol/L HCl分别调节pH值至各自等电点(预实验测得麸皮、外胚乳中蛋白等电点分别为pH 5.0和pH 4.8),离心。将沉淀重新溶于去离子水中,调节pH值至7,冻干后4 ℃条件下保藏备用。
1.3.2 蛋白颜色测定
采用L*,a*,b*表征蛋白的颜色,L*值代表亮度;a*值代表红绿,a*值越大颜色越红;b*值代表黄蓝,b*值越大表示颜色越黄。白度(whiteness index,WI)参考Shevkani等[13]的方法计算,见公式(1)。

1.3.3 表面疏水度的测定
通过荧光探针法测定蛋白的表面疏水度[14]。将待测蛋白样品溶于10 mmol/L磷酸缓冲液(pH 7)中,调节蛋白质量浓度为0.01~0.10 mg/mL。分别移取4 mL蛋白溶液,添加20 μL 8 mmol/L 8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)储液(10 mmol/L pH 7磷酸缓冲液配制),混匀,避光反应20 min,采用荧光分光光度仪测定样品的荧光强度。激发波长为370 nm,发射波长为470 nm,激发和发散狭缝宽均为10 nm。以荧光强度对蛋白质质量浓度作图,其初始阶段的斜率作为蛋白质的表面疏水度。
1.3.4 热性质的测定
参考Shevkani等[9]的方法采用DSC测定,并稍作修改。称取2.0 mg样品,倒入坩埚中,加10 μL去离子水,将坩埚密封起来,4 ℃条件下平衡24 h,测定前在室温条件下平衡1 h。测定条件为:以空坩埚作对照,初始温度20 ℃,以10 ℃/min升温至120 ℃,N2流量为40 mL/min。记录淀粉糊化过程中的相变起始温度(T0)、峰值温度(Tp)和终止温度(Tc),以及热焓值(ΔHg)。
1.3.5 蛋白溶解度的测定
蛋白溶解度的测定参考文献[13]。分别配制1 g/100 mL的蛋白悬浮液25 mL,调节pH值至2、4、5、7、9,室温条件下搅拌1 h,8 000×g离心20 min,取上清液,利用凯氏定氮测定上清液中氮含量m1/mg及样品中氮含量m0/ mg。溶解度计算公式如(2)所示。

1.3.6 蛋白持水力的测定
蛋白持水力的测定参照文献[15]。取0.1 g分离蛋白(m0),分别加入1 mL pH 2、4、5、7、9的磷酸-柠檬酸缓冲液,用涡旋仪混匀,4 ℃条件下平衡过夜。8 000×g离心20 min,倒掉上清液,45 ℃条件下倒扣10 min流干,称质量m1/g,105 ℃条件下烘干至恒质量m2/g。持水力计算公式如(3)所示。
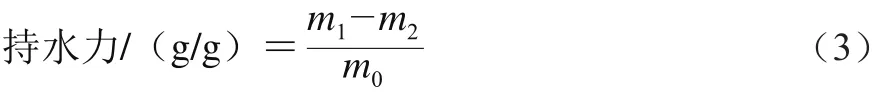
1.3.7 蛋白持油能力测定
蛋白持油能力的测定参照文献[15]。取0.1 g分离蛋白(m0),放入1.5 mL离心管(m1/g)中,加1 mL葵花籽油,用涡旋仪混匀,4 ℃条件下过夜。8 000×g离心20 min,倒掉上层油脂,45 ℃条件下倒扣20 min流干,称质量m2/g。持油能力计算公式如(4)所示。
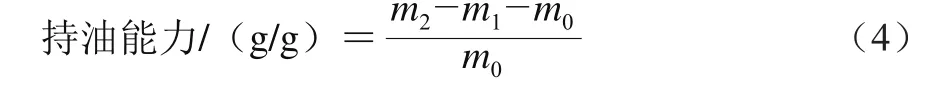
1.3.8 蛋白乳化活性和乳化稳定性测定
蛋白乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)的测定参照文献[13]。取0.21 g蛋白放入50 mL烧杯中,加入21 mL蒸馏水液和7 mL葵花籽油,涡旋混匀,调节pH 2、4、5、7、9,20 000 r/min高速分散1 min。分别在均质后0、10 min从离心管底部取100 μL乳状液,加入10 mL 0.1% SDS溶液摇匀,在500 nm波长处测定吸光度。EAI、ESI计算公式如(5)、(6)所示。

式中:A0为0 min时吸光度;T为浊度(2.303);DF为稀释倍数;ρ为蛋白质量浓度/(g/mL);φ为油在乳状液中的比例(0.25);At为放置10 min后吸光度;Δt为时间差/min。
1.3.9 蛋白发泡能力和发泡稳定性测定
蛋白发泡能力(foaming capability,FC)和发泡稳定性(foaming stability,FS)的测定参照文献[13]。分别配制1.00%的蛋白悬浮液30 mL,放入50 mL规格统一的烧杯中,调节pH值至2、4、5、7、9,平衡2 h,测定初始高度H0/mm。15 000 r/min高速剪切2 min,立即测定总高度H1/mm,30 min后再次测定总高度H2/mm。FC和FS计算公式如(7)、(8)。

2 结果与分析
2.1 沙米麸皮和外胚乳中蛋白含量及组成

表1 麸皮和外胚乳中清蛋白、球蛋白、醇溶蛋白、谷蛋白以及残渣蛋白相对含量Table 1 Contents of albumin, globulin, gliadin, glutelin and residual protein in bran and perisperm of sand rice %
脱皮过程中沙米环状胚容易脱落成为麸皮的一部分,沙米的麸皮率高达46%。麸皮中蛋白含量为33.60%,绝对含量占沙米总蛋白的70%以上。外胚乳中蛋白含量虽然有所下降(13.06%),但仍然高于大部分谷物。根据溶解性可以将蛋白分为清蛋白、球蛋白、醇溶蛋白、谷蛋白以及残渣蛋白,清蛋白和球蛋白往往有较好的水溶性,而醇溶蛋白溶于70%~80%乙醇溶液,谷蛋白溶于稀碱溶液[16-17]。沙米麸皮和外胚乳中蛋白组成如表1所示,麸皮中以球蛋白(40.59%)、清蛋白(30.21%)为主,谷蛋白为18.61%;外胚乳中以清蛋白(55.62%)和谷蛋白(24.04%)为主,球蛋白含量仅为14.57%;醇溶蛋白含量均很少。因此,将麸皮和外胚乳中的蛋白分开研究具有现实意义。另外,虽然沙米富含淀粉,食用方式与谷物相似,但高含量的清蛋白和球蛋白以及低含量的醇溶蛋白和谷蛋白表明沙米蛋白组成可能更接近豆类蛋白。
2.2 沙米B-pro和S-pro理化性质
2.2.1 沙米B-pro和S-pro颜色及纯度

表2 沙米B-pro和S-pro颜色及纯度Table 2 Color and purity of protein isolates from bran and perisperm of sand rice
Cordero-de-los-Santos等[18]发现脱脂可以使苋菜籽蛋白的纯度达到93.1%。因此,本研究中B-pro及S-pro提取前进行了脱脂。如表2所示,B-pro和S-pro的蛋白含量分别为94.33%和91.80%,达到了商业分离蛋白90%的纯度要求[13]。S-pro纯度稍低于B-pro,可能是由于外胚乳中含有大量的小颗粒淀粉(1 μm左右)。小颗粒淀粉易与蛋白形成紧密的复合体,难以分离[19]。B-pro和S-pro的L*值即亮度差异不明显,B-pro b*值高于S-pro,白度低于S-pro,说明B-pro颜色偏黄偏暗,较高的b*值可能与较高的灰分含量有关[9]。另外,酚类物质能够与蛋白交联,在提取过程中与蛋白一起被提取出从而影响到蛋白的颜色[20]。叶润等[21]从葡萄籽中分离蛋白时发现,预先除去酚类物质可以获得白色蛋白粉。
2.2.2 沙米B-pro和S-pro氨基酸分析
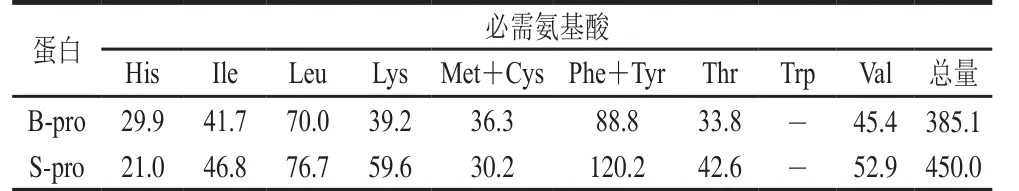
表3 B-pro和S-pro必需氨基酸组成分析Table 3 Comparison of essential amino acid composition of B-pro and S-pro mg/g pro
如表3所示,B-pro和S-pro均含有较高的必需氨基酸。S-pro中Ile、Leu、Lys、Phe+Tyr、Val含量及必需氨基酸总量高于B-pro,His、Met+Cys含量低于B-pro。与大米、小麦和大豆相比,S-pro中Lys含量较高,接近于大豆蛋白中Lys含量,尽管B-pro中Lys低于S-pro,但其含量仍然高于大部分谷物蛋白[22-23]。Lys是谷物中的第一限制氨基酸,因此与其他谷物相比,沙米蛋白氨基酸更加平衡,可以将沙米与谷物混合食用,提高蛋白利用率。
2.2.3 沙米B-pro和S-pro表面疏水度
表面疏水性是蛋白质重要的理化特性之一,表示蛋白质分子与水之间的互相排斥作用;热力学上代表非极性物质溶解在水中所需的能量高低,或者该物质在水相中自聚集的趋势大小[24]。中性条件下(pH 7),B-pro的表面疏水度(370.53)为S-pro(234.48)的1.58 倍左右,表明B-pro含有更多的暴露的疏水性基团,这是可能是由于B-pro中球蛋白含量高于S-pro。梁晗妮[24]研究认为蛋白质中球蛋白的比例越高,其表面疏水度越大,并解释为球蛋白的表面疏水度高于清蛋白。
2.3 沙米B-pro和S-pro的功能特性
2.3.1 沙米B-pro和S-pro的溶解性

图1 pH值对B-pro和S-pro蛋白溶解度的影响Fig. 1 Effect of pH on solubility of B-pro and S-pro
溶解性是植物蛋白质最重要的一个功能特性,其他的功能特性如乳化性、起泡性等都与溶解性有关[25]。蛋白质的溶解性除与本身的氨基酸组成和结构有关外,还与溶液的pH值、温度、离子强度、提取方式等有着密切联系[26]。B-pro和S-pro在pH 2~9范围内的溶解性变化如图1所示,在等电点(pH 5)附近时两者的溶解度最低,远离等电点后迅速增加,在碱性环境和强酸性环境下均有较好溶解性,变化趋势呈V字型,符合植物蛋白的溶解规律。理论上,在相同pH值条件下,S-pro的溶解性要高于B-pro,因为S-pro清蛋白含量较高,表面疏水度低,水化作用较强,溶解性应当较好[27]。但实验结果发现S-pro和B-pro的溶解性差异不明显,这可能与提取过程清蛋白发生变性有关。有研究表明,变性温度在60~70 ℃之间的蛋白主要是清蛋白,11S球蛋白变性温度在95 ℃左右[9]。蛋白质变性与其焓值的变化是伴随发生的[28]。通过DSC检测发现,B-pro和S-pro这两种蛋白仅在98 ℃附近检测到吸热峰,且B-pro的变性焓值是S-pro 2 倍多,说明B-pro和S-pro提取过程中,清蛋白均发生了不可逆的变性,而球蛋白较稳定。另外,B-pro在98 ℃附近的变性焓较高与B-pro中球蛋白含量较高这一结果相吻合。
2.3.2 沙米B-pro和S-pro的持水力
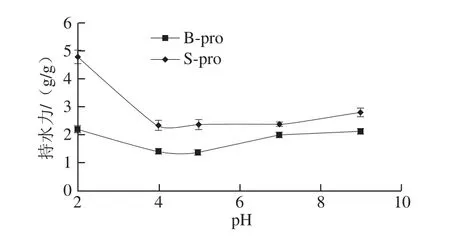
图2 pH值对B-pro和S-pro蛋白持水力的影响Fig. 2 Effect of pH on water-holding capability of B-pro and S-pro
持水力主要由蛋白的纯度及不溶性组分的水合作用决定[29]。pH值能够改变蛋白质表面净电荷数量,进而影响蛋白的解离程度及水化作用[30]。如图2所示,在pH 2、4、5、7、9范围内,持水力先减小再增大,等电点时持水力最低。等电点时,蛋白质与蛋白质相互作用达到最大,缔合和收缩的蛋白质表现出最弱的水化作用和膨胀力。相同pH值条件下S-pro的持水力高于B-pro,说明S-pro水合作用强于B-pro,这可能与S-pro中清蛋白含量较高以
及表面疏水度较低有关。
2.3.3 沙米B-pro和S-pro的乳化性
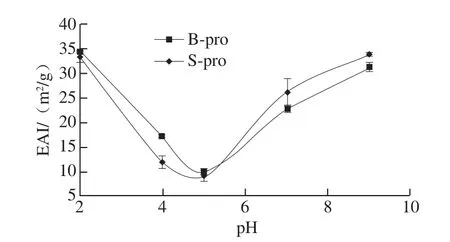
图3 pH值对B-pro和S-pro蛋白乳化活性的影响Fig. 3 Effect of pH on emulsifying activity index of B-pro and S-pro
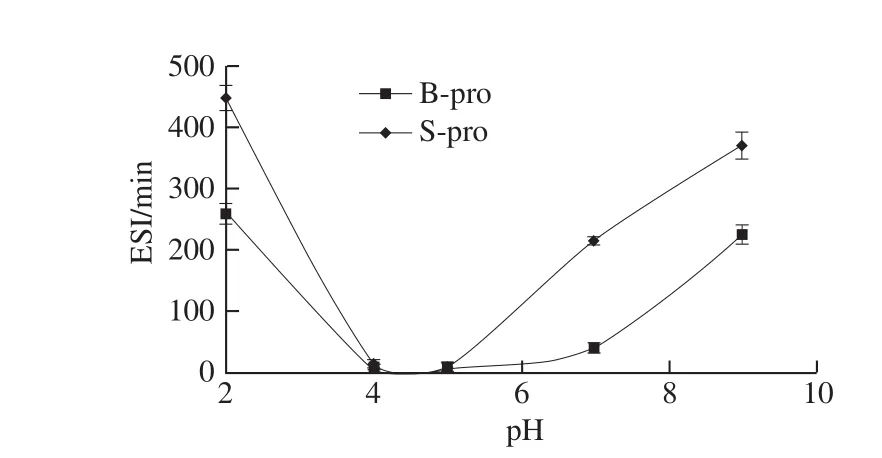
图4 pH值对B-pro和S-pro蛋白乳化稳定性的影响Fig. 4 Effect of pH on emulsion stability of B-pro and S-pro
许多食品属于乳胶体,蛋白质成分在稳定这些胶态体系中通常起重要作用。如图3、4所示,B-pro和S-pro在等电点附近均表现出较差的乳化能力,偏离等电点时,两种蛋白的EAI和ESI均增加。这是由于酸性或碱性环境下,蛋白的溶解度以及分子柔性提高,增大了成膜能力及膜的强度[26]。S-pro的ESI在酸性环境中高于在碱性环境中,且均高于B-pro,这可能是因为在酸性环境下比在中性和碱性环境下油滴表面形成的蛋白膜黏性更强、吸附蛋白所形成的网络结构更致密[24]。除此以外,蛋白的乳化性质还受到蛋白的构象、浓度、温度等因素的影响。
2.3.4 沙米B-pro和S-pro的发泡性
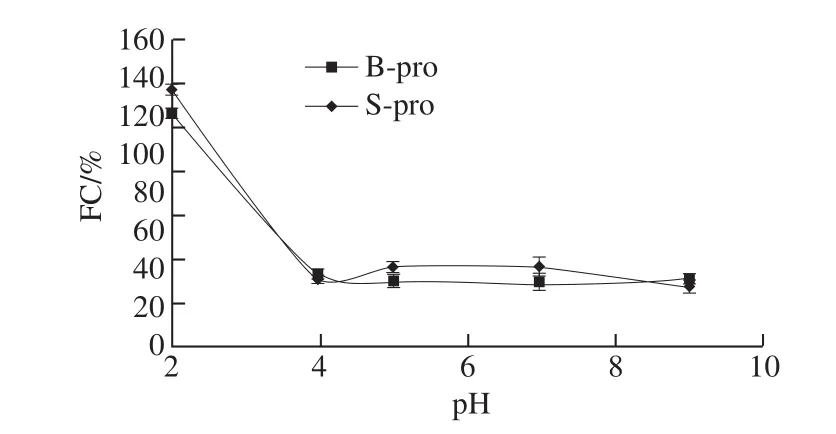
图5 pH值对B-pro和S-pro蛋白发泡能力的影响Fig. 5 Effect of pH on foaming capability of B-pro and S-pro
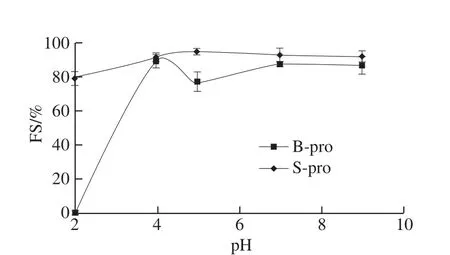
图6 pH值对B-pro和S-pro蛋白泡沫稳定性的影响Fig. 6 Effect of pH on foam stability of B-pro and S-pro
蛋白质的发泡性和泡沫稳定性对于食品产品具有重要作用。如图5、6所示,在等电点前B-pro与S-pro的发泡能力随pH值的上升而明显下降;在等电点附近,B-pro和S-pro的发泡能力最低,但发泡稳定性最好,S-pro的发泡能力及发泡稳定性均优于B-pro。pH值对泡沫的形成和稳定性的影响主要与蛋白质溶解度有关,一般来说蛋白质的溶解是必要条件,但不溶性蛋白微粒对稳定泡沫也能起到有利作用。等电点时,观察到的泡沫体积最大且不易破裂,这一现象与该理论相符合。
2.4 沙米B-pro和S-pro与大豆分离蛋白、鸡蛋蛋白的功能特性比较
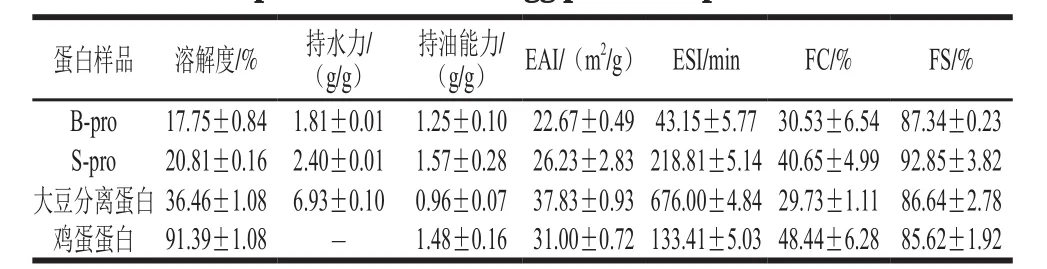
表4 B-pro、S-pro和大豆分离蛋白、鸡蛋蛋白功能特性比较(pH 7.0)Table 4 Comparison of functional properties of B-pro, S-pro, soybean protein isolate and egg protein at pH 7.0
B-pro和S-pro与大豆分离蛋白、鸡蛋蛋白的功能特性比较如表4所示。pH 7.0时,B-pro和S-pro的溶解度分别为17.75%和20.81%,低于鸡蛋蛋白(91.39%)。持水力主要由蛋白的纯度及不溶性组分的水合作用决定,与蛋白表面亲水基团数量有关,并且受到pH值、蛋白浓度、温度、离子强度等影响[29]。大豆分离蛋白在pH 7.0时溶解度只有36.46%,但是持水力很高,达到了6.93 g/g,相反,鸡蛋蛋白几乎是全溶的,因此没有对持水力进行测定;B-pro和S-pro的溶解度虽然略低于大豆分离蛋白,但持水力远低于大豆分离蛋白,只有1.81 g/g和2.40 g/g,这可能是由于水合作用较差导致的。S-pro、B-pro与大豆分离蛋白、鸡蛋蛋白在持油能力、乳化性、发泡性方面也具有差异性。S-pro的持油能力(1.57 g/g)最好,高于鸡蛋蛋白(1.48 g/g)、B-pro(1.25 g/g)和大豆分离蛋白(0.96 g/g);S-pro的EAI为26.23 m2/g,低于大豆分离蛋白(37.83 m2/g)和鸡蛋蛋白(31.00 m2/g),高于B-pro(22.67 m2/g);S-pro的ESI(218.81 min)低于大豆分离蛋白(676.00 min),高于鸡蛋蛋白(133.41 min)和B-pro(43.15 min);S-pro的发泡能力为40.65%,低于鸡蛋蛋白(48.44%),高于大豆分离蛋白(29.73%)和B-pro(30.53%);S-pro的发泡稳定性(92.85%)最佳,其次是B-pro(87.34%)、大豆分离蛋白(86.64%)和鸡蛋蛋白(85.62%)。
3 结 论
沙米种子中70%以上的蛋白集中在沙米麸皮中,可以从麸皮中获得大量分离蛋白,提高沙米综合收益。沙米麸皮和外胚乳中蛋白组成差异性明显,分别以球蛋白和清蛋白为主,分开研究具有必要性。脱脂后采用碱溶酸沉法,蛋白纯度可以超过90%。S-pro中含有更多的
Lys。B-pro和S-pro的功能特能力随pH值的变化基本符合植物蛋白一般规律;中性环境下,与大豆分离蛋白和鸡蛋蛋白相比,B-pro和S-pro的持油能力及发泡性较好,溶解性、持水力、乳化性较弱。因此,沙米粉或者沙米蛋白可以作为一种较好的食品成分或添加物,提高食品的蛋白含量及营养价值,还可以增加食品的持油能力以及发泡性。沙米蛋白提取过程中存在清蛋白变性的问题,中性及低酸性时溶解度较低会限制沙米蛋白的应用。另外,沙米蛋白的功能特性还受到浓度、温度、时间等加工环境条件及体系中其他组分的影响,因此优化沙米蛋白的提取工艺或者进行适当的修饰或水解是必要的,沙米蛋白功能特性的具体应用仍需要在实际的食品生产系统中进一步研究。
[1] 韩向东. 固沙先锋植物沙米的生物与生理生态学特征[D]. 杨凌: 西北农林科技大学, 2008: 47-48.
[2] HUANG Y X, ZHAO X Y, ZHANG H X, et al. Allometric effects of Agriophyllum squarrosum in response to soil nutrients, water, and population density in the Horqin sandy land of China[J]. Journal of Plant Biology, 2009, 52(3): 210-219. DOI:10.1007/s12374-009-9027-9.
[3] 王巧明, 张黎明, 杨建瑜, 等. 8 种荒漠药用植物种子的微形态结构[J]. 兰州大学学报(医学版), 2009, 35(1): 76-79. DOI:10.13885/ j.issn.1000-2812.2009.01.002.
[4] 包书茵, 韩英, 澈力格尔, 等. 沙蓬粗寡糖对GK大鼠胰岛素抵抗的影响[J]. 中国药理学通报, 2016, 32(3): 403-409. DOI:10.3969/ j.issn.1001-1978.2016.03.021.
[5] 靳阳, 李英华, 回业乾, 等. 沙蓬降糖总黄酮有效部位的化学成分[J].沈阳药科大学学报, 2015, 32(7): 519-522.
[6] CHEN G X, ZHAO J C, ZHAO X, et al. A psammophyte Agriophyllum squarrosum (L.) Moq.: a potential food crop[J]. Genetic Resources and Crop Evolution, 2014, 61(3): 669-676. DOI:10.1007/s10722-014-0083-8.
[7] ZHAO P S, CAPELLA-GUTIERREZ S, SHI Y, et al. Transcriptomic analysis of a psammophyte food crop, sand rice (Agriophyllum squarrosum) and identification of candidate genes essential for sand dune adaptation[J]. BMC Genomics, 2014, 15: 1-14. DOI:10.1186/1471-2164-15-872.
[8] 王雅, 赵萍, 李庆娟, 等. 腾格里沙漠沙米营养成分评价[J].食品工业科技, 2009, 30(9): 286-288. DOI:10.13863/ j.issn1001-4454.2009.05.052.
[9] SHEVKANI K, SINGH N, RANA J C, et al. Relationship between physicochemical and functional properties of amaranth (Amaranthus hypochondriacus) protein isolates[J]. International Journal of Food Science & Technology, 2014, 49: 541-550. DOI:10.1111/ijfs.12335.
[10] TÖMÖSKÖZI S, GYENGE L, PELCÉDER Á, et al. Functional properties of protein preparations from amaranth seeds in model system[J]. European Food Research and Technology, 2008, 226(6): 1343-1348. DOI:10.1007/s00217-007-0663-3.
[11] 郑煜焱, 曾洁, 李晶, 等. 米糠蛋白的组成及功能性[J]. 食品科学, 2012, 33(23): 143-147.
[12] FÖSTE M, ELGETI D, BRUNNER A, et al. Isolation of quinoa protein by milling fractionation and solvent extraction[J]. Food and Bioproducts Processing, 2015, 96: 20-26. DOI:10.1016/ j.fbp.2015.06.003.
[13] SHEVKANI K, SINGH N, KAUR A, et al. Structural and functional characterization of kidney bean and field pea protein isolates: a comparative study[J]. Food Hydrocolloids, 2015, 43: 679-689. DOI:10.1016/j.foodhyd.2014.07.024.
[14] 刘春雷, 孙立斌, 李相昕, 等. 大豆7S和11S蛋白二级结构与表面疏水性相关性的研究[J]. 食品科学, 2015, 36(17): 28-32. DOI:10.7506/ spkx1002-6630-201517006.
[15] SHEVKANI K, KAUR A, KUMAR S, et al. Cowpea protein isolates: functional properties and application in gluten-free rice muffins[J]. LWT-Food Science and Technology, 2015, 63(2): 927-933. DOI:10.1016/j.lwt.2015.04.058.
[16] GORINSTEIN S, PAWELZIK E, DELGADO-LICON E, et al. Characterisation of pseudocereal and cereal proteins by protein and amino acid analyses[J]. Journal of the Science of Food and Agriculture, 2002, 82(8): 886-891. DOI:10.1002/jsfa.1120.
[17] 张敏, 周梅, 王长远. 米糠4 种蛋白质的提取与功能性质[J]. 食品科学, 2013, 34(1): 18-21.
[18] CORDERO-de-los-SANTOS Y, OSUNA-CASTRO J A, BORODANENKO A, et al. Physicochemical and functional characterisation of amaranth (Amaranthus hypochondriacus) protein isolates obtained by isoelectric precipitation and micellisation[J]. Food Science and Technology International, 2005, 11(4): 269-280. DOI:10.1177/1082013205.
[19] 郭艳, 曾里. 大米蛋白营养价值和提取分离方法的研究进展[J]. 食品与发酵科技, 2010, 46(1): 31-34.
[20] XU L, DIOSADY L L. Interactions between canola proteins and phenolic compounds in aqueous media[J]. Food Research International, 2000, 33(9): 725-731. DOI:10.1016/S0963-9969(00)00062-4.
[21] 叶润, 牟德华. 葡萄籽中多酚类物质的脱除及蛋白质提取试验研究[J]. 食品研究与开发, 2009(12): 45-48. DOI:10.3969/ j.issn.1005-6521.2009.12.013.
[22] 金融, 赵念, 陈莎莎, 等. 大米蛋白的研究与利用[J]. 食品工业科技, 2007, 28(1): 231-234. DOI:10.13386/j.issn1002-0306.2007.01.
[23] JAMES L E A. Quinoa (Chenopodium quinoa Willd.): composition, chemistry, nutritional, and functional properties[M]. New York: Academic Press, 2009: 1-31. DOI:10.1016/S1043-4526(09)58001-1.
[24] 梁晗妮. 豆类蛋白质的乳化性质及其结构-功能相关性研究[D]. 广州:华南理工大学, 2014: 76.
[25] 王艳萍, 李双喜, AHMED Z, 等. 蚕豆蛋白的提取及NaCl浓度和pH值对其溶解性和乳化性的影响[J]. 农业工程学报, 2010, 26(1): 380-384. DOI:10.3969/j.issn.1002-6819.2010.01.068.
[26] 盛彩虹, 刘晔, 刘大川, 等. 紫苏分离蛋白功能性研究[J]. 食品科学, 2011, 32(17): 137-140.
[27] 王辰, 江连洲, 魏冬旭, 等. 不同品种大豆分离蛋白结构与表面疏水性的关系[J]. 食品科学, 2012, 33(9): 54-57.
[28] 马秀婷, 肖志刚, 罗志刚, 等. 豆渣蛋白提取及检测试验[J]. 江苏大学学报(自然科学版), 2014(2): 176-181. DOI:103969/ j.issn.1671-7775.2014.02.010.
[29] STONE A K, KARALASH A, TYLER R T, et al. Functional attributes of pea protein isolates prepared using different extraction methods and cultivars[J]. Food Research International, 2015, 76: 31-38. DOI:10.1016/j.foodres.2014.11.017.
[30] 汪东风. 食品化学[M]. 北京: 化学工业出版社, 2011: 123-127.
Physiochemical and Functional Properties of Protein Isolates Prepared from Bran and Perisperm of Sand Rice Seeds (Agriophyllum squarrosum)
PENG Jing1, ZHANG Mengqi1, XING Mengke1, CHEN Guoxiong2, LIU Tan1, TU Kang1,*
(1. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 2. Cold and Arid Regions Environmental and Engineering Research Institute, Chinese Academy of Sciences, Lanzhou 730000, China)
sand rice; bran protein; perisperm protein; physicochemical properties; functional properties
10.7506/spkx1002-6630-201713012
TS201.1
A
1002-6630(2017)13-0071-06引文格式:
2016-06-20
“十三五”国家重点研发计划重点专项(2016YFD0400304-04);江苏省农业支撑项目(BE2014399);江苏高校优势学科建设工程资助项目
彭菁(1991—),女,硕士研究生,研究方向为农产品加工与综合利用。E-mail:2014108049@njau.edu.cn
*通信作者:屠康(1968—),男,教授,博士,研究方向为农产品无损检测、农产品储藏与加工。E-mail:kangtu@njau.edu.cn
