SAHA抑制瘦素诱导的乳腺癌MDA-MB-231细胞增殖的分子机制
2017-07-24周伟强
周伟强
SAHA抑制瘦素诱导的乳腺癌MDA-MB-231细胞增殖的分子机制
周伟强
(沈阳医学院基础医学院,辽宁省环境污染与微生态重点实验室,辽宁沈阳110034)
目的:研究组蛋白去乙酰化酶抑制剂SAHA抑制瘦素诱导的乳腺癌MDA-MB-231细胞增殖的分子机制。方法:采用固相细胞凋亡抗体芯片技术测定瘦素和SAHA对乳腺癌MDA-MB-231细胞增殖产生的影响。结果:SAHA显著增强MDA-MB-231细胞中Bax、p21CIP1和p27KIP1的表达,并降低Survivin蛋白的含量;经SAHA作用后MDA-MB-231细胞中Caspase-3和Clusterin的表达水平明显上升,而肿瘤坏死因子受体超家族成员1A(TNFRSF1A)的表达水平明显下降。结论:SAHA可通过激活乳腺癌细胞内凋亡途径,并抑制细胞周期的进程而达到抑制乳腺癌发生的目的。
乳腺癌;MDA-MB-231;增殖;瘦素;SAHA
随着对乳腺癌发生的不断认识,乳腺癌的预防、治疗有了长足的进步,但有效地预防和阻断乳腺癌发生和发展仍是乳腺癌研究的关键和难点之一。尽管乳腺癌发生和发展的原因十分复杂,但归根到底均和基因表达及基因表达产物活性异常密切相关[1]。随着科技发展,特别是分子生物学技术的广泛应用,人们发现表观遗传改变在乳腺癌发生、发展中具有更普遍的意义,其主要是影响基因转录活性而非DNA序列突变,可通过细胞分裂和增殖得以稳定遗传的表达调控方式已逐渐成为乳腺癌研究和治疗的热点[2-3]。组蛋白乙酰化调控作为一种重要的表观遗传修饰方式,通过调节组蛋白乙酰化转移酶(histone acetyltra nsferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)之间的动态平衡,参与乳腺癌的形成过程[4]。
SAHA(Suberoylanilide Hydroxamic Acid)作为继HMBA(Hexamethy Lenebisacetamide)之后的第二代羟肟酸类的HDAC抑制剂,是美国Merck公司开发的用于治疗持续恶化或复发的T细胞淋巴瘤(CTCL)药物,于2006年10月获得FDA上市批准,商品名为Zolinza。大量实验证实SAHA具有良好的抑瘤性,其可非特异性结合HDAC1、HDAC2、HDAC3、HDAC6的催化位点,并抑制其活性以促进乙酰化组蛋白增加,造成癌细胞转录过程异常,诱导癌细胞分化,阻滞癌细胞周期进程和促进癌细胞凋亡的发生[5]。本文选取ER阴性乳腺癌MDA-MB-231细胞,利用固相细胞凋亡抗体芯片技术研究SAHA抑制Leptin诱导的MDA-MB-231细胞增殖的分子机制。
1 材料与方法
1.1 材料人乳腺癌细胞株MDA-MB-231由本实验室冻存;Leibovitz′s L-15培养基、胎牛血清、青霉素及链霉素购自美国Thermo公司;固相细胞凋亡抗体芯片试剂盒购自美国R&D公司;人重组Leptin蛋白、SAHA及其它化学试剂购自美国Sigma-Aldrich公司。
1.2 方法
1.2.1 细胞培养人乳腺癌MDA-MB-231细胞培养于含15%胎牛血清、100 U/ml的青霉素、100 μg/ml的链霉素的Leibovitz′s L-15培养基中。
1.2.2 全细胞蛋白提取将大约1×107个乳腺癌MDA-MB-231细胞接种于100 mm培养皿中,细胞进行无血清同步化处理后加入0.625 nmol/L Leptin和5 μmol/L SAHA与MDA-MB-231细胞孵育32 h。将处理后的MDA-MB-231细胞经胰蛋白酶消化,14 000×g离心5 min后取细胞团块经M-PER裂解液裂解,应用BCA法检测蛋白浓度待用。
1.2.3 固相细胞凋亡抗体芯片技术检测将已包被抗体的PVDF膜封闭1 h后,分别加入200 μg各蛋白样品液于4孔板各孔中,4℃振荡孵育过夜。蛋白样品-抗体膜经PBS冲洗3遍后分别加入1.5 ml生物素标记的二抗振荡孵育1 h。PVDF膜经冲洗后加入HRP偶联的链霉亲和素孵育30 min。将等体积混合的ECL化学发光底物A、B液均匀加在PVDF膜上,显色5 min。化学发光成像系统曝光后应用Gelpro Analyzer software(Media Cybernetics)计算膜上各抗体标记点的灰度值来决定Leptin和SAHA等处理因素对MDA-MB-231细胞凋亡蛋白表达产生的影响。
1.3 统计学方法采用SPSS 20.0软件进行统计学分析,结果以(x±s)表示,采用单因素方差分析方法和Student's t-test进行统计学处理,P<0.05为差异有统计学意义。
2 结果
2.1 SAHA抑制乳腺癌细胞周期调控系统因子的表达固相细胞凋亡抗体芯片技术测定结果显示,与空白对照组相比,单独SAHA处理显著诱导了乳腺癌MDA-MB-231细胞中Bax、p21CIP1和p27KIP1的表达,并降低了Survivin的蛋白表达水平;而Leptin则抑制了Bax和p21CIP1的表达,对p27KIP1和Survivin蛋白表达的影响不明显。SAHA和Leptin的联合作用不能抑制SAHA诱导的Bax、p21CIP1和p27KIP1的表达。见图1。
2.2 SAHA对乳腺癌细胞中凋亡蛋白表达的影响固相细胞凋亡抗体芯片技术测定结果表明,与空白对照组相比,经SAHA作用后MDA-MB-231细胞中Caspase-3和Clusterin的表达水平明显上升,而肿瘤坏死因子受体超家族成员1A(TNFRSF1A)的表达水平明显下降;与凋亡产生密切相关的TRAIL DR5表达水平在SAHA的作用下也有所升高。Leptin对MDA-MB-231细胞的作用效果体现在可显著增加TNFRSF1A的表达水平;但对Caspase-3等蛋白的表达水平影响不大。见图2。
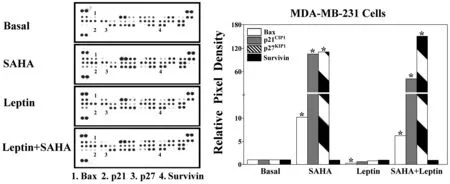
图1 SAHA对乳腺癌MDA-MB-231细胞周期调控系统因子表达的影响
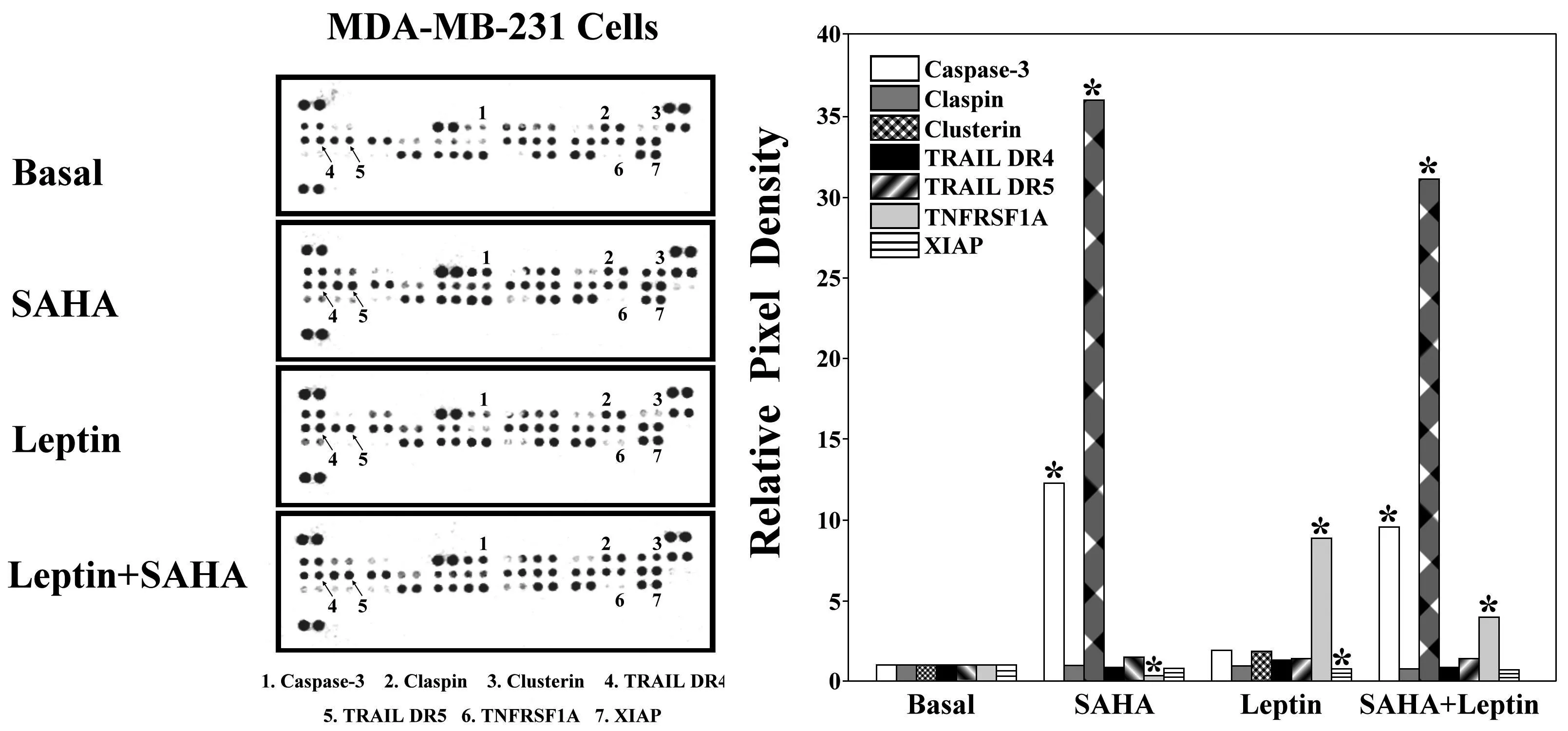
图2 SAHA诱导乳腺癌MDA-MB-231细胞中凋亡蛋白的表达
3 讨论
HDAC抑制剂是近年来发现的一类体内外抗肿瘤效果显著的药物,其生物学效应主要表现为诱导细胞凋亡、细胞周期阻滞、促进细胞分化以及抑制血管生成[6]。HDAC抑制剂可在小剂量、低浓度情况下诱导肿瘤细胞分化,选择性凋亡,对正常细胞无毒性,且具有抗肿瘤广谱性,具有潜在的临床应用前景,以HDAC抑制剂为靶标的相关研究与临床应用正广泛的开展[7-8]。
有研究通过对斑马鱼等发育生物模型研究发现,HDAC在生物体组织发育中起到关键的诱导发育的作用,而SAHA可通过抑制肿瘤生长、调控癌细胞增殖而发挥自己的生物学效能[9-10]。另外前期研究还发现SAHA可明显抑制乳腺癌MDAMB-231细胞增殖周期的进程,诱导细胞凋亡的产生,并伴有核心组蛋白H3、H4乙酰化水平的上调及HDAC1活性的下降,SAHA通过上调核心组蛋白表观遗传修饰水平,激活p53、p21WAF1/CIP1等相关基因启动子转录活性,促进细胞周期调控因子的功能,有效抑制了Leptin诱导的乳腺癌细胞增殖,并促发细胞凋亡的产生,从而阻碍乳腺癌的发生和发展[11]。本实验进一步发现,SAHA作用后MDA-MB-231细胞中Caspase-3和Clusterin的表达水平明显上升,而TNFRSF1A的表达水平明显下降。Caspase-3作为凋亡过程中最重要的关键反应元件,是细胞凋亡的主要执行者和效应分子,是多种凋亡激活信号传递的汇集点,它的活化是凋亡发生进入不可逆阶段的标志[12]。Clusterin可通过与细胞质中Bax共同作用抑制细胞色素C的释放而达到保护细胞的目的[13]。肿瘤坏死因子-α(TNF-α)通过其特异受体TNFRSF1A在体内发挥多种生物学效应,包括刺激肿瘤发生和促炎症作用[14]。综合本实验结果,我们认为SAHA可通过Caspase-3依次激活乳腺癌细胞内凋亡途径,抑制细胞周期的进程而达到抑制乳腺癌发生的目的。
本实验在蛋白水平上探讨了SAHA对Leptin诱导的乳腺癌发生所产生的抑制作用,对于拓宽乳腺癌研究方向,寻找潜在的、有效的乳腺癌靶基因治疗位点都奠定了坚实的实验和理论基础。
[1]BozkurtE,AtmacaH,KisimA,etal.EffectsofThymusserpyllum extract on cell proliferation,apoptosis and epigenetic events in human breast cancer cells[J].Nutr Cancer,2012,64(8): 1245-1250.
[2]Lee YJ,Won AJ,Lee J,et al.Molecular mechanism of SAHA on regulation of autophagic cell death in tamoxifen-resistant MCF-7 breast cancer cells[J].Int J Med Sci,2012,9(10):881-893.
[3]Gui CY,Ngo L,Xu WS,et al.Histone deacetylase(HDAC)inhibitor activation of p21WAF1 involves changes in promoterassociated proteins,including HDAC1[J].Proc Natl Acad Sci USA,2004,101(5):1241-1246.
[4]白庆阳,谷俊朝,卢晓梅,等.乳腺癌组织瘦素和瘦素受体表达及其临床意义的研究[J].中华肿瘤防治杂志,2008,15(13):996-998.
[5]Zhou W,Liang IC,Yee NS.Histone deacetylase 1 is required for exocrine pancreatic epithelial proliferation in development and cancer[J].Cancer Biol Ther,2011,11(7):659-670.
[6]Chun SG,Zhou W,Yee NS,et al.Combined targeting of histone deacetylases and hedgehog signaling enhances cytoxicity in pancreatic cancer[J].Cancer Biol Ther,2009,8(14):1328-1339.
[7]Carroll PA,Healy L,Lysaght J,et al.Influence of the metabolic syndrome on leptin and leptin receptor in breast cancer[J].Mol Carcinog,2011,50(8):643-651.
[8]Knight BB,Oprea-llies GM,Nagalingam A,et al.Survivin upregulation,dependent on leptin-EGFR-Notch1 axis,is essential for leptin-induced migration of breast carcinoma cells[J].Endocr Relat Cancer,2011,18(4):413-428.
[9]Huang L,Pardee AB.Suberoylanilide hydroxamic acid as a potential therapeutic agent for human breast cancer treatment[J]. Mol Med,2000,6(10):849-866.
[10]Yee NS,Zhou W,Chun SG,et al.Targeting developmental regulators of zebrafish exocrine pancreas as a therapeutic approach in human pancreatic cancer[J].Biol Open,2012,1(4):295-307.
[11]周伟强.组蛋白乙酰化修饰对瘦素诱导的乳腺癌MDA-MB-231细胞生长的影响[J].沈阳医学院学报,2017,19(1): 11-14.
[12]Glaser KB.HDAC inhibitors:clinical update and mechanismbased potential[J].Biochem Pharmacol,2007,74(5):659-671.
[13]Gryder BE,Sodji QH,Oyelere AK.Targeted cancer therapy: giving histone deacetylase inhibitors all they need to succeed[J].Future Med Chem,2012,4(4):505-524.
[14]Lim B,Allen JE,Prabhu W,et al.Targeting TRAIL in the treatment of cancer:new developments[J].Expert Opin Ther Targets,2015,19(9):1171-1185.
The Molecular Mechanisms of Inhibiting the Cell Proliferation with SAHA and Leptin Treatment in Breast Cancer MDA-MB-231 Cells
ZHOU Weiqiang
(Shenyang Medical College,Key Laboratory of Environmental Pollution and Microecology of Liaoning Province,Shenyang 110034,China)
Objective:To study the molecular mechanisms of histone deacetylase inhibitor SAHA for inhibiting the cell proliferation of breast cancer MDA-MB-231 cells induced by leptin.Methods:Solid phase of antibody microarray was used to detect the apoptostic effects for MDA-MB-231 cells treated with leptin and SAHA treatment.Results:SAHA significantly increased the expressions of Bax,p21CIP1and p27KIP1and reduced the level of Survivin protein.After SAHA treatment,the levels of Caspase-3 and Clusterin obviously increased and the level of TNFRSF1A significantly decreased.Conclusion:By activating apoptotic pathways in breast cancer MDA-MB-231 cells and inhibiting the cell cycle progression,SAHA achieves the purpose of inhibiting breast cancer.
breast cancer;MDA-MB-231;proliferation;leptin;SAHA
R394.3
A
1008-2344(2017)02-0084-03
10.16753/j.cnki.1008-2344.2017.02.004
2016-06-08
(文敏编辑)
国家自然科学基金项目(No.81172509)
周伟强(1970—),男(汉),教授,研究方向:乳腺癌发生与调控.E-mail:zhouwq@hotmail.com
