甲状腺激素下调慢性心力衰竭大鼠心肌钙调神经磷酸酶通路的机制研究△
2017-07-24邝素华郭锻强马伦超陆国梁张英元黄杰周翁丽芳任晓山谢少波
邝素华,郭锻强,梁 庆,马伦超,杨 超,陆国梁,张英元,黄杰周,翁丽芳,任晓山,谢少波
(1.广州医科大学附属第一医院心脏外科,广州510120;2.广州医科大学附属第一医院急诊科,广州510120)
·实验研究·
甲状腺激素下调慢性心力衰竭大鼠心肌钙调神经磷酸酶通路的机制研究△
邝素华1,郭锻强2,梁 庆2,马伦超1,杨 超1,陆国梁1,张英元1,黄杰周1,翁丽芳1,任晓山1,谢少波1
(1.广州医科大学附属第一医院心脏外科,广州510120;2.广州医科大学附属第一医院急诊科,广州510120)
目的 在体研究甲状腺素(thyroid hormone,TH)对慢性心力衰竭(heart failure,HF)大鼠血流动力学及心脏Ca2+-调神经磷酸酶(calcineurin,CaN)-T细胞核因子3(nuclear factor 3 of activated T cells,NFAT3)通路的影响。方法 SD大鼠90只随机分为3组,各组30只:(1)假手术组(sham组);(2)HF模型组(HF组);(3)TH治疗组(TH组)。缩窄腹主动脉建立HF动物模型,TH组术后灌胃予左甲状腺素钠[1.5μg/(100 g·d)]。各组大鼠喂养8周后测定有创血流动力学指标,取材称量全心湿质量(heart wet weight,HW)、全肺湿质量(lung weight,LW),计算心质量指数[HW/体质量(body weight,BW)]、肺质量指数(LW/BW),测定心肌[Ca2+]i浓度及CaN 活性,Western blot检测CaN-A、总NFAT3(T-NFAT3)、磷酸化NFAT3(P-NFAT3)蛋白表达水平。结果(1)TH治疗显著改善HF大鼠收缩压(systolic pressure,SP)、左心室收缩压(left intraventricular systolic pressure,LVSP)、+dp/dt max、左心室舒张压(left ventricular diastolic pressure,LVDP)、左心室舒张末期压力(left ventricu⁃lar end-diastolic pressure,LVEDP)、-dp/dt max;TH组与HF组心率比较,差异无统计学意义(P>0.05)。(2)TH组HW/BW[(3.44±0.27)mg/gvs.(4.18±0.28)mg/g,P<0.01]及 LW/BW[(8.02±0.41)mg/gvs.(8.56±0.45)mg/g,P<0.01]均较HF组有所降低,差异有统计学意义。(3)与HF组比较,TH组大鼠[Ca2+]i[(115.50±10.76)nmol/Lvs.(159.36±7.21)nmol/L,P<0.01]及CaN活性[(21.33±2.35)nmol·min-1·mg-1proteinvs.(42.96±3.36)nmol·min-1·mg-1protein,P<0.05]均显著降低。(4)HF组P-NFAT3表达(0.41±0.10vs.0.80±0.11,P<0.01)及P-NFAT3/T-NFAT3比值(0.13±0.03vs.0.25±0.04,P<0.01)较Sham组显著减少,差异有统计学意义;TH组P-NFAT3表达(0.86±0.11vs.0.41±0.10,P<0.01)及P-NFAT3/T-NFAT3比值(0.27±0.03vs.0.13±0.03,P<0.01)较HF组则显著增加,差异有统计学意义;虽TH组P-NFAT3表达较Sham组有所增加,而TH组P-NFAT3/T-NFAT3比值与Sham组比较,差异无统计学意义(P=0.193)。结论 TH通过改善心肌钙稳态,减少对CaN的病理激活而维持下游NFAT3蛋白磷酸化状态,使HF大鼠的解剖病理和血流动力学获益。
心力衰竭;甲状腺激素;钙调神经磷酸酶;钙调控;心肌质量构
近年的研究表明,心力衰竭(heart failure,HF)患者或开胸心脏手术行心肺转流术的先天性心脏病患者体内甲状腺激素(thyroid hormone,TH)浓度均明显较正常低,而经TH替代治疗后心功能明显改善[1-2],但其改善心功能的具体机制尚未清楚。已知TH可与心肌细胞核内特异性受体结合,通过调节钙调控蛋白相关基因转录影响心肌细胞的钙调控[1]。而钙调神经磷酸酶(calcineurin,CaN)是目前已知唯一依赖于Ca2+/钙调素(calmodulin,CaM)的磷蛋白磷酸酶,心肌细胞内Ca2+增高激活CaN信号传导通路,使得胞质中的活化T细胞核因子 3(nuclear factor 3 of activated T cells,NFAT3)去磷酸化后进入细胞核启动心肌细胞肥大基因表达[3-4]。CaN作为重要的致病因子,参与了心脏、肺脏、大脑等组织的细胞增殖和血管重构。据此,我们推测TH替代治疗可能通过发挥心肌钙调控作用并由下游的CaN信号传导通路介导从而逆转心肌重构,改善心功能。为此,我们建立了压力负荷型HF大鼠模型,研究TH替代治疗对慢性HF大鼠模型CaN信号通路及心功能的影响。
1 材料和方法
1.1 心力衰竭模型复制及实验分组
雌性SD大鼠90只,体质量180~220 g,由广东省医学实验动物中心提供(合格证号:4407208369)。按Dowell等[5]报道的方法行腹主动脉次全结扎造成腹主动脉狭窄约70%~80%,建立压力负荷型HF动物模型。动物随机分为3组:(1)假手术组(sham组30只),不结扎腹主动脉,其余操作同模型组;(2)HF组30只,通过次全结扎腹主动脉造成HF;(3)TH组30只,术后除正常喂养外,每日通过灌胃法给予左甲状腺素钠[优甲乐,德国默克制药厂制,1.5 μg/(100 g·d)]治疗。喂养8周后测定心功能,并取材进行下游实验。HF判断标准[6-7]:主要依据大鼠症状、体征的变化(如呼吸急促,喘鸣,口唇发绀,眼睑分泌物增多,活动力下降),结合血流动力学参数、解剖学测量指标(心质量指数、肺质量指数)与sham组对比综合判断。
1.2 大鼠有创血流动力学测定
应用(bl-420e生物机能实验系统)进行血流动力学测定。称质量后以10%水合氯醛(0.3 mL/100 g)行腹腔麻醉并固定,肝素化导管后行右股动脉及右侧颈总动脉插管,将血压和左心室压信号分别经YH3型生理压力传感器输入实验系统自动测取、显示左心室压力和动脉血压微分图及血流动力学各项指标,以监测心率(heart rate,HR)、收缩压(systolic pressure,SP)、舒张压(diastolic pressure,DP)、左心室收缩压(left intraventricular systolic pressure,LVSP)、左心室舒张压(left ventri⁃cular di⁃astolic pressure,LVDP)、左心室舒张末期压力(left ventricular end-diastolic pressure,LVEDP)、左心室压变化速率最大值(±dp/dt max)等指标。大鼠插管稳定10 min后记录数据,每个样本指标选取连续监测值5个,取其平均值。
1.3 大鼠心脏、肺脏取材
大鼠术后8周检测心功能后,立即开胸取心脏后用冰0.9%氯化钠溶液冲洗血液,用滤纸吸干表面血液后精密称量全心湿质量(heart weight,HW),计算心质量指数[HW/(body weight,BW)];完整取下肺组织后用滤纸吸干表面血液并精密称量全肺湿质量(lung weight,LW),计算肺质量指数(LW/BW)。心脏置冰上去除心耳心房,平行于房室沟于左心室长轴中点处将心室分为心尖部和心底部,心尖部用于Western blotting(WB)检测,心底部用于心肌细胞内游离钙离子([Ca2+]i)浓度及CaN活性的测定。
1.4 心肌游离钙离子浓度的测定
按文献报告方法分离左心室心肌细胞[8],用Fura-2/AM法测定[Ca2+]i,37℃环境中用双波长荧光分光光度计(日本岛津RF-5301),取激发波长340/380 nm,发射波长510 nm,测定样本荧光值(F)并计算荧光比值R(F340/F380);并分别加入终浓度为0.1%TritonX和10 mmol/L EDTA使Ca2+饱和及为零,获最大荧光比值(Rmax)和最小荧光比值(Rmin)。根据 Grynkiewicz经典公式[9]计算[Ca2+]i=Kd[(R-Rmin)/(Rmax-R)](Fmin/Fmax)。其中,Kd为Fura-2与Ca2+反应的解离常数,为224 nmol/L;R为各测定点样本F340/F380荧光强度比值;Rmax、Rmin分别为上述测定的最大和最小荧光比值;Fmax、Fmin分别代表Ca2+为饱和及零时,380 nm激发波长下测得的Fura-2荧光强度(F380)。
1.5 钙调神经磷酸酶活性测定
按照Biomol公司的AK-816试剂盒说明书操作:50 mg左心室组织液氮条件下置匀浆器中研磨成粉,加入0.25 mL含蛋白酶抑制剂lysis缓冲液继续匀浆,匀浆液离心(150 000 r/min,4℃)45 min后保存上清液于-80℃超低温冰箱中冻存。按试剂盒操作步骤进行。
1.6 Western blotting半定量检测CaN⁃A、总NFAT3、磷酸化NFAT3蛋白表达
冰上提取大鼠心尖部左心室总蛋白后测定总蛋白质浓度,每孔加入50 μg的总蛋白质,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)(10%的分离胶)电泳,电转膜,5%脱脂奶粉室温下封闭2 h。1∶400 CaN⁃A兔抗人单克隆抗体(购自美国Abcam公司,Cat#:ab52761),1∶400 NFAT3总蛋白(Total-NFAT3,T-NFAT3)兔抗人单克隆抗体(购自美国CST公司,Cat#:2183),1∶400磷酸化NFAT3(phosphated-NFAT3,P-NFAT3)兔抗人多克隆抗体(购自美国Sigma公司,Cat#:SAB4503946)4℃孵育过夜,洗膜后加入辣根过氧化酶标记羊抗兔二抗(1∶2 000)室温下孵育2 h,以GAPDH(1∶2 000)抗体作内参照。洗膜后电化学发光法(ECL)显影。
1.7 统计学分析
所得数据使用SPSS 16.0统计学软件进行分析。计量资料以()表示,组间比较采用单因素方差分析,方差齐采用LSD法,方差不齐采用Games-Howell法。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组血流动力学指标比较
各实验组术中无大鼠死亡,次全结扎腹主动脉术后喂养8周各组大鼠存活数如下:sham组29例,HF组22例,TH组26例。与sham组相比,HF组HR明显增快,而SP、DP、LVSP、+dp/dt max则显著降低,LVDP、LVEDP、-dp/dt max则显著升高,差异有统计学意义(P<0.05)。与sham组相比,TH组HR亦明显增快(P<0.05),但TH组与HF组HR比较,差异无统计学意义(P>0.05)。与sham组比较,TH组DP、LVSP、+dp/dt max显著降低,LVDP、LVEDP、-dp/dt max则显著升高,差异有统计学意义(P<0.05);与HF组比较,TH组SP、LVSP、+dp/dt max显 著 升 高 ,LVDP、LVEDP、-dp/dt max则显著降低,差异有统计学意义(P<0.05);TH组与HF组DP比较,差异无统计学意义(P>0.05)。各组有创测定血流动力学参数比较,详见表1。
表1 各组有创测定血流动力学参数比较 [±s]

表1 各组有创测定血流动力学参数比较 [±s]
注:与sham组比较,*P<0.05,**P<0.01;与HF组比较,1)**P<0.01;1 mmHg=0.133 kPa
项目nHR(次/min)SP(mmHg)DP(mmHg)LVSP(mmHg)LVDP(mmHg)LVEDP(mmHg)+dp/dt max(mmHg/s)-dp/dt max(mmHg/s)sham组29 402.59±27.06 128.41±15.39 80.83±7.92 141.34±6.93-16.24±5.22-13.08±5.67 6 300.38±688.65-5 380.34±409.96 HF组22 424.45±30.01**117.23±20.47*74.32±10.01**106.27±13.06**-8.6±5.83**-7.8±5.20**3 212.27±565.49**-2 127.50±451.44**TH组26 432.04±25.57**132.23±16.601)**76.00±8.15*132.08±16.59**,1)**-10.08±4.73**,1)**-9.92±4.12**,1)**5 700.04±569.22**,1)**-4 802.54±504.23**,1)**
2.2 各组全心湿质量、全肺湿质量、体质量及心质量指数、肺质量指数比较
术后8周,各组大鼠HW/BW和LW/BW之间两两比较,差异具有统计学意义(P<0.05);且与Sham组比较,HF组HW/BW和LW/BW增加明显,差异有统计学意义(P<0.05);TH治疗组与HF组治疗后HW/BW及LW/BW均较HF组有所降低,差异有统计学意义(P<0.01),详见表2。
表2 各组HW、LW、BW、HW/BW、LW/BW比较 [±s]

表2 各组HW、LW、BW、HW/BW、LW/BW比较 [±s]
注:与sham组比较,*P<0.05,**P<0.01;与HF组比较,1)**P<0.01
项目nHW(mg)LW(mg)BW(g)HW/BW(mg/g)LW/BW(mg/g)sham组29 955.62±58.12 1 653.97±85.48 347.10±10.77 2.76±0.20 4.77±0.74 HF组22 1 514.41±87.71**3 103.09±134.61**362.68±7.06**4.18±0.28**8.56±0.45**TH组26 1 213.85±92.19**,1)**2 831.42±112.89**,1)**335.12±7.58*,1)**3.44±0.27**,1)**8.02±0.41**,1)**
2.3 各组心肌[Ca2+]i浓度及CaN活性比较
HF组大鼠[Ca2+]i及CaN活性均较Sham组显著升高;TH组与sham组比较,大鼠[Ca2+]i(P<0.01)及CaN活性(P<0.05)仍有升高,而进一步与HF组比较,发现经 TH处理后大鼠[Ca2+]i(P<0.01)及CaN活性(P<0.05)均显著降低,详见表3。
表3 各组心肌[Ca2+]i浓度及CaN活性比较 [±s]

表3 各组心肌[Ca2+]i浓度及CaN活性比较 [±s]
注:与sham组比较,*P<0.05,**P<0.01;与HF组比较,1)**P<0.01
项目n[Ca2+]i(nmol/L)CaN活性(nmol·min-1·mg-1protein)sham组29 93.47±6.80 19.66±1.98 HF组22 159.36±7.21**42.96±3.60**TH组26 115.50±10.76**,1)**21.33±2.35*,1)**
2.4 各组心肌CaN-A、T-NFAT3、P-NFAT3浓度及P-NFAT3/T-NFAT3比值比较
从图1及表4可见,与Sham组比较,HF组及TH组CaN-A蛋白表达均有显著增加(P<0.01),进一步两组间比较发现,TH组CaN-A蛋白表达则较HF组显著下降(P<0.01);Sham组、HF组及TH组T-NFAT3蛋白表达水平两两比较,差异无统计学意义(P>0.05);而HF组P-NFAT3蛋白表达及P-NFAT3/T-NFAT3比值则低于Sham组(P<0.01);TH组P-NFAT3蛋白表达水平及P-NFAT3/TNFAT3比值高于HF组(P<0.01);TH组P-NFAT3蛋白表达较Sham组亦有所增加(P=0.045<0.05),而TH组P-NFAT3/T-NFAT3比值与Sham组比较,差异无统计学意义(P=0.193>0.05)。

图1 各组心肌CaN-A、T-NFAT3、P-NFAT3浓度WB检测结果
3 讨 论
TH与心肌细胞钙调控蛋白的基因转录和蛋白质表达关系密切。我们前期研究发现,TH可通过调控钙调控蛋白基因转录和蛋白质表达来调节心肌钙调控功能,纠正钙稳态失衡而改善心功能[10-11]。另外,TH的细胞作用机制是其与核受体结合形成复合物,通过与DNA相互作用使机体细胞大量的基因核内转录,调控结构蛋白及蛋白酶等的量和活性。
表4 各组心肌CaN-A、T-NFAT3、P-NFAT3浓度及P-NFAT3/T-NFAT3比值比较 [±s]
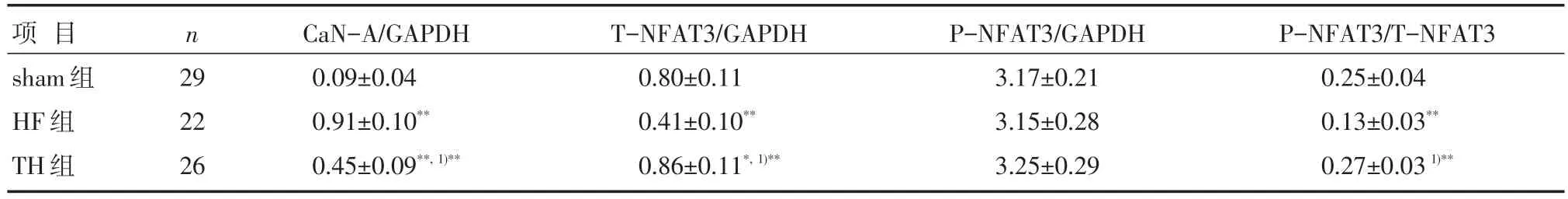
表4 各组心肌CaN-A、T-NFAT3、P-NFAT3浓度及P-NFAT3/T-NFAT3比值比较 [±s]
注:与sham组比较,*P<0.05,**P<0.01;与HF组比较,1)**P<0.01
项目sham组HF组TH组n29 22 26 CaN-A/GAPDH 0.09±0.04 0.91±0.10**0.45±0.09**,1)**T-NFAT3/GAPDH 0.80±0.11 0.41±0.10**0.86±0.11*,1)**P-NFAT3/GAPDH 3.17±0.21 3.15±0.28 3.25±0.29 P-NFAT3/T-NFAT3 0.25±0.04 0.13±0.03**0.27±0.031)**
本实验中大鼠血流动力学实验结果提示心脏收缩及舒张功能均得到显著改善。且分析发现TH组与HF组HR两组间比较,差异无统计学意义(P>0.05),提示TH改善心功能的作用并非由增快HF大鼠HR来实现,而是通过整体恢复HF大鼠的左心室收缩及舒张功能来实现血流动力学获益。进一步实验发现,HF组大鼠心脏HW、LW、BW和HW/BW、LW/BW均较Sham组显著上升,结合上述血流动力学结果说明HF大鼠造模成功。HF大鼠心脏肥厚和肺水肿明显;TH治疗后HW/BW及LW/BW均较HF组有所降低,提示TH治疗可以显著改善HF大鼠的心肌重构和肺淤血、肺水肿。
各组大鼠心肌[Ca2+]i浓度及CaN活性测定结果提示HF大鼠[Ca2+]i在心肌钙循环过程中处于高水平,由此激活了CaN活性,而TH处理可以显著改善钙循环稳态,使[Ca2+]i浓度趋于正常从而减少对下游CaN活性的病理激活。我们进一步实验发现,HF组中Ca2+-CaN-NFAT3信号传导通路的CaN蛋白表达增加,HF大鼠T-NFAT3蛋白表达量无增加,以P-NFAT3蛋白表达减少而去磷酸化NFAT3蛋白表达相对增加为主;TH处理后,抑制了HF组大鼠CaN蛋白表达,从而使得下游去磷酸化状态的NFAT3蛋白表达减少。Sham组、HF组及TH组间T-NFAT3蛋白表达水平比较均差异无统计学意义(P>0.05);而分析P-NFAT3/T-NFAT3比值结果显示TH处理可使该比值出现翻转,进一步说明TH下调CaN蛋白的下游直接效益主要是维持了NFAT3蛋白的磷酸化状态,而不是通过调控NFAT3蛋白的总量表达来发挥作用。
已知CaN属于丝氨酸苏氨酸蛋白磷酸酶,为由一个催化亚基(CaN-A)和一个调节亚基(CaN-B)组成的异源二聚体。CaN的活化需要Ca2+和CaM,是己知唯一受Ca2+和CaM控制的磷酸酶,其活化通过磷脂酶C增加[Ca2+]i来调节。在心肌中Ca2+-CaN-NFAT通路模型已在大量动物实验中得到证实:位于胞浆的CaN在Ca2+和CaM作用下,使NFAT蛋白氨基端附近多个丝氨酸残基去磷酸化,去磷酸化的NFATs从胞浆转移至细胞核中,激活下游系列肥大反应基因[12]。心肌细胞中钙信号导致CaN信号传导通路的活化是致心肌细胞肥大相关基因激活的重要信号枢纽,钙超载(calcium overload)不仅影响心脏的收缩及舒张功能,也直接参与心脏重构的发生[13]。心肌细胞在心肌肥厚因素如压力负荷刺激下,可通过增加心肌[Ca2+]i激活CaN,使NFAT3去磷酸化并进胞核,去磷酸化的NFAT3再与锌指转录因子GATA4(zinc finger transcription factor GATA4)相互作用,激活下游多种心肌肥厚相关基因如β-肌球蛋白质量链(βcardiomyosin heavy chain,β-MHC)而导致心脏重构。
综上所述,我们的研究发现TH的替代治疗可通过提高心肌细胞钙调控功能,改善心肌钙超载,并经由Ca2+-CaN-NFAT通路从功能及结构上提高心肌舒缩能力。而对心肌TH核内受体在异常钙调控蛋白表达的信号转导机制研究有待深入,以进一步阐明TH改善心功能的机理。
[1]GERDESA M,IERVASI G.Thyroid replacement therapy and heart failure[J].Circulation,2010,122(4):385-393.
[2]PEREZ A C,JHUND P S,STOTT D J,et al.Thyroid-stimulat⁃ing hormone and clinical outcomes:the CORONA trial(con⁃trolled rosuvastatin multinational study in heart failure)[J].JACC Heart Fail,2014,2(1):35-40.
[3]OJAMAA K. Signaling mechanisms in thyroid hormone in duced cardiac hypertrophy[J]. Vascul Pharmaco,2010,52(3-4):113-119.
[4]YANG D,MA S,TAN Y,et al.Adrenergic receptor blockadeinduced regression of pressure-overload cardiac hypertrophy is associated with inhibition of the calcineurin/NFAT3/GATA4 pathway[J].Mol Med Report,2010,3(3):497-501.
[5]DOWELL R T,MCMANUSRE 3rd.Pressure-induced cardiac enlargement in neonatal and adult rats.Left ventricular function⁃al characteristics and evidence of cardiac muscle cell prolifera⁃tion in the neonate[J].Circ Res,1978 ,42(3):303-310.
[6]FELDMAN A M ,WEINBERG E O,RAY P E,et al.Selective changes in cardiac gene expression during compensated hyper⁃trophy and the transition to cardiac decompensation in rats with chronic aortic banding[J].Circ Res,1993,73(1):184-192.
[7]DEL MONTEF,WILLIAMS E,LEBECHE D,et al.Improve⁃ment in survival and cardiac metabolism after gene transfer of sarcoplasmic reticulum Ca(2+)-ATPase in a rat model of heart failure[J].Circulation,2001,104(12):1424-1429.
[8]张川里,吴本.钙荧光探剂的研究及其在生命科学中的应用[J].生理科学进展,1996,27(1):37-42.
[9]GRYNKIEWICZ G,POENIE M,TSIEN R Y.A new genera⁃tion of Ca2+indicators with greatly improved fluorescence proper⁃ties[J].J Biol Chem,1985,260(6):3440-3450.
[10]林吉进,梁庆,李玉光,等.甲状腺素对心力衰竭大鼠心功能及心肌细胞钠-钙交换体表达的影响[J].心血管康复医学杂志,2005,14(5):434-437.
[11]王阳顺,梁庆,吴向红,等.甲状腺素对慢性心肌缺血大鼠心功能及心肌细胞钠-钙交换体表达的影响[J].中国现代医学杂志,2010,20(2):274-276.
[12]ZHU X,FANG J,GONG J,et al.Cardiac-specific EPI64C blunts pressure overload-induced cardiac hypertrophy[J].Hy⁃pertension,2016,67(5):866-877.
[13]KEHAT I,MOLKENTIN J D.Molecular pathways underlying cardiac remodeling during pathophysiological stimulation[J].Circulation,2010,122(25):2727-2735.
Mechanism study of thyroid hormone down-regulating myocardial calcineurin pathway in rats with chronic heart failure
KUANG Su-hua1,GUO Duan-qiang2,LIANG Qing2,MA Lun-chao1,YANG Chao1,LU Guo-liang1,ZHANG Ying-yuan1,HUANG Jie-zhou1,WENG Li-fang1,REN Xiao-shan1,XIE Shao-bo1
(1.Department of Cardiac Surgery,The First Affiliated Hospital of Guangzhou Medical University,Guangzhou 510120,China;2.Department of Emergency Medicine ,The First Affiliated Hospital of Guangzhou Medical University,Guangzhou 510120,China)
Objectives To explore the in vivo study of the thyroxine effect on hemodynamics and cardiac calcineurin(CaN)-nuclear factor 3 of activated T cells(NFAT3)pathway in chronic heart failure rats.MethodsAtotal of 90 Sprague-Dawley rats were randomly divided into 3 groups,30 rats in each group:(1)sham group;(2)heart failure(HF)group(HF group);(3)thyroid hormone(TH)treated group(TH group).HF group and TH treated group rats were subject to abdominal aortic ligation,and TH group rats
intragastric administration of levothyroxine sodium [1.5 μg/(100 g · d)].Invasive hemodynamic examination was performed before rats being sacrificed and after eight weeks.Heart wet weight(HW),lung wet weight(LW),heart weight index[HW/body weight(BW)]and pulmonary weight index(LW/BW)were calculated.Myocardial[Ca2+]i concentration and CaN activity were measured,and CaN-A,total NFAT3(T-NFAT3),phosphated-NFAT3(P-NFAT3)protein expression level were detected by Western blotting.Results(1)TH treatment significantly improved systolic pressure(SP),left intraventricular systolic pressure(LVSP),+dp/dt max,left ventricular diastolic pressure(LVDP),left ventricular end-diastolic pressure(LVEDP),-dp/dt max in HF rats,and there were no statistical difference between TH group′s HR and HF group′s(P>0.05).(2)TH group′s HW/BW[(3.44±0.27)mg/gvs.(4.18±0.28)mg/g,P<0.01]and LW/BW[(8.02±0.41)mg/gvs.(8.56±0.45)mg/g,P<0.01]were significantly lower than HF group′s.(3)Compared with HF group′s,TH group′s[Ca2+]i[(115.50±10.76)nmol/Lvs.(159.36±7.21)nmol/L,P<0.01]and CaN activity[(21.33±2.35)nmol·min-1﹒mg-1proteinvs.(42.96±3.36)nmol·min-1·mg-1protein,P<0.05]were significantly lower.(4)Caompared with those of sham group,expression level of P-NFAT3(0.41±0.10vs.0.80±0.11,P<0.01) and PNFAT3/T-NFAT3 ratio(0.13±0.03vs.0.25±0.04,P<0.01) in HF group were significantly reduced;but expression level of P-NFAT3(0.86±0.11vs.0.41±0.10,P<0.01)and P-NFAT3/T-NFAT3 ratio(0.27±0.03vs.0.13±0.03,P<0.01)in TH group increased significantly than those in HF group;although P-NFAT3 express level increased in TH group than in sham group,there was no statistically significant difference(P=0.193)between TH group′s P-NFAT3/T-NFAT3 ratio and sham group′s(P>0.05).ConclusionsTH treated HF rats can obtain anatomic,pathologic and hemodynamic benefits by the improvement of myocardial calcium homeostasis and furtherly reducing pathological CaN activation and maintaining downstream NFAT3 protein phosphorylation state.
heart failure;thyroid hormones;calcineurin;calcium handling;cardiac remodeling
R541.6
A
1007-9688(2017)03-0314-05
10.3969/j.issn.1007-9688.2017.03.18
2017-02-28)
广东省医学科研基金(项目编号:A2014287);广州市医药卫生科技项目(项目编号:20141A011077);广州市医药卫生科技项目(项目编号:20151A011069)。
邝素华(1980-),女,主治医师,研究方向为先天性心脏病围术期管理。
郭锻强,E-mail:2411901596@qq.com