微小胃肠道间质瘤及其合并消化道癌的临床病理分析
2017-07-24马小兵河北省唐山市人民医院病理科河北唐山063000
张 洁,马小兵,王 磊(河北省唐山市人民医院病理科,河北 唐山 063000)
·论 著·
微小胃肠道间质瘤及其合并消化道癌的临床病理分析
张 洁,马小兵,王 磊
(河北省唐山市人民医院病理科,河北 唐山 063000)
目的探讨微小胃肠道间质瘤(gastrointestinal stromal tumors,GISTs)的临床病理特点,并分析其中合并消化道癌病例的病理特征。方法回顾性分析微小GISTs的病理学特点,以及合并消化道癌病例的病理特征。结果40例微小GISTs病变直径均≤1 cm,其中14例合并消化道癌;病理形态均为梭形细胞型;免疫表型CD117阳性率100.0%,Dog-1阳性率90.0%,CD34阳性率95.0%,SMA阳性率47.5%,S-100阳性率17.5%,Ki-67阳性率0%~15%。3例为低复发风险,其余均为极低复发风险。结论微小GISTs无特异临床表现,其复发风险以低或极低为主,合并消化道癌者不易于术前检出,应于术前及术中给予充分重视,以免遗漏。
肠肿瘤;病理学,临床;免疫表型分型
微小胃肠道间质瘤(gastrointestinal stromal tumors,GISTs)是近年来才认识的一种独立的临床病理实体,是起源于胃肠道壁Cajal细胞(interstitial cells of Cajal,ICC)或与Cajal细胞同源的间叶干细胞并存在KIT或PDGFRA基因突变[1]的肿瘤,是胃肠道最常见的间叶性肿瘤。本研究回顾性分析微小GISTs(病变直径≤1 cm)的临床病理特点,并对其中合并消化道癌的病例进行临床病理分析。
1 资料与方法
1.1 一般资料 回顾性分析2005年6月—2016年6月河北省唐山市人民医院收治的经常规病理及免疫组织化学证实的40例微小GISTs患者的临床病理资料,GISTs诊断符合胃肠道间质瘤病理诊断依据[2]。男性30例,女性10例,年龄42~78岁,平均 (61.33±8.44)岁。发生部位:胃30例(75.0%),小肠5例(12.5%),结直肠4例(10.0%),食管1例(2.5%)。合并发生的消化道癌诊断标准参照2010年WHO消化系统肿瘤分类中的组织学及其分型描述。
1.2 方法 所有标本均经4%中性甲醛固定,石蜡包埋,4 μm厚连续切片,HE染色,光镜观察,所有病例均免疫组织化学标记CD117、SMA、CD34、Ki-67、S-100及Dog-1。所用试剂购自北京中杉金桥公司。
2 结 果
2.1 微小GISTs合并消化道癌的临床病理特点 40例微小GISTs中有14例(35.0%)合并消化道癌。伴发消化道癌的类型:胃、贲门腺癌10例,食管鳞状细胞癌3例,肝门部腺癌1例。14例伴发消化道癌的病例中有10例微小GISTs为手术中探查发现,术前均未检出,其余4例均为大体标本检查时偶然发现。见表1。
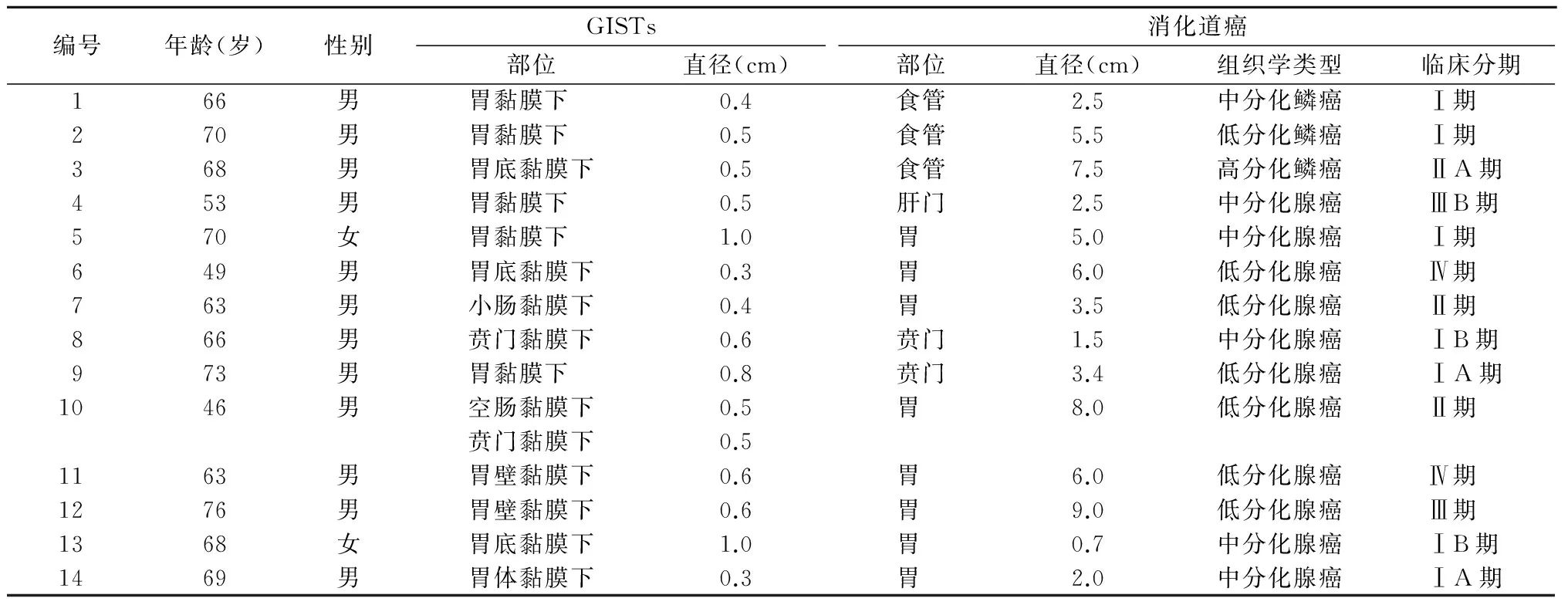
表1 GISTs合并消化道癌的临床病理特点
2.2 组织学特点 40例均为梭形细胞型(图1),肿瘤均位于黏膜下,呈推挤式生长,部分病例呈多结节状生长,肿瘤细胞长梭形或短梭形,两端钝圆,形态温和,无坏死及核异型性,排列成席纹状、栅栏状,部分肿瘤细胞核内有空泡形成。其中38例核分裂象<5个/50 HPF(95.0%),2例核分裂象>5个/50 HPF(5.0%)(图2)。
2.3 免疫组织化学表型 肿瘤细胞CD117阳性率100.0%(40/40)(图3),Dog-1阳性率90.0%(36/40)(图4),CD34阳性率95.0%(38/40),SMA阳性率 47.5%(19/40),S-100阳性率17.5%(7/40), Ki-67阳性率0%~15% ,其中Ki-67阳性率<5%者38例。
2.4 肿瘤的危险度分级 40例微小GISTs中3例为低度复发风险,其中2例伴发消化道癌,其余均为极低度复发风险。
2.5 合并消化道癌的分化程度及分期 肿瘤的分化程度:高分化1例(7.1%,1/14),中分化6例(42.9%,4/14),低分化7例(50.0%,7/14)。肿瘤分期:Ⅰ期7例(50.0%,7/14),Ⅱ期3例(21.4%,3/14),Ⅲ期2例(14.3%,2/14),Ⅳ期2例(14.3%,2/14)。
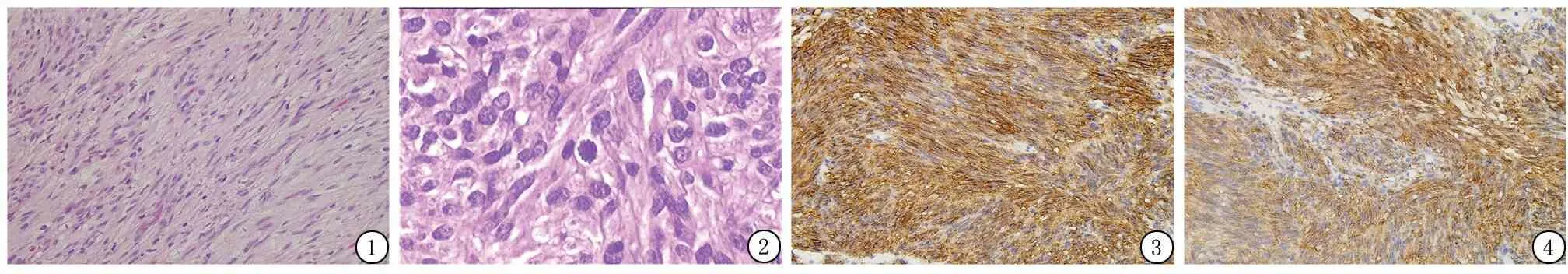
图1 GISTS由梭形细胞构成(HE ×40) 图2 GISTS中的核分裂象(HE ×40) 图3 GISTS中CD117的表达(IHC ×40) 图4 GISTS中Dog-1的表达(IHC ×40)
3 讨 论
GISTs是最常见的胃间叶性肿瘤,据统计,每年有5 000~6 000例新诊断的GISTs,其中10%~30%为恶性。多数肿瘤为散发病例,好发于40~50岁或50~60岁成年人,男性稍多于女性。随着内镜技术的发展,临床前期微小GISTs检出率显著増高,这部分肿瘤核分裂指数较低,却偶有转移。因此,目前认为所有GISTs均具有恶性潜能。近年来微小GISTs已经引起了临床医生的广泛关注。这种肿瘤因生物学行为呈惰性而极易被忽略,而且其定义因无明确大小界定,数年来一直存在主观性、随机性。直到2010年NCCN指南首次提出将<2 cm的GISTs定义为“小间质瘤”,新修订的2013年中国专家共识[2]将≤1 cm的GISTs明确定义为“微小间质瘤”。其组织学结构及免疫组织化学特性与手术切除的GISTs相似。GISTs最好发部位是胃(60%~70%),其次是小肠(20%~30%,尤其是十二指肠)、结直肠(5%)和食管(<5%)。本组中发生在胃30例(75.0%),小肠5例(12.5%),结直肠4例(10.0%),食管1例(2.5%)。与文献报道基本相符。微小GISTs病例中有1例为多部位发生,与胃腺癌伴发,发生部位分别为空肠及贲门,肿瘤均<1 cm,复发风险均为极低。
许多良性GISTs并没有临床症状,只是偶然被发现。本组患者均无特异临床症状,发生在胃部者多有上腹不适,发生在肠道者大多无明显不适,仅在查体时发现,个别病例出现腹泻及腹胀。微小GISTs最主要的症状是上腹部不适,此外还有腹胀、反酸、暧气、恶心、呕吐等。目前,内镜技术是术前诊断消化道疾病的重要手段,超声内镜更有助于发现黏膜下病灶。国外有学者认为联合应用CT和MRI有助于提高对GISTs的早期识别[3]。乔洪波等[4]认为多层螺旋CT在GISTs的定性及定位诊断上均显著优于X线钡餐检查。本组与消化道癌伴发的GISTs病例中于术前均未能检出,并且有2例术中误认为是淋巴结给予清扫。
由于绝大多数GISTs起源于肠肌神经丛内及其周围的Cajal间质细胞,这些细胞表达CD117或CD34。同时Cajal间质细胞具有肌源性和神经源性分化,这就可以解释为何来源于这种细胞的肿瘤免疫组织化学标记具有异质性。本组病例中,CD117阳性率100.0%,CD34阳性率95.0%,SMA阳性率47.5%,S-100阳性率17.5%,它们之间的免疫表达存在差异,即一部分肿瘤向肌源性分化,一部分肿瘤向神经源性分化。
目前研究发现微小GISTs中KIT基因突变普遍存在,因此它可能代表临床间质瘤早期阶段。但也有学者研究认为微小GISTs中KIT/PDGFRA总基因突变率,尤其是外显子11突变,显著低于显性间质瘤,并且携带其他罕见及新型突变,故认为微小GISTs更倾向于自限性疾病[5]。大约85%的患者有结构性激活的KIT突变,其突变类型一定程度上与肿瘤发生的部位及形态相关。KIT突变涵盖了从单一碱基对替换到复杂的缺失/插入突变,亦可出现内部串联重复序列。梭形细胞型GISTs大多数为第11号外显子突变,本组病例全部为梭形细胞型GISTs,只有1例进行了KIT分子检测,结果为11号外显子缺失。Mikami等[6]将68例微小GISTs分成2组,一组CD117阳性、SMA阴性,另一组CD117阴性、SMA阳性,结果发现CD117 阳性组其11号外显子缺失率为86.2%,而SMA阳性组缺失率为0。本组检测的11号外显子缺失病例,其CD117阳性,SMA阴性。与文献报道符合。
有研究认为,对于直径≤2 cm的原发于胃的小GISTs,在排除超声内镜高危征象的情形下,可以通过EUS密切随访观察,而超声内镜提示高危征象胃的小GISTs应当积极进行手术切除;对于胃外原发的直径≤2 cm的小GISTs,需要将手术切除作为首选[7-8]。腹腔镜是治疗GISTs较安全、合理、有效的方法,但对治疗小GISTs存在一定局限性,尤其对直径≤1 cm的微小GISTs[9]。Yan等[10]发现合并胃癌的GISTs平均直径为0.85 cm,均呈低增殖活性和低危险度,肿瘤细胞均表达CD117,且基因突变分析发现大多位于KIT基因11号外显子。本组病例11例胃癌合并GISTs,GISTs平均直径0.81 cm,均表达CD117。与文献报道相符。
GISTs的大小与预后关系密切。有学者通过超声检查对50例微小GISTs进行至少24个月的随访研究,结果14例肿瘤体积显著变化,从而认为肿瘤大小与边缘是否规则与肿瘤是否进展相关,并提出肿瘤大小临界值为1.4 cm[11]。另有学者通过对60例肿瘤大小在5 cm以内GISTs患者进行随访,其5年无病生存率为96.1%,认为肿瘤在<5 cm时尽早手术能有效改善预后。虽然本组病例均是微小GISTs,并且复发风险为低或极低,术前未能发现对患者预后并无太大影响,但对其存在却是不容忽视的。国外文献报道1例65岁男性患者体检发现贲门部一直径1 cm的黏膜下肿瘤,2个月后出现了黑便及贫血,复查发现肿瘤增至3 cm,手术切除后经病理证实为CD117阳性的GISTs,并且存在11号外显子缺失,该患者于术后6个月出现肝转移,并于2年后死亡[12]。由此可见,对任何GISTs的遗漏都有可能成为隐患。
消化道癌与GISTs均为独立分开的瘤体以互为独立的形式出现,其发生机制可能是由于某种或某些共同致瘤因素的存在导致上皮和间质细胞同时发生肿瘤。也有学者认为两者同时发生可能只是一种巧合,因为两者均属胃肠道最常见的肿瘤。北京癌症研究所通过对30例胃腺癌伴发GISTs的病例进行KIT / PDGFRA基因突变检测,发现两者突变基因并不相似,从而认为两者的发病机制从基因突变方面并无相关性。
GISTs同时伴发邻近器官的恶性上皮性肿瘤的发生率为3%~33%。两者伴发是偶然事件亦或存在某种相关的病理生理过程尚有争议,因此产生了各种假说。①一种场效应:相关的恶性肿瘤释放了生长因子/促分裂原或存在某些不确定的与胃动力相关的机制,同时刺激Cajal间质细胞。②两者仅仅为偶然伴发,仍需要大样本对其进行验证。③不同细胞株増殖过程中出现了共同的致癌通路或基因突变[13]。由于研究样本数有限,各种假说均不能排除。
上皮-间质转化(epithelial-mesenchymal transition,EMT)的概念是20世纪80年代由生物学家首次提出,即上皮细胞经过结构及形态改变获得间叶组织表型。EMT可使肿瘤细胞具有干细胞的特性,使其自身増殖、肿瘤始动能力及抗调亡力等增强[14]。间质瘤梭形细胞向上皮细胞转化可能与继发性基因突变从而引起表型错乱有一定的相关性。EMT分为3型:1型EMT与胚胎形成中器官发育有关,能通过EMT逆转录产生新型上皮;2型EMT与组织修复有关,在炎症损伤和创伤后产生成纤维细胞和其他相关细胞重建组织;3型EMT与新生的细胞、肿瘤形成和转移有关,由癌基因通路介导。EMT以E-cadherin等上皮蛋白标记物缺失及间质标记Vimentin及N-cadherin等表达上调为特征。E-cadherin甲基化水平在微小GISTs中达37%,而E-cadherin表达水平上调可以减少GISTs复发率。这表明E-cadherin基因的表达水平与GISTs转移密切相关[15]。Liu等[16]证实EMT在胃肠道间质瘤中起作用,并提出E-cadherin阴性表达的GISTs可能临床转归较差。因此,GISTs与消化道上皮源性恶性肿瘤伴发的作用机制中是否存在EMT的参与,还有待于进一步深入研究。
有研究发现PTHrP(甲状旁腺素相关肽)在GISTs中通过自分泌与旁分泌发挥作用,而在胃肠道上皮性肿瘤中通过抑制CaCo-2细胞的凋亡,同时调解AKT及MAPKs通路而起作用,因此2种肿瘤同时发生之间是否通过PTHrP存在某种内部联系,还需进一步深入研究[17]。
综上所述,许多学者对GISTs与其他肿瘤同时存在着各种假设,但目前暂无数据能支持以上各种假设。尤其是对于微小GISTs,通常因为肿瘤体积小,位于消化道壁黏膜下,CT和MRI检查常误认为是来源于上皮性恶性肿瘤转移的淋巴结,而大多是在术后病理检查出来的。因此,在消化系统肿瘤诊断与治疗过程中应考虑到肿瘤发生的多样性和GISTs的特殊性,应行仔细、全面的检查,以防漏诊微小GISTs。
[1] Lasota J,Miettinen M. Clinical significance of oncogenic KIT and PDGFRA mutations in gastrointestinal stromal tumours[J]. Histopathology,2006,53(3):245-266.
[2] CSCO胃肠间质瘤专家委员会.中国胃肠间质瘤诊断治疗共识(2013年版)[J].临床肿瘤学杂志,2013,18(11):1025-1032.
[3] Jiang ZX,Zhang SJ,Peng WJ,et al. Rectal gastrointestinal stromal tumors: Imaging features with clinical and pathological correlation[J]. World J Gastroenterol,2013,19(20):3108-3116.
[4] 乔洪波,胡金文.消化道间质瘤42例CT表现回顾分析[J].河北医科大学学报,2013,34(3):332-333.
[5] Rossi S,Gasparotto D,Toffolatti L,et al. Molecular and clinicopatholog-ic characterization of gastrointeinal stromal tumors(GISTs) of small size[J]. The Am J Surg Pathol,2010,34(10):1480-1491.
[6] Mikami T,Nemoto Y,Numata Y,et al. Small gastrointestinal stromal tumor in the stomach: Identification of precursor for clinical gastrointestinal stromal tumor using c-kit and α-smooth muscle actin expression[J]. Hum Pathol,2013,44(12):2628-2635.
[7] Corless CL. Gastrointestinal stromal tumors: what do we know now?[J]. Mod Pathol,2014,27(Suppl 1):S1-16.
[8] 黄颖秋.胃肠道间质瘤的研究进展[J].世界华人消化杂志,2014,22(12):1633-1641.
[9] Guo J,Liu Z,Sun S,et al. Ligation-assisted endoscopic enucleation for treatment of esophageal subepithelial lesions originating from the muscularis propria: a preliminary study[J]. Dis Esophagus,2015,28(4):312-317.
[10] Yan Y,Li Z,Liu Y,et al. Coexistence of gastrointestinal stromal tumors and gastric adenocarcinomas[J]. Tumour Biol,2013,34(3):919-927.
[11] Fang YJ,Cheng TY,Sun MS,et al.Suggested cutoff tumor size for ma-nagement of small EUS-suspected gastric gastrointestinal stromal tumors[J]. J Formos Med Assoc,2012,111(2):88-93.
[12] Tanaka J,Oshima T,Hori K,et al. Small gastrointestinal stromal tumor of the stomach showing rapid growth and early metastasis to the Liver[J]. Dig Endosc,2010,22(4):354-356.
[13] Shariq O,Odedra A,Alexopoulos AS,et al. Synchronous occurrence of gastrointestinal stromal tumour and ovarian neoplasm in a patient presenting with acute cholecystitis[J]. J Gastrointestinal Cancer,2012,43(1):113-116.
[14] Dave B,Mittal V,Tan NM,et al. Epithelial-mesenchymal transition,cancer stem cells and treatment resistance[J]. Breast Cancer Res,2012,14(1):202.
[15] Susa T,Ikaga R,Kajitani T,et al. Wild-type and specific mutant androgen receptor mediates transcription via 17β-estradiol in sex hormone-sensitive cancer cells[J]. J Cell Physiol,2015,230(7):1594-1606.
[16] Liu S,Liao G,Ding J. Dysregulated expression of Snail and E-cadherin correlates with gastrointestinal stromal tumor metastasis[J]. Eur J Cancer Prev,2014,23(5):329-335.
[17] Lezcano V,Gentili C,de Bolan AR. Role of PTHrP in human intestinal Caco-2 cell response to oxidative stress[J]. Biochim Biophys Acta,2013,1833(12):2834-2843.
(本文编辑:许卓文)
2017-03-21;
2017-05-24
张洁(1982-),女,河北唐山人,河北省唐山市人民医院主治医师,医学硕士,从事临床病理学研究。
R735
B
1007-3205(2017)07-0850-05
10.3969/j.issn.1007-3205.2017.07.028
